第五单元 化学方程式复习
文档属性
| 名称 | 第五单元 化学方程式复习 |  | |
| 格式 | zip | ||
| 文件大小 | 196.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-09 22:34:45 | ||
图片预览








文档简介
课件23张PPT。质量守恒定律及其应用
第五单元 复习 认识质量守恒定律,能说明常见化学反应中的质量关系。 能用分子、原子观点理解质量守恒
定律,并能用它解释一些简单现象。学习目标 本课小结:化学方程式1、定义:2、意义:(1)表示反应物,生成物和反应条件。(3)表示反应物、生成物各物质之间的质量比。3、读法:4、遵守的原则一是必须以客观事实为基础二是要遵守质量守恒定律(等号两边
各原子种类与数目必须相等) 5、书写步骤:左反右生一短线
配平之后加一线
等号上下注条件箭头标出气或淀(2)表示反应物、生成物各粒子之间的个数比。用化学式表示化学反应的式子。
如:2H2O 2H2↑ + O2↑
2×(1×2+16) : 2×(1×2) : 16×2
36 : 4 : 32
表明:
⑴ 水、氢气、氧气间的质量比为 36 : 4 : 32
⑵ 反应物是水,生成物是氢气和氧气,反应条件是通电
⑶ 水分子、氢分子、氧分子间个数比为 2 : 2 : 1练习:说出 2H2O2 2H2O + O2↑ 的意义表明: ⑴ 反应物是过氧化氢,生成物是水和氧气,反应条 件是MnO2作催化剂
⑵ 过氧化氢分子、水分子、氧分子间个数比为 2 : 2 : 1
⑶ 过氧化氢、水、氧气间的质量比为 68 : 36 : 32读法:⑴过氧化氢在二氧化锰作催化剂的条件下生成水和氧气
⑵每两个过氧化氢分子可生成两个水分子和一个氧分子
⑶每68份质量的过氧化氢可生成36份质量的水和32份质量的氧气判断下列说法是否正确:
(1)100克水变成100克水蒸气符合质量守恒定律
(2)燃烧的镁带和生成的白色粉末质量相等。
(3)3gC在10gO2中充分燃烧,生成13gC02。
(4)水在催化剂的作用下可变成燃油(主要含C、H元素)典型例题:×××
×
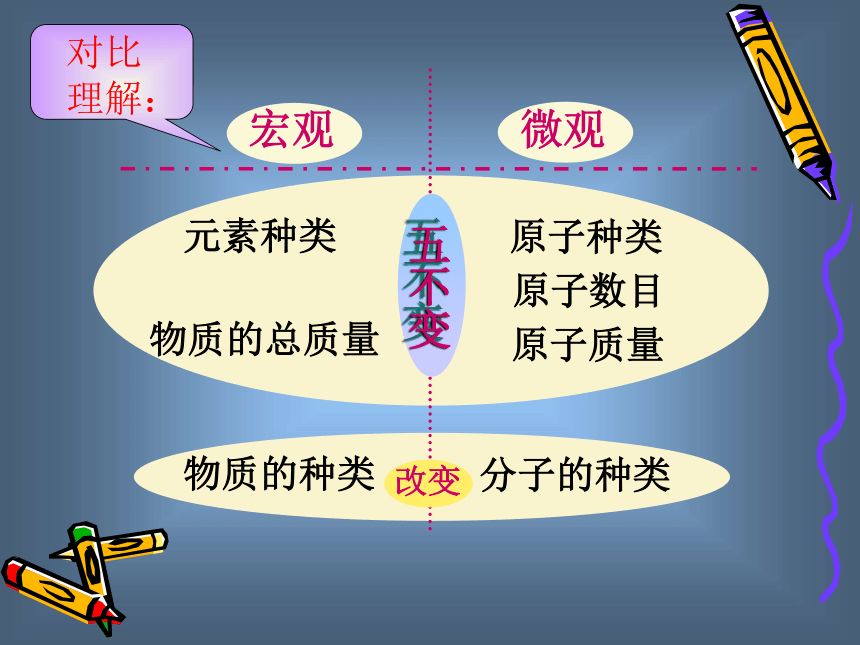
物质的种类分子的种类对比
理解:例 生物的呼吸作用表示为:
有机物 + 氧气 →二氧化碳 + 水 + 能量。以下关于有机物组成元素推断正确的是( )
A.只含碳元素
B.只含碳元素和氢元素
C.一定含碳、氢和氧元素
D.一定含有碳元素和和氢元素,可能含
有氧元素一、推断物质的组成D2.我国科学家在研究人造金刚石方面有重大突
破,用某些物质在高强电场中,有催化剂的条
件下,可转化成金刚石(碳元素组成的单质),下列物质在上述条件下可转化成金刚石的是( )
A. 氯化钾 B. 甲烷 C. 氮气 D. 硫酸锌
(KCl) (CH4) (N2) (ZnSO4)想一想,看谁脑筯转得快!1.某纯净物稍加热就分解为氨气(NH3)、
二氧化碳和水。根据实验事实能得出的结论是( )
A.它由四种元素组成 B.它是氧化物
C.它有水 D.它很稳定AB例:一氧化氮是大气的主要污染物之一。近
几年来又发现生物体内存在少量一氧化
氮,它有扩张血管、增强记忆的功能,
成为当前生命科学的热点。工业上制得
一氧化氮的化学方程式为:
4X + 5O2 =4NO + 6H2O ,
则X的化学式为 ( )
A.N2 B.NO2
C.NH3 D.N2O5 二、确定物质的化学式C比一比 看谁做得快!H2OCO2三、确定化学计量数例:在化学方程式aC2H6 + bO2 = mCO2
+ nH2O 中,各计量数之间的关系正确
的是( )
A.2m = a B.3n = 2a
C . m=2a D.2b = n + m 4.一定量的甲醇与氧气混合于密闭容器内,
引燃发生如下反应:8CH3OH + xO2 =
mCO2 + nCO + 16H2O 。则化学计量数
m和n的和等于 。 来,试一试!C8四、确定物质的质量例1:在化学反应A+2B = 2C+D中,6gA和8gB 恰好完全反应,生成9gD。若反应生成15gC,则参加反应的A的质量为( )
A.18g B.24g C.12g D.16gA例2: 将A、B、C三物质各5克混合加热进行化合反应,其中B为催化剂。当A完全反应后,生成D的质量为8克,则反应后混合物中B与C的质量比为 ( )
A、4:1 B、5:1 C、5:3 D、5:2D赛一赛 看谁最厉害!5.在化学反应A+B2=AB2中,A与B2反应的质量
关系如图所示。将5gA与8gB2充分反应,则
生成AB2的质量是( )
A.10g B.13g
C.16g D.18gA6、在A+B=C+2D的反应中,9.8克A和8克B完全反
应生成14.2克C,同时得到D的质量是( )
A、1.8克 B、3.6克
C、7.2克 D、14.4克
B若C的相对分子质量为284,则D的相对分子质量
是多少 ?367.等质量的锌、铁、镁分别与足量的H2SO4反应生成H2的质量是 ( ) A、Zn > Fe > Mg B、Mg > Fe > Zn C、Fe > Zn > Mg D、Zn = Fe = MgB记住:等质量的四种金属与足量的酸反应,
生成氢气的质量多少为:Al>Mg>Fe>Zn8.在一个密闭容器内有X、 Y 、Z、 Q四种物质,在一定条件下充分反应,测得反应前后物质质量如下:处理数据后得出的结论正确的是( )
A .反应类型为分解反应 B.反应类型为化合反应
C.生成Z为16g D.反应物为X、YB分析:前后质量比较 不变 +10 - 4 -6 9.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下: 下列说法正确的是( )
A.物质C一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为19.7g
C.反应过程中,物质B与物质D变化的质量比为87:36
D.若物质A与物质C的相对分子质量之比为197:158,
则反应中A与C的化学计量数之比为l:2A10.下列化学方程式违背了哪一条书写原则: 1、 H2O2 H2↑ + O2↑ 2、 H2O H2↑ + O2↑ 分析:方程式 1 违背了客观事实 、方程式 2 违背
了质量守恒定律
2H2O2 2H2O + O2↑
2H2O 2H2↑ + O2↑
正确的解题格式:题:72g的镁带在空气中完全燃烧,最多可得到氧化镁多少克?
解:设最多可得到氧化镁的质量为x
2 Mg + O2 2 MgO
48 80
72g x
48 : 80 = 72g : x
x = 120g
答:最多可得到氧化镁120g11.某同学将氯酸钾和二氧化锰的混合物15克放入试管内加热,每隔一段时间测定一次试管内剩余固体的质量。测得的时间与试管内剩余固体的质量如下表所示:
1、完全反应后生成氧气多少克?
2、原混合物中含氯酸钾多少克?
3、完全反应后试管内剩余的物质是什么?各多少克? 作业:
1、某学生称取12.25g的 KClO3 制取氧气,并加入了一定质量的 KMnO4,待加热反应完全后,共得到氧气4.96g ,问该学生加了多少克的高锰酸钾?2.用一定质量的氯酸钾和3g二氧化锰混合后,加热制取氧气9.6g。求:原混合物中氯酸钾的质量为多少g?反应后剩余固体的质量为多少g?
3.加热分解15.8g的高锰酸钾所产生的氧气,能使多少g铁丝完全燃烧?
第五单元 复习 认识质量守恒定律,能说明常见化学反应中的质量关系。 能用分子、原子观点理解质量守恒
定律,并能用它解释一些简单现象。学习目标 本课小结:化学方程式1、定义:2、意义:(1)表示反应物,生成物和反应条件。(3)表示反应物、生成物各物质之间的质量比。3、读法:4、遵守的原则一是必须以客观事实为基础二是要遵守质量守恒定律(等号两边
各原子种类与数目必须相等) 5、书写步骤:左反右生一短线
配平之后加一线
等号上下注条件箭头标出气或淀(2)表示反应物、生成物各粒子之间的个数比。用化学式表示化学反应的式子。
如:2H2O 2H2↑ + O2↑
2×(1×2+16) : 2×(1×2) : 16×2
36 : 4 : 32
表明:
⑴ 水、氢气、氧气间的质量比为 36 : 4 : 32
⑵ 反应物是水,生成物是氢气和氧气,反应条件是通电
⑶ 水分子、氢分子、氧分子间个数比为 2 : 2 : 1练习:说出 2H2O2 2H2O + O2↑ 的意义表明: ⑴ 反应物是过氧化氢,生成物是水和氧气,反应条 件是MnO2作催化剂
⑵ 过氧化氢分子、水分子、氧分子间个数比为 2 : 2 : 1
⑶ 过氧化氢、水、氧气间的质量比为 68 : 36 : 32读法:⑴过氧化氢在二氧化锰作催化剂的条件下生成水和氧气
⑵每两个过氧化氢分子可生成两个水分子和一个氧分子
⑶每68份质量的过氧化氢可生成36份质量的水和32份质量的氧气判断下列说法是否正确:
(1)100克水变成100克水蒸气符合质量守恒定律
(2)燃烧的镁带和生成的白色粉末质量相等。
(3)3gC在10gO2中充分燃烧,生成13gC02。
(4)水在催化剂的作用下可变成燃油(主要含C、H元素)典型例题:×××
×
物质的种类分子的种类对比
理解:例 生物的呼吸作用表示为:
有机物 + 氧气 →二氧化碳 + 水 + 能量。以下关于有机物组成元素推断正确的是( )
A.只含碳元素
B.只含碳元素和氢元素
C.一定含碳、氢和氧元素
D.一定含有碳元素和和氢元素,可能含
有氧元素一、推断物质的组成D2.我国科学家在研究人造金刚石方面有重大突
破,用某些物质在高强电场中,有催化剂的条
件下,可转化成金刚石(碳元素组成的单质),下列物质在上述条件下可转化成金刚石的是( )
A. 氯化钾 B. 甲烷 C. 氮气 D. 硫酸锌
(KCl) (CH4) (N2) (ZnSO4)想一想,看谁脑筯转得快!1.某纯净物稍加热就分解为氨气(NH3)、
二氧化碳和水。根据实验事实能得出的结论是( )
A.它由四种元素组成 B.它是氧化物
C.它有水 D.它很稳定AB例:一氧化氮是大气的主要污染物之一。近
几年来又发现生物体内存在少量一氧化
氮,它有扩张血管、增强记忆的功能,
成为当前生命科学的热点。工业上制得
一氧化氮的化学方程式为:
4X + 5O2 =4NO + 6H2O ,
则X的化学式为 ( )
A.N2 B.NO2
C.NH3 D.N2O5 二、确定物质的化学式C比一比 看谁做得快!H2OCO2三、确定化学计量数例:在化学方程式aC2H6 + bO2 = mCO2
+ nH2O 中,各计量数之间的关系正确
的是( )
A.2m = a B.3n = 2a
C . m=2a D.2b = n + m 4.一定量的甲醇与氧气混合于密闭容器内,
引燃发生如下反应:8CH3OH + xO2 =
mCO2 + nCO + 16H2O 。则化学计量数
m和n的和等于 。 来,试一试!C8四、确定物质的质量例1:在化学反应A+2B = 2C+D中,6gA和8gB 恰好完全反应,生成9gD。若反应生成15gC,则参加反应的A的质量为( )
A.18g B.24g C.12g D.16gA例2: 将A、B、C三物质各5克混合加热进行化合反应,其中B为催化剂。当A完全反应后,生成D的质量为8克,则反应后混合物中B与C的质量比为 ( )
A、4:1 B、5:1 C、5:3 D、5:2D赛一赛 看谁最厉害!5.在化学反应A+B2=AB2中,A与B2反应的质量
关系如图所示。将5gA与8gB2充分反应,则
生成AB2的质量是( )
A.10g B.13g
C.16g D.18gA6、在A+B=C+2D的反应中,9.8克A和8克B完全反
应生成14.2克C,同时得到D的质量是( )
A、1.8克 B、3.6克
C、7.2克 D、14.4克
B若C的相对分子质量为284,则D的相对分子质量
是多少 ?367.等质量的锌、铁、镁分别与足量的H2SO4反应生成H2的质量是 ( ) A、Zn > Fe > Mg B、Mg > Fe > Zn C、Fe > Zn > Mg D、Zn = Fe = MgB记住:等质量的四种金属与足量的酸反应,
生成氢气的质量多少为:Al>Mg>Fe>Zn8.在一个密闭容器内有X、 Y 、Z、 Q四种物质,在一定条件下充分反应,测得反应前后物质质量如下:处理数据后得出的结论正确的是( )
A .反应类型为分解反应 B.反应类型为化合反应
C.生成Z为16g D.反应物为X、YB分析:前后质量比较 不变 +10 - 4 -6 9.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下: 下列说法正确的是( )
A.物质C一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为19.7g
C.反应过程中,物质B与物质D变化的质量比为87:36
D.若物质A与物质C的相对分子质量之比为197:158,
则反应中A与C的化学计量数之比为l:2A10.下列化学方程式违背了哪一条书写原则: 1、 H2O2 H2↑ + O2↑ 2、 H2O H2↑ + O2↑ 分析:方程式 1 违背了客观事实 、方程式 2 违背
了质量守恒定律
2H2O2 2H2O + O2↑
2H2O 2H2↑ + O2↑
正确的解题格式:题:72g的镁带在空气中完全燃烧,最多可得到氧化镁多少克?
解:设最多可得到氧化镁的质量为x
2 Mg + O2 2 MgO
48 80
72g x
48 : 80 = 72g : x
x = 120g
答:最多可得到氧化镁120g11.某同学将氯酸钾和二氧化锰的混合物15克放入试管内加热,每隔一段时间测定一次试管内剩余固体的质量。测得的时间与试管内剩余固体的质量如下表所示:
1、完全反应后生成氧气多少克?
2、原混合物中含氯酸钾多少克?
3、完全反应后试管内剩余的物质是什么?各多少克? 作业:
1、某学生称取12.25g的 KClO3 制取氧气,并加入了一定质量的 KMnO4,待加热反应完全后,共得到氧气4.96g ,问该学生加了多少克的高锰酸钾?2.用一定质量的氯酸钾和3g二氧化锰混合后,加热制取氧气9.6g。求:原混合物中氯酸钾的质量为多少g?反应后剩余固体的质量为多少g?
3.加热分解15.8g的高锰酸钾所产生的氧气,能使多少g铁丝完全燃烧?
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
