实验活动8粗盐中难溶性杂质的去除-2021-2022学年九年级化学人教版下册(Word版含解析)
文档属性
| 名称 | 实验活动8粗盐中难溶性杂质的去除-2021-2022学年九年级化学人教版下册(Word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 330.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-09 17:51:17 | ||
图片预览


文档简介
实验活动8粗盐中难溶性杂质的去除
一、选择题(共16题)
1.海水“晒盐”得到的是粗盐,粗盐提纯的步骤可简单地概括为:溶解—过滤—蒸发,下列说法错误的是
A.溶解时用玻璃棒搅拌以加快溶解速率
B.过滤后得到的滤渣是粗盐中的难溶性杂质
C.蒸发时要将蒸发皿中的滤液全部蒸干才能停止加热
D.粗盐若未能充分溶解,则实验结果中精盐的产率将偏低
2.下列关于海水晒盐原理的分析正确的是
A.利用阳光照射,使海水升温得到食盐
B.利用海风降温析出食盐晶体
C.利用海水在阳光下发生分解反应制得食盐
D.利用阳光和风力使水分蒸发得到食盐
3.下列中草药煎制步骤中,属于过滤操作的是
A.A B.B C.C D.D
4.你认为下列实验测得的数据不合理的是
A.用温度计测得人体体温是37.5℃
B.用托盘天平称得氧化铜粉末的质量为11.5g
C.用10mL量筒量取8.52mL某溶液
D.测得某粗盐中氯化钠的质量分数为90.5%
5.下列有关粗盐提纯说法正确的是
A.将蒸发皿放在石棉网上加热 B.过滤后滤液仍然浑浊应重新过滤
C.蒸发时为了加快蒸发须用玻璃棒不断搅拌 D.当蒸发皿中水分全部蒸干时停止加热
6.下列实验操作,很难达到预期目的是
A.通过测量导电性,区分氯化钾溶液与氯化钠溶液
B.使用磁铁吸引,分离铁粉和铜粉的混合物
C.通过溶解、过滤、蒸发等操作,初步提纯粗盐
D.采用燃烧闻气味的方法,鉴别羊毛线和涤纶线
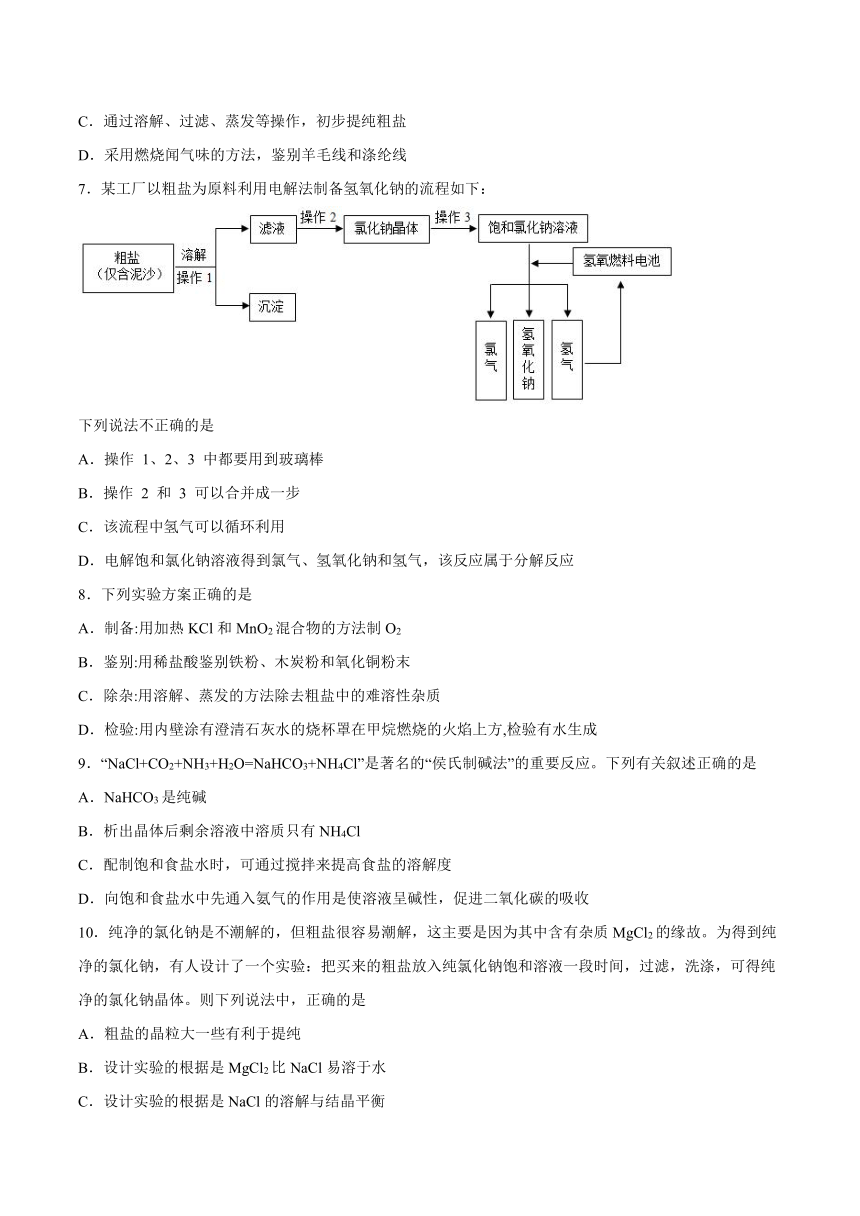
7.某工厂以粗盐为原料利用电解法制备氢氧化钠的流程如下:
下列说法不正确的是
A.操作 1、2、3 中都要用到玻璃棒
B.操作 2 和 3 可以合并成一步
C.该流程中氢气可以循环利用
D.电解饱和氯化钠溶液得到氯气、氢氧化钠和氢气,该反应属于分解反应
8.下列实验方案正确的是
A.制备:用加热KCl和MnO2混合物的方法制O2
B.鉴别:用稀盐酸鉴别铁粉、木炭粉和氧化铜粉末
C.除杂:用溶解、蒸发的方法除去粗盐中的难溶性杂质
D.检验:用内壁涂有澄清石灰水的烧杯罩在甲烷燃烧的火焰上方,检验有水生成
9.“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl”是著名的“侯氏制碱法”的重要反应。下列有关叙述正确的是
A.NaHCO3是纯碱
B.析出晶体后剩余溶液中溶质只有NH4Cl
C.配制饱和食盐水时,可通过搅拌来提高食盐的溶解度
D.向饱和食盐水中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收
10.纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中,正确的是
A.粗盐的晶粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解与结晶平衡
D.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
11.小丽同学对所学部分化学知识归纳如下,其中有错误的一组是
A 区分C粉和CuO粉末的三种方法 B 电解水可得到的结论
①做燃烧实验,观察现象 ②加入稀硫酸,观察现象 ③通入H2并加热,观察现象 ①水分子中含有氢原子和氧原子 ②水由氢、氧元素组成 ③分子在化学反应中不可以再分
C 降低NaOH溶液pH的三种方法 D 粗盐提纯的实验中玻璃棒的作用
①加水稀释 ②加入稀盐酸 ③加入硫酸铜溶液 ①溶解时搅拌,加速溶解 ②过滤时起到引流的作用 ③蒸发时搅拌,防止液滴飞溅
A.A B.B C.C D.D
12.下列实验方案能达到实验目的是
选项 实验目的 实验方案
A 除去粗盐水中的Mg2+、Ca2+、,得到精盐水 依次加入过量的Na2CO3溶液、BaCl2溶液、NaOH溶液,充分反应后过滤
B 检验久置空气中的NaOH固体是否变质 取适量样品加水充分溶解,加几滴稀盐酸
C 分离铁粉和铜粉的混合物 加足量稀硫酸,充分反应后,过滤
D 除去KC1中少量的MnO2 加水充分溶解,过滤,蒸发结晶
A.A B.B C.C D.D
13.下列实验方案中,不能达到实验目的的是
选项 实验目的 实验方案
A 分离KCl和MnO2的混合物 加水溶解后,过滤、蒸发、洗涤、干燥
B 除去CO2中少量HCl和水蒸气 将气体通过盛有碱石灰的U型管
C 检验露置在空气中的KOH溶液是否变质 取少量KOH溶液,滴入澄清石灰水
D 鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸 各取少量溶液于试管中,分别滴加紫色石蕊试液,观察溶液颜色变化
A.A B.B C.C D.D
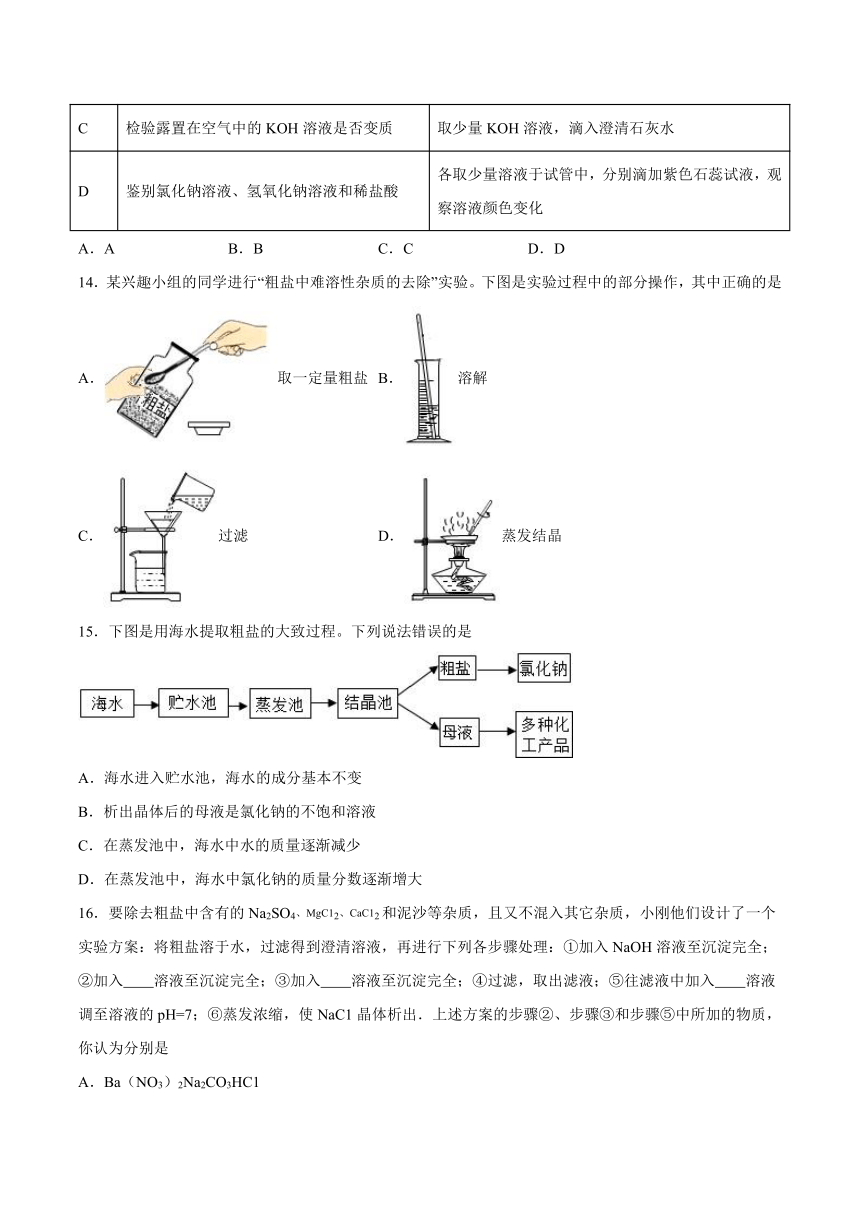
14.某兴趣小组的同学进行“粗盐中难溶性杂质的去除”实验。下图是实验过程中的部分操作,其中正确的是
A.取一定量粗盐 B.溶解
C.过滤 D.蒸发结晶
15.下图是用海水提取粗盐的大致过程。下列说法错误的是
A.海水进入贮水池,海水的成分基本不变
B.析出晶体后的母液是氯化钠的不饱和溶液
C.在蒸发池中,海水中水的质量逐渐减少
D.在蒸发池中,海水中氯化钠的质量分数逐渐增大
16.要除去粗盐中含有的Na2SO4、MgC12、CaC12和泥沙等杂质,且又不混入其它杂质,小刚他们设计了一个实验方案:将粗盐溶于水,过滤得到澄清溶液,再进行下列各步骤处理:①加入NaOH溶液至沉淀完全;②加入 溶液至沉淀完全;③加入 溶液至沉淀完全;④过滤,取出滤液;⑤往滤液中加入 溶液调至溶液的pH=7;⑥蒸发浓缩,使NaC1晶体析出.上述方案的步骤②、步骤③和步骤⑤中所加的物质,你认为分别是
A.Ba(NO3)2Na2CO3HC1
B.BaC12K2CO3H2SO4
C.BaC12Na2CO3HC1
D.Ba(NO3)2K2CO3H2SO4
二、综合题(共8题)
17.如图是初中化学的一些基本实验,请回答相关问题。
(1)实验A中反应后天平不平衡,该反应_______(选填“遵守”或“不遵守”)质量守恒定律,反应后天平不平衡的原因是_______。
(2)实验B是蒸发食盐水的实验,蒸发时用玻璃棒不断搅拌的目的是_______,当_______时停止加热。
(3)根据实验C中得出的二氧化碳的有关性质是_______,所以二氧化碳可用于_______。
18.如图1是初中化学一些基本实验,请根据实验内容回答下列问题。
利用如图1进行粗盐中难溶性杂质去除和配制一定质量分数氯化钠溶液的实验。
(1)粗盐中难溶性杂质去除的主要操作顺序是_____(填字母序号);
(2)配制11%的氯化钠溶液100g。如按如图2进行称量和量取,其它操作均规范无误,最终导致配制的氯化钠溶液的溶质质量分数_____(填“大于”、“小于”或“不能确定”)
19.化学是认识、改造和应用物质的科学。从海水中提取镁、制“碱”,都体现了人类改造物质的智慧。结合下列流程图(其中部分操作和条件已略去),请回答相关问题:
(1)提纯物质常用转化的方法,就是将杂质转化为沉淀或气体而除去。粗盐中含有氯化镁、硫酸钠、氯化钙等可溶性杂质,通过步骤Ⅰ,再利用过滤操作进行除杂。步骤Ⅰ加入下列三种溶液的先后顺序为_____(填字母序号);
a.稍过量的Na2CO3溶液b.稍过量的BaCl2溶液c.稍过量的NaOH溶液
(2)母液中有MgCl2,却经历了步骤Ⅳ、Ⅴ的转化过程,其目的是_____;
(3)步骤Ⅱ中先向饱和食盐水中通入氨气,有利于二氧化碳的吸收,这样做的目的是_____,写出该反应的化学方程式_____;
(4)化学变化是改造物质的重要途径。上述流程图中没有涉及的基本反应类型是_____。
20.某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,他们要除去杂质得到精盐,设计了下列实验方案:序号① ⑧表示实验操 作,用于沉淀的试剂稍过量。
根据上述方案,回答下列问题:
(1)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、火柴、玻璃棒、酒精灯________
(2)除去杂质是有顺序的,操作③和④的顺序能否颠倒_______ (填“能”或“不能”)
(3)操作⑤得到沉淀成分是____________
(4)滤液中加适量盐酸的目的是_____________
21.食盐是一种重要的化工原料,回答下列问题
(1)在去除粗盐中难溶性杂质时,蒸发操作中使用玻璃棒的作用是_____.
(2)在量取蒸馏水读数时,视线如图所示,会造成所配制溶液的溶质质量分数_____(填“偏大”、“偏小”或“无影响”)
(3)某粗盐样品中含有氯化镁,氯化钙和泥沙等杂质.现将130g粗盐样品溶解于足量水中,过滤得到800g滤液,取出400g溶液进行测定,其中含有镁元素1.2g,钙元素2g,氯元素42.6g,则原粗盐样品中氯化钠的质量分数为_____.
22.含钠化合物是化学研究的重要内容。
(1)一种钠的化合物, 是焙制糕点所用的发酵粉的主要成分,其化学式为_________;工业上用石灰和纯碱反应制烧碱,其反应的化学方程式为______________。
(2)配制一瓶如图所示溶液需氯化钠___________g;若配制所得的氯化钠溶液的质量分数偏小,其原因可能是下列中的______(填序号)。
①往烧杯中加水时有水溅出
②用量筒取水时仰视读数
③转移已称量好的氯化钠固体时,部分酒落在烧杯外
④将配制好的溶液往试剂瓶中转移时有少量溅出
(3)某氯化钠样品中含有少量MgCl2、Na2SO4和CaC12杂质,设计下列实验方案得到纯净的氯化钠晶体。请回答下列问题:
①写出一个加入M溶液发生反应的化学方程式______(微溶物不形成沉淀)。
②Y溶液的作用是什么______
③滤液Ⅱ中除氯化钠以外,还含有其它溶质成分,如何检验______ (写出实验步骤和现象)
(4)向50g溶质质量分数为8%的氢氧化的溶液中加入50g稀硫酸恰好完全反应,得到不饱和溶液,求反应后所得溶液中溶质的质量分数______。
23.用下列实验操作可完成两个实验,请回答下列问题。
(1)上述②操作中取用粗盐所用仪器是__________;③操作中加液定容所用仪器是__________。
(2)去除粗盐中难溶性杂质(定性),实验的操作顺序是__________(填实验操作数字序号)。过滤时,发现滤液浑浊,原因可能是__________(填下列字母序号)。
A、滤纸未贴紧漏斗内壁
B、滤纸破损
C、漏斗下端管口未紧贴烧杯内壁
D、液面高于滤纸边缘
(3)用纯净氯化钠配制50g10%的氯化钠溶液,实验的操作顺序是__________(填实验操作数字序号)。实验后测得溶质质量分数小于10%,其原因可能是__________(填下列字母序号)。
E、烧杯中有水
F、称量氯化钠时,将氯化钠放在右盘(游码始终位于零刻度)
G、量液时仰视读数
H、装瓶时溶液洒出
(4)室温为20℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤Ⅰ:查阅资料,得到氯化铜溶解度数据如下:
温度(℃) 0 20 25 40 50 60 80
溶解度(g) 69.2 74.5 76.4 81.8 85.5 89.4 98.0
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
①母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列处理母液的方法正确的是_________。
A 向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
B 收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
C 向母液中加入适量Ca(OH)2溶液,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
②若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_________ g(只列计算式。已知CuCl2的相对分子质量为135)。
24.盐城濒临黄海,海盐文化全国知名.某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究:
(1)操作①中必须用到的一种仪器是 _______ (填序号)
A 研钵 B 量筒 C 烧杯 D 试管
(2)操作③的名称是 _____ ,操作④中用到玻璃棒,作用为 _____ 。
(3)用提纯得到的“精盐”配制100g 7.5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 _____ (填序号)
①氯化钠固体不纯
②称量时精盐与砝码放反了
③量取水时俯视读数
④装瓶时,有少量溶液洒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:
①白色沉淀的化学式为 _____ .
②在得到的滤液中加入足量的稀盐酸的目的是 _____ .
③若实验过程中不考虑损耗,最终到的NaCl固体的质量将 _____ (填“大于”、“小于”或“等于”)原精盐中NaCl的质量.
参考答案
1.C
【详解】
A、溶解时用玻璃棒搅拌以加快溶解速率,说法正确,不符合题意;
B、过滤可实现固液分离,过滤后得到的滤渣是粗盐中的难溶性杂质,说法正确,不符合题意;
C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,符合题意;
D、粗盐若未能充分溶解,提纯后氯化钠的质量偏小,则实验结果中精盐的产率将偏低,不符合题意。
故选C。
2.D
【详解】
A、氯化钠的溶解度受温度变化影响不大,且随温度升高而变大,升温不会使食盐析出,所以A错;
B、海水晒盐是用阳光和风力使水分蒸发得到食盐,而不是利用海风降温,所以B错;
C、海水是混合物,食盐从中析出不是化学变化,不是分解反应,所以C错;
D、一般来说,对于任何溶质,蒸发溶剂的方法都能使溶质析出,所以D对;
故选D。
3.C
【解析】
过滤是指将固体和液体分离的步骤,图C中,是将药渣分离出来的过程,故选C。
4.C
【详解】
A、温度计可以精确到0.1℃,测得人体体温是37.5℃,正确;
B、托盘天平用于粗略称量药品的质量,能准确到0.1g,故可以用托盘天平称得氧化铜粉末11.5g,正确;
C、用10mL量筒,能准确到0.1mL,不能量取8.52mL某溶液,错误;
D、氯化钠的质量分数= ,可以计算得出氯化钠的质量分数为90.5%,该数据合理,正确。
故选C。
5.B
【详解】
A、蒸发皿可直接进行加热,无需将蒸发皿放在石棉网上进行加热,不符合题意;
B、过滤后,滤液仍然浑浊,应重新过滤,说法正确,符合题意;
C、蒸发时,应用玻璃棒不断搅拌,防止局部温度过高,造成液滴飞溅,不符合题意;
D、蒸发时,当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,不符合题意。
故选B。
6.A
【详解】
A、氯化钾溶液与氯化钠溶液中都存在可自由移动的离子,都能导电,通过测量导电性,不能区分氯化钾溶液与氯化钠溶液,故A错误;
B、铁能被磁铁吸引,铜不能被磁铁吸引,使用磁铁吸引,可分离铁粉和铜粉的混合物,故B正确;
C、采用溶解、过滤、蒸发的方法可除去不溶性杂质,可提纯粗盐,故C正确;
D、羊毛线燃烧有烧焦羽毛的气味,涤纶燃烧有特殊气味,可采用燃烧闻气味的方法鉴别羊毛线和涤纶线,故D正确。故选A。
7.D
【详解】
A、操作1为过滤,操作2蒸发,操作3为溶解。都要用到玻璃棒。正确;
B、操作2和3可以合并成一步,这样减少能耗。正确;
C、根据图可知氢气可以循环利用。正确;
D、电解饱和氯化钠溶液得到氯气、氢氧化钠和氢气,反应物为水和氯化钠,所以不属于分解反应。错误;
故选D。
8.B
【详解】
A、氯化钾不含氧元素,不能分解产生氧气,用加热KCl和MnO2混合物的方法不能制O2,错误;B、铁粉与稀盐酸反应生成氢气,木炭粉和稀盐酸不反应,氧化铜粉末与稀盐酸反应生成氯化铜和水,溶液由无色变为蓝色,可以鉴别,正确;C、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,错误;D、用内壁涂有澄清石灰水的烧杯罩在甲烷燃烧的火焰上方,二氧化碳能使澄清的石灰水变浑浊,能检验二氧化碳的存在,不能检验有水生成,错误。故选B。
9.D
【详解】
A、纯碱是碳酸钠,故A错误;
B、析出晶体后剩余溶液是NaHCO3的饱和溶液同时含有溶质NH4Cl,故所含溶质是NaHCO3与 NH4Cl,故B错误;
C、配制溶液时玻璃棒搅拌的目的是加速溶解,故C错误;
D、向饱和食盐水中先通入氨气后溶液显碱性,而二氧化碳是酸性气体,促进二氧化碳的吸收,故D正确。
故选D。
10.C
【详解】
A、NaCl固体在NaCl饱和溶NaCl液中的溶解是一种动态平衡,食盐颗粒小一些能加快溶解和析出的速率,有利于提纯,故A错误;
B、设计实验的根据是NaCl固体在NaCl饱和溶液中的溶解不再增加,而MgCl2在NaCl饱和溶液中的溶解未达到饱和,因此MgCl2溶解只剩下纯净的NaCl,故B错误;
C、饱和NaCl溶液中,NaCl固体的溶解处于平衡状态,溶解和析出同时存在,NaCl溶解的量不会再增加,但对于MgCl2并未达到饱和,因此最后的固体中只存在NaCl,故C正确;
D、NaCl溶液已达到饱和,温度不变,浓度不可能变大,故D错误。
故选C。
11.B
【详解】
A、CuO不燃烧,碳粉可以燃烧,氧化铜和稀硫酸反应,碳和稀硫酸不反应,氢气和氧化铜加热生成铜和水,碳和氧化铜高温生成铜和二氧化碳,故A正确;
B、原子在化学反应中不可以再分,故B不正确。
C、降低pH碱性减弱,加水稀释,酸碱中和、生成中性溶液都可以,故C正确。
D、粗盐提纯玻璃棒的三大作用;搅拌引流防止液滴飞溅,故D正确。故选B。
12.D
【详解】
A、除去粗盐水中的镁离子、钙离子、硫酸根离子,可依次加入氢氧化钠,镁离子和氢氧根离子结合生成氢氧化镁,除去镁离子,加入氯化钡溶液,钡离子和硫酸根离子结合生成硫酸钡,除去硫酸根离子,加入碳酸钠溶液,碳酸根离子和钙离子结合生成碳酸钙,碳酸根离子和钡离子结合生成碳酸钡,可除去钙离子和钡离子,加入碳酸钠应在加入氯化钡之后,这样才能将过量的氯化钡除去,不符合题意;
B、氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,取适量样品加水充分溶解,加几滴稀盐酸,稀盐酸先和氢氧化钠反应,被消耗点,无法和碳酸钠反应,无法验证氢氧化钠是否变质,应加入过量的稀盐酸,不符合题意;
C、加足量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜和稀硫酸不反应,充分反应后,过滤,可得铜,达不到分离的目的,不符合题意;
D、氯化钾溶于水,二氧化锰难溶于水,加水充分溶解,过滤、蒸发结晶可得氯化钾,符合题意。
故选D。
13.B
【详解】
A、分离氯化钾与二氧化锰的混合物,加水溶解后,过滤,蒸发滤液后得到纯净的氯化钾,将滤渣洗涤、干燥,得到纯净的二氧化锰,选项正确;
B、碱石灰也能与二氧化碳反应,会将欲保留的物质反应掉,不符合除杂原则,选项错误;
C、氢氧化钾置于空气中易与空气中的二氧化碳反应生成碳酸钾和水,碳酸钾与澄清石灰水反应生成碳酸钙沉淀和氢氧化钾,所以取少量KOH溶液,滴入澄清石灰水观察是否产生白色沉淀即可检验露置在空气中的KOH溶液是否变质,选项正确;
D、氯化钠溶液呈中性,氢氧化钠溶液呈碱性,稀盐酸呈酸性,紫色石蕊试液遇到酸碱性不同的溶液呈现不同的颜色,所以可以紫色石蕊试液来鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸,选项正确,故选B。
14.D
【详解】
A、在取用粗盐时,应将瓶塞倒放在桌面上,A错误;
B、溶解操作不能在量筒中进行,应在烧杯中进行,B错误;
C、过滤时要用玻璃棒引流,C错误;
D、蒸发结晶时,应用玻璃棒不断搅拌,以防液体受热不均匀,造成液滴飞溅,D正确。
故选D。
15.B
【详解】
试题分析:A、海水进入贮水池,海水的成分基本不变,正确,B、析出晶体后的母液是氯化钠的饱和溶液,正确,C、蒸发就是通过风吹日晒,把水分蒸发,所以在蒸发池中,海水中水的质量逐渐减少,正确,D、在蒸发池中,由于海水中水的质量逐渐减少,而氯化钠的质量不变,所以海水中氯化钠的质量分数逐渐增大,正确,故选B
16.C
【详解】
镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,从而使溶液的pH=7。注意不能使用硝酸钡和碳酸钾、硫酸溶液,否则会引入新的杂质硝酸钠、氯化钾、硫酸钾等。上述方案的步骤②、步骤③和步骤⑤中所加的物质,分别是氯化钡、碳酸钠、盐酸;故选C。
17.遵守 生成的气体跑到了空气中 防止因局部温度过高,造成液滴飞溅 蒸发皿中出现较多固体 二氧化碳不燃烧也不支持燃烧,密度比空气大 灭火
【详解】
(1)实验A中反应后天平不平衡,该反应遵守质量守恒定律,反应后天平不平衡的原因是:盐酸和小苏打分解生成氯化钠、水和二氧化碳,生成的二氧化碳逸出装置;故填:遵守;生成的气体跑到了空气中;
(2)在加热过程中为了防止因局部温度过高造成液体飞溅,要用玻璃棒不停地搅拌,当蒸发皿中出现较多固体时停止加热;故填:防止因局部温度过高,造成液滴飞溅;蒸发皿中出现较多固体;
(3)C实验的现象是底层的蜡烛先熄灭,然后上层的蜡烛后熄灭,通过实验可知,二氧化碳的密度比空气大,不支持燃烧也不能燃烧,由此可知二氧化碳可用于灭火;故填:二氧化碳不燃烧也不支持燃烧,密度比空气大;灭火。
18.BDC。 小于
【详解】
(1)粗盐中难溶性杂质去除的主要操作顺序是溶解B、过滤D、蒸发C,故操作顺序是BDC;
(2),配制11%的氯化钠溶液100g,需要氯化钠质量为:100g×11%=11g,溶液的质量等于溶质和溶剂的质量和,需要水的质量为:100g﹣11g=89g,如按如图2进行称量和量取,其它操作均规范无误,称量的氯化钠质量为:10g﹣1g=9g,最终导致配制的氯化钠溶液的溶质质量分数为: ×100%=9.2%<11%。
19.cba(或bca或bac) 富集、提纯MgCl2 促进碳酸氢钠的生成与析出 NaCl+H2O+CO2+NH3=NH4Cl+NaHCO3 置换反应
【详解】
(1)除去氯化镁、硫酸钠、氯化钙的顺序是除氯化钙,必须在除硫酸钠之后,因为过量的BaCl2溶液,可以用除氯化钙的过量的Na2CO3溶液,一起除去,而除氯化镁的顺序,可以在任何位置,故填写:cba(或bca或bac);
(2) 母液中除了含有MgCl2,还含有其他杂质,为了提纯、富集MgCl2需利用步骤Ⅳ、Ⅴ的转化过程,故填写:富集、提纯MgCl2;
(3) 步骤Ⅱ中先向饱和食盐水中通入氨气,是为了促进碳酸氢钠的生成与析出,故填写:促进碳酸氢钠的生成与析出;
步骤Ⅱ的反应是:氯化钠、水、二氧化碳和氨气生成氯化铵和碳酸氢钠,化学方程式为:NaCl+H2O+CO2+NH3=NH4Cl+NaHCO3;
(4)由图可知,步骤Ⅰ为复分解反应,步骤III为分解反应,没有涉及到的基本反应类型为置换反应,故填写:置换反应
20.蒸发皿 能 BaSO4、Mg(OH)2、 BaCO3、CaCO3(加“泥沙”也正确) 除去滤液中的NaOH、Na2CO3
【详解】
(1) “蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、火柴、玻璃棒、酒精灯、蒸发皿;(2) 操作③是加入过量的氢氧化钠溶液除去粗盐中的氯化镁,操作④是加入过量的碳酸钠除去氯化钙和过量的氯化钡,最后加入稀盐酸除去过量的氢氧化钠和碳酸钠,操作③和④的顺序颠倒对除去过量的氢氧化钠和碳酸钠无影响,故操作③和④的顺序能颠倒;(3)过滤是将溶液和不溶性的固体进行分离的一种操作,而经过⑤步的操作后分出了滤液和沉淀两部分,氯化钡和硫酸钠反应生成硫酸钡白色沉淀,碳酸钠和氯化钡反应生成碳酸钡白色沉淀,碳酸钠和氯化钙反应生成碳酸钙,氢氧化钠和氯化镁反应生成氢氧化镁白色沉淀,故操作⑤得到沉淀成分是:BaSO4、Mg(OH)2、 BaCO3、CaCO3;(4)通过前面的反应除杂后,滤液中的物质是氢氧化钠和碳酸钠,与盐酸反应生成氯化钠水和二氧化碳,NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═NaCl+CO2↑+H2O。
21.使液体均匀受热,防止液体飞溅 偏小 90%
【详解】
(1)在去除粗盐中难溶性杂质时,蒸发操作中使用玻璃棒的作用是使液体均匀受热,防止液体飞溅。故填:使液体均匀受热,防止液体飞溅。
(2)在量取蒸馏水读数时,视线如图所示时,会导致量取的水偏多,从而导致所配制溶液的溶质质量分数偏小。故填:偏小。
(3)氯化镁、氯化钙、氯化钠中组成元素的质量关系为:
由以上质量关系可知,和1.2g镁元素结合的氯元素质量是3.55g,和2g钙元素结合的氯元素质量是3.55g,和氯化钠结合的氯元素质量为:42.6g﹣3.55g﹣3.55g=35.5g,则和氯化钠结合的钠元素质量是23g。则氯化钠质量为:35.5g+23g=58.5g;130g粗盐样品溶解于足量水中,过滤得到800g滤液,取出400g溶液,则粗盐的质量是65g。
则原粗盐样品中氯化钠的质量分数为:×100%=90%.
故填:90%.
22. 4.5 ②③ 、(写一个即可) 除去氯化钙和过量的氢氧化钡 取滤液Ⅱ少许,加入足量的氯化钙溶液,有白色沉淀产生,说明有碳酸钠,静置,取上层清液滴加酚酞溶液,溶液变红,说明有氢氧化钠 7.1%
【详解】
(1)一种钠的化合物, 是焙制糕点所用的发酵粉的主要成分,应是碳酸氢钠,其化学式为 ;工业上用石灰和纯碱反应制烧碱,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,其反应的化学方程式为。
(2)溶质质量=溶液质量×溶质的质量分数,配制一瓶如图所示的溶液需氯化钠的质量为;
①往烧杯中加水时有水溅出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大;
②用量筒量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小;
③转移已称量好的氯化钠固体时,部分酒落在烧杯外,造成实际溶解的氯化钠固体质量偏小,则使溶质质量分数偏小;
④溶液具有均一性、稳定性,将配制好的溶液往试剂瓶中转移时有少量溅出,不影响溶质质量分数;
故填:②③。
(3)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加含钡离子的溶液之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子;M溶液应为氢氧化钡溶液;
①加入M(氢氧化钡)溶液,MgCl2与氢氧化钡反应生成氢氧化镁沉淀和氯化钡,Na2SO4和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,发生反应的化学方程式分别为、(写一个即可)。
②滤液Ⅰ中含有氯化钙和过量的氢氧化钡,Y溶液为碳酸钠,作用是除去氯化钙和过量的氢氧化钡。
③滤液Ⅱ中除氯化钠以外,可能还含有氢氧化钠、碳酸钠,碳酸钠与足量的氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,静置,取上层清液滴加酚酞溶液,溶液变红,说明含有氢氧化钠,故检验方法为:取滤液Ⅱ少许,加入足量的氯化钙溶液,有白色沉淀产生,说明有碳酸钠,静置,取上层清液滴加酚酞溶液,溶液变红,说明有氢氧化钠。
(4)设反应生成硫酸钠的质量为x,则
解得x=7.1g;
所得溶液中溶质的质量分数为。
答:所得溶液中溶质的质量分数为7.1%。
23.药匙 胶头滴管 ①④⑤ BD ②③① EG C 设100g母液含有的氯化铜的质量为m,则m:100g=74.5g:(100g+74.5g),解得m≈42.7g,设需要铁的质量为x,
x=
【详解】
(1)据图可知操作②是称量一定质量的食盐,食盐是固体小颗粒,可用药匙取用;量取一定体积的水,先用倾倒法向量筒中加入水至接近刻度,再用胶头滴管滴加到准确刻度;
(2)粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,正确的实验操作顺序是①④⑤;
A、滤纸没有紧贴漏斗内壁,会影响过滤的速率,而不会使滤液浑浊,故错误;
B、滤纸破损,会使杂质得不到过滤,使滤液浑浊,故正确;
C、漏斗下端管口没有紧贴烧杯内壁,会使液滴飞溅,而不会影响滤液浑浊,故错误;
D、液面高于滤纸边缘,会使待过滤液得不到过滤,使滤液浑浊,故正确;
故选:BD;
(3)配制50g 10%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,实验的操作步骤是②③①;
E、溶解时烧杯中有水导致溶剂偏多,所配制的溶液中溶质的质量分数偏小,符合题意;
F、称量氯化钠时,将氯化钠放在右盘,游码始终位于零刻度,所称量的氯化钠质量没有改变,对溶液中溶质的质量分数没有影响,不符合题意;
G、量取水的体积时,仰视读数导致溶剂偏多,所配制的溶液中溶质的质量分数偏小,符合题意;
H、装瓶时,有少量溶液洒出对溶液中溶质的质量分数没有影响,不符合题意;
故选:EG;
(4)①A、向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道,由于滤液中含有硝酸铜,没有除去铜离子,该方法不可用于母液处理;
B、自然风干费时间麻烦不现实,该方法不可用于母液处理;
C、向母液中加入适量Ca(OH)2溶液,充分反应后过滤,滤渣干燥保存,滤液倒入下水道,滤液中含有氯化钠,不会污染环境,故该该方法可用于母液处理;
故选:C;
②见答案。
24.A 过滤 防止局部温度过高,造成液滴飞溅 ①② Mg(OH)2 除去过量的氢氧根离子 大于
【详解】
(1)粗盐的由大变小,采用的是研磨的方法,故需要的仪器是研钵,选A。
(2)通过操作3得到了固体和液体,故采用的方法是:过滤;操作④是蒸发,蒸发要用到玻璃棒,作用是搅拌,目的是:防止局部温度过高,造成液滴飞溅。
(3)溶质的质量分数等于溶质的质量除以溶液的质量,溶液的质量=溶质的质量+溶剂的质量。溶质的质量分数偏小,可能是溶质的质量偏小或溶剂的质量偏大造成,①②都造成氯化钠质量偏少,使得溶质质量分数偏小;③量取水时俯视读数,量取的水偏少,造成溶质质量分数偏大;④装瓶时,有少量溶液洒出,不会造成溶质质量分数发生变化,因为溶液是均一的;因此本题溶质质量分数偏小的原因可能有:①②。
(4)溶液中加入氢氧化钠,氢氧化钠会与氯化镁反应生成氢氧化镁沉淀和氯化钠,故白色沉淀是氢氧化镁,化学式是:Mg(OH)2;由于加入的氢氧化钠是过量的,即氯化钠溶液中含有氢氧化钠,故要把氢氧化钠除去,加入稀盐酸的目的就是:除去过量的氢氧化钠;由于除杂质的过程中生成了氯化钠,故最终到的NaCl固体的质量将大于原精盐中NaCl的质量。
一、选择题(共16题)
1.海水“晒盐”得到的是粗盐,粗盐提纯的步骤可简单地概括为:溶解—过滤—蒸发,下列说法错误的是
A.溶解时用玻璃棒搅拌以加快溶解速率
B.过滤后得到的滤渣是粗盐中的难溶性杂质
C.蒸发时要将蒸发皿中的滤液全部蒸干才能停止加热
D.粗盐若未能充分溶解,则实验结果中精盐的产率将偏低
2.下列关于海水晒盐原理的分析正确的是
A.利用阳光照射,使海水升温得到食盐
B.利用海风降温析出食盐晶体
C.利用海水在阳光下发生分解反应制得食盐
D.利用阳光和风力使水分蒸发得到食盐
3.下列中草药煎制步骤中,属于过滤操作的是
A.A B.B C.C D.D
4.你认为下列实验测得的数据不合理的是
A.用温度计测得人体体温是37.5℃
B.用托盘天平称得氧化铜粉末的质量为11.5g
C.用10mL量筒量取8.52mL某溶液
D.测得某粗盐中氯化钠的质量分数为90.5%
5.下列有关粗盐提纯说法正确的是
A.将蒸发皿放在石棉网上加热 B.过滤后滤液仍然浑浊应重新过滤
C.蒸发时为了加快蒸发须用玻璃棒不断搅拌 D.当蒸发皿中水分全部蒸干时停止加热
6.下列实验操作,很难达到预期目的是
A.通过测量导电性,区分氯化钾溶液与氯化钠溶液
B.使用磁铁吸引,分离铁粉和铜粉的混合物
C.通过溶解、过滤、蒸发等操作,初步提纯粗盐
D.采用燃烧闻气味的方法,鉴别羊毛线和涤纶线
7.某工厂以粗盐为原料利用电解法制备氢氧化钠的流程如下:
下列说法不正确的是
A.操作 1、2、3 中都要用到玻璃棒
B.操作 2 和 3 可以合并成一步
C.该流程中氢气可以循环利用
D.电解饱和氯化钠溶液得到氯气、氢氧化钠和氢气,该反应属于分解反应
8.下列实验方案正确的是
A.制备:用加热KCl和MnO2混合物的方法制O2
B.鉴别:用稀盐酸鉴别铁粉、木炭粉和氧化铜粉末
C.除杂:用溶解、蒸发的方法除去粗盐中的难溶性杂质
D.检验:用内壁涂有澄清石灰水的烧杯罩在甲烷燃烧的火焰上方,检验有水生成
9.“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl”是著名的“侯氏制碱法”的重要反应。下列有关叙述正确的是
A.NaHCO3是纯碱
B.析出晶体后剩余溶液中溶质只有NH4Cl
C.配制饱和食盐水时,可通过搅拌来提高食盐的溶解度
D.向饱和食盐水中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收
10.纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中,正确的是
A.粗盐的晶粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解与结晶平衡
D.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
11.小丽同学对所学部分化学知识归纳如下,其中有错误的一组是
A 区分C粉和CuO粉末的三种方法 B 电解水可得到的结论
①做燃烧实验,观察现象 ②加入稀硫酸,观察现象 ③通入H2并加热,观察现象 ①水分子中含有氢原子和氧原子 ②水由氢、氧元素组成 ③分子在化学反应中不可以再分
C 降低NaOH溶液pH的三种方法 D 粗盐提纯的实验中玻璃棒的作用
①加水稀释 ②加入稀盐酸 ③加入硫酸铜溶液 ①溶解时搅拌,加速溶解 ②过滤时起到引流的作用 ③蒸发时搅拌,防止液滴飞溅
A.A B.B C.C D.D
12.下列实验方案能达到实验目的是
选项 实验目的 实验方案
A 除去粗盐水中的Mg2+、Ca2+、,得到精盐水 依次加入过量的Na2CO3溶液、BaCl2溶液、NaOH溶液,充分反应后过滤
B 检验久置空气中的NaOH固体是否变质 取适量样品加水充分溶解,加几滴稀盐酸
C 分离铁粉和铜粉的混合物 加足量稀硫酸,充分反应后,过滤
D 除去KC1中少量的MnO2 加水充分溶解,过滤,蒸发结晶
A.A B.B C.C D.D
13.下列实验方案中,不能达到实验目的的是
选项 实验目的 实验方案
A 分离KCl和MnO2的混合物 加水溶解后,过滤、蒸发、洗涤、干燥
B 除去CO2中少量HCl和水蒸气 将气体通过盛有碱石灰的U型管
C 检验露置在空气中的KOH溶液是否变质 取少量KOH溶液,滴入澄清石灰水
D 鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸 各取少量溶液于试管中,分别滴加紫色石蕊试液,观察溶液颜色变化
A.A B.B C.C D.D
14.某兴趣小组的同学进行“粗盐中难溶性杂质的去除”实验。下图是实验过程中的部分操作,其中正确的是
A.取一定量粗盐 B.溶解
C.过滤 D.蒸发结晶
15.下图是用海水提取粗盐的大致过程。下列说法错误的是
A.海水进入贮水池,海水的成分基本不变
B.析出晶体后的母液是氯化钠的不饱和溶液
C.在蒸发池中,海水中水的质量逐渐减少
D.在蒸发池中,海水中氯化钠的质量分数逐渐增大
16.要除去粗盐中含有的Na2SO4、MgC12、CaC12和泥沙等杂质,且又不混入其它杂质,小刚他们设计了一个实验方案:将粗盐溶于水,过滤得到澄清溶液,再进行下列各步骤处理:①加入NaOH溶液至沉淀完全;②加入 溶液至沉淀完全;③加入 溶液至沉淀完全;④过滤,取出滤液;⑤往滤液中加入 溶液调至溶液的pH=7;⑥蒸发浓缩,使NaC1晶体析出.上述方案的步骤②、步骤③和步骤⑤中所加的物质,你认为分别是
A.Ba(NO3)2Na2CO3HC1
B.BaC12K2CO3H2SO4
C.BaC12Na2CO3HC1
D.Ba(NO3)2K2CO3H2SO4
二、综合题(共8题)
17.如图是初中化学的一些基本实验,请回答相关问题。
(1)实验A中反应后天平不平衡,该反应_______(选填“遵守”或“不遵守”)质量守恒定律,反应后天平不平衡的原因是_______。
(2)实验B是蒸发食盐水的实验,蒸发时用玻璃棒不断搅拌的目的是_______,当_______时停止加热。
(3)根据实验C中得出的二氧化碳的有关性质是_______,所以二氧化碳可用于_______。
18.如图1是初中化学一些基本实验,请根据实验内容回答下列问题。
利用如图1进行粗盐中难溶性杂质去除和配制一定质量分数氯化钠溶液的实验。
(1)粗盐中难溶性杂质去除的主要操作顺序是_____(填字母序号);
(2)配制11%的氯化钠溶液100g。如按如图2进行称量和量取,其它操作均规范无误,最终导致配制的氯化钠溶液的溶质质量分数_____(填“大于”、“小于”或“不能确定”)
19.化学是认识、改造和应用物质的科学。从海水中提取镁、制“碱”,都体现了人类改造物质的智慧。结合下列流程图(其中部分操作和条件已略去),请回答相关问题:
(1)提纯物质常用转化的方法,就是将杂质转化为沉淀或气体而除去。粗盐中含有氯化镁、硫酸钠、氯化钙等可溶性杂质,通过步骤Ⅰ,再利用过滤操作进行除杂。步骤Ⅰ加入下列三种溶液的先后顺序为_____(填字母序号);
a.稍过量的Na2CO3溶液b.稍过量的BaCl2溶液c.稍过量的NaOH溶液
(2)母液中有MgCl2,却经历了步骤Ⅳ、Ⅴ的转化过程,其目的是_____;
(3)步骤Ⅱ中先向饱和食盐水中通入氨气,有利于二氧化碳的吸收,这样做的目的是_____,写出该反应的化学方程式_____;
(4)化学变化是改造物质的重要途径。上述流程图中没有涉及的基本反应类型是_____。
20.某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,他们要除去杂质得到精盐,设计了下列实验方案:序号① ⑧表示实验操 作,用于沉淀的试剂稍过量。
根据上述方案,回答下列问题:
(1)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、火柴、玻璃棒、酒精灯________
(2)除去杂质是有顺序的,操作③和④的顺序能否颠倒_______ (填“能”或“不能”)
(3)操作⑤得到沉淀成分是____________
(4)滤液中加适量盐酸的目的是_____________
21.食盐是一种重要的化工原料,回答下列问题
(1)在去除粗盐中难溶性杂质时,蒸发操作中使用玻璃棒的作用是_____.
(2)在量取蒸馏水读数时,视线如图所示,会造成所配制溶液的溶质质量分数_____(填“偏大”、“偏小”或“无影响”)
(3)某粗盐样品中含有氯化镁,氯化钙和泥沙等杂质.现将130g粗盐样品溶解于足量水中,过滤得到800g滤液,取出400g溶液进行测定,其中含有镁元素1.2g,钙元素2g,氯元素42.6g,则原粗盐样品中氯化钠的质量分数为_____.
22.含钠化合物是化学研究的重要内容。
(1)一种钠的化合物, 是焙制糕点所用的发酵粉的主要成分,其化学式为_________;工业上用石灰和纯碱反应制烧碱,其反应的化学方程式为______________。
(2)配制一瓶如图所示溶液需氯化钠___________g;若配制所得的氯化钠溶液的质量分数偏小,其原因可能是下列中的______(填序号)。
①往烧杯中加水时有水溅出
②用量筒取水时仰视读数
③转移已称量好的氯化钠固体时,部分酒落在烧杯外
④将配制好的溶液往试剂瓶中转移时有少量溅出
(3)某氯化钠样品中含有少量MgCl2、Na2SO4和CaC12杂质,设计下列实验方案得到纯净的氯化钠晶体。请回答下列问题:
①写出一个加入M溶液发生反应的化学方程式______(微溶物不形成沉淀)。
②Y溶液的作用是什么______
③滤液Ⅱ中除氯化钠以外,还含有其它溶质成分,如何检验______ (写出实验步骤和现象)
(4)向50g溶质质量分数为8%的氢氧化的溶液中加入50g稀硫酸恰好完全反应,得到不饱和溶液,求反应后所得溶液中溶质的质量分数______。
23.用下列实验操作可完成两个实验,请回答下列问题。
(1)上述②操作中取用粗盐所用仪器是__________;③操作中加液定容所用仪器是__________。
(2)去除粗盐中难溶性杂质(定性),实验的操作顺序是__________(填实验操作数字序号)。过滤时,发现滤液浑浊,原因可能是__________(填下列字母序号)。
A、滤纸未贴紧漏斗内壁
B、滤纸破损
C、漏斗下端管口未紧贴烧杯内壁
D、液面高于滤纸边缘
(3)用纯净氯化钠配制50g10%的氯化钠溶液,实验的操作顺序是__________(填实验操作数字序号)。实验后测得溶质质量分数小于10%,其原因可能是__________(填下列字母序号)。
E、烧杯中有水
F、称量氯化钠时,将氯化钠放在右盘(游码始终位于零刻度)
G、量液时仰视读数
H、装瓶时溶液洒出
(4)室温为20℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤Ⅰ:查阅资料,得到氯化铜溶解度数据如下:
温度(℃) 0 20 25 40 50 60 80
溶解度(g) 69.2 74.5 76.4 81.8 85.5 89.4 98.0
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
①母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列处理母液的方法正确的是_________。
A 向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
B 收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
C 向母液中加入适量Ca(OH)2溶液,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
②若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_________ g(只列计算式。已知CuCl2的相对分子质量为135)。
24.盐城濒临黄海,海盐文化全国知名.某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究:
(1)操作①中必须用到的一种仪器是 _______ (填序号)
A 研钵 B 量筒 C 烧杯 D 试管
(2)操作③的名称是 _____ ,操作④中用到玻璃棒,作用为 _____ 。
(3)用提纯得到的“精盐”配制100g 7.5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 _____ (填序号)
①氯化钠固体不纯
②称量时精盐与砝码放反了
③量取水时俯视读数
④装瓶时,有少量溶液洒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:
①白色沉淀的化学式为 _____ .
②在得到的滤液中加入足量的稀盐酸的目的是 _____ .
③若实验过程中不考虑损耗,最终到的NaCl固体的质量将 _____ (填“大于”、“小于”或“等于”)原精盐中NaCl的质量.
参考答案
1.C
【详解】
A、溶解时用玻璃棒搅拌以加快溶解速率,说法正确,不符合题意;
B、过滤可实现固液分离,过滤后得到的滤渣是粗盐中的难溶性杂质,说法正确,不符合题意;
C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,符合题意;
D、粗盐若未能充分溶解,提纯后氯化钠的质量偏小,则实验结果中精盐的产率将偏低,不符合题意。
故选C。
2.D
【详解】
A、氯化钠的溶解度受温度变化影响不大,且随温度升高而变大,升温不会使食盐析出,所以A错;
B、海水晒盐是用阳光和风力使水分蒸发得到食盐,而不是利用海风降温,所以B错;
C、海水是混合物,食盐从中析出不是化学变化,不是分解反应,所以C错;
D、一般来说,对于任何溶质,蒸发溶剂的方法都能使溶质析出,所以D对;
故选D。
3.C
【解析】
过滤是指将固体和液体分离的步骤,图C中,是将药渣分离出来的过程,故选C。
4.C
【详解】
A、温度计可以精确到0.1℃,测得人体体温是37.5℃,正确;
B、托盘天平用于粗略称量药品的质量,能准确到0.1g,故可以用托盘天平称得氧化铜粉末11.5g,正确;
C、用10mL量筒,能准确到0.1mL,不能量取8.52mL某溶液,错误;
D、氯化钠的质量分数= ,可以计算得出氯化钠的质量分数为90.5%,该数据合理,正确。
故选C。
5.B
【详解】
A、蒸发皿可直接进行加热,无需将蒸发皿放在石棉网上进行加热,不符合题意;
B、过滤后,滤液仍然浑浊,应重新过滤,说法正确,符合题意;
C、蒸发时,应用玻璃棒不断搅拌,防止局部温度过高,造成液滴飞溅,不符合题意;
D、蒸发时,当蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,不符合题意。
故选B。
6.A
【详解】
A、氯化钾溶液与氯化钠溶液中都存在可自由移动的离子,都能导电,通过测量导电性,不能区分氯化钾溶液与氯化钠溶液,故A错误;
B、铁能被磁铁吸引,铜不能被磁铁吸引,使用磁铁吸引,可分离铁粉和铜粉的混合物,故B正确;
C、采用溶解、过滤、蒸发的方法可除去不溶性杂质,可提纯粗盐,故C正确;
D、羊毛线燃烧有烧焦羽毛的气味,涤纶燃烧有特殊气味,可采用燃烧闻气味的方法鉴别羊毛线和涤纶线,故D正确。故选A。
7.D
【详解】
A、操作1为过滤,操作2蒸发,操作3为溶解。都要用到玻璃棒。正确;
B、操作2和3可以合并成一步,这样减少能耗。正确;
C、根据图可知氢气可以循环利用。正确;
D、电解饱和氯化钠溶液得到氯气、氢氧化钠和氢气,反应物为水和氯化钠,所以不属于分解反应。错误;
故选D。
8.B
【详解】
A、氯化钾不含氧元素,不能分解产生氧气,用加热KCl和MnO2混合物的方法不能制O2,错误;B、铁粉与稀盐酸反应生成氢气,木炭粉和稀盐酸不反应,氧化铜粉末与稀盐酸反应生成氯化铜和水,溶液由无色变为蓝色,可以鉴别,正确;C、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,错误;D、用内壁涂有澄清石灰水的烧杯罩在甲烷燃烧的火焰上方,二氧化碳能使澄清的石灰水变浑浊,能检验二氧化碳的存在,不能检验有水生成,错误。故选B。
9.D
【详解】
A、纯碱是碳酸钠,故A错误;
B、析出晶体后剩余溶液是NaHCO3的饱和溶液同时含有溶质NH4Cl,故所含溶质是NaHCO3与 NH4Cl,故B错误;
C、配制溶液时玻璃棒搅拌的目的是加速溶解,故C错误;
D、向饱和食盐水中先通入氨气后溶液显碱性,而二氧化碳是酸性气体,促进二氧化碳的吸收,故D正确。
故选D。
10.C
【详解】
A、NaCl固体在NaCl饱和溶NaCl液中的溶解是一种动态平衡,食盐颗粒小一些能加快溶解和析出的速率,有利于提纯,故A错误;
B、设计实验的根据是NaCl固体在NaCl饱和溶液中的溶解不再增加,而MgCl2在NaCl饱和溶液中的溶解未达到饱和,因此MgCl2溶解只剩下纯净的NaCl,故B错误;
C、饱和NaCl溶液中,NaCl固体的溶解处于平衡状态,溶解和析出同时存在,NaCl溶解的量不会再增加,但对于MgCl2并未达到饱和,因此最后的固体中只存在NaCl,故C正确;
D、NaCl溶液已达到饱和,温度不变,浓度不可能变大,故D错误。
故选C。
11.B
【详解】
A、CuO不燃烧,碳粉可以燃烧,氧化铜和稀硫酸反应,碳和稀硫酸不反应,氢气和氧化铜加热生成铜和水,碳和氧化铜高温生成铜和二氧化碳,故A正确;
B、原子在化学反应中不可以再分,故B不正确。
C、降低pH碱性减弱,加水稀释,酸碱中和、生成中性溶液都可以,故C正确。
D、粗盐提纯玻璃棒的三大作用;搅拌引流防止液滴飞溅,故D正确。故选B。
12.D
【详解】
A、除去粗盐水中的镁离子、钙离子、硫酸根离子,可依次加入氢氧化钠,镁离子和氢氧根离子结合生成氢氧化镁,除去镁离子,加入氯化钡溶液,钡离子和硫酸根离子结合生成硫酸钡,除去硫酸根离子,加入碳酸钠溶液,碳酸根离子和钙离子结合生成碳酸钙,碳酸根离子和钡离子结合生成碳酸钡,可除去钙离子和钡离子,加入碳酸钠应在加入氯化钡之后,这样才能将过量的氯化钡除去,不符合题意;
B、氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,取适量样品加水充分溶解,加几滴稀盐酸,稀盐酸先和氢氧化钠反应,被消耗点,无法和碳酸钠反应,无法验证氢氧化钠是否变质,应加入过量的稀盐酸,不符合题意;
C、加足量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜和稀硫酸不反应,充分反应后,过滤,可得铜,达不到分离的目的,不符合题意;
D、氯化钾溶于水,二氧化锰难溶于水,加水充分溶解,过滤、蒸发结晶可得氯化钾,符合题意。
故选D。
13.B
【详解】
A、分离氯化钾与二氧化锰的混合物,加水溶解后,过滤,蒸发滤液后得到纯净的氯化钾,将滤渣洗涤、干燥,得到纯净的二氧化锰,选项正确;
B、碱石灰也能与二氧化碳反应,会将欲保留的物质反应掉,不符合除杂原则,选项错误;
C、氢氧化钾置于空气中易与空气中的二氧化碳反应生成碳酸钾和水,碳酸钾与澄清石灰水反应生成碳酸钙沉淀和氢氧化钾,所以取少量KOH溶液,滴入澄清石灰水观察是否产生白色沉淀即可检验露置在空气中的KOH溶液是否变质,选项正确;
D、氯化钠溶液呈中性,氢氧化钠溶液呈碱性,稀盐酸呈酸性,紫色石蕊试液遇到酸碱性不同的溶液呈现不同的颜色,所以可以紫色石蕊试液来鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸,选项正确,故选B。
14.D
【详解】
A、在取用粗盐时,应将瓶塞倒放在桌面上,A错误;
B、溶解操作不能在量筒中进行,应在烧杯中进行,B错误;
C、过滤时要用玻璃棒引流,C错误;
D、蒸发结晶时,应用玻璃棒不断搅拌,以防液体受热不均匀,造成液滴飞溅,D正确。
故选D。
15.B
【详解】
试题分析:A、海水进入贮水池,海水的成分基本不变,正确,B、析出晶体后的母液是氯化钠的饱和溶液,正确,C、蒸发就是通过风吹日晒,把水分蒸发,所以在蒸发池中,海水中水的质量逐渐减少,正确,D、在蒸发池中,由于海水中水的质量逐渐减少,而氯化钠的质量不变,所以海水中氯化钠的质量分数逐渐增大,正确,故选B
16.C
【详解】
镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,从而使溶液的pH=7。注意不能使用硝酸钡和碳酸钾、硫酸溶液,否则会引入新的杂质硝酸钠、氯化钾、硫酸钾等。上述方案的步骤②、步骤③和步骤⑤中所加的物质,分别是氯化钡、碳酸钠、盐酸;故选C。
17.遵守 生成的气体跑到了空气中 防止因局部温度过高,造成液滴飞溅 蒸发皿中出现较多固体 二氧化碳不燃烧也不支持燃烧,密度比空气大 灭火
【详解】
(1)实验A中反应后天平不平衡,该反应遵守质量守恒定律,反应后天平不平衡的原因是:盐酸和小苏打分解生成氯化钠、水和二氧化碳,生成的二氧化碳逸出装置;故填:遵守;生成的气体跑到了空气中;
(2)在加热过程中为了防止因局部温度过高造成液体飞溅,要用玻璃棒不停地搅拌,当蒸发皿中出现较多固体时停止加热;故填:防止因局部温度过高,造成液滴飞溅;蒸发皿中出现较多固体;
(3)C实验的现象是底层的蜡烛先熄灭,然后上层的蜡烛后熄灭,通过实验可知,二氧化碳的密度比空气大,不支持燃烧也不能燃烧,由此可知二氧化碳可用于灭火;故填:二氧化碳不燃烧也不支持燃烧,密度比空气大;灭火。
18.BDC。 小于
【详解】
(1)粗盐中难溶性杂质去除的主要操作顺序是溶解B、过滤D、蒸发C,故操作顺序是BDC;
(2),配制11%的氯化钠溶液100g,需要氯化钠质量为:100g×11%=11g,溶液的质量等于溶质和溶剂的质量和,需要水的质量为:100g﹣11g=89g,如按如图2进行称量和量取,其它操作均规范无误,称量的氯化钠质量为:10g﹣1g=9g,最终导致配制的氯化钠溶液的溶质质量分数为: ×100%=9.2%<11%。
19.cba(或bca或bac) 富集、提纯MgCl2 促进碳酸氢钠的生成与析出 NaCl+H2O+CO2+NH3=NH4Cl+NaHCO3 置换反应
【详解】
(1)除去氯化镁、硫酸钠、氯化钙的顺序是除氯化钙,必须在除硫酸钠之后,因为过量的BaCl2溶液,可以用除氯化钙的过量的Na2CO3溶液,一起除去,而除氯化镁的顺序,可以在任何位置,故填写:cba(或bca或bac);
(2) 母液中除了含有MgCl2,还含有其他杂质,为了提纯、富集MgCl2需利用步骤Ⅳ、Ⅴ的转化过程,故填写:富集、提纯MgCl2;
(3) 步骤Ⅱ中先向饱和食盐水中通入氨气,是为了促进碳酸氢钠的生成与析出,故填写:促进碳酸氢钠的生成与析出;
步骤Ⅱ的反应是:氯化钠、水、二氧化碳和氨气生成氯化铵和碳酸氢钠,化学方程式为:NaCl+H2O+CO2+NH3=NH4Cl+NaHCO3;
(4)由图可知,步骤Ⅰ为复分解反应,步骤III为分解反应,没有涉及到的基本反应类型为置换反应,故填写:置换反应
20.蒸发皿 能 BaSO4、Mg(OH)2、 BaCO3、CaCO3(加“泥沙”也正确) 除去滤液中的NaOH、Na2CO3
【详解】
(1) “蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、火柴、玻璃棒、酒精灯、蒸发皿;(2) 操作③是加入过量的氢氧化钠溶液除去粗盐中的氯化镁,操作④是加入过量的碳酸钠除去氯化钙和过量的氯化钡,最后加入稀盐酸除去过量的氢氧化钠和碳酸钠,操作③和④的顺序颠倒对除去过量的氢氧化钠和碳酸钠无影响,故操作③和④的顺序能颠倒;(3)过滤是将溶液和不溶性的固体进行分离的一种操作,而经过⑤步的操作后分出了滤液和沉淀两部分,氯化钡和硫酸钠反应生成硫酸钡白色沉淀,碳酸钠和氯化钡反应生成碳酸钡白色沉淀,碳酸钠和氯化钙反应生成碳酸钙,氢氧化钠和氯化镁反应生成氢氧化镁白色沉淀,故操作⑤得到沉淀成分是:BaSO4、Mg(OH)2、 BaCO3、CaCO3;(4)通过前面的反应除杂后,滤液中的物质是氢氧化钠和碳酸钠,与盐酸反应生成氯化钠水和二氧化碳,NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═NaCl+CO2↑+H2O。
21.使液体均匀受热,防止液体飞溅 偏小 90%
【详解】
(1)在去除粗盐中难溶性杂质时,蒸发操作中使用玻璃棒的作用是使液体均匀受热,防止液体飞溅。故填:使液体均匀受热,防止液体飞溅。
(2)在量取蒸馏水读数时,视线如图所示时,会导致量取的水偏多,从而导致所配制溶液的溶质质量分数偏小。故填:偏小。
(3)氯化镁、氯化钙、氯化钠中组成元素的质量关系为:
由以上质量关系可知,和1.2g镁元素结合的氯元素质量是3.55g,和2g钙元素结合的氯元素质量是3.55g,和氯化钠结合的氯元素质量为:42.6g﹣3.55g﹣3.55g=35.5g,则和氯化钠结合的钠元素质量是23g。则氯化钠质量为:35.5g+23g=58.5g;130g粗盐样品溶解于足量水中,过滤得到800g滤液,取出400g溶液,则粗盐的质量是65g。
则原粗盐样品中氯化钠的质量分数为:×100%=90%.
故填:90%.
22. 4.5 ②③ 、(写一个即可) 除去氯化钙和过量的氢氧化钡 取滤液Ⅱ少许,加入足量的氯化钙溶液,有白色沉淀产生,说明有碳酸钠,静置,取上层清液滴加酚酞溶液,溶液变红,说明有氢氧化钠 7.1%
【详解】
(1)一种钠的化合物, 是焙制糕点所用的发酵粉的主要成分,应是碳酸氢钠,其化学式为 ;工业上用石灰和纯碱反应制烧碱,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,其反应的化学方程式为。
(2)溶质质量=溶液质量×溶质的质量分数,配制一瓶如图所示的溶液需氯化钠的质量为;
①往烧杯中加水时有水溅出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大;
②用量筒量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小;
③转移已称量好的氯化钠固体时,部分酒落在烧杯外,造成实际溶解的氯化钠固体质量偏小,则使溶质质量分数偏小;
④溶液具有均一性、稳定性,将配制好的溶液往试剂瓶中转移时有少量溅出,不影响溶质质量分数;
故填:②③。
(3)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加含钡离子的溶液之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子;M溶液应为氢氧化钡溶液;
①加入M(氢氧化钡)溶液,MgCl2与氢氧化钡反应生成氢氧化镁沉淀和氯化钡,Na2SO4和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,发生反应的化学方程式分别为、(写一个即可)。
②滤液Ⅰ中含有氯化钙和过量的氢氧化钡,Y溶液为碳酸钠,作用是除去氯化钙和过量的氢氧化钡。
③滤液Ⅱ中除氯化钠以外,可能还含有氢氧化钠、碳酸钠,碳酸钠与足量的氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,静置,取上层清液滴加酚酞溶液,溶液变红,说明含有氢氧化钠,故检验方法为:取滤液Ⅱ少许,加入足量的氯化钙溶液,有白色沉淀产生,说明有碳酸钠,静置,取上层清液滴加酚酞溶液,溶液变红,说明有氢氧化钠。
(4)设反应生成硫酸钠的质量为x,则
解得x=7.1g;
所得溶液中溶质的质量分数为。
答:所得溶液中溶质的质量分数为7.1%。
23.药匙 胶头滴管 ①④⑤ BD ②③① EG C 设100g母液含有的氯化铜的质量为m,则m:100g=74.5g:(100g+74.5g),解得m≈42.7g,设需要铁的质量为x,
x=
【详解】
(1)据图可知操作②是称量一定质量的食盐,食盐是固体小颗粒,可用药匙取用;量取一定体积的水,先用倾倒法向量筒中加入水至接近刻度,再用胶头滴管滴加到准确刻度;
(2)粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,正确的实验操作顺序是①④⑤;
A、滤纸没有紧贴漏斗内壁,会影响过滤的速率,而不会使滤液浑浊,故错误;
B、滤纸破损,会使杂质得不到过滤,使滤液浑浊,故正确;
C、漏斗下端管口没有紧贴烧杯内壁,会使液滴飞溅,而不会影响滤液浑浊,故错误;
D、液面高于滤纸边缘,会使待过滤液得不到过滤,使滤液浑浊,故正确;
故选:BD;
(3)配制50g 10%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,实验的操作步骤是②③①;
E、溶解时烧杯中有水导致溶剂偏多,所配制的溶液中溶质的质量分数偏小,符合题意;
F、称量氯化钠时,将氯化钠放在右盘,游码始终位于零刻度,所称量的氯化钠质量没有改变,对溶液中溶质的质量分数没有影响,不符合题意;
G、量取水的体积时,仰视读数导致溶剂偏多,所配制的溶液中溶质的质量分数偏小,符合题意;
H、装瓶时,有少量溶液洒出对溶液中溶质的质量分数没有影响,不符合题意;
故选:EG;
(4)①A、向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道,由于滤液中含有硝酸铜,没有除去铜离子,该方法不可用于母液处理;
B、自然风干费时间麻烦不现实,该方法不可用于母液处理;
C、向母液中加入适量Ca(OH)2溶液,充分反应后过滤,滤渣干燥保存,滤液倒入下水道,滤液中含有氯化钠,不会污染环境,故该该方法可用于母液处理;
故选:C;
②见答案。
24.A 过滤 防止局部温度过高,造成液滴飞溅 ①② Mg(OH)2 除去过量的氢氧根离子 大于
【详解】
(1)粗盐的由大变小,采用的是研磨的方法,故需要的仪器是研钵,选A。
(2)通过操作3得到了固体和液体,故采用的方法是:过滤;操作④是蒸发,蒸发要用到玻璃棒,作用是搅拌,目的是:防止局部温度过高,造成液滴飞溅。
(3)溶质的质量分数等于溶质的质量除以溶液的质量,溶液的质量=溶质的质量+溶剂的质量。溶质的质量分数偏小,可能是溶质的质量偏小或溶剂的质量偏大造成,①②都造成氯化钠质量偏少,使得溶质质量分数偏小;③量取水时俯视读数,量取的水偏少,造成溶质质量分数偏大;④装瓶时,有少量溶液洒出,不会造成溶质质量分数发生变化,因为溶液是均一的;因此本题溶质质量分数偏小的原因可能有:①②。
(4)溶液中加入氢氧化钠,氢氧化钠会与氯化镁反应生成氢氧化镁沉淀和氯化钠,故白色沉淀是氢氧化镁,化学式是:Mg(OH)2;由于加入的氢氧化钠是过量的,即氯化钠溶液中含有氢氧化钠,故要把氢氧化钠除去,加入稀盐酸的目的就是:除去过量的氢氧化钠;由于除杂质的过程中生成了氯化钠,故最终到的NaCl固体的质量将大于原精盐中NaCl的质量。
同课章节目录
