2021_2022学年新教材高中化学第4章化学反应与电能第1节第1课时原电池的工作原理课件新人教版选择性必修1
文档属性
| 名称 | 2021_2022学年新教材高中化学第4章化学反应与电能第1节第1课时原电池的工作原理课件新人教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 00:00:00 | ||
图片预览










文档简介
(共62张PPT)
第四章 化学反应与电能
①通过铜锌原电池的分析,了解原电池的工作原理。
②会正确判断原电池的正极和负极;学会书写电极反应式,掌握书写电极反应式的技巧与方法。
③知道化学电源的分类方法。熟悉几种常
见化学电源的组成和工作原理。
④了解化学电源广泛的应用及废旧电池对环境的危害,设想其处理方法。
⑤从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。
⑥建立对电解过程的系统分析认识的思维模型,理解电解的规律,会判断电解的产物,会书写电解的电极反应式和总反应式。
⑦通过实验科学探究金属腐蚀的本质及其原因,认识金属腐蚀的主要类型,能正确书写析氢腐蚀和吸氧腐蚀的电极反应式。
⑧认识金属腐蚀产生的危害和影响,树立防止金属腐蚀的意识,熟知金属常用的防护方法。
学习内容 考查重点
原电池 原电池的工作原理 ①新型化学电源的工作原理,特别是电极反应式的书写或正误判断
②二次电池放电或充电时的原理
③电解池、电解精炼池、电镀池的构造及原理
④电化学腐蚀的分类、原理及防止措施
⑤新型电化学装置中离子交换膜的作用、电子或离子移动方向的判断等
⑥有关原电池或电解池的计算
化学电源
电解池 电解原理
电解原理的应用
金属的腐蚀与防护 金属的腐蚀
金属的防护
第一节 原电池
第1课时 原电池的工作原理
素养目标
1.认识双液原电池相比普通原电池的优点,特别是盐桥的作用,培养宏观辨识与微观探析、变化观念与平衡思想等学科核心素养
2.依据带盐桥的锌铜原电池装置,学会分析电子、阴阳离子的移动方向,并以电极反应式的形式表达出来,培养证据推理与模型认知、变化观念与平衡思想等学科核心素养
学法指导
1.复习必修第二册中的铜锌原电池装置,巩固原电池装置的构造及形成条件
2.比较单液原电池与双液原电池的区别,认识盐桥的作用
3.依据原电池工作原理,回顾氧化还原反应中电子转移的表示方法中的“双线桥法”等知识,熟练掌握原电池电极反应式的书写方法
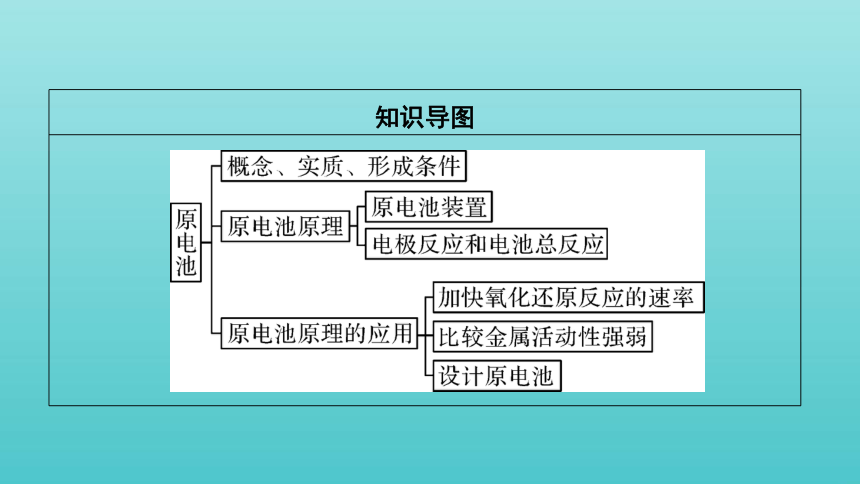
知识导图
课前 · 新知导学
1.构成条件
(1)具有两个__________不同的电极。
(2)合适的__________溶液。
(3)形成________回路(两电极用导线相连或互相接触并插入电解质溶液中)。
(4)能自发地发生________________反应。
活泼性
原电池的工作原理
电解质
闭合
氧化还原
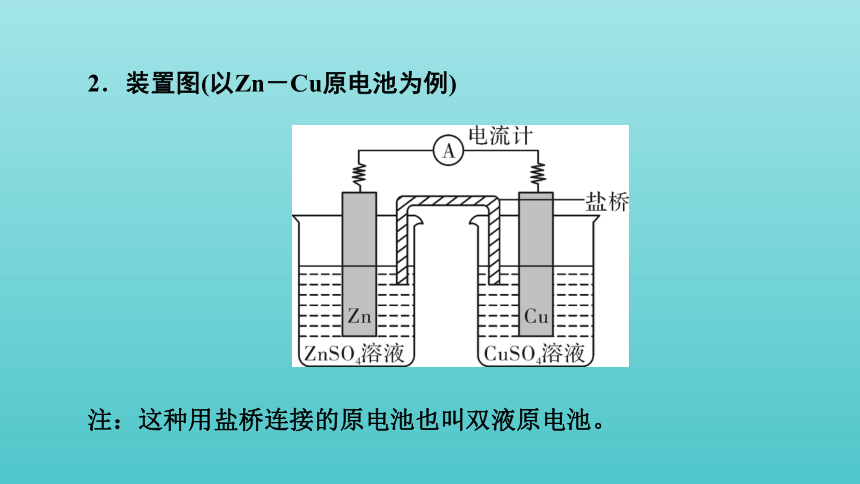
2.装置图(以Zn-Cu原电池为例)
注:这种用盐桥连接的原电池也叫双液原电池。
电极 Zn电极 Cu电极
电极名称 ________ ________
得失电子 失电子 得电子
电子流向 ________ ________
反应类型 ________反应 ________反应
电极反应式 ____________________ ___________________
总反应式 ____________________________________
3.工作原理(以上述原电池为例)
负极
正极
流出
流入
氧化
还原
Zn-2e-═══Zn2+
Cu2++2e-═══Cu
Zn+Cu2+═══Zn2++Cu
(1)盐桥在原电池装置中的作用是什么?
(2)原电池工作时,阴、阳离子在电解质溶液中的运动方向是怎样的?
微思考
【答案】(1)①连接两个“半电池”,形成闭合回路;②盐桥中的阳离子移向正极区电解质溶液中,阴离子移向负极区电解质溶液中,使氧化还原反应持续进行,不断产生电流。
(2)原电池的电解质溶液中,阴离子向负极移动,阳离子向正极移动。
正误判断。(对的打“√”,错的打“×”)
(1)原电池是把化学能转化为电能的一种装置。 ( )
(2)原电池正极发生氧化反应,负极发生还原反应。 ( )
(3)不能自发进行的氧化还原反应,通过原电池装置可以实现。
( )
(4)碳棒不能用来作原电池的电极。 ( )
(5)反应Cu+2Ag+═══2Ag+Cu2+能以原电池的形式来实现。
( )
【答案】(1)√ (2)× (3)× (4)× (5)√
2.内电路
将两电极浸入__________________中,阴、阳离子作__________________。
还原性
原电池的设计
氧化性
电解质溶液
定向运动
3.闭合回路
【答案】负 正
(1)NaOH+HCl═══NaCl+H2O可自发进行,能否设计成原电池?
(2)Zn-Cu-稀硫酸原电池中,正极“半电池”可设计为Cu-稀硫酸,负极“半电池”可设计为Zn-ZnSO4溶液,这一说法是否正确?
微思考
【答案】(1)NaOH+HCl═══NaCl+H2O不能设计成原电池,因该反应不是氧化还原反应。
(2)正确。
(2020·山东临沂高二检测)某原电池的离子方程式是Zn+Cu2+═══Zn2++Cu,该原电池正确的组成是 ( )
【答案】A
选项 正极 负极 电解质溶液
A C Zn CuCl2
B Zn Cu CuSO4
C Zn Mg CuSO4
D Cu Zn ZnCl2
课堂 · 素养初培
任务一 原电池工作原理
素养探源 核心素养 考查途径
宏观辨识与微观探析 变化观念与平衡思想 在新型化学电源中考查电极名称、电极反应式的书写或正误判断、电子或离子移动方向、电解质溶液酸碱性的变化情况等,常以选择题形式考查,也会在大题中与其他化学反应原理知识一起考查
[情境导入]
(1)Cu、Ag与稀硫酸能否设计成原电池?
【答案】不能。Cu、Ag与稀硫酸都不能自发地发生氧化还原反应。
(2)外电路中电流方向与电子的流动方向有何关系?
【答案】电流方向与电子的流动方向相反。
(3)试分析用镁、铝作电极,氢氧化钠溶液作电解质溶液构成原电池时的正、负极及电子得失情况。
【答案】镁、铝、氢氧化钠溶液构成的原电池中,发生反应:2Al+2NaOH+2H2O═══2NaAlO2+3H2↑,铝失去电子,作负极,H2O得到电子,镁作正极。
[深化理解]
1.两种原电池的比较
甲装置所示原电池俗称单液原电池,锌片、铜片用导线相连后,都插入稀硫酸中,所以,锌片上失去
的电子一部分通过导线流向铜片,
形成电流,还有一部分直接传递给
溶液中碰撞到锌片上的氢离子,这
一部分电子不形成电流,这种原电
池供电效率不高,且电流在较短时间内就会衰减。
乙装置所示原电池俗称双液原电池,锌片、铜片用导线相连后,锌片插入ZnSO4溶液中,铜片插入稀硫酸中,这样就避免了锌片与稀硫酸直接接触发生反应而造成的电能损失,锌失去的电子全部通过导线流向铜片,这种原电池供电效率高,且能提供较稳定的电流。
2.判断原电池正、负极的方法
判断依据 负极 正极
电极材料 活动性较强的金属 活动性较弱的金属或能导电的非金属
电子流动方向 电子流出极 电子流入极
电极上发生的反应 氧化反应 还原反应
电解质溶液中离子的移动方向 阴离子移向的极 阳离子移向的极
3.盐桥的作用
盐桥中通常装有含KCl饱和溶液的琼胶。当盐桥存在时,使两个半电池中的溶液连成一个通路。随着反应的进行,盐桥中的Cl-向硫酸锌溶液方向移动,K+向稀硫酸方向移动,使硫酸锌溶液和稀硫酸一直保持电中性,氧化还原反应得以继续进行,从而使电子不断从锌极流向铜极,能持续、稳定地产生电流。
依据氧化还原反应:2Ag+(aq)+Cu(s)═══Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
[典例精练]
(1)电极X的材料是__________;电解质溶液Y是__________________。
(2)银电极为电池的________极,发生的电极反应为________________________;X电极上发生的电极反应为________________________。
(3)外电路中的电子是从________极流向______极。
【答案】(1)Cu AgNO3溶液
(2)正 2Ag++2e-═══2Ag Cu-2e-═══Cu2+
(3)负(Cu) 正(Ag)
【解析】原电池中负极上发生氧化反应,正极上发生还原反应,盐桥起到形成闭合回路、平衡电荷的作用。由总反应方程式可知,电极X的材料是Cu,发生氧化反应,电解质溶液Y是可溶性银盐溶液,常用AgNO3溶液。
【答案】C
任务二 原电池原理的应用
素养探源 核心素养 考查途径
科学探究与创新意识 变化观念与平衡思想 常考查形成原电池对化学反应速率的影响,原电池结构的判断——给出反应原理,能发生该反应的原电池装置等
[情境导入]
锌是一种蓝白色金属,熔点为419.5 ℃。在室温下,性较脆;100~150 ℃时,变软;超过200 ℃后,又变脆。锌的化学性质活泼,在常温下的空气中,表面生成一层薄而致密的碱式碳酸锌膜,可阻止锌进一步被氧化。
锌与稀硫酸反应所用原电池装置如下图所示:
(1)若纯锌与粗锌(含Fe、C等)分别与同浓度的稀硫酸反应制取H2,哪种方法产生H2的速率大?
【答案】粗锌。粗锌中的铁、碳可以与锌构成原电池,从而增大反应速率。
(2)根据反应Na2CO3+2HCl═══2NaCl+H2O+CO2↑能设计出原电池吗?
【答案】不能;因为这个反应不是氧化还原反应,反应过程中没有电子的转移,不符合原电池的构成条件。
(3)X、Y、Z、W四块金属板分别用导线两两相连浸入稀硫酸中构成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。根据所学内容判断四种金属的活动性顺序。
【答案】四种金属的活动性顺序由强到弱是X>Z>W>Y。
[深化理解]
原电池原理的应用
(1)增大氧化还原反应速率。
如实验室用Zn和稀硫酸反应制H2,常用粗锌,它产生H2的速率大。原因是粗锌中的杂质和锌、稀硫酸形成原电池,增大了锌与稀硫酸的反应速率,使产生H2的速率增大。
(2)比较金属的活动性强弱。
原电池中,负极一般为活动性较强的金属,正极一般为活动性较弱的金属。
(3)设计原电池。
原电池的设计一定要满足构成原电池的几个条件。原电池是一种将化学能转化为电能的装置,因此只有放热的氧化还原反应才可以设计成原电池。在电池中,通过电极和导线将电子转移变成了电子的定向移动,将氧化反应和还原反应分到两个电极上进行,使其成为两个“半反应”。设计原电池思路:①电极材料的选择。负极一般选用活动性强的金属材料,正极一般选用活动性比负极弱的金属材料或石墨等惰性电极。②电解质溶液的选择。电解质溶液一般要能够与负极发生反应。③保证设计出的原电池装置中,还原剂在负极上发生反应,氧化剂在正极上发生反应。
(4)寻求和制造干电池和蓄电池等化学能源。
某原电池总反应的离子方程式为2Fe3++Fe═══3Fe2+,能实现该反应的原电池是 ( )
A.正极为Cu,负极为C,电解质为FeCl3溶液
B.正极为C,负极为Fe,电解质为FeCl3溶液
C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质为CuSO4溶液
【答案】B
[典例精练]
【解析】将总反应拆分为氧化反应和还原反应两个半反应,即为负极Fe-2e-═══Fe2+,正极2Fe3++2e-═══2Fe2+,然后根据原电池的构成条件确定正、负极材料和电解质溶液。因此,本题负极必是Fe,正极可为比Fe活动性弱的金属或非金属导体,电解质溶液为含Fe3+的盐溶液,所以B正确。
利用反应Zn+2FeCl3═══ZnCl2+2FeCl2设计一个双液原电池。在下图方格内画出实验装置图,并注明电极材料。
(1)正极材料为__________,电极反应式为______________________ _____________。
(2)负极材料为__________,电极反应式为___________________ _______。
【解析】将Zn+2FeCl3═══ZnCl2+2FeCl2拆分为两个“半反应”:Zn-2e-═══Zn2+(氧化反应),2Fe3++2e-═══2Fe2+(还原反应)。结合原电池的电极反应特点分析可知,该电池的负极材料应用锌片,正极材料用活动性比锌弱的金属或导电的非金属,为保证Fe3+在正极得电子,正极区电解质溶液为FeCl3等易溶的铁盐溶液。
辨析 · 易错易混
原电池的构造及工作原理中的误区
例1 对于原电池的电极名称,下列叙述正确的是 ( )
A.构成原电池正负极的必须是两种活泼性不同的金属
B.正极上发生还原反应,一定产生气体
C.电子流出的一极为负极
D.阴离子在电解质溶液中向正极移动
错解:A或D
错因分析:本题易片面理解原电池的构成及工作原理,导致错选A项或D项。A项原电池的正负极可以是金属和非金属(如石墨);B项原电池的正极也有可能析出固体;D项电解质溶液中,阴离子向负极移动。
满分策略:(1)原电池的电解质溶液中,阴离子向负极移动,阳离子向正极移动。可简记为:正正负负[解释:正(指阳离子)→正(指正极)、负(指阴离子)→负(指负极)]。(2)失电子的物质一定在负极反应,得电子的物质一定在正极反应。(3)原电池中,电子只能在电极和导线间流动,电子不能进入电解质溶液。
正解:C
错解:D
满分策略:判断原电池的正负极时,要考虑金属在电解质溶液中的活泼性,活泼金属在原电池中不一定作负极,如本题中Si-Fe-NaOH溶液电池。类似的还有:Mg-Al-NaOH溶液原电池,Fe-Cu-浓HNO3原电池、Al-Cu-浓HNO3原电池等。
正解:C
小练 · 素养达成
1.下列反应不可用于设计成原电池的是 ( )
A.CaCO3+2HCl═══CaCl2+CO2↑+H2O
B.2CH3OH+3O2═══2CO2+4H2O
C.Zn+2HCl═══ZnCl2+H2↑
D.4Al+3O2+6H2O═══4Al(OH)3
【答案】A
2.下列关于原电池的叙述中正确的是 ( )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子,并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
【答案】A
3.(2020·湖南长沙长郡中学高二期中)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有含KCl饱和溶液的琼胶)构成一个原电池(如图)。
以下有关该原电池的叙述正确的是 ( )
①在外电路中,电子由铜电极流向银电极
②正极反应为Ag++e-═══Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.①②④
C.②③ D.①③④
【答案】B
【解析】Cu的金属性强于Ag的,则Cu作负极,Ag作正极。在外电路中,电子由Cu流向Ag,正极反应式为Ag++e-═══Ag,负极反应式为Cu-2e-═══Cu2+。若取出盐桥,破坏了闭合回路,原电池不能工作。该原电池反应原理为2AgNO3+Cu═══Cu(NO3)2+2Ag。
【答案】D
5.由锌片、铜片和200 mL稀硫酸组成的原电池如下图所示。
(1)原电池的负极反应式为______________,
正极反应式为________________________。
(2)电流的方向是______________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况)气体时,右侧烧杯中的H2SO4恰好消耗一半。则产生这些气体的同时,共消耗__________g锌,有________个电子通过了导线,原稀硫酸中c(H2SO4)=______________(设溶液体积不变)。
【答案】(1)Zn-2e-═══Zn2+ 2H++2e-═══H2↑
(2)由Cu极经导线流向Zn极
(3)4.875 9.03×1022 1.5 mol·L-1
6.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:2FeCl3+Mg═══2FeCl2+MgCl2。画出原电池的示意图并写出电极反应式和电池总反应式。
【答案】原电池设计如下图:
负极:Mg-2e-═══Mg2+
正极:2Fe3++2e-═══2Fe2+
总反应:2Fe3++Mg═══2Fe2++Mg2+
第四章 化学反应与电能
①通过铜锌原电池的分析,了解原电池的工作原理。
②会正确判断原电池的正极和负极;学会书写电极反应式,掌握书写电极反应式的技巧与方法。
③知道化学电源的分类方法。熟悉几种常
见化学电源的组成和工作原理。
④了解化学电源广泛的应用及废旧电池对环境的危害,设想其处理方法。
⑤从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。
⑥建立对电解过程的系统分析认识的思维模型,理解电解的规律,会判断电解的产物,会书写电解的电极反应式和总反应式。
⑦通过实验科学探究金属腐蚀的本质及其原因,认识金属腐蚀的主要类型,能正确书写析氢腐蚀和吸氧腐蚀的电极反应式。
⑧认识金属腐蚀产生的危害和影响,树立防止金属腐蚀的意识,熟知金属常用的防护方法。
学习内容 考查重点
原电池 原电池的工作原理 ①新型化学电源的工作原理,特别是电极反应式的书写或正误判断
②二次电池放电或充电时的原理
③电解池、电解精炼池、电镀池的构造及原理
④电化学腐蚀的分类、原理及防止措施
⑤新型电化学装置中离子交换膜的作用、电子或离子移动方向的判断等
⑥有关原电池或电解池的计算
化学电源
电解池 电解原理
电解原理的应用
金属的腐蚀与防护 金属的腐蚀
金属的防护
第一节 原电池
第1课时 原电池的工作原理
素养目标
1.认识双液原电池相比普通原电池的优点,特别是盐桥的作用,培养宏观辨识与微观探析、变化观念与平衡思想等学科核心素养
2.依据带盐桥的锌铜原电池装置,学会分析电子、阴阳离子的移动方向,并以电极反应式的形式表达出来,培养证据推理与模型认知、变化观念与平衡思想等学科核心素养
学法指导
1.复习必修第二册中的铜锌原电池装置,巩固原电池装置的构造及形成条件
2.比较单液原电池与双液原电池的区别,认识盐桥的作用
3.依据原电池工作原理,回顾氧化还原反应中电子转移的表示方法中的“双线桥法”等知识,熟练掌握原电池电极反应式的书写方法
知识导图
课前 · 新知导学
1.构成条件
(1)具有两个__________不同的电极。
(2)合适的__________溶液。
(3)形成________回路(两电极用导线相连或互相接触并插入电解质溶液中)。
(4)能自发地发生________________反应。
活泼性
原电池的工作原理
电解质
闭合
氧化还原
2.装置图(以Zn-Cu原电池为例)
注:这种用盐桥连接的原电池也叫双液原电池。
电极 Zn电极 Cu电极
电极名称 ________ ________
得失电子 失电子 得电子
电子流向 ________ ________
反应类型 ________反应 ________反应
电极反应式 ____________________ ___________________
总反应式 ____________________________________
3.工作原理(以上述原电池为例)
负极
正极
流出
流入
氧化
还原
Zn-2e-═══Zn2+
Cu2++2e-═══Cu
Zn+Cu2+═══Zn2++Cu
(1)盐桥在原电池装置中的作用是什么?
(2)原电池工作时,阴、阳离子在电解质溶液中的运动方向是怎样的?
微思考
【答案】(1)①连接两个“半电池”,形成闭合回路;②盐桥中的阳离子移向正极区电解质溶液中,阴离子移向负极区电解质溶液中,使氧化还原反应持续进行,不断产生电流。
(2)原电池的电解质溶液中,阴离子向负极移动,阳离子向正极移动。
正误判断。(对的打“√”,错的打“×”)
(1)原电池是把化学能转化为电能的一种装置。 ( )
(2)原电池正极发生氧化反应,负极发生还原反应。 ( )
(3)不能自发进行的氧化还原反应,通过原电池装置可以实现。
( )
(4)碳棒不能用来作原电池的电极。 ( )
(5)反应Cu+2Ag+═══2Ag+Cu2+能以原电池的形式来实现。
( )
【答案】(1)√ (2)× (3)× (4)× (5)√
2.内电路
将两电极浸入__________________中,阴、阳离子作__________________。
还原性
原电池的设计
氧化性
电解质溶液
定向运动
3.闭合回路
【答案】负 正
(1)NaOH+HCl═══NaCl+H2O可自发进行,能否设计成原电池?
(2)Zn-Cu-稀硫酸原电池中,正极“半电池”可设计为Cu-稀硫酸,负极“半电池”可设计为Zn-ZnSO4溶液,这一说法是否正确?
微思考
【答案】(1)NaOH+HCl═══NaCl+H2O不能设计成原电池,因该反应不是氧化还原反应。
(2)正确。
(2020·山东临沂高二检测)某原电池的离子方程式是Zn+Cu2+═══Zn2++Cu,该原电池正确的组成是 ( )
【答案】A
选项 正极 负极 电解质溶液
A C Zn CuCl2
B Zn Cu CuSO4
C Zn Mg CuSO4
D Cu Zn ZnCl2
课堂 · 素养初培
任务一 原电池工作原理
素养探源 核心素养 考查途径
宏观辨识与微观探析 变化观念与平衡思想 在新型化学电源中考查电极名称、电极反应式的书写或正误判断、电子或离子移动方向、电解质溶液酸碱性的变化情况等,常以选择题形式考查,也会在大题中与其他化学反应原理知识一起考查
[情境导入]
(1)Cu、Ag与稀硫酸能否设计成原电池?
【答案】不能。Cu、Ag与稀硫酸都不能自发地发生氧化还原反应。
(2)外电路中电流方向与电子的流动方向有何关系?
【答案】电流方向与电子的流动方向相反。
(3)试分析用镁、铝作电极,氢氧化钠溶液作电解质溶液构成原电池时的正、负极及电子得失情况。
【答案】镁、铝、氢氧化钠溶液构成的原电池中,发生反应:2Al+2NaOH+2H2O═══2NaAlO2+3H2↑,铝失去电子,作负极,H2O得到电子,镁作正极。
[深化理解]
1.两种原电池的比较
甲装置所示原电池俗称单液原电池,锌片、铜片用导线相连后,都插入稀硫酸中,所以,锌片上失去
的电子一部分通过导线流向铜片,
形成电流,还有一部分直接传递给
溶液中碰撞到锌片上的氢离子,这
一部分电子不形成电流,这种原电
池供电效率不高,且电流在较短时间内就会衰减。
乙装置所示原电池俗称双液原电池,锌片、铜片用导线相连后,锌片插入ZnSO4溶液中,铜片插入稀硫酸中,这样就避免了锌片与稀硫酸直接接触发生反应而造成的电能损失,锌失去的电子全部通过导线流向铜片,这种原电池供电效率高,且能提供较稳定的电流。
2.判断原电池正、负极的方法
判断依据 负极 正极
电极材料 活动性较强的金属 活动性较弱的金属或能导电的非金属
电子流动方向 电子流出极 电子流入极
电极上发生的反应 氧化反应 还原反应
电解质溶液中离子的移动方向 阴离子移向的极 阳离子移向的极
3.盐桥的作用
盐桥中通常装有含KCl饱和溶液的琼胶。当盐桥存在时,使两个半电池中的溶液连成一个通路。随着反应的进行,盐桥中的Cl-向硫酸锌溶液方向移动,K+向稀硫酸方向移动,使硫酸锌溶液和稀硫酸一直保持电中性,氧化还原反应得以继续进行,从而使电子不断从锌极流向铜极,能持续、稳定地产生电流。
依据氧化还原反应:2Ag+(aq)+Cu(s)═══Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
[典例精练]
(1)电极X的材料是__________;电解质溶液Y是__________________。
(2)银电极为电池的________极,发生的电极反应为________________________;X电极上发生的电极反应为________________________。
(3)外电路中的电子是从________极流向______极。
【答案】(1)Cu AgNO3溶液
(2)正 2Ag++2e-═══2Ag Cu-2e-═══Cu2+
(3)负(Cu) 正(Ag)
【解析】原电池中负极上发生氧化反应,正极上发生还原反应,盐桥起到形成闭合回路、平衡电荷的作用。由总反应方程式可知,电极X的材料是Cu,发生氧化反应,电解质溶液Y是可溶性银盐溶液,常用AgNO3溶液。
【答案】C
任务二 原电池原理的应用
素养探源 核心素养 考查途径
科学探究与创新意识 变化观念与平衡思想 常考查形成原电池对化学反应速率的影响,原电池结构的判断——给出反应原理,能发生该反应的原电池装置等
[情境导入]
锌是一种蓝白色金属,熔点为419.5 ℃。在室温下,性较脆;100~150 ℃时,变软;超过200 ℃后,又变脆。锌的化学性质活泼,在常温下的空气中,表面生成一层薄而致密的碱式碳酸锌膜,可阻止锌进一步被氧化。
锌与稀硫酸反应所用原电池装置如下图所示:
(1)若纯锌与粗锌(含Fe、C等)分别与同浓度的稀硫酸反应制取H2,哪种方法产生H2的速率大?
【答案】粗锌。粗锌中的铁、碳可以与锌构成原电池,从而增大反应速率。
(2)根据反应Na2CO3+2HCl═══2NaCl+H2O+CO2↑能设计出原电池吗?
【答案】不能;因为这个反应不是氧化还原反应,反应过程中没有电子的转移,不符合原电池的构成条件。
(3)X、Y、Z、W四块金属板分别用导线两两相连浸入稀硫酸中构成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。根据所学内容判断四种金属的活动性顺序。
【答案】四种金属的活动性顺序由强到弱是X>Z>W>Y。
[深化理解]
原电池原理的应用
(1)增大氧化还原反应速率。
如实验室用Zn和稀硫酸反应制H2,常用粗锌,它产生H2的速率大。原因是粗锌中的杂质和锌、稀硫酸形成原电池,增大了锌与稀硫酸的反应速率,使产生H2的速率增大。
(2)比较金属的活动性强弱。
原电池中,负极一般为活动性较强的金属,正极一般为活动性较弱的金属。
(3)设计原电池。
原电池的设计一定要满足构成原电池的几个条件。原电池是一种将化学能转化为电能的装置,因此只有放热的氧化还原反应才可以设计成原电池。在电池中,通过电极和导线将电子转移变成了电子的定向移动,将氧化反应和还原反应分到两个电极上进行,使其成为两个“半反应”。设计原电池思路:①电极材料的选择。负极一般选用活动性强的金属材料,正极一般选用活动性比负极弱的金属材料或石墨等惰性电极。②电解质溶液的选择。电解质溶液一般要能够与负极发生反应。③保证设计出的原电池装置中,还原剂在负极上发生反应,氧化剂在正极上发生反应。
(4)寻求和制造干电池和蓄电池等化学能源。
某原电池总反应的离子方程式为2Fe3++Fe═══3Fe2+,能实现该反应的原电池是 ( )
A.正极为Cu,负极为C,电解质为FeCl3溶液
B.正极为C,负极为Fe,电解质为FeCl3溶液
C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质为CuSO4溶液
【答案】B
[典例精练]
【解析】将总反应拆分为氧化反应和还原反应两个半反应,即为负极Fe-2e-═══Fe2+,正极2Fe3++2e-═══2Fe2+,然后根据原电池的构成条件确定正、负极材料和电解质溶液。因此,本题负极必是Fe,正极可为比Fe活动性弱的金属或非金属导体,电解质溶液为含Fe3+的盐溶液,所以B正确。
利用反应Zn+2FeCl3═══ZnCl2+2FeCl2设计一个双液原电池。在下图方格内画出实验装置图,并注明电极材料。
(1)正极材料为__________,电极反应式为______________________ _____________。
(2)负极材料为__________,电极反应式为___________________ _______。
【解析】将Zn+2FeCl3═══ZnCl2+2FeCl2拆分为两个“半反应”:Zn-2e-═══Zn2+(氧化反应),2Fe3++2e-═══2Fe2+(还原反应)。结合原电池的电极反应特点分析可知,该电池的负极材料应用锌片,正极材料用活动性比锌弱的金属或导电的非金属,为保证Fe3+在正极得电子,正极区电解质溶液为FeCl3等易溶的铁盐溶液。
辨析 · 易错易混
原电池的构造及工作原理中的误区
例1 对于原电池的电极名称,下列叙述正确的是 ( )
A.构成原电池正负极的必须是两种活泼性不同的金属
B.正极上发生还原反应,一定产生气体
C.电子流出的一极为负极
D.阴离子在电解质溶液中向正极移动
错解:A或D
错因分析:本题易片面理解原电池的构成及工作原理,导致错选A项或D项。A项原电池的正负极可以是金属和非金属(如石墨);B项原电池的正极也有可能析出固体;D项电解质溶液中,阴离子向负极移动。
满分策略:(1)原电池的电解质溶液中,阴离子向负极移动,阳离子向正极移动。可简记为:正正负负[解释:正(指阳离子)→正(指正极)、负(指阴离子)→负(指负极)]。(2)失电子的物质一定在负极反应,得电子的物质一定在正极反应。(3)原电池中,电子只能在电极和导线间流动,电子不能进入电解质溶液。
正解:C
错解:D
满分策略:判断原电池的正负极时,要考虑金属在电解质溶液中的活泼性,活泼金属在原电池中不一定作负极,如本题中Si-Fe-NaOH溶液电池。类似的还有:Mg-Al-NaOH溶液原电池,Fe-Cu-浓HNO3原电池、Al-Cu-浓HNO3原电池等。
正解:C
小练 · 素养达成
1.下列反应不可用于设计成原电池的是 ( )
A.CaCO3+2HCl═══CaCl2+CO2↑+H2O
B.2CH3OH+3O2═══2CO2+4H2O
C.Zn+2HCl═══ZnCl2+H2↑
D.4Al+3O2+6H2O═══4Al(OH)3
【答案】A
2.下列关于原电池的叙述中正确的是 ( )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子,并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
【答案】A
3.(2020·湖南长沙长郡中学高二期中)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有含KCl饱和溶液的琼胶)构成一个原电池(如图)。
以下有关该原电池的叙述正确的是 ( )
①在外电路中,电子由铜电极流向银电极
②正极反应为Ag++e-═══Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.①②④
C.②③ D.①③④
【答案】B
【解析】Cu的金属性强于Ag的,则Cu作负极,Ag作正极。在外电路中,电子由Cu流向Ag,正极反应式为Ag++e-═══Ag,负极反应式为Cu-2e-═══Cu2+。若取出盐桥,破坏了闭合回路,原电池不能工作。该原电池反应原理为2AgNO3+Cu═══Cu(NO3)2+2Ag。
【答案】D
5.由锌片、铜片和200 mL稀硫酸组成的原电池如下图所示。
(1)原电池的负极反应式为______________,
正极反应式为________________________。
(2)电流的方向是______________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况)气体时,右侧烧杯中的H2SO4恰好消耗一半。则产生这些气体的同时,共消耗__________g锌,有________个电子通过了导线,原稀硫酸中c(H2SO4)=______________(设溶液体积不变)。
【答案】(1)Zn-2e-═══Zn2+ 2H++2e-═══H2↑
(2)由Cu极经导线流向Zn极
(3)4.875 9.03×1022 1.5 mol·L-1
6.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:2FeCl3+Mg═══2FeCl2+MgCl2。画出原电池的示意图并写出电极反应式和电池总反应式。
【答案】原电池设计如下图:
负极:Mg-2e-═══Mg2+
正极:2Fe3++2e-═══2Fe2+
总反应:2Fe3++Mg═══2Fe2++Mg2+
