2021_2022学年新教材高中化学第3章水溶液中的离子反应与平衡第3节第1课时盐类的水解课件新人教版选择性必修1
文档属性
| 名称 | 2021_2022学年新教材高中化学第3章水溶液中的离子反应与平衡第3节第1课时盐类的水解课件新人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 15:20:09 | ||
图片预览








文档简介
(共58张PPT)
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
第1课时 盐类的水解
素养目标
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,从盐的构成上探究盐溶液呈现不同酸碱性的原因,总结其规律,形成宏观辨识与微观探析的能力
2.熟练掌握盐类水解的表示方法——水解离子方程式的书写
学法指导
1.首先依据实验认识盐溶液的酸碱性,然后分析盐所对应的酸和碱的强弱,从而找出实验结论和对应酸碱强弱间的对应关系
2.运用离子共存知识和水的电离平衡,认识什么样的盐可水解,及盐类的水解可看作酸碱中和反应的逆反应
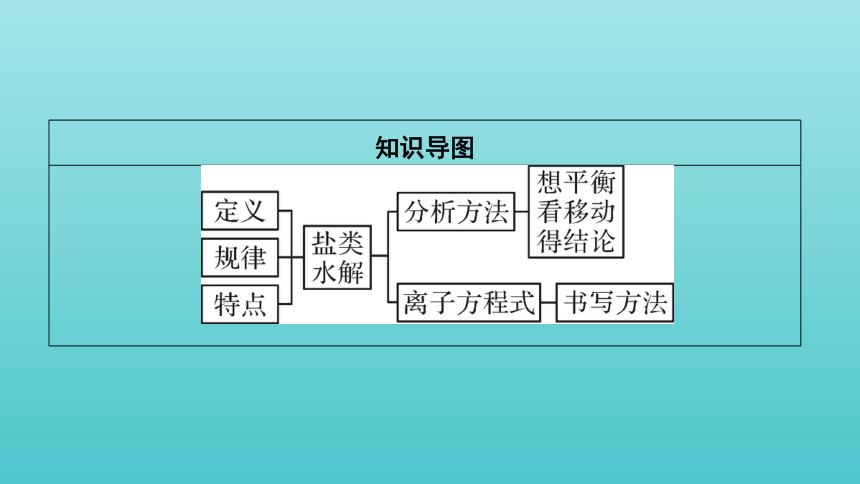
知识导图
课前 · 新知导学
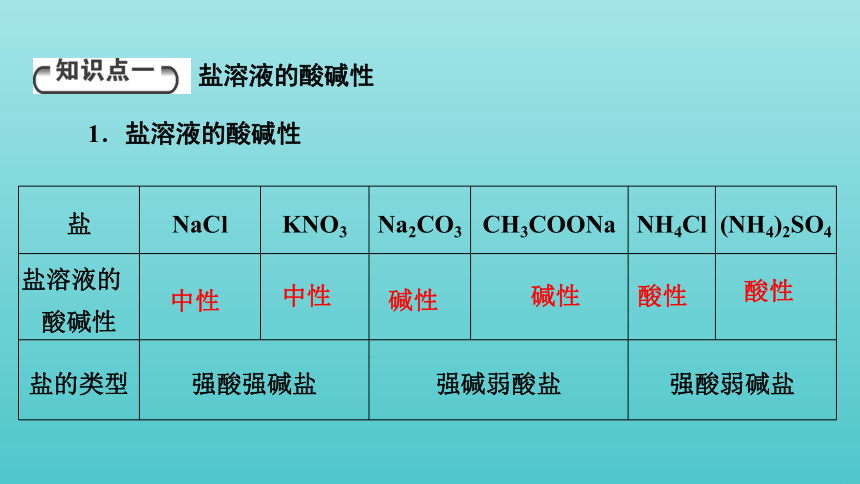
盐 NaCl KNO3 Na2CO3 CH3COONa NH4Cl (NH4)2SO4
盐溶液的 酸碱性
盐的类型 强酸强碱盐 强碱弱酸盐 强酸弱碱盐
1.盐溶液的酸碱性
中性
盐溶液的酸碱性
中性
碱性
碱性
酸性
酸性
H++OH-
NH3·H2O
>
酸
CH3COO-+Na+
H++OH-
CH3COOH
电离
>
碱
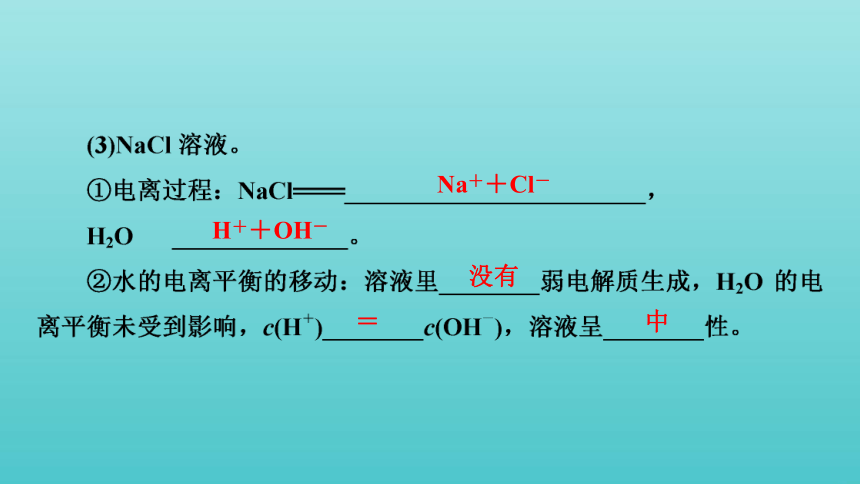
Na++Cl-
H++OH-
没有
=
中
3.结论
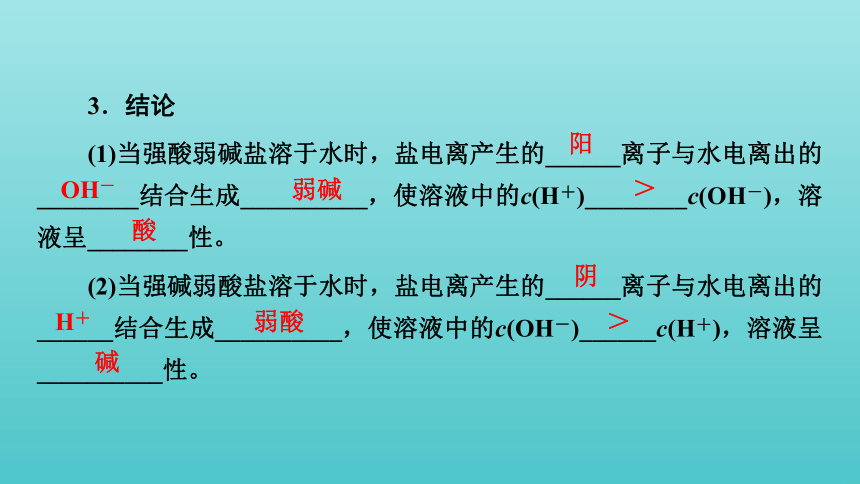
(1)当强酸弱碱盐溶于水时,盐电离产生的______离子与水电离出的________结合生成__________,使溶液中的c(H+)________c(OH-),溶液呈________性。
(2)当强碱弱酸盐溶于水时,盐电离产生的______离子与水电离出的______结合生成__________,使溶液中的c(OH-)______c(H+),溶液呈__________性。
阳
OH-
弱碱
>
酸
阴
H+
弱酸
>
碱
(3)当强酸强碱盐溶于水时,盐电离产生的阴离子、阳离子都不能与水电离出的H+或OH-结合生成弱电解质,即强酸强碱盐________,溶液中的c(OH-)____c(H+),溶液呈______性。
不水解
=
中
某溶液呈酸性,则该溶液可能是某酸的溶液、强酸弱碱盐溶液或某酸的酸式盐溶液,这种说法是否正确?
微思考
【答案】正确,如盐酸、氯化铵溶液、硫酸氢钠溶液都呈酸性。
(2019·浙江4月选考)下列溶液呈碱性的是 ( )
A.NH4NO3 B.(NH4)2SO4
C.KCl D.K2CO3
【答案】D
1.实质
盐电离出来的阴离子或阳离子与水电离出来的____或________结合生成了____________,破坏了水的电离平衡。
2.条件
(1)盐必须溶于水中。
(2)盐中必须有弱酸根阴离子或弱碱阳离子(有弱才水解,都强不水解)。
H+
盐类的水解
OH-
弱电解质
【答案】C
【解析】A项为HCOOH的电离方程式;B项为CO2与H2O反应生成的H2CO3的一级电离方程式;D项为H2S的二级电离方程式。
1.电荷守恒
(1)内容:电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数__________,即电荷守恒,溶液呈电________性。
(2)实例:碳酸钠溶液中的电荷守恒式为_________________________________________________。
相等
电解质溶液中的电荷守恒与元素质量守恒
中
2.元素质量守恒
(1)内容:在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。就该离子所含的某种元素来说,其质量在变化前后是________的,即元素质量守恒。
(2)实例:0.1 mol·L-1Na2CO3溶液中用钠元素表示碳元素的质量守恒式为___________________________________________。
守恒
碳酸钠中的碳酸根也水解,碳酸根水解分几步进行?与碳酸的元数有何对应关系?
微思考
【答案】由于碳酸为二元弱酸,则碳酸根水解分两步进行。
(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同。 ( )
(6)NaHCO3、NaHSO4都能促进水的电离。 ( )
【答案】(1)√ (2)× (3)√ (4)× (5)× (6)×
课堂 · 素养初培
任务一 盐类水解的规律
素养探源 核心素养 考查途径
宏观辨识与微观探析 科学探究与创新意识 离子共存中溶液酸碱性的限制、弱酸酸式盐的水解和电离的强弱程度比较与应用、根据盐的组成初步判断其溶液的酸碱性等,题型有选择题也有填空题
(1)请从化学的角度分析海水呈碱性的原因是什么?
(2)在预测NaHCO3溶液的酸碱性时,甲同学认为NaHCO3为酸式盐,应呈酸性;乙同学认为HCO会水解,溶液应呈碱性;丙同学认为HCO既会发生电离又会发生水解,溶液的酸碱性取决于电离程度、水解程度的相对大小。上述三位同学的观点哪个是正确的?
(3)NaHCO3、Na2CO3同样为碳酸盐,试分析同浓度时二者的碱性强弱。
[深化理解]
1.盐类的水解规律
(1)无弱(弱离子:弱酸提供的阴离子或弱碱提供的阳离子)不水解、有弱才水解——判断某种盐是否水解。
(2)谁弱谁水解、都弱都水解——判断盐溶液中哪种微粒水解,据此书写水解的离子方程式。
(3)谁强(强离子:强酸提供的阴离子或强碱提供的阳离子)显谁性、同强(都为强离子或同为弱离子且弱的程度相同)显中性——判断某种盐溶液的酸碱性。
(2020·江苏盐城新丰中学高二期中)相同物质的量浓度的NaCN和NaClO溶液相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO的说法中,正确的是 ( )
A.酸的强弱:HCN>HClO
B.pH:HClO>HCN
C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)[典例精练]
【答案】D
【解析】根据越弱越水解的盐类水解规律可知,酸性:HClO>HCN,相同浓度时溶液的pH:HClOHCN,所以溶液中c(CN-)温度相同、浓度均为0.2 mol·L-1的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤Na2CO3、⑥CH3COONa溶液,它们的pH由小到大的排列顺序为 ( )
A.③①④②⑥⑤ B.①③⑥④②⑤
C.③②①⑥④⑤ D.②④①③⑤⑥
【答案】A
任务二 盐类水解离子方程式的书写
素养探源 核心素养 考查途径
证据推理与模型认知 盐类水解的离子方程式作为一种常见化学用语,在各类考题中经常考查,往往与其他化学用语,如普通离子方程式、化学方程式,甚至与某些微粒符号等融合考查,但分值一般较小
[情境导入]
硫氢化钠为无色针状结晶,味苦,易潮解,易溶于水和醇。其水溶液呈强碱性,遇酸反应生成硫化氢。染料工业用于合成有机中间体和制备硫化染料的助剂,制革工业用于生皮的脱毛及鞣革;化肥工业用于脱去活性炭脱硫剂中的单体硫,采矿工业大量用于铜矿选矿。
【答案】B
[典例精练]
【答案】CE
辨析 · 易错易混
由水电离出的氢离子或氢氧根离子浓度的大小判断
例 常温下,在pH=12的某溶液中,甲、乙、丙、丁四位同学计算出由水电离出的c(OH-)的数据分别为
甲:1.0×10-7 mol·L-1;乙:1.0×10-6 mol·L-1;
丙:1.0×10-2 mol·L-1;丁:1.0×10-12 mol·L-1。其中你认为正确的数据是 ( )
A.甲、乙 B.丙
C.丙、丁 D.乙、丁
错解:B
错因分析:本题易根据水的离子积,只求得c(OH-)总=1.0×10-2 mol·L-1,错选B。
正解:C
小练 · 素养达成
1.有关盐类水解的说法不正确的是 ( )
A.盐类的水解过程破坏了水的电离平衡
B.盐类的水解是酸碱中和反应的逆过程
C.盐类水解的结果使溶液可能仍呈中性
D.Na2CO3水解的实质是Na+与H2O电离出的OH-结合生成了NaOH
【答案】D
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
【答案】B
【解析】利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸对应的钠盐溶液的pH可推知,盐溶液碱性越强则对应的酸越弱。
3.(2020·浙江7月选考)下列说法不正确的是 ( )
A.2.0×10-7 mol·L-1的盐酸中c(H+)=2.0×10-7 mol·L-1
B.将KCl溶液从常温加热至80 ℃,溶液的pH变小但仍保持中性
C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质
D.常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
【答案】A
4.有四种物质的量浓度相同且由+1价阳离子A+、B+和-1价阴离子X-、Y-组成的盐溶液。据测定,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH>7,BX溶液的pH<7。据此推断,可能不水解的盐是 ( )
A.AX B.BX
C.AY D.BY
【答案】A
【解析】常温时,AX溶液和BY溶液的pH都为7,说明形成BY和AX的酸、碱的强弱相当,可能是强酸、强碱,也可能是强弱相当的弱酸、弱碱。AY溶液的pH>7,则说明Y-所对应的酸一定是弱酸,BX溶液的pH<7 ,则说明B+所对应的碱一定是弱碱,X-和A+所对应的酸和碱应是相对较强的,它们所形成的盐AX有可能不发生水解。
5.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验 编号 HA物质的量浓度/(mol·L-1) NaOH物质的量浓度/(mol·L-1) 混合溶液的pH
① 0.1 0.1 pH=9
② c 0.2 pH=7
③ 0.2 0.1 pH<7
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?____。
(2)②组情况表明,c______0.2(填“>”“<”或“=”,下同)。混合溶液中离子浓度c(A-)________c(Na+)。
(3)从③组实验结果分析,说明HA的电离程度________NaA的水解程度(填“大于”“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是________________________________。
【答案】(1)弱酸 (2)> =
(3)大于 c(A-)>c(Na+)>c(H+)>c(OH-)
【解析】(1)实验①恰好完全反应,得到NaA溶液,由pH=9知,HA为弱酸。(2)由pH=7知,实验②中HA过量,c>0.2,根据电荷守恒,溶液中c(A-)+c(OH-)=c(Na+)+c(H+),pH=7时,c(H+)=c(OH-),故c(A-)=c(Na+)。(3)实验③得到的是等物质的量浓度的HA和NaA的混合溶液,由pH<7知,HA的电离程度大于A-的水解程度,溶液中离子浓度由大到小的顺序为c(A-)>c(Na+)>c(H+)>c(OH-)。
6.(1)25 ℃时,pH=12.0的KOH溶液中,由水电离出来的c(OH-)=________ mol·L-1;pH=12.0的KCN溶液中,由水电离出来的c(OH-)=________mol·L-1。
(2)在25 ℃时,pH=4的HCl溶液和pH=4的NH4Cl溶液中c(OH-)各为多少?在上述两种溶液中,NH4Cl溶液中由水电离的c(OH-)是HCl溶液中的多少倍?
【答案】(1)10-12 10-2
(2)两溶液中c(OH-)均为1×10-10 mol·L-1;NH4Cl溶液中由水电离的c(OH-)是HCl溶液中的1×106倍。
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
第1课时 盐类的水解
素养目标
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,从盐的构成上探究盐溶液呈现不同酸碱性的原因,总结其规律,形成宏观辨识与微观探析的能力
2.熟练掌握盐类水解的表示方法——水解离子方程式的书写
学法指导
1.首先依据实验认识盐溶液的酸碱性,然后分析盐所对应的酸和碱的强弱,从而找出实验结论和对应酸碱强弱间的对应关系
2.运用离子共存知识和水的电离平衡,认识什么样的盐可水解,及盐类的水解可看作酸碱中和反应的逆反应
知识导图
课前 · 新知导学
盐 NaCl KNO3 Na2CO3 CH3COONa NH4Cl (NH4)2SO4
盐溶液的 酸碱性
盐的类型 强酸强碱盐 强碱弱酸盐 强酸弱碱盐
1.盐溶液的酸碱性
中性
盐溶液的酸碱性
中性
碱性
碱性
酸性
酸性
H++OH-
NH3·H2O
>
酸
CH3COO-+Na+
H++OH-
CH3COOH
电离
>
碱
Na++Cl-
H++OH-
没有
=
中
3.结论
(1)当强酸弱碱盐溶于水时,盐电离产生的______离子与水电离出的________结合生成__________,使溶液中的c(H+)________c(OH-),溶液呈________性。
(2)当强碱弱酸盐溶于水时,盐电离产生的______离子与水电离出的______结合生成__________,使溶液中的c(OH-)______c(H+),溶液呈__________性。
阳
OH-
弱碱
>
酸
阴
H+
弱酸
>
碱
(3)当强酸强碱盐溶于水时,盐电离产生的阴离子、阳离子都不能与水电离出的H+或OH-结合生成弱电解质,即强酸强碱盐________,溶液中的c(OH-)____c(H+),溶液呈______性。
不水解
=
中
某溶液呈酸性,则该溶液可能是某酸的溶液、强酸弱碱盐溶液或某酸的酸式盐溶液,这种说法是否正确?
微思考
【答案】正确,如盐酸、氯化铵溶液、硫酸氢钠溶液都呈酸性。
(2019·浙江4月选考)下列溶液呈碱性的是 ( )
A.NH4NO3 B.(NH4)2SO4
C.KCl D.K2CO3
【答案】D
1.实质
盐电离出来的阴离子或阳离子与水电离出来的____或________结合生成了____________,破坏了水的电离平衡。
2.条件
(1)盐必须溶于水中。
(2)盐中必须有弱酸根阴离子或弱碱阳离子(有弱才水解,都强不水解)。
H+
盐类的水解
OH-
弱电解质
【答案】C
【解析】A项为HCOOH的电离方程式;B项为CO2与H2O反应生成的H2CO3的一级电离方程式;D项为H2S的二级电离方程式。
1.电荷守恒
(1)内容:电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数__________,即电荷守恒,溶液呈电________性。
(2)实例:碳酸钠溶液中的电荷守恒式为_________________________________________________。
相等
电解质溶液中的电荷守恒与元素质量守恒
中
2.元素质量守恒
(1)内容:在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。就该离子所含的某种元素来说,其质量在变化前后是________的,即元素质量守恒。
(2)实例:0.1 mol·L-1Na2CO3溶液中用钠元素表示碳元素的质量守恒式为___________________________________________。
守恒
碳酸钠中的碳酸根也水解,碳酸根水解分几步进行?与碳酸的元数有何对应关系?
微思考
【答案】由于碳酸为二元弱酸,则碳酸根水解分两步进行。
(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同。 ( )
(6)NaHCO3、NaHSO4都能促进水的电离。 ( )
【答案】(1)√ (2)× (3)√ (4)× (5)× (6)×
课堂 · 素养初培
任务一 盐类水解的规律
素养探源 核心素养 考查途径
宏观辨识与微观探析 科学探究与创新意识 离子共存中溶液酸碱性的限制、弱酸酸式盐的水解和电离的强弱程度比较与应用、根据盐的组成初步判断其溶液的酸碱性等,题型有选择题也有填空题
(1)请从化学的角度分析海水呈碱性的原因是什么?
(2)在预测NaHCO3溶液的酸碱性时,甲同学认为NaHCO3为酸式盐,应呈酸性;乙同学认为HCO会水解,溶液应呈碱性;丙同学认为HCO既会发生电离又会发生水解,溶液的酸碱性取决于电离程度、水解程度的相对大小。上述三位同学的观点哪个是正确的?
(3)NaHCO3、Na2CO3同样为碳酸盐,试分析同浓度时二者的碱性强弱。
[深化理解]
1.盐类的水解规律
(1)无弱(弱离子:弱酸提供的阴离子或弱碱提供的阳离子)不水解、有弱才水解——判断某种盐是否水解。
(2)谁弱谁水解、都弱都水解——判断盐溶液中哪种微粒水解,据此书写水解的离子方程式。
(3)谁强(强离子:强酸提供的阴离子或强碱提供的阳离子)显谁性、同强(都为强离子或同为弱离子且弱的程度相同)显中性——判断某种盐溶液的酸碱性。
(2020·江苏盐城新丰中学高二期中)相同物质的量浓度的NaCN和NaClO溶液相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO的说法中,正确的是 ( )
A.酸的强弱:HCN>HClO
B.pH:HClO>HCN
C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)
【答案】D
【解析】根据越弱越水解的盐类水解规律可知,酸性:HClO>HCN,相同浓度时溶液的pH:HClO
A.③①④②⑥⑤ B.①③⑥④②⑤
C.③②①⑥④⑤ D.②④①③⑤⑥
【答案】A
任务二 盐类水解离子方程式的书写
素养探源 核心素养 考查途径
证据推理与模型认知 盐类水解的离子方程式作为一种常见化学用语,在各类考题中经常考查,往往与其他化学用语,如普通离子方程式、化学方程式,甚至与某些微粒符号等融合考查,但分值一般较小
[情境导入]
硫氢化钠为无色针状结晶,味苦,易潮解,易溶于水和醇。其水溶液呈强碱性,遇酸反应生成硫化氢。染料工业用于合成有机中间体和制备硫化染料的助剂,制革工业用于生皮的脱毛及鞣革;化肥工业用于脱去活性炭脱硫剂中的单体硫,采矿工业大量用于铜矿选矿。
【答案】B
[典例精练]
【答案】CE
辨析 · 易错易混
由水电离出的氢离子或氢氧根离子浓度的大小判断
例 常温下,在pH=12的某溶液中,甲、乙、丙、丁四位同学计算出由水电离出的c(OH-)的数据分别为
甲:1.0×10-7 mol·L-1;乙:1.0×10-6 mol·L-1;
丙:1.0×10-2 mol·L-1;丁:1.0×10-12 mol·L-1。其中你认为正确的数据是 ( )
A.甲、乙 B.丙
C.丙、丁 D.乙、丁
错解:B
错因分析:本题易根据水的离子积,只求得c(OH-)总=1.0×10-2 mol·L-1,错选B。
正解:C
小练 · 素养达成
1.有关盐类水解的说法不正确的是 ( )
A.盐类的水解过程破坏了水的电离平衡
B.盐类的水解是酸碱中和反应的逆过程
C.盐类水解的结果使溶液可能仍呈中性
D.Na2CO3水解的实质是Na+与H2O电离出的OH-结合生成了NaOH
【答案】D
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
【答案】B
【解析】利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸对应的钠盐溶液的pH可推知,盐溶液碱性越强则对应的酸越弱。
3.(2020·浙江7月选考)下列说法不正确的是 ( )
A.2.0×10-7 mol·L-1的盐酸中c(H+)=2.0×10-7 mol·L-1
B.将KCl溶液从常温加热至80 ℃,溶液的pH变小但仍保持中性
C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质
D.常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
【答案】A
4.有四种物质的量浓度相同且由+1价阳离子A+、B+和-1价阴离子X-、Y-组成的盐溶液。据测定,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH>7,BX溶液的pH<7。据此推断,可能不水解的盐是 ( )
A.AX B.BX
C.AY D.BY
【答案】A
【解析】常温时,AX溶液和BY溶液的pH都为7,说明形成BY和AX的酸、碱的强弱相当,可能是强酸、强碱,也可能是强弱相当的弱酸、弱碱。AY溶液的pH>7,则说明Y-所对应的酸一定是弱酸,BX溶液的pH<7 ,则说明B+所对应的碱一定是弱碱,X-和A+所对应的酸和碱应是相对较强的,它们所形成的盐AX有可能不发生水解。
5.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验 编号 HA物质的量浓度/(mol·L-1) NaOH物质的量浓度/(mol·L-1) 混合溶液的pH
① 0.1 0.1 pH=9
② c 0.2 pH=7
③ 0.2 0.1 pH<7
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?____。
(2)②组情况表明,c______0.2(填“>”“<”或“=”,下同)。混合溶液中离子浓度c(A-)________c(Na+)。
(3)从③组实验结果分析,说明HA的电离程度________NaA的水解程度(填“大于”“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是________________________________。
【答案】(1)弱酸 (2)> =
(3)大于 c(A-)>c(Na+)>c(H+)>c(OH-)
【解析】(1)实验①恰好完全反应,得到NaA溶液,由pH=9知,HA为弱酸。(2)由pH=7知,实验②中HA过量,c>0.2,根据电荷守恒,溶液中c(A-)+c(OH-)=c(Na+)+c(H+),pH=7时,c(H+)=c(OH-),故c(A-)=c(Na+)。(3)实验③得到的是等物质的量浓度的HA和NaA的混合溶液,由pH<7知,HA的电离程度大于A-的水解程度,溶液中离子浓度由大到小的顺序为c(A-)>c(Na+)>c(H+)>c(OH-)。
6.(1)25 ℃时,pH=12.0的KOH溶液中,由水电离出来的c(OH-)=________ mol·L-1;pH=12.0的KCN溶液中,由水电离出来的c(OH-)=________mol·L-1。
(2)在25 ℃时,pH=4的HCl溶液和pH=4的NH4Cl溶液中c(OH-)各为多少?在上述两种溶液中,NH4Cl溶液中由水电离的c(OH-)是HCl溶液中的多少倍?
【答案】(1)10-12 10-2
(2)两溶液中c(OH-)均为1×10-10 mol·L-1;NH4Cl溶液中由水电离的c(OH-)是HCl溶液中的1×106倍。
