2021_2022学年新教材高中化学第3章水溶液中的离子反应与平衡第1节电离平衡课件新人教版选择性必修1
文档属性
| 名称 | 2021_2022学年新教材高中化学第3章水溶液中的离子反应与平衡第1节电离平衡课件新人教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 00:00:00 | ||
图片预览









文档简介
(共84张PPT)
第三章 水溶液中的离子反应与平衡
①从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应。
②理解强电解质、弱电解质的概念。认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。
③认识水的电离,了解水的离子积常数。
④认识溶液的酸碱性及pH,掌握检测溶液pH的方法。
⑤掌握酸碱中和滴定的概念和原理。了解指示剂的选择方法。掌握中和滴定实验的操作步骤和误差分析。
⑥了解不同盐溶液的酸碱性。理解盐溶液的水解规律。掌握盐类水解方程式的书写方法。了解盐类水解在生产、生活中的应用。
⑦掌握离子浓度大小比较的方法。
⑧知道沉淀溶解平衡的概念及其影响因素。明确溶度积和离子积的关系,学会判断反应进行的方向。
⑨能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。学会用沉淀溶解平衡的移动解决生产、生活中的实际问题。
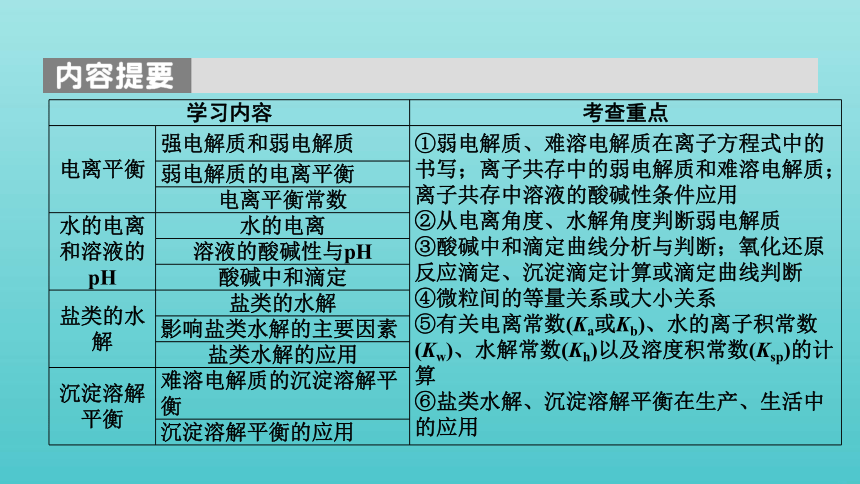
学习内容 考查重点
电离平衡 强电解质和弱电解质 ①弱电解质、难溶电解质在离子方程式中的书写;离子共存中的弱电解质和难溶电解质;离子共存中溶液的酸碱性条件应用
②从电离角度、水解角度判断弱电解质
③酸碱中和滴定曲线分析与判断;氧化还原反应滴定、沉淀滴定计算或滴定曲线判断
④微粒间的等量关系或大小关系
⑤有关电离常数(Ka或Kb)、水的离子积常数(Kw)、水解常数(Kh)以及溶度积常数(Ksp)的计算
⑥盐类水解、沉淀溶解平衡在生产、生活中的应用
弱电解质的电离平衡
电离平衡常数
水的电离和溶液的pH 水的电离
溶液的酸碱性与pH
酸碱中和滴定
盐类的水解 盐类的水解
影响盐类水解的主要因素
盐类水解的应用
沉淀溶解平衡 难溶电解质的沉淀溶解平衡
沉淀溶解平衡的应用
第一节 电离平衡
素养目标
1.能准确判断强电解质和弱电解质,培养宏观辨识与微观探析的核心素养
2.会用变化观念与平衡思想描述弱电解质的电离平衡,能正确书写弱电解质的电离方程式,会分析电离平衡的移动
3.知道电离平衡常数的意义,培养证据推理与模型认知的核心素养
学法指导
1.复习必修第一册学习的电解质、非电解质概念和常见实例
2.从电离可逆性的角度认识强、弱电解质的根本区别
3.运用化学平衡原理认识弱电解质电离平衡的特点
4.复习化学平衡“三段式”计算方法,并将该方法应用于电离平衡常数的计算
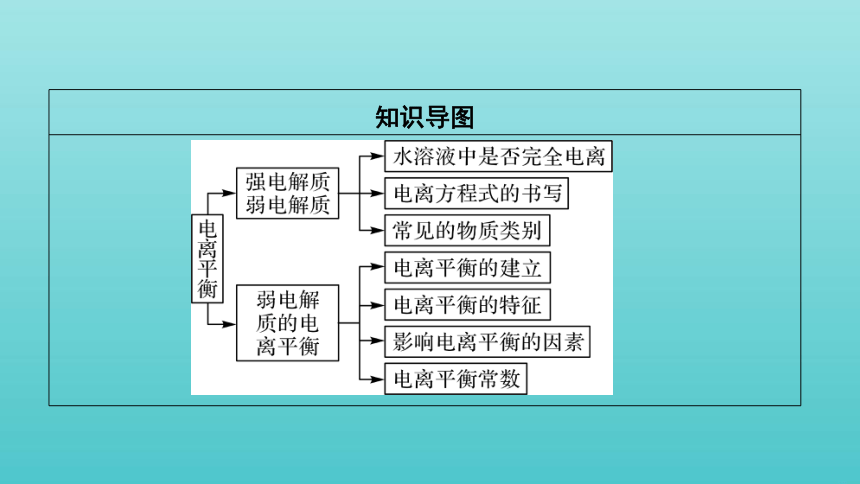
知识导图
课前 · 新知导学
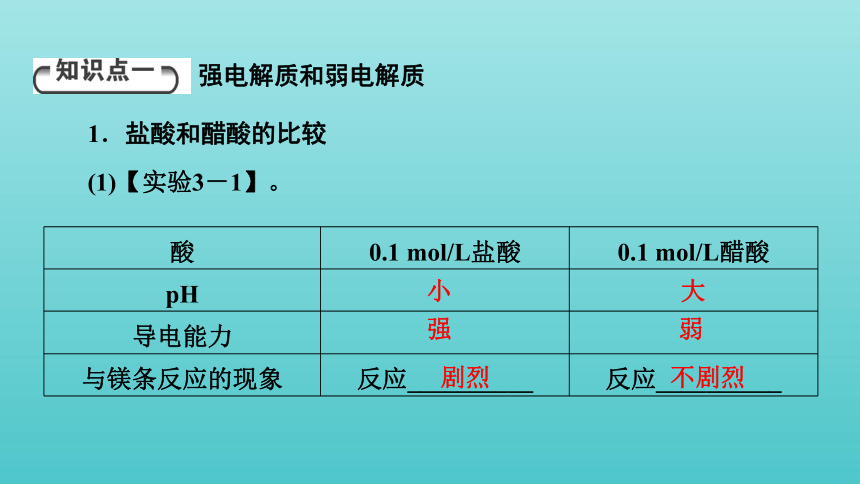
1.盐酸和醋酸的比较
(1)【实验3-1】。
强电解质和弱电解质
酸 0.1 mol/L盐酸 0.1 mol/L醋酸
pH
导电能力
与镁条反应的现象 反应__________ 反应__________
小
大
强
弱
剧烈
不剧烈
(2)实验结论。
①盐酸中c(H+)________醋酸溶液中c(H+),即盐酸中HCl电离程度比醋酸溶液中CH3COOH电离程度________。
②同浓度的盐酸与醋酸溶液比较,HCl________电离,CH3COOH________电离。
大于
大
全部
部分
2.强、弱电解质
(1)定义。
①强电解质:在水溶液中能够__________的电解质。
②弱电解质:在水溶液中只能__________的电解质。
(2)常见的强、弱电解质。
①强电解质:________、________、______________。
②弱电解质:________、________、________。
全部电离
部分电离
强酸
强碱
大部分盐
弱酸
弱碱
水
氨水可导电,且呈弱碱性,氨水是否属于弱碱?
微思考
【答案】氨水是氨气的水溶液,属于混合物,而碱属于化合物,所以氨水不属于弱碱,但氨水中的NH3·H2O属于弱碱。
下列属于强电解质的是 ( )
A.硫酸钡 B.食盐水
C.二氧化硅 D.醋酸
【答案】A
【解析】硫酸钡是强电解质,A正确;食盐水为混合物,B错误;二氧化硅是非电解质,C错误;醋酸在水中不完全电离,为弱电解质,D错误。
弱电解质的电离平衡
2.电离平衡
(1)定义:在一定条件下的弱电解质溶液中,电解质分子______________的速率和_________________的速率相等时,电离过程达到电离平衡状态。
(2)建立过程(用v-t图像描述)。
电离成离子
离子结合成分子
(3)电离平衡的特征。
【答案】(3) 弱 弱电解质分子电离成离子的速率 离子结合成弱电解质分子的速率 动态 保持恒定 发生移动
(4)浓度、温度对电离平衡的影响。
①浓度:对于同一弱电解质,一般浓度越小,电离程度越________。
②温度:因电离需要吸收热量,所以温度升高,电离程度增________。
大
大
微思考
【答案】D
1.定义
对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。
电离平衡常数
2.表示方法
(1)CH3COOH的电离常数Ka=______________。
(2)NH3·H2O的电离常数Kb=______________。
(3)H2CO3的Ka1=_________________、Ka2 =________________。
3.规律与应用
(1)一定温度下,Ka或Kb越大,对应弱电解质越易电离,电离程度______。如25 ℃时,Ka(CH3COOH)>Ka(HCN),则HCN的酸性比CH3COOH更________。
(2)同一种多元弱酸,第一步的电离常数__________第二步的,即Ka1________Ka2,则比较多元弱酸的酸性相对强弱时,通常只考虑__________电离。
越大
弱
远大于
第一步
4.影响因素
【答案】弱电解质本身 温度 温度 越大
氢硫酸(H2S)是一种常见的二元弱酸,其电离常数表达式能否写成Ka=c2(H+)·c(S2-)/c(H2S)
微思考
【答案】不能,因H2S是二元弱酸,其电离分为两步进行,其中第一步电离远大于第二步。
在25 ℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,已知四种酸的电离常数分别为4.6×10-4、1.8×10-4、4.9×10-10、Ka1=4.3×10-7和Ka2=5.6×10-11,溶液中氢离子浓度最小的是 ( )
A.HNO2 B.HCOOH
C.HCN D.H2CO3
【答案】C
【解析】根据电离平衡常数大小可以判断弱酸(或弱碱)的相对强弱,弱酸的Ka(多元弱酸则比较Ka1)越小,其电离程度越小,c(H+)越小,由题中数据可知,HCN酸性最弱,c(H+)最小。
课堂 · 素养初培
任务一 强电解质、弱电解质的比较
素养探源 核心素养 考查途径
宏观辨识与微观探析 离子方程式的书写或正误判断、离子共存判断、在图像中特别是酸碱中和滴定曲线中判断电解质的强弱、通过电解角度或水解角度判断电解质的强弱等,题型既有选择题,又会以原理综合题形式考查
[情境导入]
(1)将质量相等、表面积相同的两粒锌粒分别加入相同体积、相同浓度的HCl、CH3COOH溶液中,产生H2的速率相同吗?为什么?
【答案】不相同。因为HCl在溶液中全部电离,而CH3COOH在溶液中部分电离,溶液中的c(H+)前者比后者大,因此前者产生H2的速率比后者快。
(2)若取c(H+)相同、体积相同的盐酸与CH3COOH溶液做相同的实验(已知锌足量),两者反应过程中产生H2的量谁更大?
【答案】CH3COOH溶液产生H2的量更大。
[深化理解]
1.强、弱电解质的比较
项目 强电解质 弱电解质
定义 在水溶液中能够全部电离的电解质 在水溶液中只能部分电离的电解质
化学键类型 离子键或极性键 极性键
电离程度 全部电离 部分电离
2.易错概念辨析
(1)强电解质和弱电解质的分类依据是在水溶液中是否全部电离,全部电离的电解质是强电解质,部分电离的电解质是弱电解质。
(2)常见的强电解质有强酸(H2SO4、HNO3、HClO4、HCl、HBr、HI等)、强碱[KOH、NaOH、Ba(OH)2、Ca(OH)2等]、大部分盐。
(3)电解质的强弱与其溶液的导电性没有直接关系,强电解质溶液的导电性不一定比弱电解质溶液的导电性强。
(4)电解质的强弱与物质的溶解性没有关系,只要溶解到水中的部分全部电离就是强电解质。比如CH3COOH易溶于水,但溶于水后只能部分电离,所以CH3COOH是弱电解质;BaSO4难溶于水,但溶于水的部分全部电离,所以BaSO4是强电解质。
下列关于强、弱电解质的叙述中,正确的是 ( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
D.强电解质溶液的导电能力强,弱电解质溶液的导电能力弱
【答案】C
[典例精练]
【解析】HCl、HNO3是强电解质,但属于共价化合物,A错误;BaSO4、CaCO3为强电解质,尽管它们难溶于水,但它们溶于水的部分是全部电离的,B错误;若强电解质溶液的浓度很小,其导电能力也会很弱,D错误。
现有以下物质:①硫酸铜晶体,②碳酸钙固体,③纯磷酸,④硫化氢,⑤三氧化硫,⑥金属镁,⑦石墨,⑧固态苛性钾,⑨氨水,⑩熟石灰固体。
(1)属于强电解质的是__________(填序号,下同)。
(2)属于弱电解质的是__________。
(3)属于非电解质的是__________。
(4)既不是电解质,又不是非电解质的是__________。
(5)能导电的是__________。
【答案】 (1)①②⑧⑩ (2)③④ (3)⑤ (4)⑥⑦⑨ (5)⑥⑦⑨
【解析】(1)强电解质是溶于水全部电离的电解质,故①②⑧⑩是强电解质。(2)③④是溶于水部分电离的电解质,属于弱电解质。(3)⑤属于化合物,它的水溶液虽然能导电,但并不是它自身电离使溶液导电,所以是非电解质。(4)⑥⑦都是单质,⑨是混合物,它们既不是电解质也不是非电解质。(5)⑥⑦中均有能够自由移动的电子,⑨中有自由移动的离子,都能导电。
任务二 电离平衡的影响因素
素养探源 核心素养 考查途径
科学探究与创新意识 变化观念与平衡思想 本知识点在考题中常考查:外界条件对某些微粒或若干种微粒浓度组合的影响,且考查较为灵活,要多运用化学平衡常数表达式及其变形表达式
(1)当人体代谢产生的酸进入血液时,上述平衡将会发生怎样的移动以维持血液的pH基本不变?
【答案】当人体代谢产生的酸进入血液时,血液中的HCO和H+反应生成H2CO3,H2CO3分解产生CO2,CO2从肺部呼出,上述平衡逆向移动,及时地把进入的H+从血液中除去,pH基本不变。
(2)当人体代谢产生的碱进入血液时,上述平衡将会发生怎样的移动以维持血液的pH基本不变?
[深化理解]
1.外界条件对电离平衡的影响
电离平衡的移动符合勒夏特列原理,达到平衡时,离子浓度相当于可逆反应中生成物的平衡浓度,电解质分子浓度相当于可逆反应中反应物的平衡浓度,外界条件对其影响可归纳为:
(1)浓度:对于同一弱电解质,浓度越大,电离程度越小;浓度越小,电离程度越大,即溶液加水稀释时,电离平衡向着电离的方向移动。
(2)温度:由于弱电解质的电离过程一般是吸热的,升高温度,电离平衡向着电离的方向移动。
(3)同离子效应:在弱电解质溶液中加入与弱电解质电离产生相同离子的强电解质,电离平衡将向电离的反方向移动。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,电离平衡将向电离的方向移动。
3.注意事项
用化学平衡理论分析弱电解质的电离平衡问题时,考虑的主要影响因素有稀释、改变温度、加入含有相同分子或离子的物质等,在分析此类问题时应注意以下两点:
(1)平衡向“削弱”这种改变的方向移动,移动结果不能“抵消”或“超越”这种改变。
(2)加水稀释有利于电离,但是离子浓度降低,因为溶液体积增大程度大于离子增多程度。
[典例精练]
【答案】D
【答案】A
任务三 有关电离常数的计算
素养探源 核心素养 考查途径
科学探究与创新意识 证据推理与模型认知 考查一定条件下的电离平衡常数的计算,特别是与相应盐的水解常数及水的离子积常数融合在一起的计算,难度一般较大
[情境导入]
弱酸酸性强弱的比较:醋酸、碳酸、次氯酸的电离常数分别是:1.7×10-5 mol·L-1、4.4×10-7 mol·L-1(第一步电离)和4.7×10-8 mol·L-1。
(1)上述实验中能观察到什么现象?
【答案】锥形瓶中大理石溶解,有无色气泡产生,试管内澄清溶液变浑浊。
(2)由电离常数和实验现象,能得出哪些结论?
【答案】①相同条件下,弱酸的电离常数越大,酸性越强;②三种酸由弱到强的顺序是:次氯酸、碳酸、醋酸;③弱酸能与更弱酸的盐反应制取更弱的酸。
25 ℃时,在0.5 L 0.2 mol·L-1的HA溶液中,有0.001 mol的HA电离。
(1)求该温度下HA的电离常数。
(2)计算25 ℃时,0.1 mol·L-1该酸溶液中的c(H+)。
[典例精练]
辨析 · 易错易混
不能很好运用平衡移动原理来理解弱电解质的电离平衡
例1 已知 HA 是一种酸性很弱的弱酸。对0.5 mol/L的HA溶液,下列叙述正确的是 ( )
A.加入少量 NaOH 固体,平衡正向移动
B.加水,平衡不移动
C.滴加少量 0.1 mol/L HCl 溶液,溶液中 c(H+)减小
D.加入少量 NaA 固体,平衡正向移动
错解:B 或 C
错因分析:错选 B 的主要原因是认为加水稀释使弱电解质 HA 及其电离出的离子的浓度减小相同倍数,平衡不移动。错选C的主要原因是未考虑弱电解质的电离程度很小,仅凭给出的溶液浓度做判断,而忽视了盐酸是强电解质,0.1 mol/L 盐酸中c(H+)比0.5 mol/L HA溶液的大得多。
满分策略:(1)在弱电解质的电离平衡中,当外界条件改变时,弱电解质的电离平衡会发生移动,可依据化学平衡移动原理进行分析。即“加谁谁大”“减谁谁小”。加入参与平衡建立的某种微粒,其浓度一定增大;减少参与平衡建立的某种微粒,其浓度一定减小。
(2)加水稀释或增大弱电解质的浓度,都使电离平衡向电离的方向移动,但加水稀释时弱电解质的电离程度增大,而增大浓度时弱电解质的电离程度减小。
正解:A
未关注冰醋酸开始加水稀释时离子浓度的变化
例2 冰醋酸加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是( )
错解:B
正解:C
小练 · 素养达成
1.下列叙述正确的是 ( )
A.硫酸钡难溶于水,故硫酸钡为弱电解质
B.硝酸钾溶液能导电,故硝酸钾溶液为电解质
C.二氧化碳溶于水能部分电离,故二氧化碳为弱电解质
D.石墨虽能导电,但既不是电解质,也不是非电解质
【答案】D
【解析】BaSO4溶于水的部分全部电离,BaSO4是强电解质,A错误;KNO3溶液为混合物,不属于电解质,B错误;CO2不是电解质,C错误;石墨为单质,既不是电解质,也不是非电解质,D正确。
【答案】B
3.下列关于盐酸与醋酸两种稀溶液的说法正确的是 ( )
A.相同物质的量浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
C.c(H+)=10-3 mol·L-1的两溶液稀释到原溶液体积的100倍,c(H+)都为10-5 mol·L-1
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
【答案】B
【答案】D
5.有以下物质:
①石墨 ②铝 ③酒精 ④氨水 ⑤二氧化碳
⑥碳酸氢钠固体 ⑦氢氧化钡溶液 ⑧纯醋酸
⑨氧化钠固体 ⑩氯化氢气体
(1)其中能导电的是______________。
(2)属于非电解质的是______________。
(3)属于强电解质的是______________。
(4)属于弱电解质的是______________。
【答案】(1)①②④⑦ (2)③⑤ (3)⑥⑨⑩ (4)⑧
【解析】(1)石墨和铝都能导电,氨水和氢氧化钡溶液都有自由移动的离子,所以能导电。(2)酒精和二氧化碳为非电解质。(3)碳酸氢钠固体和氯化氢气体在水溶液中能完全电离,氧化钠固体在熔融状态时能完全电离,为强电解质。(4)纯醋酸在水中只能部分电离,为弱电解质。
6.有下列物质的溶液:
①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为________________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小顺序为________________。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为____________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=____________,温度升高,Ka将________(填“变大”“不变”或“变小”,下同);加入少量CH3COONa后,c(H+)________,Ka________。
【答案】(1)③>②=④>① (2)①>④=②>③
(3)0.1 mol·L-1 1.96×10-5 变大 变小 不变
第三章 水溶液中的离子反应与平衡
①从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应。
②理解强电解质、弱电解质的概念。认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。
③认识水的电离,了解水的离子积常数。
④认识溶液的酸碱性及pH,掌握检测溶液pH的方法。
⑤掌握酸碱中和滴定的概念和原理。了解指示剂的选择方法。掌握中和滴定实验的操作步骤和误差分析。
⑥了解不同盐溶液的酸碱性。理解盐溶液的水解规律。掌握盐类水解方程式的书写方法。了解盐类水解在生产、生活中的应用。
⑦掌握离子浓度大小比较的方法。
⑧知道沉淀溶解平衡的概念及其影响因素。明确溶度积和离子积的关系,学会判断反应进行的方向。
⑨能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。学会用沉淀溶解平衡的移动解决生产、生活中的实际问题。
学习内容 考查重点
电离平衡 强电解质和弱电解质 ①弱电解质、难溶电解质在离子方程式中的书写;离子共存中的弱电解质和难溶电解质;离子共存中溶液的酸碱性条件应用
②从电离角度、水解角度判断弱电解质
③酸碱中和滴定曲线分析与判断;氧化还原反应滴定、沉淀滴定计算或滴定曲线判断
④微粒间的等量关系或大小关系
⑤有关电离常数(Ka或Kb)、水的离子积常数(Kw)、水解常数(Kh)以及溶度积常数(Ksp)的计算
⑥盐类水解、沉淀溶解平衡在生产、生活中的应用
弱电解质的电离平衡
电离平衡常数
水的电离和溶液的pH 水的电离
溶液的酸碱性与pH
酸碱中和滴定
盐类的水解 盐类的水解
影响盐类水解的主要因素
盐类水解的应用
沉淀溶解平衡 难溶电解质的沉淀溶解平衡
沉淀溶解平衡的应用
第一节 电离平衡
素养目标
1.能准确判断强电解质和弱电解质,培养宏观辨识与微观探析的核心素养
2.会用变化观念与平衡思想描述弱电解质的电离平衡,能正确书写弱电解质的电离方程式,会分析电离平衡的移动
3.知道电离平衡常数的意义,培养证据推理与模型认知的核心素养
学法指导
1.复习必修第一册学习的电解质、非电解质概念和常见实例
2.从电离可逆性的角度认识强、弱电解质的根本区别
3.运用化学平衡原理认识弱电解质电离平衡的特点
4.复习化学平衡“三段式”计算方法,并将该方法应用于电离平衡常数的计算
知识导图
课前 · 新知导学
1.盐酸和醋酸的比较
(1)【实验3-1】。
强电解质和弱电解质
酸 0.1 mol/L盐酸 0.1 mol/L醋酸
pH
导电能力
与镁条反应的现象 反应__________ 反应__________
小
大
强
弱
剧烈
不剧烈
(2)实验结论。
①盐酸中c(H+)________醋酸溶液中c(H+),即盐酸中HCl电离程度比醋酸溶液中CH3COOH电离程度________。
②同浓度的盐酸与醋酸溶液比较,HCl________电离,CH3COOH________电离。
大于
大
全部
部分
2.强、弱电解质
(1)定义。
①强电解质:在水溶液中能够__________的电解质。
②弱电解质:在水溶液中只能__________的电解质。
(2)常见的强、弱电解质。
①强电解质:________、________、______________。
②弱电解质:________、________、________。
全部电离
部分电离
强酸
强碱
大部分盐
弱酸
弱碱
水
氨水可导电,且呈弱碱性,氨水是否属于弱碱?
微思考
【答案】氨水是氨气的水溶液,属于混合物,而碱属于化合物,所以氨水不属于弱碱,但氨水中的NH3·H2O属于弱碱。
下列属于强电解质的是 ( )
A.硫酸钡 B.食盐水
C.二氧化硅 D.醋酸
【答案】A
【解析】硫酸钡是强电解质,A正确;食盐水为混合物,B错误;二氧化硅是非电解质,C错误;醋酸在水中不完全电离,为弱电解质,D错误。
弱电解质的电离平衡
2.电离平衡
(1)定义:在一定条件下的弱电解质溶液中,电解质分子______________的速率和_________________的速率相等时,电离过程达到电离平衡状态。
(2)建立过程(用v-t图像描述)。
电离成离子
离子结合成分子
(3)电离平衡的特征。
【答案】(3) 弱 弱电解质分子电离成离子的速率 离子结合成弱电解质分子的速率 动态 保持恒定 发生移动
(4)浓度、温度对电离平衡的影响。
①浓度:对于同一弱电解质,一般浓度越小,电离程度越________。
②温度:因电离需要吸收热量,所以温度升高,电离程度增________。
大
大
微思考
【答案】D
1.定义
对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。
电离平衡常数
2.表示方法
(1)CH3COOH的电离常数Ka=______________。
(2)NH3·H2O的电离常数Kb=______________。
(3)H2CO3的Ka1=_________________、Ka2 =________________。
3.规律与应用
(1)一定温度下,Ka或Kb越大,对应弱电解质越易电离,电离程度______。如25 ℃时,Ka(CH3COOH)>Ka(HCN),则HCN的酸性比CH3COOH更________。
(2)同一种多元弱酸,第一步的电离常数__________第二步的,即Ka1________Ka2,则比较多元弱酸的酸性相对强弱时,通常只考虑__________电离。
越大
弱
远大于
第一步
4.影响因素
【答案】弱电解质本身 温度 温度 越大
氢硫酸(H2S)是一种常见的二元弱酸,其电离常数表达式能否写成Ka=c2(H+)·c(S2-)/c(H2S)
微思考
【答案】不能,因H2S是二元弱酸,其电离分为两步进行,其中第一步电离远大于第二步。
在25 ℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,已知四种酸的电离常数分别为4.6×10-4、1.8×10-4、4.9×10-10、Ka1=4.3×10-7和Ka2=5.6×10-11,溶液中氢离子浓度最小的是 ( )
A.HNO2 B.HCOOH
C.HCN D.H2CO3
【答案】C
【解析】根据电离平衡常数大小可以判断弱酸(或弱碱)的相对强弱,弱酸的Ka(多元弱酸则比较Ka1)越小,其电离程度越小,c(H+)越小,由题中数据可知,HCN酸性最弱,c(H+)最小。
课堂 · 素养初培
任务一 强电解质、弱电解质的比较
素养探源 核心素养 考查途径
宏观辨识与微观探析 离子方程式的书写或正误判断、离子共存判断、在图像中特别是酸碱中和滴定曲线中判断电解质的强弱、通过电解角度或水解角度判断电解质的强弱等,题型既有选择题,又会以原理综合题形式考查
[情境导入]
(1)将质量相等、表面积相同的两粒锌粒分别加入相同体积、相同浓度的HCl、CH3COOH溶液中,产生H2的速率相同吗?为什么?
【答案】不相同。因为HCl在溶液中全部电离,而CH3COOH在溶液中部分电离,溶液中的c(H+)前者比后者大,因此前者产生H2的速率比后者快。
(2)若取c(H+)相同、体积相同的盐酸与CH3COOH溶液做相同的实验(已知锌足量),两者反应过程中产生H2的量谁更大?
【答案】CH3COOH溶液产生H2的量更大。
[深化理解]
1.强、弱电解质的比较
项目 强电解质 弱电解质
定义 在水溶液中能够全部电离的电解质 在水溶液中只能部分电离的电解质
化学键类型 离子键或极性键 极性键
电离程度 全部电离 部分电离
2.易错概念辨析
(1)强电解质和弱电解质的分类依据是在水溶液中是否全部电离,全部电离的电解质是强电解质,部分电离的电解质是弱电解质。
(2)常见的强电解质有强酸(H2SO4、HNO3、HClO4、HCl、HBr、HI等)、强碱[KOH、NaOH、Ba(OH)2、Ca(OH)2等]、大部分盐。
(3)电解质的强弱与其溶液的导电性没有直接关系,强电解质溶液的导电性不一定比弱电解质溶液的导电性强。
(4)电解质的强弱与物质的溶解性没有关系,只要溶解到水中的部分全部电离就是强电解质。比如CH3COOH易溶于水,但溶于水后只能部分电离,所以CH3COOH是弱电解质;BaSO4难溶于水,但溶于水的部分全部电离,所以BaSO4是强电解质。
下列关于强、弱电解质的叙述中,正确的是 ( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
D.强电解质溶液的导电能力强,弱电解质溶液的导电能力弱
【答案】C
[典例精练]
【解析】HCl、HNO3是强电解质,但属于共价化合物,A错误;BaSO4、CaCO3为强电解质,尽管它们难溶于水,但它们溶于水的部分是全部电离的,B错误;若强电解质溶液的浓度很小,其导电能力也会很弱,D错误。
现有以下物质:①硫酸铜晶体,②碳酸钙固体,③纯磷酸,④硫化氢,⑤三氧化硫,⑥金属镁,⑦石墨,⑧固态苛性钾,⑨氨水,⑩熟石灰固体。
(1)属于强电解质的是__________(填序号,下同)。
(2)属于弱电解质的是__________。
(3)属于非电解质的是__________。
(4)既不是电解质,又不是非电解质的是__________。
(5)能导电的是__________。
【答案】 (1)①②⑧⑩ (2)③④ (3)⑤ (4)⑥⑦⑨ (5)⑥⑦⑨
【解析】(1)强电解质是溶于水全部电离的电解质,故①②⑧⑩是强电解质。(2)③④是溶于水部分电离的电解质,属于弱电解质。(3)⑤属于化合物,它的水溶液虽然能导电,但并不是它自身电离使溶液导电,所以是非电解质。(4)⑥⑦都是单质,⑨是混合物,它们既不是电解质也不是非电解质。(5)⑥⑦中均有能够自由移动的电子,⑨中有自由移动的离子,都能导电。
任务二 电离平衡的影响因素
素养探源 核心素养 考查途径
科学探究与创新意识 变化观念与平衡思想 本知识点在考题中常考查:外界条件对某些微粒或若干种微粒浓度组合的影响,且考查较为灵活,要多运用化学平衡常数表达式及其变形表达式
(1)当人体代谢产生的酸进入血液时,上述平衡将会发生怎样的移动以维持血液的pH基本不变?
【答案】当人体代谢产生的酸进入血液时,血液中的HCO和H+反应生成H2CO3,H2CO3分解产生CO2,CO2从肺部呼出,上述平衡逆向移动,及时地把进入的H+从血液中除去,pH基本不变。
(2)当人体代谢产生的碱进入血液时,上述平衡将会发生怎样的移动以维持血液的pH基本不变?
[深化理解]
1.外界条件对电离平衡的影响
电离平衡的移动符合勒夏特列原理,达到平衡时,离子浓度相当于可逆反应中生成物的平衡浓度,电解质分子浓度相当于可逆反应中反应物的平衡浓度,外界条件对其影响可归纳为:
(1)浓度:对于同一弱电解质,浓度越大,电离程度越小;浓度越小,电离程度越大,即溶液加水稀释时,电离平衡向着电离的方向移动。
(2)温度:由于弱电解质的电离过程一般是吸热的,升高温度,电离平衡向着电离的方向移动。
(3)同离子效应:在弱电解质溶液中加入与弱电解质电离产生相同离子的强电解质,电离平衡将向电离的反方向移动。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,电离平衡将向电离的方向移动。
3.注意事项
用化学平衡理论分析弱电解质的电离平衡问题时,考虑的主要影响因素有稀释、改变温度、加入含有相同分子或离子的物质等,在分析此类问题时应注意以下两点:
(1)平衡向“削弱”这种改变的方向移动,移动结果不能“抵消”或“超越”这种改变。
(2)加水稀释有利于电离,但是离子浓度降低,因为溶液体积增大程度大于离子增多程度。
[典例精练]
【答案】D
【答案】A
任务三 有关电离常数的计算
素养探源 核心素养 考查途径
科学探究与创新意识 证据推理与模型认知 考查一定条件下的电离平衡常数的计算,特别是与相应盐的水解常数及水的离子积常数融合在一起的计算,难度一般较大
[情境导入]
弱酸酸性强弱的比较:醋酸、碳酸、次氯酸的电离常数分别是:1.7×10-5 mol·L-1、4.4×10-7 mol·L-1(第一步电离)和4.7×10-8 mol·L-1。
(1)上述实验中能观察到什么现象?
【答案】锥形瓶中大理石溶解,有无色气泡产生,试管内澄清溶液变浑浊。
(2)由电离常数和实验现象,能得出哪些结论?
【答案】①相同条件下,弱酸的电离常数越大,酸性越强;②三种酸由弱到强的顺序是:次氯酸、碳酸、醋酸;③弱酸能与更弱酸的盐反应制取更弱的酸。
25 ℃时,在0.5 L 0.2 mol·L-1的HA溶液中,有0.001 mol的HA电离。
(1)求该温度下HA的电离常数。
(2)计算25 ℃时,0.1 mol·L-1该酸溶液中的c(H+)。
[典例精练]
辨析 · 易错易混
不能很好运用平衡移动原理来理解弱电解质的电离平衡
例1 已知 HA 是一种酸性很弱的弱酸。对0.5 mol/L的HA溶液,下列叙述正确的是 ( )
A.加入少量 NaOH 固体,平衡正向移动
B.加水,平衡不移动
C.滴加少量 0.1 mol/L HCl 溶液,溶液中 c(H+)减小
D.加入少量 NaA 固体,平衡正向移动
错解:B 或 C
错因分析:错选 B 的主要原因是认为加水稀释使弱电解质 HA 及其电离出的离子的浓度减小相同倍数,平衡不移动。错选C的主要原因是未考虑弱电解质的电离程度很小,仅凭给出的溶液浓度做判断,而忽视了盐酸是强电解质,0.1 mol/L 盐酸中c(H+)比0.5 mol/L HA溶液的大得多。
满分策略:(1)在弱电解质的电离平衡中,当外界条件改变时,弱电解质的电离平衡会发生移动,可依据化学平衡移动原理进行分析。即“加谁谁大”“减谁谁小”。加入参与平衡建立的某种微粒,其浓度一定增大;减少参与平衡建立的某种微粒,其浓度一定减小。
(2)加水稀释或增大弱电解质的浓度,都使电离平衡向电离的方向移动,但加水稀释时弱电解质的电离程度增大,而增大浓度时弱电解质的电离程度减小。
正解:A
未关注冰醋酸开始加水稀释时离子浓度的变化
例2 冰醋酸加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是( )
错解:B
正解:C
小练 · 素养达成
1.下列叙述正确的是 ( )
A.硫酸钡难溶于水,故硫酸钡为弱电解质
B.硝酸钾溶液能导电,故硝酸钾溶液为电解质
C.二氧化碳溶于水能部分电离,故二氧化碳为弱电解质
D.石墨虽能导电,但既不是电解质,也不是非电解质
【答案】D
【解析】BaSO4溶于水的部分全部电离,BaSO4是强电解质,A错误;KNO3溶液为混合物,不属于电解质,B错误;CO2不是电解质,C错误;石墨为单质,既不是电解质,也不是非电解质,D正确。
【答案】B
3.下列关于盐酸与醋酸两种稀溶液的说法正确的是 ( )
A.相同物质的量浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
C.c(H+)=10-3 mol·L-1的两溶液稀释到原溶液体积的100倍,c(H+)都为10-5 mol·L-1
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
【答案】B
【答案】D
5.有以下物质:
①石墨 ②铝 ③酒精 ④氨水 ⑤二氧化碳
⑥碳酸氢钠固体 ⑦氢氧化钡溶液 ⑧纯醋酸
⑨氧化钠固体 ⑩氯化氢气体
(1)其中能导电的是______________。
(2)属于非电解质的是______________。
(3)属于强电解质的是______________。
(4)属于弱电解质的是______________。
【答案】(1)①②④⑦ (2)③⑤ (3)⑥⑨⑩ (4)⑧
【解析】(1)石墨和铝都能导电,氨水和氢氧化钡溶液都有自由移动的离子,所以能导电。(2)酒精和二氧化碳为非电解质。(3)碳酸氢钠固体和氯化氢气体在水溶液中能完全电离,氧化钠固体在熔融状态时能完全电离,为强电解质。(4)纯醋酸在水中只能部分电离,为弱电解质。
6.有下列物质的溶液:
①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为________________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小顺序为________________。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为____________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=____________,温度升高,Ka将________(填“变大”“不变”或“变小”,下同);加入少量CH3COONa后,c(H+)________,Ka________。
【答案】(1)③>②=④>① (2)①>④=②>③
(3)0.1 mol·L-1 1.96×10-5 变大 变小 不变
