2021_2022学年新教材高中化学第3章水溶液中的离子反应与平衡本章总结课件新人教版选择性必修1
文档属性
| 名称 | 2021_2022学年新教材高中化学第3章水溶液中的离子反应与平衡本章总结课件新人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 15:25:38 | ||
图片预览









文档简介
(共54张PPT)
第三章 水溶液中的离子反应与平衡
本章总结
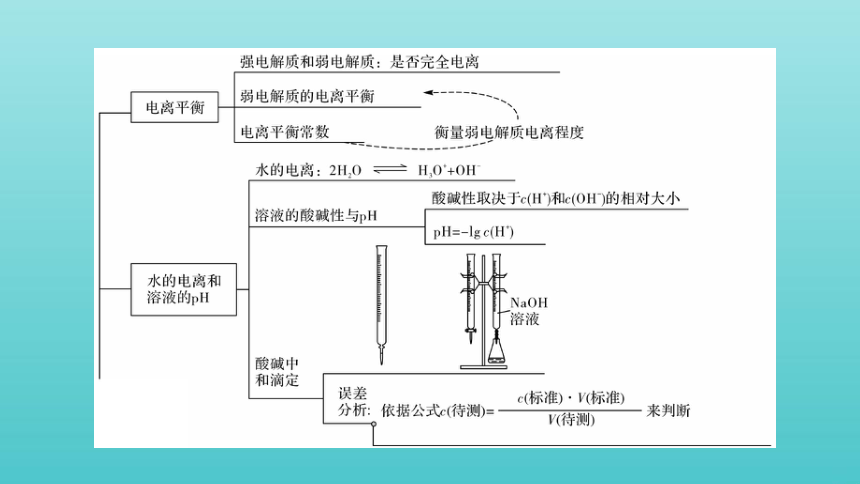
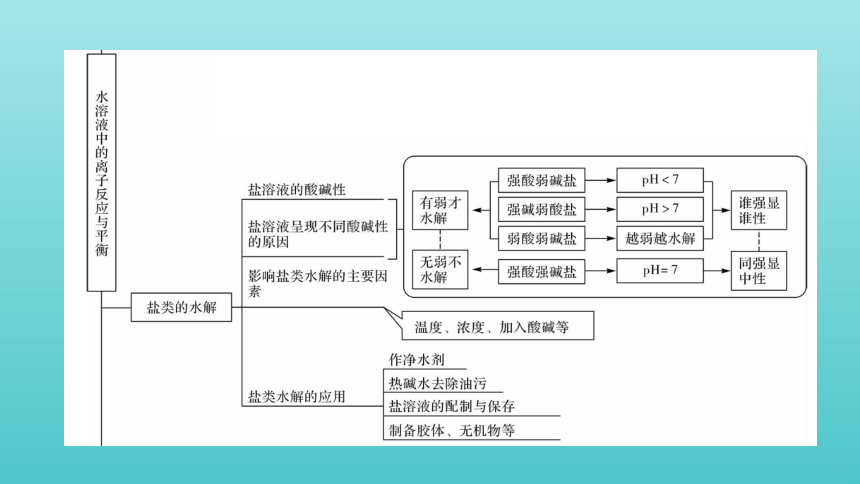
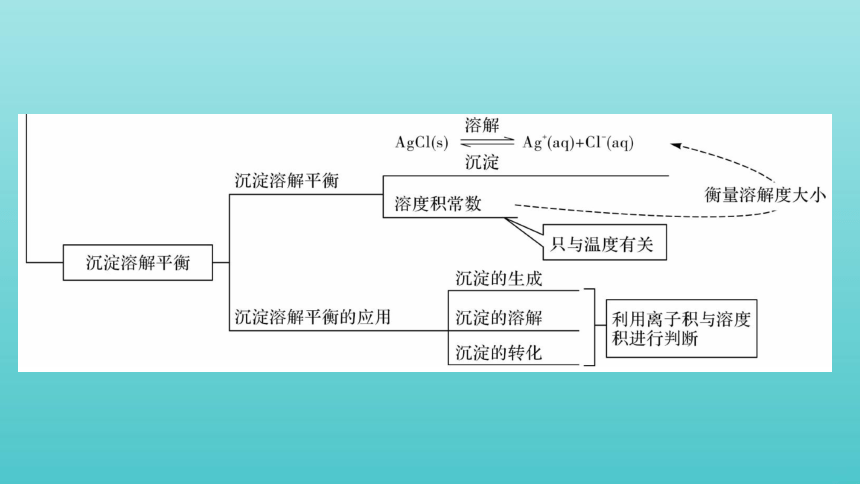
构建 · 知识网络
总结 · 专题提升
1.水解常数的概念
在一定温度下,能水解的盐(强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐)在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)浓度之比是一个常数,该常数就叫水解平衡常数。
水解常数(Kh)与电离常数的关系及应用
3.水解平衡常数是描述能水解的盐水解平衡的主要参数。它只受温度的影响,因水解过程是吸热过程,故它随温度的升高而增大。
磷酸是三元弱酸,常温下三级电离常数分别是
Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:
(1)常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序是____________(填序号)。
(2)常温下,NaH2PO4的水溶液pH________(填“>”“<”或“=”)7。
(3)常温下,Na2HPO4的水溶液呈________(填“酸”“碱”或“中”)性,用Ka与Kh的相对大小,说明判断理由:_________________________。
常数及溶度积的比较
化学平衡常数、水的离子积、电离平衡
项目 化学平衡常数 水的离子积 电离平衡常数 溶度积
影响 因素 温度
适应 范围 一般化学反应平衡体系 稀的酸性、碱性或中性溶液或盐溶液 弱电解质的电离平衡体系 难溶电解质的沉淀溶解平衡体系
(2020·辽宁丹东高二期末)化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数。下列关于这些常数的说法正确的是 ( )
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B.Ka(HCN)C.向硝酸银溶液中加入同浓度的氯化钠和溴化钠溶液,先产生浅黄色沉淀,则Ksp(AgBr)>Ksp(AgCl)
D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大
【答案】D
【解析】化学平衡常数只与温度有关,与浓度、压强、催化剂无关,A错误;HCN和CH3COOH都是一元弱酸,浓度相同时,电离常数越小,说明酸的电离程度越小,氢离子浓度越小,溶液的酸性越弱,故氢氰酸的酸性比醋酸弱,B错误;溶解度越小的越先沉淀,AgCl和AgBr结构相似,溶解度越小,溶度积就越小,故Ksp(AgBr)解决酸碱中和滴定曲线类问题的关键是巧抓“5点”,即曲线的起点、恰好反应点、中性点、反应一半点和过量点,先判断出各个点对应的溶质及溶液的酸碱性,再进行相关的分析和判
断。下面以室温时用0.1 mol·L-1 NaOH溶液滴定
20 mL 0.1 mol·L-1 HA溶液为例(如图),总结如
何抓住滴定曲线的5个关键点:
酸、碱中和滴定的图像
关键点 离子浓度的关系
起点(点①) 起点为HA的单一溶液,0.1 mol·L-1 HA溶液的pH>1说明HA是弱酸;溶液中c(HA)>c(H+)>c(A-)>c(OH-)
反应一半点(点②) 点②溶液是等物质的量的NaA和HA的混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,溶液中c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
中性点(点③) 此时溶液的pH=7,溶液呈中性,酸没有完全被中和,此时溶液中c(Na+)=c(A-)>c(HA)>c(H+)=c(OH-)
关键点 离子浓度的关系
恰好完全反应点(点④) 此时二者恰好完全反应生成NaA,NaA为强碱弱酸盐,溶液呈碱性,c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+)
过量点(点⑤) 此时,NaOH溶液过量,得到NaA与NaOH等物质的量的混合液,溶液呈碱性,溶液中c(Na+)>c(OH-)>c(A-)>c(H+)
(2020·江西上饶中学高二月考)25 ℃时,将pH均为2的盐酸与HX溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是 ( )
A.a、b两点:c(X-)>c(Cl-)
B.溶液的导电性:a>b
C.稀释前,c(HX)>0.01 mol·L-1
D.溶液体积稀释到原来的10倍,HX溶液的pH<3
【答案】B
【解析】盐酸是强酸,完全电离,HX为弱酸,部分电离。相同温度下,相同pH的盐酸和HX溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,所以a、b两点:c(X-)>c(Cl-),溶液的导电性:a0.01 mol·L-1,C正确;HX为弱酸,溶液稀释时,HX进一步电离,pH=2的HX溶液稀释到体积为原来的10倍,HX溶液的pH<3,D正确。
电解质溶液中三大守恒关系的应用
根据质子守恒有c(H2S)+c(H3O+)=c(S2-)+c(OH-),即c(H2S)+c(H+)=c(S2-)+c(OH-)。
如在K2S溶液中,H2O电离出的OH-即存在如下关系:c(OH-)=c(H+)+c(HS-)+2c(H2S)。
【答案】AD
典练 · 素养提升
素养解读 水溶液广泛存在于生命体及其赖以生存的环境中。许多化学反应都是在水溶液中进行的,其中,酸、碱和盐等电解质在水溶液中发生的离子反应,以及弱电解质的电离平衡、盐类的水解平衡和难溶电解质的沉淀溶解平衡,都与生命活动、日常生活、工农业生产和环境保护等息息相关。培养学生宏观辨识与微观探析、变化观念与平衡思想、科学探究与创新意识等学科核心素养。
1.(变化观念与平衡思想)下列物质的溶液在蒸发皿中加热蒸干、灼烧,可以得到该物质的固体的是 ( )
A.FeCl3 B.Na2SO3
C.KMnO4 D.MgSO4
【答案】D
【解析】FeCl3溶液在蒸发皿中加热蒸干、灼烧得到Fe2O3;Na2SO3溶液在蒸发皿中加热蒸干、灼烧得到Na2SO4;KMnO4加热分解。
【答案】D
【答案】D
【答案】D
5.(证据推理与模型认知)在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。
【答案】B
6.(科学探究与创新意识)在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈__________(填“酸”“中”或“碱”)性,原因是____________________________________(用离子方程式表示);实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以__________(填“促进”或“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应:______________。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是__________(填序号)。
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
C.丙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
D.丁同学:在醋酸钠溶液中滴加2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热的
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是__________(填化学式)。
对话 · 命题专家
(2020·天津卷)常温下,下列有关电解质溶液的说法错误的是
( )
A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)>Ka(HF)
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)
D.在1 mol·L-1 Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1
考查 角度 水解规律的应用、微粒浓度的大小顺序、溶度积大小比较、物料守恒等
考查 目的 通过强碱弱酸盐溶液的pH比较对应弱酸的电离平衡常数的大小;根据弱酸与弱酸的强碱盐混合溶液的pH推断微粒浓度的大小顺序;根据相似物质的溶解性比较Ksp的大小;物料守恒的应用等,从而培养考生的宏观辨识与微观探析等学科核心素养
考查 形式 在高考中主要以选择题形式呈现,具体考查形式有文字叙述型,也有图像解读型,其中涉及图像的题目难度系数较大
解题策略:先认真阅读各选项提供的已知信息及判断的落脚点;然后,回顾有关理论知识,并与选项内容相结合,从而得出各选项的判断。
答案:A
下列叙述正确的是 ( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol/L
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
考查 角度 微粒变化曲线判断、微粒浓度的大小计算、电离常数Ka的计算、微粒浓度大小判断等
考查 目的 以图像中呈现的酸碱中和滴定过程中pH变化、微粒分布系数的变化求算电离常数、微粒物质的量浓度及微粒浓度大小比较等,培养考生的识图能力,从而考查考生的宏观辨识与微观探析等学科核心素养
考查 形式 在高考中主要以图像题形式呈现,题型灵活,可以是选择题,也可能是填空题,难度系数较大
答案:C
第三章 水溶液中的离子反应与平衡
本章总结
构建 · 知识网络
总结 · 专题提升
1.水解常数的概念
在一定温度下,能水解的盐(强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐)在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)浓度之比是一个常数,该常数就叫水解平衡常数。
水解常数(Kh)与电离常数的关系及应用
3.水解平衡常数是描述能水解的盐水解平衡的主要参数。它只受温度的影响,因水解过程是吸热过程,故它随温度的升高而增大。
磷酸是三元弱酸,常温下三级电离常数分别是
Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:
(1)常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序是____________(填序号)。
(2)常温下,NaH2PO4的水溶液pH________(填“>”“<”或“=”)7。
(3)常温下,Na2HPO4的水溶液呈________(填“酸”“碱”或“中”)性,用Ka与Kh的相对大小,说明判断理由:_________________________。
常数及溶度积的比较
化学平衡常数、水的离子积、电离平衡
项目 化学平衡常数 水的离子积 电离平衡常数 溶度积
影响 因素 温度
适应 范围 一般化学反应平衡体系 稀的酸性、碱性或中性溶液或盐溶液 弱电解质的电离平衡体系 难溶电解质的沉淀溶解平衡体系
(2020·辽宁丹东高二期末)化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数。下列关于这些常数的说法正确的是 ( )
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B.Ka(HCN)
D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大
【答案】D
【解析】化学平衡常数只与温度有关,与浓度、压强、催化剂无关,A错误;HCN和CH3COOH都是一元弱酸,浓度相同时,电离常数越小,说明酸的电离程度越小,氢离子浓度越小,溶液的酸性越弱,故氢氰酸的酸性比醋酸弱,B错误;溶解度越小的越先沉淀,AgCl和AgBr结构相似,溶解度越小,溶度积就越小,故Ksp(AgBr)
断。下面以室温时用0.1 mol·L-1 NaOH溶液滴定
20 mL 0.1 mol·L-1 HA溶液为例(如图),总结如
何抓住滴定曲线的5个关键点:
酸、碱中和滴定的图像
关键点 离子浓度的关系
起点(点①) 起点为HA的单一溶液,0.1 mol·L-1 HA溶液的pH>1说明HA是弱酸;溶液中c(HA)>c(H+)>c(A-)>c(OH-)
反应一半点(点②) 点②溶液是等物质的量的NaA和HA的混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,溶液中c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
中性点(点③) 此时溶液的pH=7,溶液呈中性,酸没有完全被中和,此时溶液中c(Na+)=c(A-)>c(HA)>c(H+)=c(OH-)
关键点 离子浓度的关系
恰好完全反应点(点④) 此时二者恰好完全反应生成NaA,NaA为强碱弱酸盐,溶液呈碱性,c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+)
过量点(点⑤) 此时,NaOH溶液过量,得到NaA与NaOH等物质的量的混合液,溶液呈碱性,溶液中c(Na+)>c(OH-)>c(A-)>c(H+)
(2020·江西上饶中学高二月考)25 ℃时,将pH均为2的盐酸与HX溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是 ( )
A.a、b两点:c(X-)>c(Cl-)
B.溶液的导电性:a>b
C.稀释前,c(HX)>0.01 mol·L-1
D.溶液体积稀释到原来的10倍,HX溶液的pH<3
【答案】B
【解析】盐酸是强酸,完全电离,HX为弱酸,部分电离。相同温度下,相同pH的盐酸和HX溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,所以a、b两点:c(X-)>c(Cl-),溶液的导电性:a
电解质溶液中三大守恒关系的应用
根据质子守恒有c(H2S)+c(H3O+)=c(S2-)+c(OH-),即c(H2S)+c(H+)=c(S2-)+c(OH-)。
如在K2S溶液中,H2O电离出的OH-即存在如下关系:c(OH-)=c(H+)+c(HS-)+2c(H2S)。
【答案】AD
典练 · 素养提升
素养解读 水溶液广泛存在于生命体及其赖以生存的环境中。许多化学反应都是在水溶液中进行的,其中,酸、碱和盐等电解质在水溶液中发生的离子反应,以及弱电解质的电离平衡、盐类的水解平衡和难溶电解质的沉淀溶解平衡,都与生命活动、日常生活、工农业生产和环境保护等息息相关。培养学生宏观辨识与微观探析、变化观念与平衡思想、科学探究与创新意识等学科核心素养。
1.(变化观念与平衡思想)下列物质的溶液在蒸发皿中加热蒸干、灼烧,可以得到该物质的固体的是 ( )
A.FeCl3 B.Na2SO3
C.KMnO4 D.MgSO4
【答案】D
【解析】FeCl3溶液在蒸发皿中加热蒸干、灼烧得到Fe2O3;Na2SO3溶液在蒸发皿中加热蒸干、灼烧得到Na2SO4;KMnO4加热分解。
【答案】D
【答案】D
【答案】D
5.(证据推理与模型认知)在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。
【答案】B
6.(科学探究与创新意识)在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈__________(填“酸”“中”或“碱”)性,原因是____________________________________(用离子方程式表示);实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以__________(填“促进”或“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应:______________。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是__________(填序号)。
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
C.丙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
D.丁同学:在醋酸钠溶液中滴加2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热的
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是__________(填化学式)。
对话 · 命题专家
(2020·天津卷)常温下,下列有关电解质溶液的说法错误的是
( )
A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)>Ka(HF)
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)
D.在1 mol·L-1 Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1
考查 角度 水解规律的应用、微粒浓度的大小顺序、溶度积大小比较、物料守恒等
考查 目的 通过强碱弱酸盐溶液的pH比较对应弱酸的电离平衡常数的大小;根据弱酸与弱酸的强碱盐混合溶液的pH推断微粒浓度的大小顺序;根据相似物质的溶解性比较Ksp的大小;物料守恒的应用等,从而培养考生的宏观辨识与微观探析等学科核心素养
考查 形式 在高考中主要以选择题形式呈现,具体考查形式有文字叙述型,也有图像解读型,其中涉及图像的题目难度系数较大
解题策略:先认真阅读各选项提供的已知信息及判断的落脚点;然后,回顾有关理论知识,并与选项内容相结合,从而得出各选项的判断。
答案:A
下列叙述正确的是 ( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol/L
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
考查 角度 微粒变化曲线判断、微粒浓度的大小计算、电离常数Ka的计算、微粒浓度大小判断等
考查 目的 以图像中呈现的酸碱中和滴定过程中pH变化、微粒分布系数的变化求算电离常数、微粒物质的量浓度及微粒浓度大小比较等,培养考生的识图能力,从而考查考生的宏观辨识与微观探析等学科核心素养
考查 形式 在高考中主要以图像题形式呈现,题型灵活,可以是选择题,也可能是填空题,难度系数较大
答案:C
