2021_2022学年新教材高中化学第2章化学反应速率与化学平衡第3节化学反应的方向课件新人教版选择性必修1
文档属性
| 名称 | 2021_2022学年新教材高中化学第2章化学反应速率与化学平衡第3节化学反应的方向课件新人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 15:48:53 | ||
图片预览











文档简介
(共38张PPT)
第二章 化学反应速率与化学平衡
第三节 化学反应的方向
素养目标
1.结合学过的化学反应实例,了解自发反应和非自发反应的含义
2.通过“有序”和“无序”的对比,了解熵和熵变的意义
3.初步了解焓变和熵变对化学反应方向的影响,能用焓变和熵变解释化学反应的方向,培养证据推理与模型认知能力
学法指导
1.结合生产、生活中的实例,如“水总是自发地从高处流向低处”等感受某些过程的自发性,进而结合“白磷自燃”“铁的锈蚀”等实例认识某些化学反应的自发性
2.阅读教材,结合实例认识只依据“焓判据”或“熵判据”判断反应自发性的局限性
3.结合“焓判据”和“熵判据”,综合认识自由能和化学反应方向判断的科学性
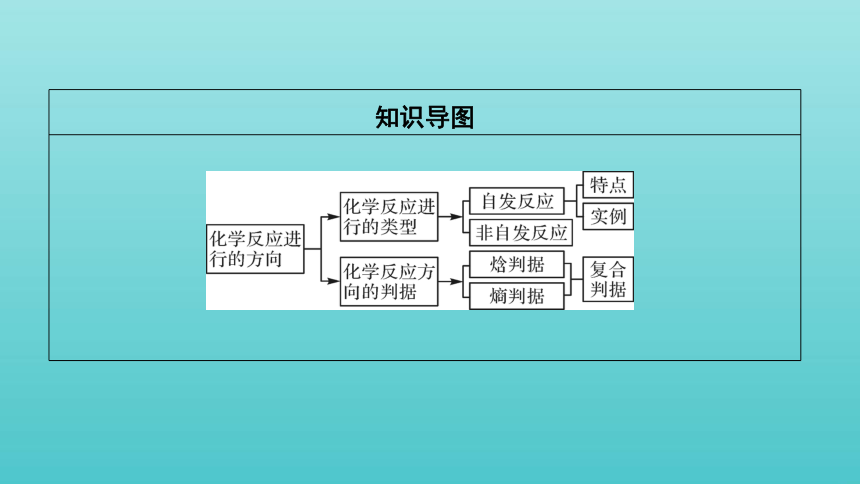
知识导图
课前 · 新知导学
1.自发过程:自然界有一些过程是自发进行的,而且是有方向性的。如:水由高处流向低处。
2.自发反应:有些化学反应也是自发进行的,而且有__________。
3.化学反应的自发性与反应焓变的关系
(1)放热反应:绝大多数都能______________,且反应放出的热量越多,体系能量降低得也越多,反应越完全。
(2)吸热反应:有些也能自发进行。
(3)结论:反应的焓变是制约化学反应能否自发进行的因素之一,但不是唯一因素。
方向性
化学反应的方向
自发进行
4.化学反应的自发性与熵变的关系
(1)熵。
熵是衡量一个体系______________的物理量,即表示体系的不规则或无序状态程度的物理量。混乱度________,体系越无序,体系的熵就________。熵的符号为S。
(2)物质熵大小的判断。
物质的存在状态:对于同一物质,等物质的量的该物质其熵值大小与物质的存在状态有关,气态时熵值______,固态时熵值________,而液态时介于二者之间,物质的状态与熵大小的关系:S(g)>S(l)>S(s)。
混乱度
越大
越大
最大
最小
(3)熵变与反应方向。
①含义:大多数自发反应有趋向于体系混乱度______的倾向,导致体系的熵________。
②规律:大多数__________的反应都能自发进行。
③局限性:少数__________的反应在一定条件下也可以自发进行,如-10 ℃的液态水自动结冰、NH3(g)+HCl(g)===NH4Cl(s)。
④结论:熵变是影响反应自发进行的因素之一,但不是唯一因素。
增大
增大
熵增加
熵减少
5.自由能与化学反应的方向
体系的自由能变化(符号ΔG,单位kJ·mol-1)综合考虑了________和________对体系的影响,可用于判断化学反应自发进行的方向,表达式为ΔG=_________。在温度、压强一定的条件下,自发反应总是向ΔG____0的方向进行。
焓变
熵变
ΔH-T·ΔS
<
什么样的体系,自发过程才向着熵增的方向进行?
微思考
【答案】孤立体系或绝热体系。
(5)能自发进行的反应不一定真的能发生。 ( )
(6)由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程。 ( )
【答案】(1)× (2)√ (3)√ (4)× (5)√ (6)√
课堂 · 素养初培
任务 判断化学反应方向的依据
素养探源 核心素养 考查途径
证据推理与模型认知 变化观念与平衡思想 在近几年的考题中有时会出现考查化学反应进行方向的判断选项,特别是有关综合判据的应用,但难度一般,所占分值较小
④硝酸铵溶于水要吸热。
⑤冰融化要吸热。
⑥两种或两种以上互不反应的气体通入一密闭容器中,最终会混合均匀。
(1)对于自发反应①②③,从能量角度分析它们为什么可以自发。
【答案】反应①②③的ΔH均小于0,根据焓判据可知该反应为自发反应。
(2)对于自发过程④⑤⑥,这些过程都是自发的,与焓有关吗?是什么因素决定它们能自发进行?
【答案】自发过程④⑤⑥与焓无关,是根据熵判据,它们属于自发过程。
【答案】合成氨反应根据焓判据可知该反应能自发进行,但是根据熵判据可知该反应不能自发进行。所以,判断该反应是否能自发进行,应用综合判据ΔG=ΔH- TΔS=-92.2×103 J·mol-1-298 K×(-198.2 J·mol-1·K-1 )<0。
[深化理解]
1.焓判据:放热过程中体系能量降低,ΔH<0,反应具有自发进行的倾向。
2.熵判据:在密闭条件下,体系有自发地向混乱度增加(ΔS>0)的方向转变的倾向。
3.复合判据
(1)判据。
(2)温度对反应方向的影响。
对于化学反应能否自发进行,下列说法中错误的是 ( )
A.若ΔH<0,ΔS>0,任何温度下都能自发进行
B.若ΔH>0,ΔS<0,任何温度下都不能自发进行
C.若ΔH>0,ΔS>0,低温时可自发进行
D.若ΔH<0,ΔS<0,低温时可自发进行
[典例精练]
【答案】C
【解析】
选项 内容分析 结论
A ΔH<0,ΔS>0 ΔH-TΔS<0,任何温度下都能自发进行 正确
B ΔH>0,ΔS<0 ΔH-TΔS>0,任何温度下都不能自发进行 正确
C ΔH>0,ΔS>0,高温时能满足ΔH-TΔS<0 错误
D ΔH<0,ΔS<0,低温时能满足ΔH-TΔS<0 正确
【答案】C
辨析 · 易错易混
片面单一使用能量判据或熵判据
例1 下列说法中正确的是 ( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
错解:A
错因分析:部分同学片面单一使用能量判据或熵判据。
满分策略:放热反应常常是容易进行的过程,吸热反应有些也是自发反应;自发反应的熵不一定增大,可能减少,也可能不变。过程的自发性只能用于判断过程的方向,是否能实现还要看具体的条件。
正解:C
错解:A、B、D
错因分析:错选A的原因在于把反应的方向与反应速率混淆;且反应的自发性只表明反应具有能自发进行的趋势,并不能说明反应一定进行。易错选B的原因在于误认为非自发进行的反应在任何条件下都不能进行。错选D的原因在于忽视了“电解”是“输入能量”,是借助了外力。
满分策略:非自发反应在有外力作用时有可能发生,如有些反应常温时不能进行,高温时可以进行。
正解:C
不明确混乱度与物质的状态关系
例3 下列关于冰熔化为水的过程判断正确的是 ( )
A.ΔH>0,ΔS<0 B.ΔH<0,ΔS>0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS<0
错解:A
错因分析:部分同学误认为冰融化成水,分子活动能力减小,混乱度减小,ΔS<0,而误选A。熔化是吸热的变化,故ΔH>0,冰融化成水,分子活动能力增强,混乱度增大,故ΔS>0。
满分策略:等量的同种物质,熵值与其状态有关,固态时熵值最小,气态时熵值最大。固→液→气,属于熵增过程;气→液→固,属于熵减过程。
正解:C
小练 · 素养达成
1.研究过程自发性的目的是 ( )
A.判断过程的方向
B.确定过程是否一定发生
C.判断过程发生的速率
D.判断过程的热效应
【答案】A
【解析】研究过程的自发性用于判断过程的方向,不能确定过程是否一定会发生、过程发生的速率、过程的热效应等。
2.下列反应中,在一定温度下,属于自发进行的吸热反应的是 ( )
A.NaOH与HCl反应
B.CO与O2点燃
C.Ba(OH)2·8H2O与NH4Cl反应
D.SO3与H2O反应
【答案】C
【答案】A
【解析】一般来说,化合反应的焓变小于0,气体体积减小的反应ΔS<0。
4.反应CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度下才能自发向右进行,若反应的|ΔH|=17 kJ·mol-1,该温度下|ΔH-TΔS|=17 kJ·mol-1,则下列选项中正确的是 ( )
A.ΔH>0,ΔH-TΔS<0
B.ΔH<0,ΔH-TΔS>0
C.ΔH>0,ΔH-TΔS>0
D.ΔH<0,ΔH-TΔS<0
【答案】A
【解析】根据方程式可知该反应的ΔS>0,如果ΔH<0,则该反应在任何温度下都自发进行,不符合事实,故ΔH=+17 kJ·mol-1>0,所以选A。
5.某化学反应的ΔH=-122 kJ·mol-1,ΔS=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
【答案】A
【解析】题中ΔH<0、ΔS>0,故必有ΔH-TΔS<0,故在任何温度下都能自发进行。
【答案】(1)减小 (2)无明显变化 (3)增大 (4)减小 (5)增大
第二章 化学反应速率与化学平衡
第三节 化学反应的方向
素养目标
1.结合学过的化学反应实例,了解自发反应和非自发反应的含义
2.通过“有序”和“无序”的对比,了解熵和熵变的意义
3.初步了解焓变和熵变对化学反应方向的影响,能用焓变和熵变解释化学反应的方向,培养证据推理与模型认知能力
学法指导
1.结合生产、生活中的实例,如“水总是自发地从高处流向低处”等感受某些过程的自发性,进而结合“白磷自燃”“铁的锈蚀”等实例认识某些化学反应的自发性
2.阅读教材,结合实例认识只依据“焓判据”或“熵判据”判断反应自发性的局限性
3.结合“焓判据”和“熵判据”,综合认识自由能和化学反应方向判断的科学性
知识导图
课前 · 新知导学
1.自发过程:自然界有一些过程是自发进行的,而且是有方向性的。如:水由高处流向低处。
2.自发反应:有些化学反应也是自发进行的,而且有__________。
3.化学反应的自发性与反应焓变的关系
(1)放热反应:绝大多数都能______________,且反应放出的热量越多,体系能量降低得也越多,反应越完全。
(2)吸热反应:有些也能自发进行。
(3)结论:反应的焓变是制约化学反应能否自发进行的因素之一,但不是唯一因素。
方向性
化学反应的方向
自发进行
4.化学反应的自发性与熵变的关系
(1)熵。
熵是衡量一个体系______________的物理量,即表示体系的不规则或无序状态程度的物理量。混乱度________,体系越无序,体系的熵就________。熵的符号为S。
(2)物质熵大小的判断。
物质的存在状态:对于同一物质,等物质的量的该物质其熵值大小与物质的存在状态有关,气态时熵值______,固态时熵值________,而液态时介于二者之间,物质的状态与熵大小的关系:S(g)>S(l)>S(s)。
混乱度
越大
越大
最大
最小
(3)熵变与反应方向。
①含义:大多数自发反应有趋向于体系混乱度______的倾向,导致体系的熵________。
②规律:大多数__________的反应都能自发进行。
③局限性:少数__________的反应在一定条件下也可以自发进行,如-10 ℃的液态水自动结冰、NH3(g)+HCl(g)===NH4Cl(s)。
④结论:熵变是影响反应自发进行的因素之一,但不是唯一因素。
增大
增大
熵增加
熵减少
5.自由能与化学反应的方向
体系的自由能变化(符号ΔG,单位kJ·mol-1)综合考虑了________和________对体系的影响,可用于判断化学反应自发进行的方向,表达式为ΔG=_________。在温度、压强一定的条件下,自发反应总是向ΔG____0的方向进行。
焓变
熵变
ΔH-T·ΔS
<
什么样的体系,自发过程才向着熵增的方向进行?
微思考
【答案】孤立体系或绝热体系。
(5)能自发进行的反应不一定真的能发生。 ( )
(6)由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程。 ( )
【答案】(1)× (2)√ (3)√ (4)× (5)√ (6)√
课堂 · 素养初培
任务 判断化学反应方向的依据
素养探源 核心素养 考查途径
证据推理与模型认知 变化观念与平衡思想 在近几年的考题中有时会出现考查化学反应进行方向的判断选项,特别是有关综合判据的应用,但难度一般,所占分值较小
④硝酸铵溶于水要吸热。
⑤冰融化要吸热。
⑥两种或两种以上互不反应的气体通入一密闭容器中,最终会混合均匀。
(1)对于自发反应①②③,从能量角度分析它们为什么可以自发。
【答案】反应①②③的ΔH均小于0,根据焓判据可知该反应为自发反应。
(2)对于自发过程④⑤⑥,这些过程都是自发的,与焓有关吗?是什么因素决定它们能自发进行?
【答案】自发过程④⑤⑥与焓无关,是根据熵判据,它们属于自发过程。
【答案】合成氨反应根据焓判据可知该反应能自发进行,但是根据熵判据可知该反应不能自发进行。所以,判断该反应是否能自发进行,应用综合判据ΔG=ΔH- TΔS=-92.2×103 J·mol-1-298 K×(-198.2 J·mol-1·K-1 )<0。
[深化理解]
1.焓判据:放热过程中体系能量降低,ΔH<0,反应具有自发进行的倾向。
2.熵判据:在密闭条件下,体系有自发地向混乱度增加(ΔS>0)的方向转变的倾向。
3.复合判据
(1)判据。
(2)温度对反应方向的影响。
对于化学反应能否自发进行,下列说法中错误的是 ( )
A.若ΔH<0,ΔS>0,任何温度下都能自发进行
B.若ΔH>0,ΔS<0,任何温度下都不能自发进行
C.若ΔH>0,ΔS>0,低温时可自发进行
D.若ΔH<0,ΔS<0,低温时可自发进行
[典例精练]
【答案】C
【解析】
选项 内容分析 结论
A ΔH<0,ΔS>0 ΔH-TΔS<0,任何温度下都能自发进行 正确
B ΔH>0,ΔS<0 ΔH-TΔS>0,任何温度下都不能自发进行 正确
C ΔH>0,ΔS>0,高温时能满足ΔH-TΔS<0 错误
D ΔH<0,ΔS<0,低温时能满足ΔH-TΔS<0 正确
【答案】C
辨析 · 易错易混
片面单一使用能量判据或熵判据
例1 下列说法中正确的是 ( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
错解:A
错因分析:部分同学片面单一使用能量判据或熵判据。
满分策略:放热反应常常是容易进行的过程,吸热反应有些也是自发反应;自发反应的熵不一定增大,可能减少,也可能不变。过程的自发性只能用于判断过程的方向,是否能实现还要看具体的条件。
正解:C
错解:A、B、D
错因分析:错选A的原因在于把反应的方向与反应速率混淆;且反应的自发性只表明反应具有能自发进行的趋势,并不能说明反应一定进行。易错选B的原因在于误认为非自发进行的反应在任何条件下都不能进行。错选D的原因在于忽视了“电解”是“输入能量”,是借助了外力。
满分策略:非自发反应在有外力作用时有可能发生,如有些反应常温时不能进行,高温时可以进行。
正解:C
不明确混乱度与物质的状态关系
例3 下列关于冰熔化为水的过程判断正确的是 ( )
A.ΔH>0,ΔS<0 B.ΔH<0,ΔS>0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS<0
错解:A
错因分析:部分同学误认为冰融化成水,分子活动能力减小,混乱度减小,ΔS<0,而误选A。熔化是吸热的变化,故ΔH>0,冰融化成水,分子活动能力增强,混乱度增大,故ΔS>0。
满分策略:等量的同种物质,熵值与其状态有关,固态时熵值最小,气态时熵值最大。固→液→气,属于熵增过程;气→液→固,属于熵减过程。
正解:C
小练 · 素养达成
1.研究过程自发性的目的是 ( )
A.判断过程的方向
B.确定过程是否一定发生
C.判断过程发生的速率
D.判断过程的热效应
【答案】A
【解析】研究过程的自发性用于判断过程的方向,不能确定过程是否一定会发生、过程发生的速率、过程的热效应等。
2.下列反应中,在一定温度下,属于自发进行的吸热反应的是 ( )
A.NaOH与HCl反应
B.CO与O2点燃
C.Ba(OH)2·8H2O与NH4Cl反应
D.SO3与H2O反应
【答案】C
【答案】A
【解析】一般来说,化合反应的焓变小于0,气体体积减小的反应ΔS<0。
4.反应CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度下才能自发向右进行,若反应的|ΔH|=17 kJ·mol-1,该温度下|ΔH-TΔS|=17 kJ·mol-1,则下列选项中正确的是 ( )
A.ΔH>0,ΔH-TΔS<0
B.ΔH<0,ΔH-TΔS>0
C.ΔH>0,ΔH-TΔS>0
D.ΔH<0,ΔH-TΔS<0
【答案】A
【解析】根据方程式可知该反应的ΔS>0,如果ΔH<0,则该反应在任何温度下都自发进行,不符合事实,故ΔH=+17 kJ·mol-1>0,所以选A。
5.某化学反应的ΔH=-122 kJ·mol-1,ΔS=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
【答案】A
【解析】题中ΔH<0、ΔS>0,故必有ΔH-TΔS<0,故在任何温度下都能自发进行。
【答案】(1)减小 (2)无明显变化 (3)增大 (4)减小 (5)增大
