2021_2022学年新教材高中化学第2章化学反应速率与化学平衡第2节第3课时影响化学平衡的因素课件新人教版选择性必修1
文档属性
| 名称 | 2021_2022学年新教材高中化学第2章化学反应速率与化学平衡第2节第3课时影响化学平衡的因素课件新人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 15:48:47 | ||
图片预览










文档简介
(共68张PPT)
第二章 化学反应速率与化学平衡
第二节 化学平衡
第3课时 影响化学平衡的因素
素养目标
1.通过实验探究,了解温度、浓度、压强和催化剂对化学平衡状态的影响
2.学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向
学法指导
1.认真做好对比实验,从感性上认识浓度、压强或温度等外界条件的改变对化学平衡的影响及化学移动方向
2.通过实验结果的对比,总结加深对化学平衡移动原理中“减弱”二字的领会,理解平衡移动原理的实质
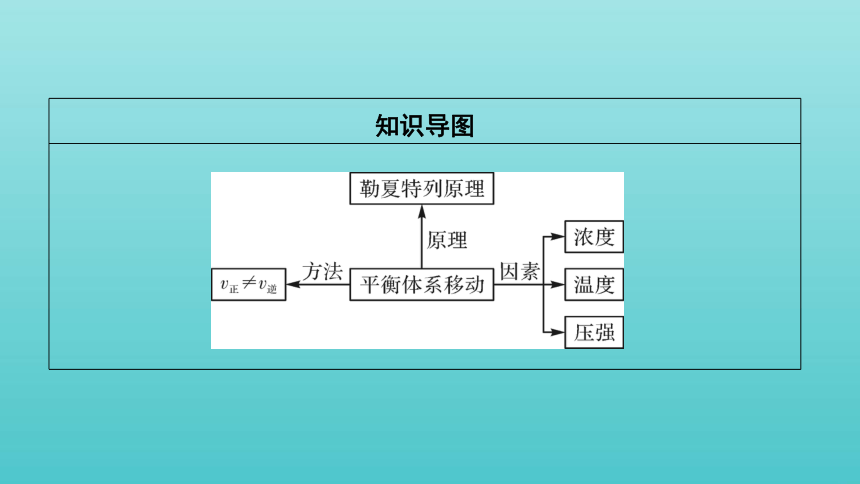
知识导图
课前 · 新知导学
1.化学平衡移动
(1)含义:当一个可逆反应达到平衡后,如果改变________、________、压强等反应条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到______________。
(2)实质:改变条件后。
①v正______v逆。
②各组分的百分含量发生________。
浓度
化学平衡的移动
温度
新的平衡状态
≠
改变
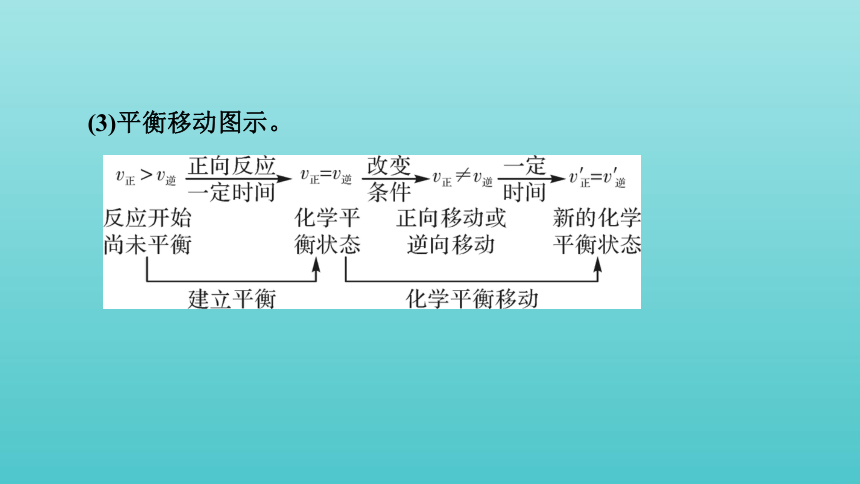
(3)平衡移动图示。
2.外界条件对化学平衡的影响
(1)浓度对化学平衡的影响。
①实验探究浓度对化学平衡的影响[实验2-1]。
现象 a试管中溶液变红色,b试管溶液红色________,c试管中溶液红色________
实验结论 增大c(Fe3+)或c(SCN-)后,化学平衡均向________方向移动,Fe(SCN)3的浓度________,溶液红色加深;
加入少量铁粉,由于Fe+2Fe3+===3Fe2+,使c(Fe3+)______,化学平衡向__________方向移动,Fe(SCN)3的浓度______,溶液红色变浅
变浅
变深
正反应
增大
减小
逆反应
减小
②结论。
在可逆反应达到平衡时,在其他条件不变的情况下:
c(反应物)增大或c(生成物)减小,平衡向__________方向移动。
c(反应物)减小或c(生成物)增大,平衡向__________方向移动。
正反应
逆反应
(2)压强对化学平衡的影响。
①实验探究压强对化学平衡的影响[实验2-2]。
最终比原来深
先变深,后变浅,
先变浅,后变
深,最终比原来浅
实验结论 压强增大,体积减小时,c(NO2)____________,平衡向________(填“左”或“右”)移动 压强减小,体积增大时,c(NO2 )____________,平衡向____(填“左”或“右”)移动
变大后又减小
左
减小后又增大
右
气体体积减小
气体体积增大
不移动
(3)温度对化学平衡的影响。
①实验探究温度对化学平衡的影响[实验2-3]。
实验现象 热水中混合气体颜色__________;冰水中混合气体颜色________
实验结论 混合气体受热颜色________,说明NO2________,即平衡向________方向移动;混合气体被冷却时颜色________,说明________________,即平衡向________方向移动
加深
变浅
加深
浓度增大
逆反应
变浅
NO2 浓度减小
正反应
②结论。
其他条件不变时,升高温度平衡向着________的方向移动,降低温度平衡向着________的方向移动。
(4)催化剂。
催化剂可____________地改变正反应速率和逆反应速率,因此催化剂对化学平衡的移动____________。但催化剂可_______反应达到平衡所需的时间。
吸热反应
放热反应
同等程度
没有影响
改变
【名师点拨】
平衡移动的结果是“减弱”外界条件的影响,而不是“消除”外界条件的影响,更不是“扭转”外界条件的影响。
3.勒夏特列原理
如果改变影响平衡的条件之一,平衡将向着能够__________这种改变的方向移动,该结论就是勒夏特列原理。
减弱
(1)对于只有固体或液体参加的反应,体系压强的改变会使化学平衡状态发生变化吗?
(2)催化剂对化学平衡有没有影响?工业生产往往使用催化剂,其目的是什么?
微思考
【答案】(1)压强的改变只影响有气体参加或生成的可逆反应。
(2)催化剂能够同等程度改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但是可以改变达到平衡所需要的时间。工业生产往往使用催化剂,其目的是加快化学反应的速率,提高单位时间内的产量。
【答案】(1)× (2)× (3)× (4)× (5)×
(6)× (7)× (8)× (9)√ (10)√
课堂 · 素养初培
任务 外界条件对化学平衡的影响
素养探源 核心素养 考查途径
变化观念与平衡思想 外界条件对化学平衡的影响属于近几年高考的必考点,题型年年创新,特别是有关速率与平衡图像的变化更是命题者关注的考点,但实际难度并不是很大,解题的关键是弄懂图像所包含的意义
(1)阅读材料并解释为什么空气中一氧化碳浓度增大时会发生一氧化碳中毒?
【答案】空气中一氧化碳浓度增大,更多的Hb(CO)取代Hb(O2),造成人体缺氧,导致一氧化碳中毒。
(2)思考并讨论如何利用平衡移动原理设计合理的方法救治一氧化碳中毒的病人?简述你的理由。
【答案】如果有人一氧化碳中毒,应立即切断一氧化碳来源并将中毒者移至空气流通处,必要时可以将其放到高压氧舱中,增大氧气浓度。
(3)已知透光率与气体颜色有关,气体颜色越深,透光率越小。你能用平衡移动的原理解释NO2-N2O4体系体积变化过程中透光率变化的原因吗?
【答案】压缩针筒时体系内压强增大,体积减小,气体颜色加深,透光率减小,但平衡会向正反应方向移动,所以透光率又会有所增大;拉伸针筒时体系压强又减小,气体颜色变浅,透光率增大,但平衡又会向逆反应方向移动,所以透光率又会有所减小。
【名师点拨】
(1)压强改变只影响有气体参加或生成的可逆反应,对于只涉及固体或液体的反应,压强的影响不予考虑。
(2)恒容时,通入稀有气体,压强增大,平衡不移动;恒压时,通入稀有气体,体积增大,平衡向气体体积增大的方向移动。
(3)在恒容容器中,改变其中一种气态物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析。
(4)同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
3.温度对平衡的影响
规律 在其他条件不变的情况下,升高温度,平衡向吸热反应的方向移动;
降低温度,平衡向放热反应的方向移动
[典例精练]
【答案】A
【解析】B项,通入Z,平衡逆向移动,Z的体积分数增大。C项,W为固体,改变其用量,平衡不移动。D项,ΔH的大小与方程式中各物质的化学计量数及状态有关,与加入反应物的量无关。
【答案】A
【解析】一般来说,有两种及两种以上反应物的可逆反应中,在其他条件不变时,增大其中一种反应物的浓度,能使其他反应物的转化率升高,但其本身的转化率反而降低,故A错误。
【答案】C
【解析】反应已达平衡,此时c(X)=0.3 mol/L,其他条件不变,将容器缩小到原来的1/2,若此时平衡不移动,c(X)=0.6 mol/L,但平衡移动之后c(X)=0.5 mol/L,说明加压平衡向正反应方向移动,正反应为气体减少的反应,若Y为固体或液体,则需要满足m>2m,A、B错误;若Y是气体,且m+n>2m,所以n>m,C正确;平衡正向移动,产物Z的体积分数应该增大,D错误。
(4)若x+y=z,缩小体积,增大压强,则平衡________(填“移动”或“不移动”)。
【答案】 (1)正反应 (2)不移动 (3)x+y在三个连通的烧瓶里盛有NO2和N2O4的混合气体,然后用弹簧夹夹住乳胶管。先将三个烧瓶分别浸泡在盛有室温水的烧杯里,可以观察到混合气体颜色无变化,接着向左边烧杯里加入制热盐无水CaCl2,向右边烧杯里加入制冷盐KNO3,不断搅拌直至溶液饱和,可以看到,随着盐的加入,左边混合气体的颜色变深,右边混合气体的颜色变浅,中间混合气体的颜色不变。
根据实验现象,回答有关问题:
(1)左边的混合气体颜色变深的原因是____________________;
右边的混合气体颜色变浅的原因是______________________。
(2)总结温度变化与可逆反应的热量变化之间的关系是______ _________________。
【答案】(1)左边烧杯中加入制热盐,混合气体温度升高,平衡向逆反应方向移动,NO2的浓度增大,颜色加深 右边烧杯中加入制冷盐,混合气体温度降低,平衡向正反应方向移动,NO2的浓度减小,颜色变浅
(2)升高温度时,平衡向吸热反应的方向移动;降低温度时,平衡向放热反应的方向移动
【答案】B
【解析】A项,升温时,正、逆反应速率均增大;B项,升温时增大反应速率,能缩短达到平衡的时间;C项,该反应为放热反应,升温时平衡向逆反应方向移动;D项,降温或增大压强有利于平衡向正反应方向移动。
辨析 · 易错易混
错解:D
错因分析:通入SO2气体会与H2S发生反应:SO2+2H2S===3S↓+2H2O,H2S浓度减小,平衡发生移动;充入氮气,保持压强不变,则容器的体积增大,导致NH3(g)和H2S的浓度减小,平衡发生移动;NH4HS为固体,因此,改变NH4HS的多少对化学平衡不产生影响;保持容积不变,充入氨气,NH3(g)的浓度增大,平衡发生移动。
满分策略:(1)对于气体体积变化的反应,改变其反应物或生成物浓度,能使平衡移动。(2)改变纯固体或液体的质量,不能使平衡移动。
正解:B
错因分析:
题号 内 容
(1) 易错答案 认为平衡不移动,压强不变
错因分析 没看清水的状态,想当然地认为水是液态
(2) 易错答案 增大
错因分析 误认为只要加入反应物,反应速率就增大,没注意到C为固体
(3) 易错答案 正反应
错因分析 把ΔH>0的反应错误地当成放热反应,应为吸热反应
题号 内 容
(4) 易错答案 无法确定
错因分析 误认为加入CO,平衡向逆反应方向移动,气体的体积减小,气体的质量也减小,而无法确定密度,实际上,达新平衡后气体的总物质的量比原平衡物质的量大,气体总质量也增大,由于容器容积不变,故混合气体的密度增大
满分策略:对化学平衡移动原理的理解。
化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变,改变是不可逆转的。达到新平衡时此物理量更靠近于改变的方向。如①增大反应物A的浓度,平衡右移,A的浓度在增大的基础上减小,但达到新平衡时,A的浓度一定比原平衡大;②若将体系温度从50 ℃升高到80 ℃,则化学平衡向吸热反应方向移动,达到新的平衡状态时体系的温度(T):50 ℃正解:(1)正反应 增大 (2)不变 (3)逆反应
(4)增大
小练 · 素养达成
1.(2020·广东广州执信中学检测)下列事实不能用勒夏特列原理解释的是 ( )
A.光照新制的氯水时,溶液的pH逐渐减小
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制氨
D.增大压强,有利于SO2与O2反应生成SO3
【答案】B
【答案】A
【解析】降低温度化学平衡向放热反应(ΔH<0)方向移动。
【答案】D
【解析】由图知t时刻v(正)、v(逆)均突增,故改变的条件是升温或加压;由v(正)>v(逆),平衡正向移动知该条件为增大压强,因升温平衡逆向移动。
【答案】C
(3)保持反应容器的容积和温度不变,通入N2,则平衡______________,c(CO2)________。
(4)保持反应容器的容积不变,升高温度,则平衡______________,c(CO)________。
【答案】(1)不移动 不变 (2)向左移动 增大
(3)不移动 不变 (4)向右移动 增大
【解析】(1)C为固体,增加C,其浓度不变,平衡不移动,c(CO2)不变。(2)缩小反应容器的容积,即增大压强,平衡向气体体积减小的方向移动,c(CO2)增大。(3)通入N2,容积和温度不变,平衡不会发生移动,c(CO2)不变。(4)容积不变,温度升高,平衡向吸热方向移动,c(CO)增大。
(4)若B是固体,A、C是气体,减小压强,A的反应速率________,平衡________移动。
(5)若B是气体,增大压强时,平衡向逆反应方向移动,则C一定是________体,A是________体。
【答案】(1)放 (2)正 (3)正 不 (4)减小 不 (5)气 固(或液)
【解析】(1)A的量增加,说明平衡逆向移动,升高温度导致平衡逆向移动,说明正反应是放热反应。(2)正反应为气体物质的量减小的反应,加压,平衡向正反应方向移动。(3)增大气体反应物浓度,平衡向正反应方向移动;恒温、恒容时,加入不反应的气体,体系中各物质的浓度不变,平衡不移动。(4)反应前后气体物质的量不变,减小压强,平衡不移动,但反应速率要减小。(5)加压,平衡逆向移动,说明逆反应是气体体积减小的反应,B是气体,C一定是气体,则A一定不是气体。
第二章 化学反应速率与化学平衡
第二节 化学平衡
第3课时 影响化学平衡的因素
素养目标
1.通过实验探究,了解温度、浓度、压强和催化剂对化学平衡状态的影响
2.学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向
学法指导
1.认真做好对比实验,从感性上认识浓度、压强或温度等外界条件的改变对化学平衡的影响及化学移动方向
2.通过实验结果的对比,总结加深对化学平衡移动原理中“减弱”二字的领会,理解平衡移动原理的实质
知识导图
课前 · 新知导学
1.化学平衡移动
(1)含义:当一个可逆反应达到平衡后,如果改变________、________、压强等反应条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到______________。
(2)实质:改变条件后。
①v正______v逆。
②各组分的百分含量发生________。
浓度
化学平衡的移动
温度
新的平衡状态
≠
改变
(3)平衡移动图示。
2.外界条件对化学平衡的影响
(1)浓度对化学平衡的影响。
①实验探究浓度对化学平衡的影响[实验2-1]。
现象 a试管中溶液变红色,b试管溶液红色________,c试管中溶液红色________
实验结论 增大c(Fe3+)或c(SCN-)后,化学平衡均向________方向移动,Fe(SCN)3的浓度________,溶液红色加深;
加入少量铁粉,由于Fe+2Fe3+===3Fe2+,使c(Fe3+)______,化学平衡向__________方向移动,Fe(SCN)3的浓度______,溶液红色变浅
变浅
变深
正反应
增大
减小
逆反应
减小
②结论。
在可逆反应达到平衡时,在其他条件不变的情况下:
c(反应物)增大或c(生成物)减小,平衡向__________方向移动。
c(反应物)减小或c(生成物)增大,平衡向__________方向移动。
正反应
逆反应
(2)压强对化学平衡的影响。
①实验探究压强对化学平衡的影响[实验2-2]。
最终比原来深
先变深,后变浅,
先变浅,后变
深,最终比原来浅
实验结论 压强增大,体积减小时,c(NO2)____________,平衡向________(填“左”或“右”)移动 压强减小,体积增大时,c(NO2 )____________,平衡向____(填“左”或“右”)移动
变大后又减小
左
减小后又增大
右
气体体积减小
气体体积增大
不移动
(3)温度对化学平衡的影响。
①实验探究温度对化学平衡的影响[实验2-3]。
实验现象 热水中混合气体颜色__________;冰水中混合气体颜色________
实验结论 混合气体受热颜色________,说明NO2________,即平衡向________方向移动;混合气体被冷却时颜色________,说明________________,即平衡向________方向移动
加深
变浅
加深
浓度增大
逆反应
变浅
NO2 浓度减小
正反应
②结论。
其他条件不变时,升高温度平衡向着________的方向移动,降低温度平衡向着________的方向移动。
(4)催化剂。
催化剂可____________地改变正反应速率和逆反应速率,因此催化剂对化学平衡的移动____________。但催化剂可_______反应达到平衡所需的时间。
吸热反应
放热反应
同等程度
没有影响
改变
【名师点拨】
平衡移动的结果是“减弱”外界条件的影响,而不是“消除”外界条件的影响,更不是“扭转”外界条件的影响。
3.勒夏特列原理
如果改变影响平衡的条件之一,平衡将向着能够__________这种改变的方向移动,该结论就是勒夏特列原理。
减弱
(1)对于只有固体或液体参加的反应,体系压强的改变会使化学平衡状态发生变化吗?
(2)催化剂对化学平衡有没有影响?工业生产往往使用催化剂,其目的是什么?
微思考
【答案】(1)压强的改变只影响有气体参加或生成的可逆反应。
(2)催化剂能够同等程度改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但是可以改变达到平衡所需要的时间。工业生产往往使用催化剂,其目的是加快化学反应的速率,提高单位时间内的产量。
【答案】(1)× (2)× (3)× (4)× (5)×
(6)× (7)× (8)× (9)√ (10)√
课堂 · 素养初培
任务 外界条件对化学平衡的影响
素养探源 核心素养 考查途径
变化观念与平衡思想 外界条件对化学平衡的影响属于近几年高考的必考点,题型年年创新,特别是有关速率与平衡图像的变化更是命题者关注的考点,但实际难度并不是很大,解题的关键是弄懂图像所包含的意义
(1)阅读材料并解释为什么空气中一氧化碳浓度增大时会发生一氧化碳中毒?
【答案】空气中一氧化碳浓度增大,更多的Hb(CO)取代Hb(O2),造成人体缺氧,导致一氧化碳中毒。
(2)思考并讨论如何利用平衡移动原理设计合理的方法救治一氧化碳中毒的病人?简述你的理由。
【答案】如果有人一氧化碳中毒,应立即切断一氧化碳来源并将中毒者移至空气流通处,必要时可以将其放到高压氧舱中,增大氧气浓度。
(3)已知透光率与气体颜色有关,气体颜色越深,透光率越小。你能用平衡移动的原理解释NO2-N2O4体系体积变化过程中透光率变化的原因吗?
【答案】压缩针筒时体系内压强增大,体积减小,气体颜色加深,透光率减小,但平衡会向正反应方向移动,所以透光率又会有所增大;拉伸针筒时体系压强又减小,气体颜色变浅,透光率增大,但平衡又会向逆反应方向移动,所以透光率又会有所减小。
【名师点拨】
(1)压强改变只影响有气体参加或生成的可逆反应,对于只涉及固体或液体的反应,压强的影响不予考虑。
(2)恒容时,通入稀有气体,压强增大,平衡不移动;恒压时,通入稀有气体,体积增大,平衡向气体体积增大的方向移动。
(3)在恒容容器中,改变其中一种气态物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析。
(4)同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
3.温度对平衡的影响
规律 在其他条件不变的情况下,升高温度,平衡向吸热反应的方向移动;
降低温度,平衡向放热反应的方向移动
[典例精练]
【答案】A
【解析】B项,通入Z,平衡逆向移动,Z的体积分数增大。C项,W为固体,改变其用量,平衡不移动。D项,ΔH的大小与方程式中各物质的化学计量数及状态有关,与加入反应物的量无关。
【答案】A
【解析】一般来说,有两种及两种以上反应物的可逆反应中,在其他条件不变时,增大其中一种反应物的浓度,能使其他反应物的转化率升高,但其本身的转化率反而降低,故A错误。
【答案】C
【解析】反应已达平衡,此时c(X)=0.3 mol/L,其他条件不变,将容器缩小到原来的1/2,若此时平衡不移动,c(X)=0.6 mol/L,但平衡移动之后c(X)=0.5 mol/L,说明加压平衡向正反应方向移动,正反应为气体减少的反应,若Y为固体或液体,则需要满足m>2m,A、B错误;若Y是气体,且m+n>2m,所以n>m,C正确;平衡正向移动,产物Z的体积分数应该增大,D错误。
(4)若x+y=z,缩小体积,增大压强,则平衡________(填“移动”或“不移动”)。
【答案】 (1)正反应 (2)不移动 (3)x+y
根据实验现象,回答有关问题:
(1)左边的混合气体颜色变深的原因是____________________;
右边的混合气体颜色变浅的原因是______________________。
(2)总结温度变化与可逆反应的热量变化之间的关系是______ _________________。
【答案】(1)左边烧杯中加入制热盐,混合气体温度升高,平衡向逆反应方向移动,NO2的浓度增大,颜色加深 右边烧杯中加入制冷盐,混合气体温度降低,平衡向正反应方向移动,NO2的浓度减小,颜色变浅
(2)升高温度时,平衡向吸热反应的方向移动;降低温度时,平衡向放热反应的方向移动
【答案】B
【解析】A项,升温时,正、逆反应速率均增大;B项,升温时增大反应速率,能缩短达到平衡的时间;C项,该反应为放热反应,升温时平衡向逆反应方向移动;D项,降温或增大压强有利于平衡向正反应方向移动。
辨析 · 易错易混
错解:D
错因分析:通入SO2气体会与H2S发生反应:SO2+2H2S===3S↓+2H2O,H2S浓度减小,平衡发生移动;充入氮气,保持压强不变,则容器的体积增大,导致NH3(g)和H2S的浓度减小,平衡发生移动;NH4HS为固体,因此,改变NH4HS的多少对化学平衡不产生影响;保持容积不变,充入氨气,NH3(g)的浓度增大,平衡发生移动。
满分策略:(1)对于气体体积变化的反应,改变其反应物或生成物浓度,能使平衡移动。(2)改变纯固体或液体的质量,不能使平衡移动。
正解:B
错因分析:
题号 内 容
(1) 易错答案 认为平衡不移动,压强不变
错因分析 没看清水的状态,想当然地认为水是液态
(2) 易错答案 增大
错因分析 误认为只要加入反应物,反应速率就增大,没注意到C为固体
(3) 易错答案 正反应
错因分析 把ΔH>0的反应错误地当成放热反应,应为吸热反应
题号 内 容
(4) 易错答案 无法确定
错因分析 误认为加入CO,平衡向逆反应方向移动,气体的体积减小,气体的质量也减小,而无法确定密度,实际上,达新平衡后气体的总物质的量比原平衡物质的量大,气体总质量也增大,由于容器容积不变,故混合气体的密度增大
满分策略:对化学平衡移动原理的理解。
化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变,改变是不可逆转的。达到新平衡时此物理量更靠近于改变的方向。如①增大反应物A的浓度,平衡右移,A的浓度在增大的基础上减小,但达到新平衡时,A的浓度一定比原平衡大;②若将体系温度从50 ℃升高到80 ℃,则化学平衡向吸热反应方向移动,达到新的平衡状态时体系的温度(T):50 ℃
(4)增大
小练 · 素养达成
1.(2020·广东广州执信中学检测)下列事实不能用勒夏特列原理解释的是 ( )
A.光照新制的氯水时,溶液的pH逐渐减小
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制氨
D.增大压强,有利于SO2与O2反应生成SO3
【答案】B
【答案】A
【解析】降低温度化学平衡向放热反应(ΔH<0)方向移动。
【答案】D
【解析】由图知t时刻v(正)、v(逆)均突增,故改变的条件是升温或加压;由v(正)>v(逆),平衡正向移动知该条件为增大压强,因升温平衡逆向移动。
【答案】C
(3)保持反应容器的容积和温度不变,通入N2,则平衡______________,c(CO2)________。
(4)保持反应容器的容积不变,升高温度,则平衡______________,c(CO)________。
【答案】(1)不移动 不变 (2)向左移动 增大
(3)不移动 不变 (4)向右移动 增大
【解析】(1)C为固体,增加C,其浓度不变,平衡不移动,c(CO2)不变。(2)缩小反应容器的容积,即增大压强,平衡向气体体积减小的方向移动,c(CO2)增大。(3)通入N2,容积和温度不变,平衡不会发生移动,c(CO2)不变。(4)容积不变,温度升高,平衡向吸热方向移动,c(CO)增大。
(4)若B是固体,A、C是气体,减小压强,A的反应速率________,平衡________移动。
(5)若B是气体,增大压强时,平衡向逆反应方向移动,则C一定是________体,A是________体。
【答案】(1)放 (2)正 (3)正 不 (4)减小 不 (5)气 固(或液)
【解析】(1)A的量增加,说明平衡逆向移动,升高温度导致平衡逆向移动,说明正反应是放热反应。(2)正反应为气体物质的量减小的反应,加压,平衡向正反应方向移动。(3)增大气体反应物浓度,平衡向正反应方向移动;恒温、恒容时,加入不反应的气体,体系中各物质的浓度不变,平衡不移动。(4)反应前后气体物质的量不变,减小压强,平衡不移动,但反应速率要减小。(5)加压,平衡逆向移动,说明逆反应是气体体积减小的反应,B是气体,C一定是气体,则A一定不是气体。
