2021_2022学年新教材高中化学第1章化学反应的热效应第2节反应热的计算课件新人教版选择性必修1
文档属性
| 名称 | 2021_2022学年新教材高中化学第1章化学反应的热效应第2节反应热的计算课件新人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 15:26:19 | ||
图片预览











文档简介
(共55张PPT)
第一章 化学反应的热效应
第二节 反应热的计算
素养目标
1.通过学习并理解盖斯定律的内容,能用盖斯定律进行有关反应热的简单计算,培养宏观辨识与微观探析的核心素养
2.通过学会有关反应热计算的方法技巧,进一步提高化学计算的能力
学法指导
1.结合教材第13页图1-7 “人势能的变化与上山的途径无关”,领会盖斯定律的含义,体会能量守恒在化学反应中的具体应用
2.学习教材第15-16页【例题1】、【例题2】、【例题3】的解题思路与步骤,初步掌握有关反应热计算的类型与基本方法
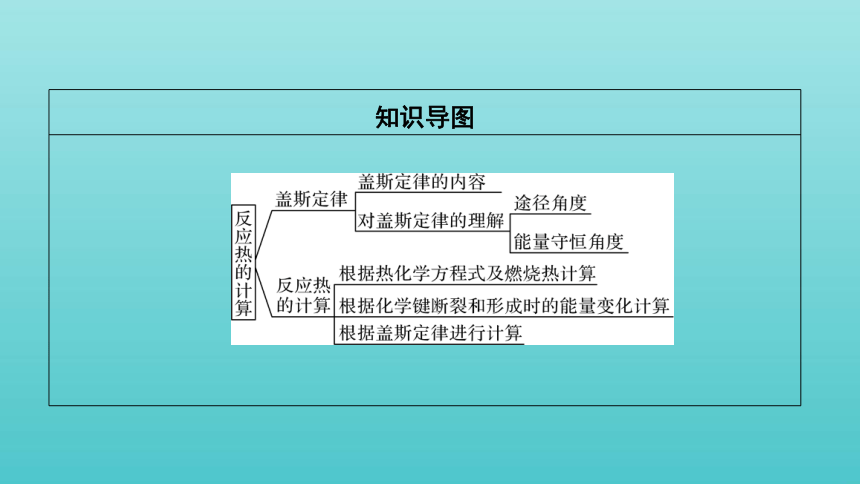
知识导图
课前 · 新知导学
1.内容
一个化学反应 ,不管是一步完成的还是分几步完成的,其反应热是__________的。
相同
盖斯定律
2.特点
(1)在一定条件下,化学反应的反应热,只与反应体系的始态、终态有关,而与反应进行的________无关。
(2)反应热的总值一定,如图表示始态到终态的反应热。
则ΔH=__________=_________________。
途径
ΔH1 + ΔH2
ΔH3 + ΔH4+ΔH5
-110.5
1.利用热化学方程式计算
25 ℃、101 kPa,使1.0 g Na与足量Cl2反应,生成NaCl晶体并放出17.87 kJ热量,则生成1 mol NaCl的反应热为____________________。
2.利用燃烧热计算
乙醇的燃烧热为ΔH =-1 366.8 kJ·mol-1,则25 ℃、101 kPa时1 g乙醇完全燃烧放出的热量为________。
-411.01 kJ·mol-1
反应热的计算
29.71 kJ
3.利用盖斯定律计算
已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+2H2(g)===W(s)+2H2O(g) ΔH1
②WO2(g)+2H2(g)===W(s)+2H2O(g) ΔH2
则WO2(s)===WO2(g)的 ΔH=______________。
ΔH1 - ΔH2
反应①:2C(g)+O2(g)===2CO(g)和反应②:2CO(g)+O2(g)===2CO2(g)。两反应中的CO可看成“中间量”,将两反应直接相加,整理后得到的总反应方程式如何?
微思考
【答案】C(g)+O2(g)===CO2(g)。
正误判断。(对的打“√”,错的打“×”)
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量就越多。 ( )
(2)化学反应的反应热与化学反应的始态有关,与终态无关。 ( )
(3)利用盖斯定律,可计算某些反应的反应热。 ( )
(4)任何化学反应的反应热都可以直接测定。 ( )
【答案】(1)× (2)× (3)√ (4)× (5)× (6)×
课堂 · 素养初培
任务一 盖斯定律的理解与应用
素养探源 核心素养 考查途径
证据推理与模型认知 给出相关反应的热化学方程式或热化学图像或有关物质的燃烧热,通过盖斯定律求算指定反应的反应热或反应热量变化或某些共价键的键能等,多以填空题形式考查,难度中等,分值一般为2~3分
[情境导入]
“异曲同工”是指不同的曲调演得同样好,比喻不同的人的辞章或言论同样精彩,或者不同的做法收到同样的效果。热化学奠基人盖斯从化学反应的角度发现了同一反应虽然历经不同途径,但是不影响其反应热的规律,该规律被命名为“盖斯定律”。
(1)物质相互转化过程中,对于同一反应,经历的过程越多,损失的能量越大,正确吗?
【答案】不正确。根据盖斯定律可知,反应过程无论经历多少步,其反应热不变。
(2)利用盖斯定律计算反应热时需要注意哪些事项?
【答案】①求总反应的反应热,不能将各步反应的反应热简单地相加;②不论反应是一步进行还是分步进行,只有始态和终态完全一致,盖斯定律才成立;③某些物质在反应分步进行时作为中间产物出现,最后应该恰好“消耗”完。
[深化理解]
运用盖斯定律解题的常用方法
(1)虚拟路径法:若反应物A变为生成物D,可以有两个途径:①由A直接变成D,反应热为ΔH;②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。如图所示:
则有: ΔH=ΔH1+ΔH2+ΔH3 。
(3)解题注意事项。
①热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减,所求之和为其代数和。
③将一个热化学方程式颠倒时, ΔH 的“+”“-”号必须随之改变。
煤可通过下列两种途径成为燃料。
途径Ⅰ C(s)+O2(g)===CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0 ①
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0 ②
2H2(g)+O2(g)===2H2O(g) ΔH4<0 ③
[典例精练]
请填写下列空白:
(1)判断两种途径放出的热量:途径Ⅰ放出的热量________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是__________________ ________________。
(3)由于制取水煤气的反应里,反应物具有的总能量__________(填“大于”“等于”或“小于”)生成物具有的总能量,所以该反应发生时,反应物须________能量才能转化为生成物,因此其反应条件为________________________。
已知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为 ( )
A.+519.4 kJ·mol-1
B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1
D.-519.4 kJ·mol-1
【答案】C
任务二 反应热计算的常用方法
素养探源 核心素养 考查途径
证据推理与模型认知 ΔH最常见的考查方式:一是运用盖斯定律求算,二是运用共价键的键能求算。多数出现在化学反应原理大题中,多为第一问,难度中等或较难。
(1)根据信息①,求生成2 mol NaCl的反应热。
【答案】ΔH′=2ΔH=-411 kJ·mol-1×2=-822 kJ·mol-1。
(2)根据信息②,求1 kg乙醇充分燃烧后放出多少热量?
(3)根据信息③,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热。
【答案】根据盖斯定律,将已知中的后2个方程式分别乘以2,然后相加,最后减去第一个方程式即得要求的方程式,ΔH也进行相应处理。即ΔH′=-(393.5 kJ·mol-1+285.8 kJ·mol-1)×2-(-870.3 kJ·mol-1)=-488.3 kJ·mol-1。
[深化理解]
反应热的计算方法
计算依据 计算方法
热化学方程式 热化学方程式与数学上的方程式相似,可以左右颠倒同时改变正负号,各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数
根据盖斯定律 根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式
计算依据 计算方法
根据燃烧热 可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热
根据化学键的变化 ΔH=E(断键)反应物-E(成键)生成物
根据反应物和生成物的总能量 ΔH=E(生成物)-E(反应物)
工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为________________。
【答案】 5 520 kJ
[典例精练]
甲烷的燃烧热ΔH=-890.3 kJ· mol-1,1 kg CH4在25 ℃、101 kPa时充分燃烧生成液态水放出的热量约为 ( )
A.-5.56×104 kJ· mol-1
B.5.56×104 kJ· mol-1
C.5.56×104 kJ
D.-5.56×104 kJ
【答案】C
辨析 · 易错易混
错解:D
满分策略:①先写出目标方程式,②利用盖斯定律求反应热,③利用热化学方程式求反应热。
正解:C
错解:C
错因分析:题目中给出64 g SO2气体转化为SO3气体时放出热量为98.3 kJ。然后根据转化率为80%,即得实际放热98.3 kJ×80%=78.64 kJ,从而错选C。
正解:A
小练 · 素养达成
【答案】D
【解析】ΔH为“+”时,反应为吸热反应,A错误;生成物为CO,不是C的燃烧热,B错误;C中反应热的大小与反应物和生成物的总能量有关,C错误。
【答案】C
【解析】将①式改写成2H2(g)+O2(g)===2H2O(g) ΔH3=-2Q1 kJ·mol-1③,将②式改写成2H2(g)+O2(g)===2H2O(l) ΔH4=-Q2 kJ·mol-1④。③式中各物质的化学计量数与④式相同,但③式中H2O为气态,④式中H2O为液态,生成液态水比生成等物质的量的气态水所放出的热量多,故2Q1【答案】A
【答案】B
【解析】C在O2中完全燃烧生成CO2,故2 mol C完全燃烧放出的热量为2 mol×393.5 kJ/mol=787 kJ。
5.液态水分解生成H2和O2可通过下列途径来完成:
已知:氢气的燃烧热为286 kJ/mol,则ΔH2为 ( )
A.+330 kJ/mol B.-330 kJ/mol
C.+242 kJ/mol D.-242 kJ/mol
【答案】C
【解析】由盖斯定律可知ΔH1+ΔH2=+286 kJ/mol,则ΔH2=+286 kJ/mol-ΔH1=+286 kJ/mol-(+44 kJ/mol)=+242 kJ/mol。
请回答下列问题:
①图中A点表示____________________________;C点表示2 mol SO3(g)的总能量。E所代表的能量是____________;E的大小对该反应的反应热________(填“有”或“无”)影响。
②图中ΔH1=________kJ·mol-1。
【答案】(1)-1 034.9 kJ·mol-1
(2)①2 mol SO2(g)和1 mol O2(g)的总能量 活化能 无 ②-198
【解析】(1)将两个热化学方程式依次标注为①、②,依据盖斯定律,由①×2-②即得4H2(g)+2NO2(g)===N2(g)+4H2O(g) ΔH=-483.6 kJ·mol-1×2-67.7 kJ·mol-1=-1 034.9 kJ·mol-1。(2)①A点表示反应物的能量总和;E代表破坏旧化学键所需的最低能量,即活化能;反应热的大小仅取决于反应体系的始态和终态,与活化能无关。②ΔH1=2×(-99 kJ·mol-1)=-198 kJ·mol-1。
第一章 化学反应的热效应
第二节 反应热的计算
素养目标
1.通过学习并理解盖斯定律的内容,能用盖斯定律进行有关反应热的简单计算,培养宏观辨识与微观探析的核心素养
2.通过学会有关反应热计算的方法技巧,进一步提高化学计算的能力
学法指导
1.结合教材第13页图1-7 “人势能的变化与上山的途径无关”,领会盖斯定律的含义,体会能量守恒在化学反应中的具体应用
2.学习教材第15-16页【例题1】、【例题2】、【例题3】的解题思路与步骤,初步掌握有关反应热计算的类型与基本方法
知识导图
课前 · 新知导学
1.内容
一个化学反应 ,不管是一步完成的还是分几步完成的,其反应热是__________的。
相同
盖斯定律
2.特点
(1)在一定条件下,化学反应的反应热,只与反应体系的始态、终态有关,而与反应进行的________无关。
(2)反应热的总值一定,如图表示始态到终态的反应热。
则ΔH=__________=_________________。
途径
ΔH1 + ΔH2
ΔH3 + ΔH4+ΔH5
-110.5
1.利用热化学方程式计算
25 ℃、101 kPa,使1.0 g Na与足量Cl2反应,生成NaCl晶体并放出17.87 kJ热量,则生成1 mol NaCl的反应热为____________________。
2.利用燃烧热计算
乙醇的燃烧热为ΔH =-1 366.8 kJ·mol-1,则25 ℃、101 kPa时1 g乙醇完全燃烧放出的热量为________。
-411.01 kJ·mol-1
反应热的计算
29.71 kJ
3.利用盖斯定律计算
已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+2H2(g)===W(s)+2H2O(g) ΔH1
②WO2(g)+2H2(g)===W(s)+2H2O(g) ΔH2
则WO2(s)===WO2(g)的 ΔH=______________。
ΔH1 - ΔH2
反应①:2C(g)+O2(g)===2CO(g)和反应②:2CO(g)+O2(g)===2CO2(g)。两反应中的CO可看成“中间量”,将两反应直接相加,整理后得到的总反应方程式如何?
微思考
【答案】C(g)+O2(g)===CO2(g)。
正误判断。(对的打“√”,错的打“×”)
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量就越多。 ( )
(2)化学反应的反应热与化学反应的始态有关,与终态无关。 ( )
(3)利用盖斯定律,可计算某些反应的反应热。 ( )
(4)任何化学反应的反应热都可以直接测定。 ( )
【答案】(1)× (2)× (3)√ (4)× (5)× (6)×
课堂 · 素养初培
任务一 盖斯定律的理解与应用
素养探源 核心素养 考查途径
证据推理与模型认知 给出相关反应的热化学方程式或热化学图像或有关物质的燃烧热,通过盖斯定律求算指定反应的反应热或反应热量变化或某些共价键的键能等,多以填空题形式考查,难度中等,分值一般为2~3分
[情境导入]
“异曲同工”是指不同的曲调演得同样好,比喻不同的人的辞章或言论同样精彩,或者不同的做法收到同样的效果。热化学奠基人盖斯从化学反应的角度发现了同一反应虽然历经不同途径,但是不影响其反应热的规律,该规律被命名为“盖斯定律”。
(1)物质相互转化过程中,对于同一反应,经历的过程越多,损失的能量越大,正确吗?
【答案】不正确。根据盖斯定律可知,反应过程无论经历多少步,其反应热不变。
(2)利用盖斯定律计算反应热时需要注意哪些事项?
【答案】①求总反应的反应热,不能将各步反应的反应热简单地相加;②不论反应是一步进行还是分步进行,只有始态和终态完全一致,盖斯定律才成立;③某些物质在反应分步进行时作为中间产物出现,最后应该恰好“消耗”完。
[深化理解]
运用盖斯定律解题的常用方法
(1)虚拟路径法:若反应物A变为生成物D,可以有两个途径:①由A直接变成D,反应热为ΔH;②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。如图所示:
则有: ΔH=ΔH1+ΔH2+ΔH3 。
(3)解题注意事项。
①热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减,所求之和为其代数和。
③将一个热化学方程式颠倒时, ΔH 的“+”“-”号必须随之改变。
煤可通过下列两种途径成为燃料。
途径Ⅰ C(s)+O2(g)===CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0 ①
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0 ②
2H2(g)+O2(g)===2H2O(g) ΔH4<0 ③
[典例精练]
请填写下列空白:
(1)判断两种途径放出的热量:途径Ⅰ放出的热量________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是__________________ ________________。
(3)由于制取水煤气的反应里,反应物具有的总能量__________(填“大于”“等于”或“小于”)生成物具有的总能量,所以该反应发生时,反应物须________能量才能转化为生成物,因此其反应条件为________________________。
已知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为 ( )
A.+519.4 kJ·mol-1
B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1
D.-519.4 kJ·mol-1
【答案】C
任务二 反应热计算的常用方法
素养探源 核心素养 考查途径
证据推理与模型认知 ΔH最常见的考查方式:一是运用盖斯定律求算,二是运用共价键的键能求算。多数出现在化学反应原理大题中,多为第一问,难度中等或较难。
(1)根据信息①,求生成2 mol NaCl的反应热。
【答案】ΔH′=2ΔH=-411 kJ·mol-1×2=-822 kJ·mol-1。
(2)根据信息②,求1 kg乙醇充分燃烧后放出多少热量?
(3)根据信息③,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热。
【答案】根据盖斯定律,将已知中的后2个方程式分别乘以2,然后相加,最后减去第一个方程式即得要求的方程式,ΔH也进行相应处理。即ΔH′=-(393.5 kJ·mol-1+285.8 kJ·mol-1)×2-(-870.3 kJ·mol-1)=-488.3 kJ·mol-1。
[深化理解]
反应热的计算方法
计算依据 计算方法
热化学方程式 热化学方程式与数学上的方程式相似,可以左右颠倒同时改变正负号,各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数
根据盖斯定律 根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式
计算依据 计算方法
根据燃烧热 可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热
根据化学键的变化 ΔH=E(断键)反应物-E(成键)生成物
根据反应物和生成物的总能量 ΔH=E(生成物)-E(反应物)
工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为________________。
【答案】 5 520 kJ
[典例精练]
甲烷的燃烧热ΔH=-890.3 kJ· mol-1,1 kg CH4在25 ℃、101 kPa时充分燃烧生成液态水放出的热量约为 ( )
A.-5.56×104 kJ· mol-1
B.5.56×104 kJ· mol-1
C.5.56×104 kJ
D.-5.56×104 kJ
【答案】C
辨析 · 易错易混
错解:D
满分策略:①先写出目标方程式,②利用盖斯定律求反应热,③利用热化学方程式求反应热。
正解:C
错解:C
错因分析:题目中给出64 g SO2气体转化为SO3气体时放出热量为98.3 kJ。然后根据转化率为80%,即得实际放热98.3 kJ×80%=78.64 kJ,从而错选C。
正解:A
小练 · 素养达成
【答案】D
【解析】ΔH为“+”时,反应为吸热反应,A错误;生成物为CO,不是C的燃烧热,B错误;C中反应热的大小与反应物和生成物的总能量有关,C错误。
【答案】C
【解析】将①式改写成2H2(g)+O2(g)===2H2O(g) ΔH3=-2Q1 kJ·mol-1③,将②式改写成2H2(g)+O2(g)===2H2O(l) ΔH4=-Q2 kJ·mol-1④。③式中各物质的化学计量数与④式相同,但③式中H2O为气态,④式中H2O为液态,生成液态水比生成等物质的量的气态水所放出的热量多,故2Q1
【答案】B
【解析】C在O2中完全燃烧生成CO2,故2 mol C完全燃烧放出的热量为2 mol×393.5 kJ/mol=787 kJ。
5.液态水分解生成H2和O2可通过下列途径来完成:
已知:氢气的燃烧热为286 kJ/mol,则ΔH2为 ( )
A.+330 kJ/mol B.-330 kJ/mol
C.+242 kJ/mol D.-242 kJ/mol
【答案】C
【解析】由盖斯定律可知ΔH1+ΔH2=+286 kJ/mol,则ΔH2=+286 kJ/mol-ΔH1=+286 kJ/mol-(+44 kJ/mol)=+242 kJ/mol。
请回答下列问题:
①图中A点表示____________________________;C点表示2 mol SO3(g)的总能量。E所代表的能量是____________;E的大小对该反应的反应热________(填“有”或“无”)影响。
②图中ΔH1=________kJ·mol-1。
【答案】(1)-1 034.9 kJ·mol-1
(2)①2 mol SO2(g)和1 mol O2(g)的总能量 活化能 无 ②-198
【解析】(1)将两个热化学方程式依次标注为①、②,依据盖斯定律,由①×2-②即得4H2(g)+2NO2(g)===N2(g)+4H2O(g) ΔH=-483.6 kJ·mol-1×2-67.7 kJ·mol-1=-1 034.9 kJ·mol-1。(2)①A点表示反应物的能量总和;E代表破坏旧化学键所需的最低能量,即活化能;反应热的大小仅取决于反应体系的始态和终态,与活化能无关。②ΔH1=2×(-99 kJ·mol-1)=-198 kJ·mol-1。
