2021_2022学年新教材高中化学第1章化学反应的热效应第1节第2课时热化学方程式燃烧热课件新人教版选择性必修1
文档属性
| 名称 | 2021_2022学年新教材高中化学第1章化学反应的热效应第1节第2课时热化学方程式燃烧热课件新人教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 15:26:50 | ||
图片预览











文档简介
(共58张PPT)
第一章 化学反应的热效应
第一节 反应热
第2课时 热化学方程式 燃烧热
素养目标
1.学会书写热化学方程式,培养证据推理与模型认知的能力
2.掌握燃烧热的概念及燃烧热的判断,并了解重要化石燃料应用在工业生产和人们日常生活中的意义,培养科学态度与社会责任等学科核心素养
学法指导
1.对比普通化学方程式,认识热化学方程式在表示物质变化和能量变化方面的优点,掌握书写热化学方程式时的注意事项,避免书写热化学方程式时出现不必要的错误
2.认识燃烧热定义中的1 mol纯物质、指定产物等重要概念。
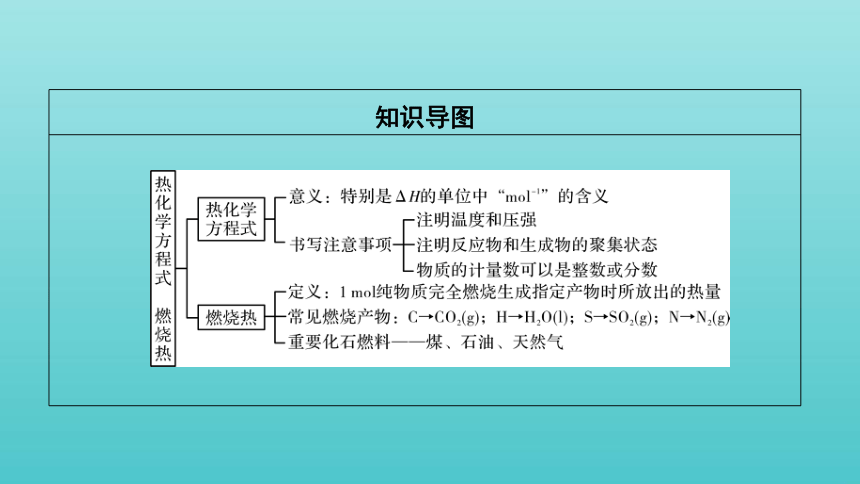
知识导图
课前 · 新知导学
所释放或吸收的热量
热化学方程式
0.5 mol气态O2
1 mol液态H2O
放出
3.书写热化学方程式的注意事项
(1)需注明反应时的____________。但中学时所用的ΔH的数据,一般都是______________时的数据,因此可不特别注明。
(2)需注明反应物和生成物的________。气态、液态、固态和水溶液需注明的符号分别为g、l、s、______。
(3)化学方程式中各物质的化学计量数可以是_________,也可以是__________。
温度和压强
25 ℃和101 kPa
聚集状态
aq
整数
分数
微思考
【答案】少于285.8 kJ,因同一物质由液态变为气态时要吸收热量。
1.概念:在__________时,_________纯物质完全燃烧生成________时所放出的热量。燃烧热的单位是__________。
2.注意事项:“完全燃烧生成指定产物”是指单质或化合物燃烧后变为最稳定的物质。完全燃烧时,下列元素要生成对应的物质:C→______,H→H2O(__),S→________,N→__________等。
101 kPa
燃烧热
1 mol
指定产物
kJ/mol
CO2(g)
l
SO2(g)
N2(g)
3.意义:甲烷的燃烧热为ΔH=-890.31 kJ· mo1-1,它表示25 ℃、101 kPa时,______CH4完全燃烧生成________和________时放出890.31 kJ的热量。
1 mol
二氧化碳
液态水
微思考
【答案】不正确。因H2O的状态为气体。
正误判断。(对的打“√”,错的打“×”)
(1)1 mol H2燃烧放出的热量为氢气的燃烧热。 ( )
(2)1 mol硫完全燃烧生成SO3所放出的热量为硫的燃烧热。 ( )
(3)根据2H2(g)+O2(g)===2H2O(l) ΔH=-571 kJ· mol-1可知氢气的燃烧热为571 kJ· mol-1。 ( )
(4)表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ· mol-1。 ( )
【答案】(1)× (2)× (3)× (4)×
课堂 · 素养初培
任务一 热化学方程式的书写与正误判断
素养探源 核心素养 考查途径
宏观辨识与微观探析 本知识点在化学原理综合题中考查,往往借助第二节的盖斯定律书写某几个反应的总反应的热化学方程式,实际是考查了反应热的计算,有时也会利用给出的热化学方程式进行热量变化的计算,分值一般为2~3分
[情境导入]
四氧化二氮,分子式为N2O4,强氧化剂,为重要的火箭推进剂之一。N2O4有剧毒,且有腐蚀性,易分解为红棕色的二氧化氮气体,具有神经麻醉的毒性。
下图是NO2(g)与N2O4(g)、N2O4(l)间互相转化的能量变化示意图。
(1)试写出反应热分别为ΔH1和ΔH2的两个热化学方程式。体会热化学方程式与普通化学方程式的不同。
(2)热化学方程式中各物质前面的化学计量数与反应的ΔH的绝对值之间有关系吗?
【答案】有。热化学方程式中各物质前面的化学计量数与反应的ΔH的绝对值成正比关系。
(3)热化学方程式中各物质前面的化学计量数能否为分数?为什么?
【答案】可以。因为热化学方程式中各物质前面的化学计量数代表物质的物质的量。
(4)热化学方程式中,ΔH的单位的含义是什么?
【答案】ΔH的单位是kJ·mol-1,它表示按给定反应的热化学方程式中各物质的物质的量完全反应时的热效应,并不一定是反应1 mol物质或生成1 mol物质放出或吸收的热量。
[深化理解]
1.“五步”突破热化学方程式的书写
2.“五查”法判断热化学方程式的正误
(1)一查化学方程式是否书写正确。
(2)二查是否标明各物质的聚集状态:固(s)、液(l)、气(g)、溶液(aq)。
(3)三查ΔH的“+”“-”号是否与吸热、放热一致。
(4)四查ΔH的单位是否正确,一般用kJ·mol-1(或kJ/mol)。
(5)五查ΔH的绝对值是否与热化学方程式中各物质前面的计量数相对应。
写出下列条件下反应的热化学方程式。
(1)1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量,该反应的热化学方程式为_________________________。
(2)0.3 mol的气态乙硼烷(分子式B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,该反应的热化学方程式为_______________________。
[典例精练]
(3)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化的示意图,请写出NO2和CO反应的热化学方程式:_________ _________________。
【答案】(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ· mol-1
(2)B2H6(g)+3O2(g)===B2O3(s)+3H2O(l)
ΔH=-2 165 kJ· mol-1
(3)NO2(g)+CO(g)===CO2(g)+NO(g)
ΔH=-234 kJ· mol-1
在常温常压下,1 g H2在足量Cl2中燃烧生成HCl气体,放出92.3 kJ的热量。下列热化学方程式中正确的是 ( )
A.H2(g)+Cl2(g)===2HCl(g) ΔH=-92.3 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=+92.3 kJ·mol-1
C.H2(g)+Cl2(g)===2HCl(g) ΔH=+184.6 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+184.6 kJ·mol-1
【答案】D
【解析】H2在Cl2中燃烧生成HCl气体,1 g H2完全燃烧放出92.3 kJ的热量,则1 mol(即2 g)H2完全燃烧放出184.6 kJ的热量,化学反应放出热量,ΔH符号为“-”。一个放热反应的逆反应是吸热反应,并且在其他条件相同时,正、逆反应的ΔH绝对值相等,符号相反,则D正确。
任务二 燃烧热的理解与计算
[情境导入]
我国在太原卫星发射中心用长征四号乙运载火箭已成功发射中巴地球资源卫星04A星。此次任务同时搭载了“天琴一号”技术试验卫星等8颗卫星。长征火箭燃料为偏二甲基肼(C2H8N2)。已知:1.5 g偏二甲基肼完全燃烧放出50 kJ热量。
(1)在计算偏二甲基肼的燃烧热时,碳、氢元素的产物应该是什么?
【答案】C→CO2(g),H→H2O(l)。
(2)通过材料中所给数据计算偏二甲基肼的燃烧热。
[深化理解]
1.对燃烧热的理解
(1)反应条件:25 ℃和101 kPa(书中给出的燃烧热数值均为此条件下测得)。
(2)物质的燃烧热要求的是纯物质。
(3)特别注意:C→CO不是完全燃烧;而S→SO3,SO3不是燃烧产物;生成的水是液态。
(4)文字叙述燃烧热时,用正值或ΔH表示。例如,CH4的燃烧热为890.3 kJ·mol-1或ΔH=-890.3 kJ·mol -1。
[典例精练]
【答案】B
【解析】C(s)燃烧应生成CO2(g),A错误;其反应热表示的是2 mol H2 完全燃烧时的热量变化,C错误;该反应中生成的是H2O(g),而不是H2O(l),D错误。
在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)===2H2O(l)+CO2(g)
ΔH=-890.31 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.96 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。则混合气体中CH4和CO的体积比约为 ( )
A.1∶2 B.1∶3
C.2∶3 D.3∶2
【答案】C
辨析 · 易错易混
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-725.76 kJ/mol
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=+1 451.52 kJ/mol
错解:D
错因分析:对于ΔH的正负号的规定记忆不清,误认为放热反应的ΔH为“+x kJ/mol”而错选D。由于在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ,根据CH3OH的相对分子质量为32,可求得1 mol CH3OH燃烧放出的热量为725.76 kJ。
满分策略:计算ΔH时要注意物质的质量与物质的量的转化及其符号的书写。
正解:B
错解:A
错因分析:由于没有注意到该反应为可逆反应,认为0.5 mol N2与3 mol H2能完全反应,从而计算出放出的热量为46.19 kJ,而错选A。
满分策略:可逆反应是有一定限度的,不能按反应物完全反应计算放出或吸收的热量。
正解:C
错解:A
错因分析:对氢气燃烧生成H2O(l)中的状态未理解透彻。
满分策略:燃烧热概念中“完全燃烧生成指定产物”是指单质或化合物燃烧后变为最稳定的物质。完全燃烧时,下列元素要生成对应的物质:C→CO2(g),H→H2O(l),S→SO2(g)。
正解:C
小练 · 素养达成
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小。下列符合未来新能源标准的是 ( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能
⑥风能 ⑦氢能
A.①②③④ B.③⑤⑥⑦
C.④⑤⑥⑦ D.③④⑤⑥⑦
【答案】C
【解析】天然气、煤和石油属于化石能源,不属于新能源。
【答案】C
【解析】A中生成的H2O是气态,B中生成的CO可继续燃烧生成CO2,D中生成的S也可继续燃烧生成SO2。
3.下列对燃烧热的说法正确的是 ( )
A.1 mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热
B.放热反应的热化学方程式中,ΔH就是该反应物的燃烧热
C.物质的燃烧热不能用仪器通过实验测得
D.物质燃烧必然伴随发光发热现象且肯定是氧化还原反应
【答案】D
【解析】在燃烧热的定义中有三个要点:①必须是在101 kPa条件下;②可燃物物质的量必须为1 mol;③可燃物必须完全燃烧,生成指定产物。A项,未强调“101 kPa”和“生成指定产物”;B项,放热反应不一定是燃烧反应,且燃烧反应的ΔH不一定就是该反应物的燃烧热;C项,物质的燃烧热可利用量热计通过实验测得。
【答案】B
【解析】乙醇燃烧是放热反应,ΔH应为“-”,1 g C2H5OH燃烧放出29.71 kJ热量,则1 mol(46 g)C2H5OH燃烧放出的热量为1 366.66 kJ。
5.对于2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述不正确的是 ( )
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:在25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2和液态水时放出热量5 800 kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5 800 kJ·mol-1
【答案】D
【解析】燃烧热的概念,必须为1 mol纯物质完全燃烧,生成指定产物放出的热量。
6.能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是__________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)某国科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是__________________ __________________________________。
(3)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇完全燃烧的热化学方程式为____________________________________________________________。
【答案】(1)ACD
(2)使煤油雾化,增大与助燃剂的接触面积,提高燃烧效率
(3)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 366.89 kJ·mol-1
第一章 化学反应的热效应
第一节 反应热
第2课时 热化学方程式 燃烧热
素养目标
1.学会书写热化学方程式,培养证据推理与模型认知的能力
2.掌握燃烧热的概念及燃烧热的判断,并了解重要化石燃料应用在工业生产和人们日常生活中的意义,培养科学态度与社会责任等学科核心素养
学法指导
1.对比普通化学方程式,认识热化学方程式在表示物质变化和能量变化方面的优点,掌握书写热化学方程式时的注意事项,避免书写热化学方程式时出现不必要的错误
2.认识燃烧热定义中的1 mol纯物质、指定产物等重要概念。
知识导图
课前 · 新知导学
所释放或吸收的热量
热化学方程式
0.5 mol气态O2
1 mol液态H2O
放出
3.书写热化学方程式的注意事项
(1)需注明反应时的____________。但中学时所用的ΔH的数据,一般都是______________时的数据,因此可不特别注明。
(2)需注明反应物和生成物的________。气态、液态、固态和水溶液需注明的符号分别为g、l、s、______。
(3)化学方程式中各物质的化学计量数可以是_________,也可以是__________。
温度和压强
25 ℃和101 kPa
聚集状态
aq
整数
分数
微思考
【答案】少于285.8 kJ,因同一物质由液态变为气态时要吸收热量。
1.概念:在__________时,_________纯物质完全燃烧生成________时所放出的热量。燃烧热的单位是__________。
2.注意事项:“完全燃烧生成指定产物”是指单质或化合物燃烧后变为最稳定的物质。完全燃烧时,下列元素要生成对应的物质:C→______,H→H2O(__),S→________,N→__________等。
101 kPa
燃烧热
1 mol
指定产物
kJ/mol
CO2(g)
l
SO2(g)
N2(g)
3.意义:甲烷的燃烧热为ΔH=-890.31 kJ· mo1-1,它表示25 ℃、101 kPa时,______CH4完全燃烧生成________和________时放出890.31 kJ的热量。
1 mol
二氧化碳
液态水
微思考
【答案】不正确。因H2O的状态为气体。
正误判断。(对的打“√”,错的打“×”)
(1)1 mol H2燃烧放出的热量为氢气的燃烧热。 ( )
(2)1 mol硫完全燃烧生成SO3所放出的热量为硫的燃烧热。 ( )
(3)根据2H2(g)+O2(g)===2H2O(l) ΔH=-571 kJ· mol-1可知氢气的燃烧热为571 kJ· mol-1。 ( )
(4)表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ· mol-1。 ( )
【答案】(1)× (2)× (3)× (4)×
课堂 · 素养初培
任务一 热化学方程式的书写与正误判断
素养探源 核心素养 考查途径
宏观辨识与微观探析 本知识点在化学原理综合题中考查,往往借助第二节的盖斯定律书写某几个反应的总反应的热化学方程式,实际是考查了反应热的计算,有时也会利用给出的热化学方程式进行热量变化的计算,分值一般为2~3分
[情境导入]
四氧化二氮,分子式为N2O4,强氧化剂,为重要的火箭推进剂之一。N2O4有剧毒,且有腐蚀性,易分解为红棕色的二氧化氮气体,具有神经麻醉的毒性。
下图是NO2(g)与N2O4(g)、N2O4(l)间互相转化的能量变化示意图。
(1)试写出反应热分别为ΔH1和ΔH2的两个热化学方程式。体会热化学方程式与普通化学方程式的不同。
(2)热化学方程式中各物质前面的化学计量数与反应的ΔH的绝对值之间有关系吗?
【答案】有。热化学方程式中各物质前面的化学计量数与反应的ΔH的绝对值成正比关系。
(3)热化学方程式中各物质前面的化学计量数能否为分数?为什么?
【答案】可以。因为热化学方程式中各物质前面的化学计量数代表物质的物质的量。
(4)热化学方程式中,ΔH的单位的含义是什么?
【答案】ΔH的单位是kJ·mol-1,它表示按给定反应的热化学方程式中各物质的物质的量完全反应时的热效应,并不一定是反应1 mol物质或生成1 mol物质放出或吸收的热量。
[深化理解]
1.“五步”突破热化学方程式的书写
2.“五查”法判断热化学方程式的正误
(1)一查化学方程式是否书写正确。
(2)二查是否标明各物质的聚集状态:固(s)、液(l)、气(g)、溶液(aq)。
(3)三查ΔH的“+”“-”号是否与吸热、放热一致。
(4)四查ΔH的单位是否正确,一般用kJ·mol-1(或kJ/mol)。
(5)五查ΔH的绝对值是否与热化学方程式中各物质前面的计量数相对应。
写出下列条件下反应的热化学方程式。
(1)1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量,该反应的热化学方程式为_________________________。
(2)0.3 mol的气态乙硼烷(分子式B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,该反应的热化学方程式为_______________________。
[典例精练]
(3)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化的示意图,请写出NO2和CO反应的热化学方程式:_________ _________________。
【答案】(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ· mol-1
(2)B2H6(g)+3O2(g)===B2O3(s)+3H2O(l)
ΔH=-2 165 kJ· mol-1
(3)NO2(g)+CO(g)===CO2(g)+NO(g)
ΔH=-234 kJ· mol-1
在常温常压下,1 g H2在足量Cl2中燃烧生成HCl气体,放出92.3 kJ的热量。下列热化学方程式中正确的是 ( )
A.H2(g)+Cl2(g)===2HCl(g) ΔH=-92.3 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=+92.3 kJ·mol-1
C.H2(g)+Cl2(g)===2HCl(g) ΔH=+184.6 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+184.6 kJ·mol-1
【答案】D
【解析】H2在Cl2中燃烧生成HCl气体,1 g H2完全燃烧放出92.3 kJ的热量,则1 mol(即2 g)H2完全燃烧放出184.6 kJ的热量,化学反应放出热量,ΔH符号为“-”。一个放热反应的逆反应是吸热反应,并且在其他条件相同时,正、逆反应的ΔH绝对值相等,符号相反,则D正确。
任务二 燃烧热的理解与计算
[情境导入]
我国在太原卫星发射中心用长征四号乙运载火箭已成功发射中巴地球资源卫星04A星。此次任务同时搭载了“天琴一号”技术试验卫星等8颗卫星。长征火箭燃料为偏二甲基肼(C2H8N2)。已知:1.5 g偏二甲基肼完全燃烧放出50 kJ热量。
(1)在计算偏二甲基肼的燃烧热时,碳、氢元素的产物应该是什么?
【答案】C→CO2(g),H→H2O(l)。
(2)通过材料中所给数据计算偏二甲基肼的燃烧热。
[深化理解]
1.对燃烧热的理解
(1)反应条件:25 ℃和101 kPa(书中给出的燃烧热数值均为此条件下测得)。
(2)物质的燃烧热要求的是纯物质。
(3)特别注意:C→CO不是完全燃烧;而S→SO3,SO3不是燃烧产物;生成的水是液态。
(4)文字叙述燃烧热时,用正值或ΔH表示。例如,CH4的燃烧热为890.3 kJ·mol-1或ΔH=-890.3 kJ·mol -1。
[典例精练]
【答案】B
【解析】C(s)燃烧应生成CO2(g),A错误;其反应热表示的是2 mol H2 完全燃烧时的热量变化,C错误;该反应中生成的是H2O(g),而不是H2O(l),D错误。
在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)===2H2O(l)+CO2(g)
ΔH=-890.31 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.96 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。则混合气体中CH4和CO的体积比约为 ( )
A.1∶2 B.1∶3
C.2∶3 D.3∶2
【答案】C
辨析 · 易错易混
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-725.76 kJ/mol
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=+1 451.52 kJ/mol
错解:D
错因分析:对于ΔH的正负号的规定记忆不清,误认为放热反应的ΔH为“+x kJ/mol”而错选D。由于在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ,根据CH3OH的相对分子质量为32,可求得1 mol CH3OH燃烧放出的热量为725.76 kJ。
满分策略:计算ΔH时要注意物质的质量与物质的量的转化及其符号的书写。
正解:B
错解:A
错因分析:由于没有注意到该反应为可逆反应,认为0.5 mol N2与3 mol H2能完全反应,从而计算出放出的热量为46.19 kJ,而错选A。
满分策略:可逆反应是有一定限度的,不能按反应物完全反应计算放出或吸收的热量。
正解:C
错解:A
错因分析:对氢气燃烧生成H2O(l)中的状态未理解透彻。
满分策略:燃烧热概念中“完全燃烧生成指定产物”是指单质或化合物燃烧后变为最稳定的物质。完全燃烧时,下列元素要生成对应的物质:C→CO2(g),H→H2O(l),S→SO2(g)。
正解:C
小练 · 素养达成
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小。下列符合未来新能源标准的是 ( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能
⑥风能 ⑦氢能
A.①②③④ B.③⑤⑥⑦
C.④⑤⑥⑦ D.③④⑤⑥⑦
【答案】C
【解析】天然气、煤和石油属于化石能源,不属于新能源。
【答案】C
【解析】A中生成的H2O是气态,B中生成的CO可继续燃烧生成CO2,D中生成的S也可继续燃烧生成SO2。
3.下列对燃烧热的说法正确的是 ( )
A.1 mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热
B.放热反应的热化学方程式中,ΔH就是该反应物的燃烧热
C.物质的燃烧热不能用仪器通过实验测得
D.物质燃烧必然伴随发光发热现象且肯定是氧化还原反应
【答案】D
【解析】在燃烧热的定义中有三个要点:①必须是在101 kPa条件下;②可燃物物质的量必须为1 mol;③可燃物必须完全燃烧,生成指定产物。A项,未强调“101 kPa”和“生成指定产物”;B项,放热反应不一定是燃烧反应,且燃烧反应的ΔH不一定就是该反应物的燃烧热;C项,物质的燃烧热可利用量热计通过实验测得。
【答案】B
【解析】乙醇燃烧是放热反应,ΔH应为“-”,1 g C2H5OH燃烧放出29.71 kJ热量,则1 mol(46 g)C2H5OH燃烧放出的热量为1 366.66 kJ。
5.对于2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述不正确的是 ( )
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:在25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2和液态水时放出热量5 800 kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5 800 kJ·mol-1
【答案】D
【解析】燃烧热的概念,必须为1 mol纯物质完全燃烧,生成指定产物放出的热量。
6.能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是__________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)某国科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是__________________ __________________________________。
(3)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇完全燃烧的热化学方程式为____________________________________________________________。
【答案】(1)ACD
(2)使煤油雾化,增大与助燃剂的接触面积,提高燃烧效率
(3)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 366.89 kJ·mol-1
