2021-2022学年高一上学期化学鲁科版(2019)必修第一册第3章:物质的性质与转化期末复习(word版含答案)
文档属性
| 名称 | 2021-2022学年高一上学期化学鲁科版(2019)必修第一册第3章:物质的性质与转化期末复习(word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 428.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 19:58:05 | ||
图片预览


文档简介
第3章:物质的性质与转化期末复习含答案2021—2022学年上学期高一化学鲁科版(2019)必修第一册
一、选择题。(14题)
1、下列金属①铁、②镁、③锰、④矾、⑤铬,可用铝热法制备的有( )。
A.①②④ B.①②③⑤ C.①③④⑤ D.①②③④⑤
2、某化学兴趣小组探究铜丝与足量浓硫酸的反应,装置(已略去夹持装置,其中铜丝可抽动)如图,下列有关说法不正确的是( )
A.①中生成的气体可使品红溶液褪色
B.②中可观察到溶液黄色变浅,且有白色沉淀生成
C.为进行尾气处理,③中装有溶液
D.反应后,通过向①中加水,观察溶液颜色可判断反应有硫酸铜生成
3、从下列事实所列出的相应结论合理的是( )
A. SO2的水溶液可以导电说明是SO2电解质
B. 常温下白磷可自燃而氮气须在放电时才与氧气反应说明N的非金属性大于P
C. 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定有NH4+
D. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32﹣或HCO3﹣
4、可消除NO的污染,反应方程式为。现有1 mol No与的混合物充分反应,若还原产物比氧化产物多1.4g,则下列判断中正确的是( )
A.原混合物中NO与的物质的量之比可能为3:2
B.有0.6mol被氧化
C.生成还原产物2.8g
D.原混合气体中含氨气为0.2mol或0.7mol
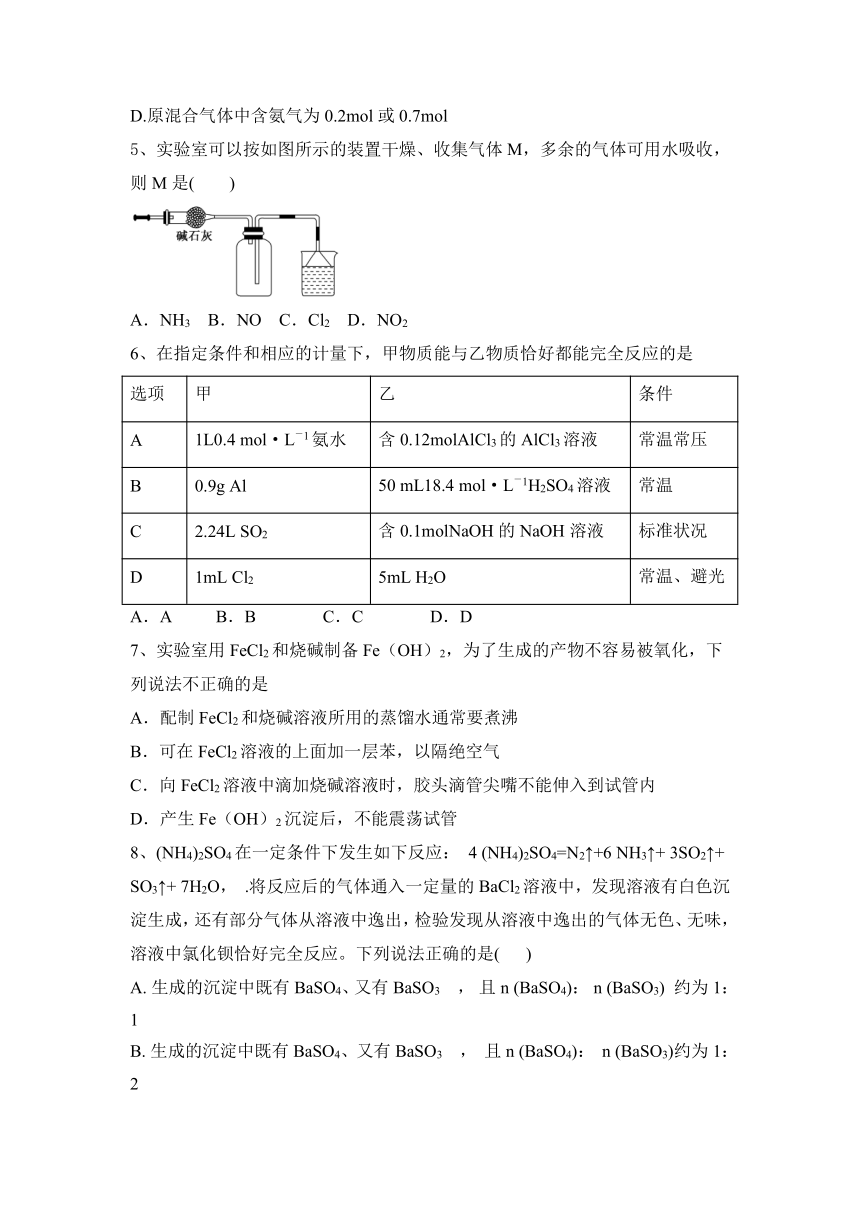
5、实验室可以按如图所示的装置干燥、收集气体M,多余的气体可用水吸收,则M是( )
A.NH3 B.NO C.Cl2 D.NO2
6、在指定条件和相应的计量下,甲物质能与乙物质恰好都能完全反应的是
选项 甲 乙 条件
A 1L0.4 mol·L-1氨水 含0.12molAlCl3的AlCl3溶液 常温常压
B 0.9g Al 50 mL18.4 mol·L-1H2SO4溶液 常温
C 2.24L SO2 含0.1molNaOH的NaOH溶液 标准状况
D 1mL Cl2 5mL H2O 常温、避光
A.A B.B C.C D.D
7、实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能震荡试管
8、(NH4)2SO4在一定条件下发生如下反应: 4 (NH4)2SO4=N2↑+6 NH3↑+ 3SO2↑+ SO3↑+ 7H2O, .将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )
A. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3) 约为1: 1
B. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 2
C. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 3
D. 从溶液中逸出的气体只有N2 , 最后留下溶液中溶质只有较多的NH4Cl
9、下列实验现象叙述正确的是( )
A. 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B. 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C. 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D. 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
10、下图喷泉实验的现象与下列性质无关的是( )
A. 氨易溶于水 B. 氨能与水反应
C. 氨水显碱性 D. 氨易液化
11、有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
12、常温下,下列有关离子反应的说法不正确的是( )
A. 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B. 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
C. NaClO溶液通入少量SO2,反应的离子方程式为:SO2+2ClO-+H2O=SO32-+2HClO
D. c(H+)水=1×10-13 mol·L-1的溶液中,Na+、K+、SO32-、CO32-可能大量存在
13、现只用一种试剂(可以加热)鉴别 NH4Cl、(NH4)2SO4、K2SO4、 NaCl四种无色溶液,该试剂是 ( )
A.AgNO3溶液 B.BaCl2溶液 C.Ba(OH)2溶液 D.NaOH溶液
14、以下情况都有气体产生,其中不产生红棕色气体的是( )
A.加热浓硝酸 B.光照硝酸银
C.加热硝酸钙 D.加热溴化钾和浓硫酸混合物
二、非选择题。(4题)
15、下列物质转化关系如图所示,反应过程中部分产物可能已略去。
请回答以下问题:
(1)E溶液中溶质的化学式为________。若将沉淀C加热至恒重,最终得到的物质是________。
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是________ ,发生反应的化学方程式有________ 。
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式________ 。
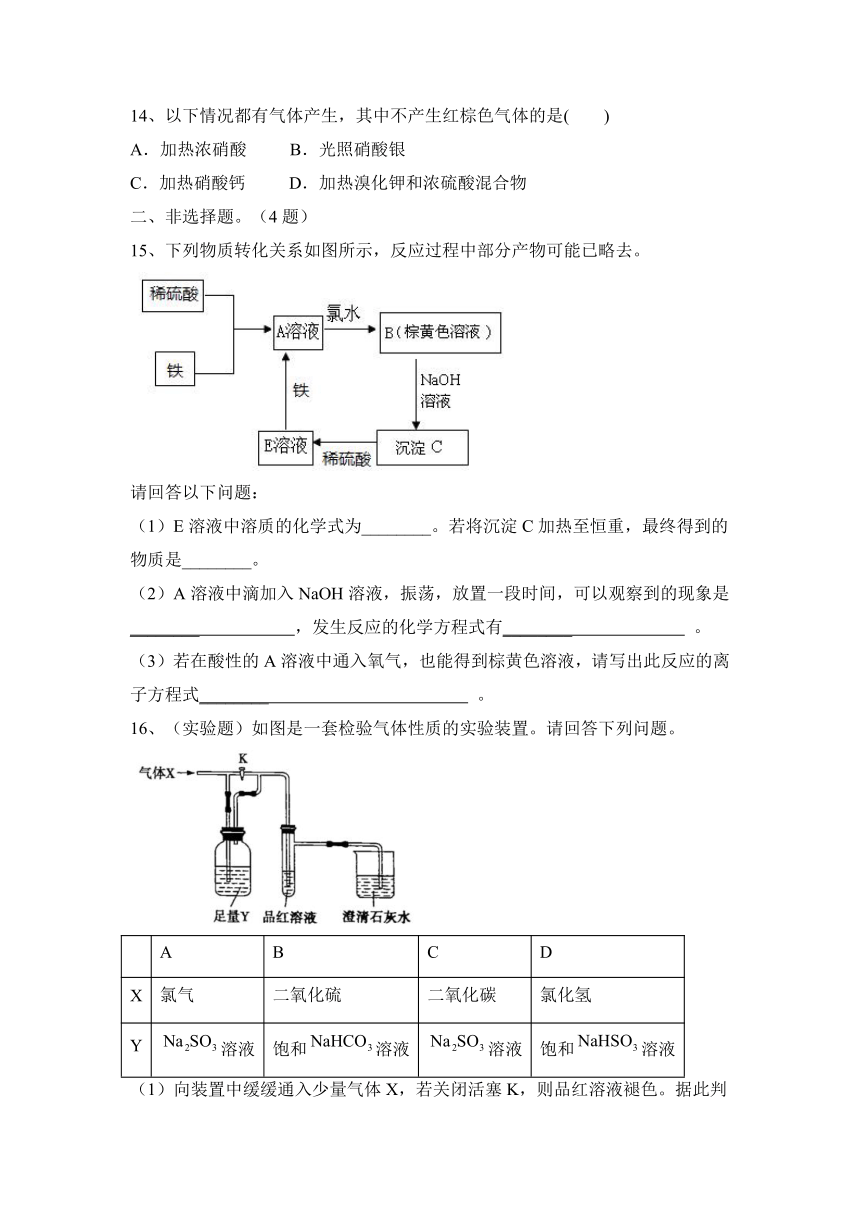
16、(实验题)如图是一套检验气体性质的实验装置。请回答下列问题。
A B C D
X 氯气 二氧化硫 二氧化碳 氯化氢
Y 溶液 饱和溶液 溶液 饱和溶液
(1)向装置中缓缓通入少量气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是________(填表中序号,下同)。
(2)若打开活塞K,品红溶液褪色,同时澄清石灰水变浑浊,则气体X和洗气瓶内液体Y可能的组合是________。
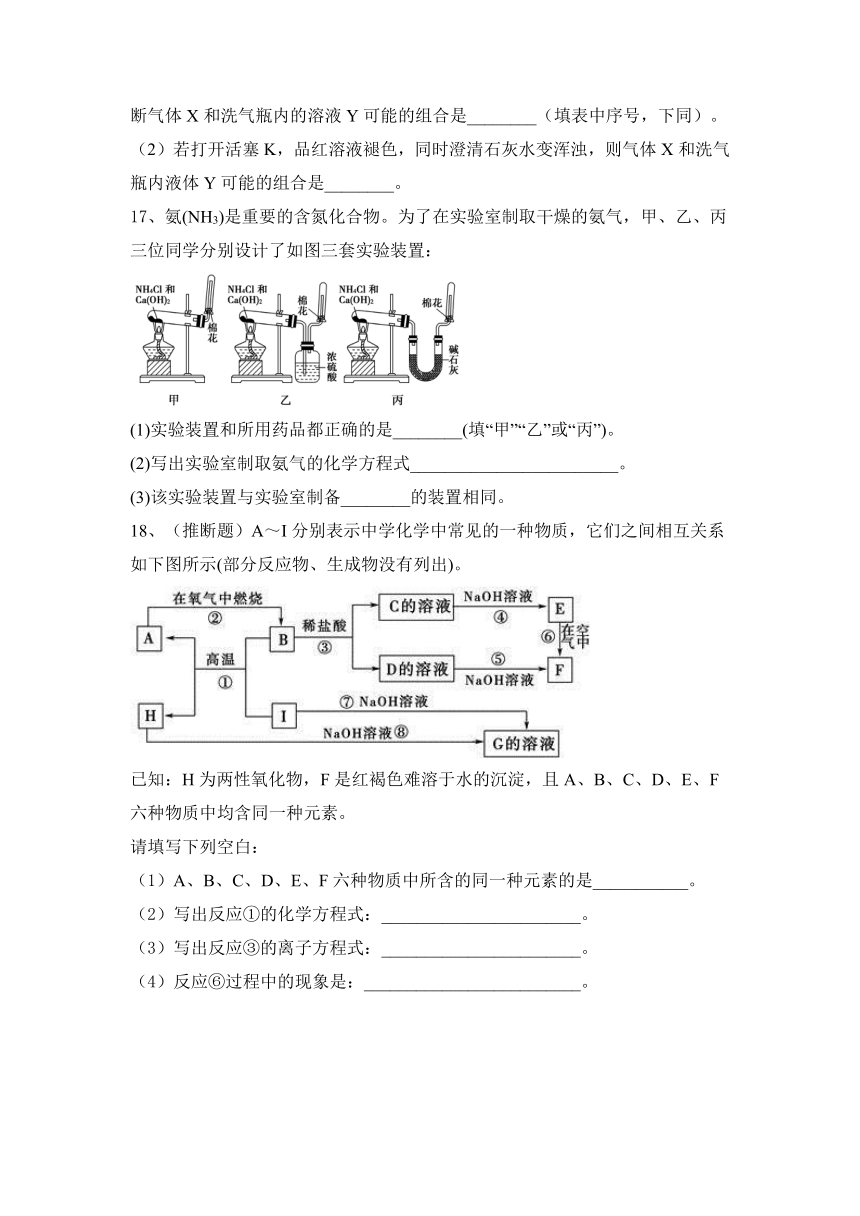
17、氨(NH3)是重要的含氮化合物。为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如图三套实验装置:
(1)实验装置和所用药品都正确的是________(填“甲”“乙”或“丙”)。
(2)写出实验室制取氨气的化学方程式________________________。
(3)该实验装置与实验室制备________的装置相同。
18、(推断题)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。
已知:H为两性氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的是___________。
(2)写出反应①的化学方程式:_______________________。
(3)写出反应③的离子方程式:_______________________。
(4)反应⑥过程中的现象是:_________________________。
第3章:物质的性质与转化期末复习含答案2021—2022学年上学期高一化学鲁科版(2019)必修第一册
一、选择题。(14题)
1、下列金属①铁、②镁、③锰、④矾、⑤铬,可用铝热法制备的有( )。
A.①②④ B.①②③⑤ C.①③④⑤ D.①②③④⑤
【答案】C
2、某化学兴趣小组探究铜丝与足量浓硫酸的反应,装置(已略去夹持装置,其中铜丝可抽动)如图,下列有关说法不正确的是( )
A.①中生成的气体可使品红溶液褪色
B.②中可观察到溶液黄色变浅,且有白色沉淀生成
C.为进行尾气处理,③中装有溶液
D.反应后,通过向①中加水,观察溶液颜色可判断反应有硫酸铜生成
【答案】D
3、从下列事实所列出的相应结论合理的是( )
A. SO2的水溶液可以导电说明是SO2电解质
B. 常温下白磷可自燃而氮气须在放电时才与氧气反应说明N的非金属性大于P
C. 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定有NH4+
D. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32﹣或HCO3﹣
【答案】C
4、可消除NO的污染,反应方程式为。现有1 mol No与的混合物充分反应,若还原产物比氧化产物多1.4g,则下列判断中正确的是( )
A.原混合物中NO与的物质的量之比可能为3:2
B.有0.6mol被氧化
C.生成还原产物2.8g
D.原混合气体中含氨气为0.2mol或0.7mol
【答案】D
5、实验室可以按如图所示的装置干燥、收集气体M,多余的气体可用水吸收,则M是( )
A.NH3 B.NO C.Cl2 D.NO2
【答案】A
6、在指定条件和相应的计量下,甲物质能与乙物质恰好都能完全反应的是
选项 甲 乙 条件
A 1L0.4 mol·L-1氨水 含0.12molAlCl3的AlCl3溶液 常温常压
B 0.9g Al 50 mL18.4 mol·L-1H2SO4溶液 常温
C 2.24L SO2 含0.1molNaOH的NaOH溶液 标准状况
D 1mL Cl2 5mL H2O 常温、避光
A.A B.B C.C D.D
【答案】C
7、实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能震荡试管
【答案】C
8、(NH4)2SO4在一定条件下发生如下反应: 4 (NH4)2SO4=N2↑+6 NH3↑+ 3SO2↑+ SO3↑+ 7H2O, .将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )
A. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3) 约为1: 1
B. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 2
C. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 3
D. 从溶液中逸出的气体只有N2 , 最后留下溶液中溶质只有较多的NH4Cl
【答案】 A
9、下列实验现象叙述正确的是( )
A. 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B. 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C. 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D. 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
【答案】 B
10、下图喷泉实验的现象与下列性质无关的是( )
A. 氨易溶于水 B. 氨能与水反应
C. 氨水显碱性 D. 氨易液化
【答案】D
11、有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
【答案】B
12、常温下,下列有关离子反应的说法不正确的是( )
A. 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B. 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
C. NaClO溶液通入少量SO2,反应的离子方程式为:SO2+2ClO-+H2O=SO32-+2HClO
D. c(H+)水=1×10-13 mol·L-1的溶液中,Na+、K+、SO32-、CO32-可能大量存在
【答案】 C
13、现只用一种试剂(可以加热)鉴别 NH4Cl、(NH4)2SO4、K2SO4、 NaCl四种无色溶液,该试剂是 ( )
A.AgNO3溶液 B.BaCl2溶液 C.Ba(OH)2溶液 D.NaOH溶液
【答案】C
14、以下情况都有气体产生,其中不产生红棕色气体的是( )
A.加热浓硝酸 B.光照硝酸银
C.加热硝酸钙 D.加热溴化钾和浓硫酸混合物
【答案】C
二、非选择题。(4题)
15、下列物质转化关系如图所示,反应过程中部分产物可能已略去。
请回答以下问题:
(1)E溶液中溶质的化学式为________。若将沉淀C加热至恒重,最终得到的物质是________。
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是________ ,发生反应的化学方程式有________ 。
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式________ 。
【答案】 (1)Fe2(SO4)3;Fe2O3
(2)有白色沉淀产生,迅速变为灰绿色,最后变为红褐色;FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4 , 4Fe(OH)2 + O2 + 2H2O =4Fe(OH)3
(3)4Fe2++ O2 + 4H+=4Fe3++2H2O
16、(实验题)如图是一套检验气体性质的实验装置。请回答下列问题。
A B C D
X 氯气 二氧化硫 二氧化碳 氯化氢
Y 溶液 饱和溶液 溶液 饱和溶液
(1)向装置中缓缓通入少量气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是________(填表中序号,下同)。
(2)若打开活塞K,品红溶液褪色,同时澄清石灰水变浑浊,则气体X和洗气瓶内液体Y可能的组合是________。
【答案】D B
17、氨(NH3)是重要的含氮化合物。为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如图三套实验装置:
(1)实验装置和所用药品都正确的是________(填“甲”“乙”或“丙”)。
(2)写出实验室制取氨气的化学方程式________________________。
(3)该实验装置与实验室制备________的装置相同。
【答案】(1)丙 (2)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O (3)氧气
18、(推断题)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。
已知:H为两性氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的是___________。
(2)写出反应①的化学方程式:_______________________。
(3)写出反应③的离子方程式:_______________________。
(4)反应⑥过程中的现象是:_________________________。
【答案】铁元素 8Al+3Fe3O44Al2O3+9Fe Fe3O4+8H+=Fe2++2Fe3++4H2O
生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色
一、选择题。(14题)
1、下列金属①铁、②镁、③锰、④矾、⑤铬,可用铝热法制备的有( )。
A.①②④ B.①②③⑤ C.①③④⑤ D.①②③④⑤
2、某化学兴趣小组探究铜丝与足量浓硫酸的反应,装置(已略去夹持装置,其中铜丝可抽动)如图,下列有关说法不正确的是( )
A.①中生成的气体可使品红溶液褪色
B.②中可观察到溶液黄色变浅,且有白色沉淀生成
C.为进行尾气处理,③中装有溶液
D.反应后,通过向①中加水,观察溶液颜色可判断反应有硫酸铜生成
3、从下列事实所列出的相应结论合理的是( )
A. SO2的水溶液可以导电说明是SO2电解质
B. 常温下白磷可自燃而氮气须在放电时才与氧气反应说明N的非金属性大于P
C. 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定有NH4+
D. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32﹣或HCO3﹣
4、可消除NO的污染,反应方程式为。现有1 mol No与的混合物充分反应,若还原产物比氧化产物多1.4g,则下列判断中正确的是( )
A.原混合物中NO与的物质的量之比可能为3:2
B.有0.6mol被氧化
C.生成还原产物2.8g
D.原混合气体中含氨气为0.2mol或0.7mol
5、实验室可以按如图所示的装置干燥、收集气体M,多余的气体可用水吸收,则M是( )
A.NH3 B.NO C.Cl2 D.NO2
6、在指定条件和相应的计量下,甲物质能与乙物质恰好都能完全反应的是
选项 甲 乙 条件
A 1L0.4 mol·L-1氨水 含0.12molAlCl3的AlCl3溶液 常温常压
B 0.9g Al 50 mL18.4 mol·L-1H2SO4溶液 常温
C 2.24L SO2 含0.1molNaOH的NaOH溶液 标准状况
D 1mL Cl2 5mL H2O 常温、避光
A.A B.B C.C D.D
7、实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能震荡试管
8、(NH4)2SO4在一定条件下发生如下反应: 4 (NH4)2SO4=N2↑+6 NH3↑+ 3SO2↑+ SO3↑+ 7H2O, .将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )
A. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3) 约为1: 1
B. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 2
C. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 3
D. 从溶液中逸出的气体只有N2 , 最后留下溶液中溶质只有较多的NH4Cl
9、下列实验现象叙述正确的是( )
A. 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B. 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C. 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D. 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
10、下图喷泉实验的现象与下列性质无关的是( )
A. 氨易溶于水 B. 氨能与水反应
C. 氨水显碱性 D. 氨易液化
11、有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
12、常温下,下列有关离子反应的说法不正确的是( )
A. 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B. 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
C. NaClO溶液通入少量SO2,反应的离子方程式为:SO2+2ClO-+H2O=SO32-+2HClO
D. c(H+)水=1×10-13 mol·L-1的溶液中,Na+、K+、SO32-、CO32-可能大量存在
13、现只用一种试剂(可以加热)鉴别 NH4Cl、(NH4)2SO4、K2SO4、 NaCl四种无色溶液,该试剂是 ( )
A.AgNO3溶液 B.BaCl2溶液 C.Ba(OH)2溶液 D.NaOH溶液
14、以下情况都有气体产生,其中不产生红棕色气体的是( )
A.加热浓硝酸 B.光照硝酸银
C.加热硝酸钙 D.加热溴化钾和浓硫酸混合物
二、非选择题。(4题)
15、下列物质转化关系如图所示,反应过程中部分产物可能已略去。
请回答以下问题:
(1)E溶液中溶质的化学式为________。若将沉淀C加热至恒重,最终得到的物质是________。
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是________ ,发生反应的化学方程式有________ 。
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式________ 。
16、(实验题)如图是一套检验气体性质的实验装置。请回答下列问题。
A B C D
X 氯气 二氧化硫 二氧化碳 氯化氢
Y 溶液 饱和溶液 溶液 饱和溶液
(1)向装置中缓缓通入少量气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是________(填表中序号,下同)。
(2)若打开活塞K,品红溶液褪色,同时澄清石灰水变浑浊,则气体X和洗气瓶内液体Y可能的组合是________。
17、氨(NH3)是重要的含氮化合物。为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如图三套实验装置:
(1)实验装置和所用药品都正确的是________(填“甲”“乙”或“丙”)。
(2)写出实验室制取氨气的化学方程式________________________。
(3)该实验装置与实验室制备________的装置相同。
18、(推断题)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。
已知:H为两性氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的是___________。
(2)写出反应①的化学方程式:_______________________。
(3)写出反应③的离子方程式:_______________________。
(4)反应⑥过程中的现象是:_________________________。
第3章:物质的性质与转化期末复习含答案2021—2022学年上学期高一化学鲁科版(2019)必修第一册
一、选择题。(14题)
1、下列金属①铁、②镁、③锰、④矾、⑤铬,可用铝热法制备的有( )。
A.①②④ B.①②③⑤ C.①③④⑤ D.①②③④⑤
【答案】C
2、某化学兴趣小组探究铜丝与足量浓硫酸的反应,装置(已略去夹持装置,其中铜丝可抽动)如图,下列有关说法不正确的是( )
A.①中生成的气体可使品红溶液褪色
B.②中可观察到溶液黄色变浅,且有白色沉淀生成
C.为进行尾气处理,③中装有溶液
D.反应后,通过向①中加水,观察溶液颜色可判断反应有硫酸铜生成
【答案】D
3、从下列事实所列出的相应结论合理的是( )
A. SO2的水溶液可以导电说明是SO2电解质
B. 常温下白磷可自燃而氮气须在放电时才与氧气反应说明N的非金属性大于P
C. 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定有NH4+
D. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32﹣或HCO3﹣
【答案】C
4、可消除NO的污染,反应方程式为。现有1 mol No与的混合物充分反应,若还原产物比氧化产物多1.4g,则下列判断中正确的是( )
A.原混合物中NO与的物质的量之比可能为3:2
B.有0.6mol被氧化
C.生成还原产物2.8g
D.原混合气体中含氨气为0.2mol或0.7mol
【答案】D
5、实验室可以按如图所示的装置干燥、收集气体M,多余的气体可用水吸收,则M是( )
A.NH3 B.NO C.Cl2 D.NO2
【答案】A
6、在指定条件和相应的计量下,甲物质能与乙物质恰好都能完全反应的是
选项 甲 乙 条件
A 1L0.4 mol·L-1氨水 含0.12molAlCl3的AlCl3溶液 常温常压
B 0.9g Al 50 mL18.4 mol·L-1H2SO4溶液 常温
C 2.24L SO2 含0.1molNaOH的NaOH溶液 标准状况
D 1mL Cl2 5mL H2O 常温、避光
A.A B.B C.C D.D
【答案】C
7、实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能震荡试管
【答案】C
8、(NH4)2SO4在一定条件下发生如下反应: 4 (NH4)2SO4=N2↑+6 NH3↑+ 3SO2↑+ SO3↑+ 7H2O, .将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )
A. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3) 约为1: 1
B. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 2
C. 生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 3
D. 从溶液中逸出的气体只有N2 , 最后留下溶液中溶质只有较多的NH4Cl
【答案】 A
9、下列实验现象叙述正确的是( )
A. 滴入硝酸酸化的BaCl2 溶液,产生白色沉淀,溶液中一定存在SO42-
B. 硫粉在纯氧中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
C. 铁粉加入稀硫酸,银白色固体表面有气泡产生,固体减少,放热,溶液由无色变浅绿色
D. 水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
【答案】 B
10、下图喷泉实验的现象与下列性质无关的是( )
A. 氨易溶于水 B. 氨能与水反应
C. 氨水显碱性 D. 氨易液化
【答案】D
11、有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
【答案】B
12、常温下,下列有关离子反应的说法不正确的是( )
A. 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B. 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
C. NaClO溶液通入少量SO2,反应的离子方程式为:SO2+2ClO-+H2O=SO32-+2HClO
D. c(H+)水=1×10-13 mol·L-1的溶液中,Na+、K+、SO32-、CO32-可能大量存在
【答案】 C
13、现只用一种试剂(可以加热)鉴别 NH4Cl、(NH4)2SO4、K2SO4、 NaCl四种无色溶液,该试剂是 ( )
A.AgNO3溶液 B.BaCl2溶液 C.Ba(OH)2溶液 D.NaOH溶液
【答案】C
14、以下情况都有气体产生,其中不产生红棕色气体的是( )
A.加热浓硝酸 B.光照硝酸银
C.加热硝酸钙 D.加热溴化钾和浓硫酸混合物
【答案】C
二、非选择题。(4题)
15、下列物质转化关系如图所示,反应过程中部分产物可能已略去。
请回答以下问题:
(1)E溶液中溶质的化学式为________。若将沉淀C加热至恒重,最终得到的物质是________。
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是________ ,发生反应的化学方程式有________ 。
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式________ 。
【答案】 (1)Fe2(SO4)3;Fe2O3
(2)有白色沉淀产生,迅速变为灰绿色,最后变为红褐色;FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4 , 4Fe(OH)2 + O2 + 2H2O =4Fe(OH)3
(3)4Fe2++ O2 + 4H+=4Fe3++2H2O
16、(实验题)如图是一套检验气体性质的实验装置。请回答下列问题。
A B C D
X 氯气 二氧化硫 二氧化碳 氯化氢
Y 溶液 饱和溶液 溶液 饱和溶液
(1)向装置中缓缓通入少量气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是________(填表中序号,下同)。
(2)若打开活塞K,品红溶液褪色,同时澄清石灰水变浑浊,则气体X和洗气瓶内液体Y可能的组合是________。
【答案】D B
17、氨(NH3)是重要的含氮化合物。为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如图三套实验装置:
(1)实验装置和所用药品都正确的是________(填“甲”“乙”或“丙”)。
(2)写出实验室制取氨气的化学方程式________________________。
(3)该实验装置与实验室制备________的装置相同。
【答案】(1)丙 (2)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O (3)氧气
18、(推断题)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。
已知:H为两性氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的是___________。
(2)写出反应①的化学方程式:_______________________。
(3)写出反应③的离子方程式:_______________________。
(4)反应⑥过程中的现象是:_________________________。
【答案】铁元素 8Al+3Fe3O44Al2O3+9Fe Fe3O4+8H+=Fe2++2Fe3++4H2O
生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色
同课章节目录
