陕西省咸阳市三原县城关北城高级中学2021-2022学年高二上学期12月月考化学试题(Word版含答案)
文档属性
| 名称 | 陕西省咸阳市三原县城关北城高级中学2021-2022学年高二上学期12月月考化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 274.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 20:00:04 | ||
图片预览



文档简介
三原县城关北城高级中学2021-2022学年高二上学期12月月考
化学试卷
一、单选题
1.室温25℃时,下列溶液里微粒间物质的量浓度的关系中正确的是( )
A. 浓度0.1mol/L的NH4HSO3溶液:c(NH4+)+ c(H+)= c(OH-)+ c(HSO3-)+ c(SO32-)
B. 等体积等浓度Na2S和NaHS混合液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+)
C. 将0.2mol/LNH3·H2O与0.1mol/LHCl等体积混合:c(Cl-)>c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D. 在0.1mol/L的Na2CO3溶液中:c (OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
2.瑞典皇家科学院2001年10月10日宣布,2001年诺贝尔化学奖授予“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家。在有机物中,若碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子。下列分子中含有“手性碳原子”的是( )
A. CBr2F2 B. CH3CH2OH C. CH3CH2CH3 D. CH3CH(OH)COOH
3.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入FeCl3溶液中; ②过量NaOH溶液和明矾溶液混合;
③少量Ca(OH)2投入过量NaHCO3溶液中; ④向AlCl3溶液中滴入NaHCO3溶液;
⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
4.下列叙述正确的是( )
A. 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b
B. 常温下,某溶液中由水电离的c(OH-) = 1.0×10-13mol/L,则此溶液一定呈酸性
C. 25℃时,将pH=4的盐酸稀释1000倍后,溶液的pH=7
D. 25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:10
5.下列有关化学反应发生的实验条件说法错误的是( )
A. 乙醛的银镜反应:水浴加热 B. 醇的消去反应:浓硫酸加热
C. 烯烃与氢气加成反应:Ni(催化剂)加热 D. 卤代烃的消去反应:氢氧化钠水溶液加热
6.下列燃烧反应的反应热是燃烧热的是( )
A. H2(g)+ O2(g)=H2O(g) ΔH1 B. C(s)+O2(g)=CO(g) ΔH2
C. S(s)+O2(g)=SO2(g) ΔH3 D. H2S(g)+ O2(g)=S(s)+H2O(l) ΔH4
7.下列有关说法中错误的是( )
A. 侯氏制碱法中的“碱”指的是烧碱
B. 硫酸铵或氯化钠溶液都能使鸡蛋清凝固
C. 粮食发酵产生的酒精分散在酒糟中,可以通过蒸馏与酒糟分离
D. 食品包装中常见的抗氧化剂成分为:还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同
8.NA是阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,2.24LCCl4中共价键数目为0.4NA
B. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C. 常温常压下,32g氧气和臭氧混合气体中含有2NA个氧原子
D. pH=1的硫酸溶液,含有氢离子数目为NA
9.下列根据实验操作和实验现象所得出的结论中,正确的是( )
选项 实验操作 现象 结论
A 常温下分别测定等浓度的KNO2、KCl溶液的pH pH值:KNO2>KCl 非金属性:Cl>N
B 打磨后的铝片投入沸水中,加热一段时间,取出铝片,用一束光照射溶液 加热,铝片表面无明显现象;用光照射溶液时,有一条光亮的“通路” 铝与热水发生了反应
C 将某溶液与盐酸反应产生的气体通入澄清石灰水中 澄清石灰水变浑浊 某溶液中一定含有HCO3-或CO32-
D 向Cu(OH)2沉淀中分别滴加盐酸和氨水 沉淀均能溶解 Cu(OH)2为两性氢氧化物
A. A B. B C. C D. D
10.某元素X的逐级电离能如图所示,下列说法正确的是( )
A. X元素可能显+4价 B. X为非金属元素
C. X为第5周期元素 D. X的单质与氯气反应时最可能生成的阳离子为X3+
11.乙醇分子中各种化学键如下图所示,关于乙醇在各种反应中断裂键的说法错误的是( )
A. 和浓H2SO4共热到140℃时仅有键②断裂 B. 和浓H2SO4共热到170℃时键②和⑤断裂
C. 和金属钠反应时键①断裂 D. 在Ag催化下与O2反应时键①和③断裂
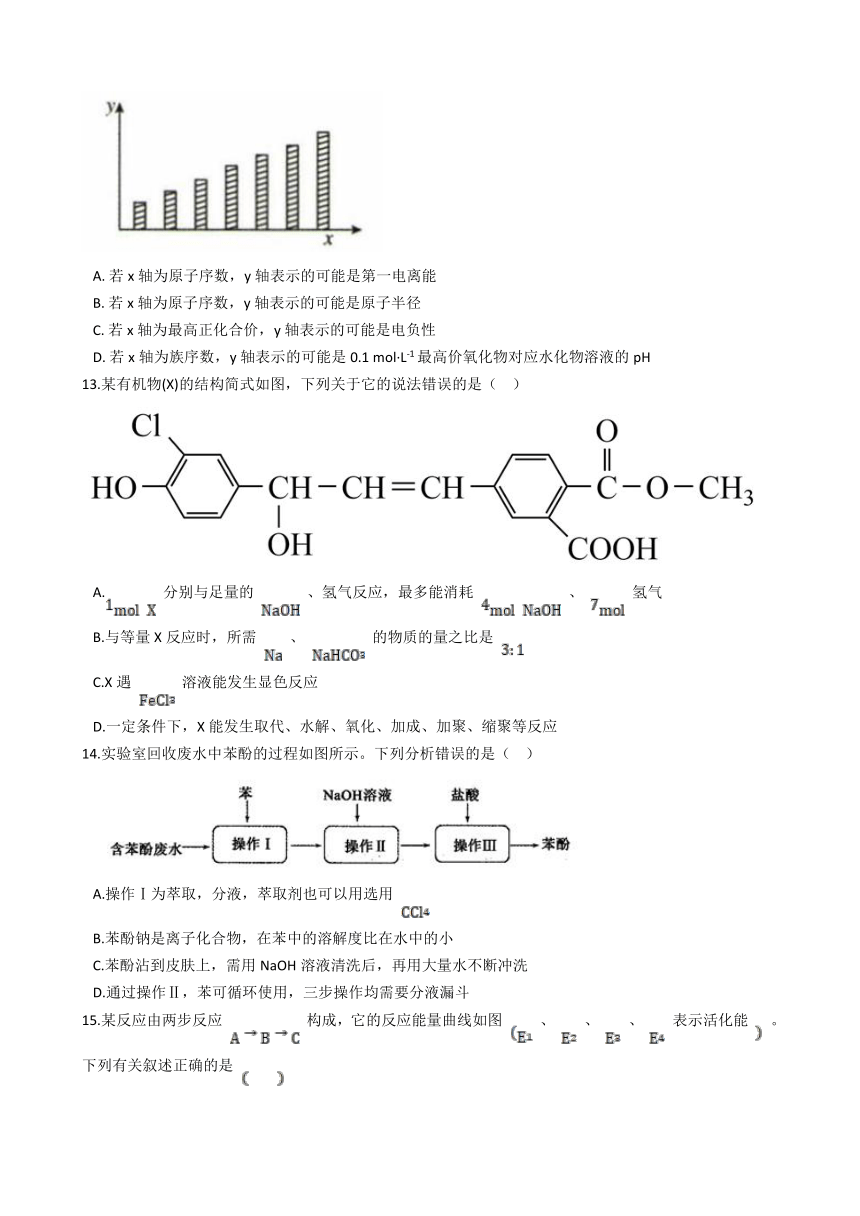
12.如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
A. 若x轴为原子序数,y轴表示的可能是第一电离能
B. 若x轴为原子序数,y轴表示的可能是原子半径
C. 若x轴为最高正化合价,y轴表示的可能是电负性
D. 若x轴为族序数,y轴表示的可能是0.1 mol·L-1最高价氧化物对应水化物溶液的pH
13.某有机物(X)的结构简式如图,下列关于它的说法错误的是( )
A. 分别与足量的 、氢气反应,最多能消耗 、 氢气
B.与等量X反应时,所需 、 的物质的量之比是
C.X遇 溶液能发生显色反应
D.一定条件下,X能发生取代、水解、氧化、加成、加聚、缩聚等反应
14.实验室回收废水中苯酚的过程如图所示。下列分析错误的是( )
A.操作Ⅰ为萃取,分液,萃取剂也可以用选用
B.苯酚钠是离子化合物,在苯中的溶解度比在水中的小
C.苯酚沾到皮肤上,需用NaOH溶液清洗后,再用大量水不断冲洗
D.通过操作Ⅱ,苯可循环使用,三步操作均需要分液漏斗
15.某反应由两步反应 构成,它的反应能量曲线如图 、 、 、 表示活化能 。下列有关叙述正确的是
A. 相同条件下 反应的速率小于 的速率 B. 两步反应均为吸热反应
C. A,B,C中物质B最稳定 D. 整个反应的
16.已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮,如:
现有化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,且峰面积之比为9:6:1,满足条件的烯烃经O3氧化后,在Zn存在下水解的产物共可能有几种(不考虑立体异构)( )
A. 2种 B. 4种 C. 5种 D. 6种
17.下列说法正确的是( )
A. 天然气和液化石油气的主要成分都是甲烷
B. 乙醇的沸点比丙烷高,是因为乙醇分子间存在氢键
C. 福尔马林有一定毒性,不能作消毒剂和防腐剂
D. 苯酚有毒,不慎沾到皮肤上,可以用氢氧化钠溶液处理
18.密闭容器中进行的可逆反应: 在不同温度( 和 )及压强( 和 )下,混合气体中B的质量分数 与反应时间(t)的关系如图所示。下列判断正确的是( )
A. , , ,正反应为吸热反应
B. , , ,正反应为吸热反应
C. , , ,正反应为吸热反应
D. , , ,正反应为放热反应
19.下列化学用语的表述错误的是( )
A. 重铬酸钾的化学式:K2Cr2O7 B. NH3分子的球棍模型:
C. 铝原子的结构示意图: D. N2的电子式:
20.在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g) 3Z(g) H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
A. 升高温度,平衡常数增大
B. W点X的正反应速率等于M点X的正反应速率
C. Q点时,Y的转化率最大
D. 恒温下,平衡时再充入适量Z,则达到新平衡时Z的体积分数比原平衡时大
二、解答题
21.为了预防碘缺乏病,国家规定每千克食盐中应含40~50mg的碘酸钾.为检验某种食盐产品是否合格,某同学取食盐样品428g,设法溶解出其中全部的碘酸钾,将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去.试通过计算说明该加碘盐是否为合格产品.有关反应如下:
IO3-+5I-+6H+===3I2+3H2O,
I2+2S2O32-===2I-+S4O62-.
三、综合题
22.水的电离平衡曲线如图所示:
(1)若以A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点(横纵坐标都是10﹣6 , )则此时水的离子积从 变到 , 造成水的离子积变化的原因是 .
(2)已知25℃时,0.1L 0.1mol L﹣1的NaA溶液的pH=10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为 .
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
(5)常温25℃时pH=2的硫酸升高到100℃时pH= 常温25℃时pH=12NaOH升高到100℃时pH= .
四、推断题
23.A,B,C,D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
(1)若A是淡黄色固体,C,D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途: .
(2)若B是气态氢化物,C,D是氧化物且会造成光化学烟雾污染.B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式: .
(3)若A是太阳能电池用的光伏材料.B可用于制造光导纤维,C,D为钠盐,且D是厨房中常用的物质.则C的电离方程式 写出④反应的化学方程式: .
五、实验探究题
24.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为 H1、 H2、 H3 , 则 H1、 H2、 H3的大小关系为________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3 , 又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.2 20.4 23.4
3 20.4 20.6 23.6
4 20.1 20.3 26.9
依据该学生的实验数据计算,该实验测得的中和热 H________(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量________ (填“相等、不相等”),所求中和热________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
答案解析部分
一、单选题
1.【答案】 D
2.【答案】 D
3.【答案】 D
4.【答案】 D
5.【答案】 D
6.【答案】 C
7.【答案】 A
8.【答案】 C
9.【答案】 B
10.【答案】 D
11.【答案】 A
12.【答案】 C
13.【答案】 A
14.【答案】 C
15.【答案】 A
16.【答案】 C
17.【答案】 B
18.【答案】 B
19.【答案】 D
20.【答案】 C
二、解答题
21.【答案】 设碘酸钾的物质的量为n,由于IO3-+5I-+6H+===3I2+3H2O,I2+2S2O32--===2I-+S4O62-.则可联立得关系式:
IO3- ~ 6S2O32-
1 6
n 0.030mol/L×18.00mL×10-3L/mL
n(KIO3)=0.09×10-3mol.每千克食盐中KIO3为
×1000mg/g
=45mg/kg.所以该加碘盐是合格的.
三、综合题
22.【答案】 (1)10﹣14;10﹣12;水的电离为吸热反应,升高温度促进水电离
(2)c(Na+)>c(A﹣)>c(OH﹣)>c(H+)
(3)1:9
(4)a+b=13
(5)2;10
四、推断题
23.【答案】 (1)漂白、杀菌、消毒、作为硫酸的原料等
(2)4NH3+6NO 5N2+6H2O
(3)Na2SiO3═2Na++SiO32﹣;Na2SiO3+CO2+H2O═Na2CO3+H2SiO3↓
五、实验探究题
24.【答案】 (1)HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol
(2)△H1=△H2<△H3
(3)-51.8kJ/mol
(4)不相等;相等
(5)D
化学试卷
一、单选题
1.室温25℃时,下列溶液里微粒间物质的量浓度的关系中正确的是( )
A. 浓度0.1mol/L的NH4HSO3溶液:c(NH4+)+ c(H+)= c(OH-)+ c(HSO3-)+ c(SO32-)
B. 等体积等浓度Na2S和NaHS混合液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+)
C. 将0.2mol/LNH3·H2O与0.1mol/LHCl等体积混合:c(Cl-)>c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D. 在0.1mol/L的Na2CO3溶液中:c (OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
2.瑞典皇家科学院2001年10月10日宣布,2001年诺贝尔化学奖授予“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家。在有机物中,若碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子。下列分子中含有“手性碳原子”的是( )
A. CBr2F2 B. CH3CH2OH C. CH3CH2CH3 D. CH3CH(OH)COOH
3.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入FeCl3溶液中; ②过量NaOH溶液和明矾溶液混合;
③少量Ca(OH)2投入过量NaHCO3溶液中; ④向AlCl3溶液中滴入NaHCO3溶液;
⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
4.下列叙述正确的是( )
A. 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b
B. 常温下,某溶液中由水电离的c(OH-) = 1.0×10-13mol/L,则此溶液一定呈酸性
C. 25℃时,将pH=4的盐酸稀释1000倍后,溶液的pH=7
D. 25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:10
5.下列有关化学反应发生的实验条件说法错误的是( )
A. 乙醛的银镜反应:水浴加热 B. 醇的消去反应:浓硫酸加热
C. 烯烃与氢气加成反应:Ni(催化剂)加热 D. 卤代烃的消去反应:氢氧化钠水溶液加热
6.下列燃烧反应的反应热是燃烧热的是( )
A. H2(g)+ O2(g)=H2O(g) ΔH1 B. C(s)+O2(g)=CO(g) ΔH2
C. S(s)+O2(g)=SO2(g) ΔH3 D. H2S(g)+ O2(g)=S(s)+H2O(l) ΔH4
7.下列有关说法中错误的是( )
A. 侯氏制碱法中的“碱”指的是烧碱
B. 硫酸铵或氯化钠溶液都能使鸡蛋清凝固
C. 粮食发酵产生的酒精分散在酒糟中,可以通过蒸馏与酒糟分离
D. 食品包装中常见的抗氧化剂成分为:还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同
8.NA是阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,2.24LCCl4中共价键数目为0.4NA
B. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C. 常温常压下,32g氧气和臭氧混合气体中含有2NA个氧原子
D. pH=1的硫酸溶液,含有氢离子数目为NA
9.下列根据实验操作和实验现象所得出的结论中,正确的是( )
选项 实验操作 现象 结论
A 常温下分别测定等浓度的KNO2、KCl溶液的pH pH值:KNO2>KCl 非金属性:Cl>N
B 打磨后的铝片投入沸水中,加热一段时间,取出铝片,用一束光照射溶液 加热,铝片表面无明显现象;用光照射溶液时,有一条光亮的“通路” 铝与热水发生了反应
C 将某溶液与盐酸反应产生的气体通入澄清石灰水中 澄清石灰水变浑浊 某溶液中一定含有HCO3-或CO32-
D 向Cu(OH)2沉淀中分别滴加盐酸和氨水 沉淀均能溶解 Cu(OH)2为两性氢氧化物
A. A B. B C. C D. D
10.某元素X的逐级电离能如图所示,下列说法正确的是( )
A. X元素可能显+4价 B. X为非金属元素
C. X为第5周期元素 D. X的单质与氯气反应时最可能生成的阳离子为X3+
11.乙醇分子中各种化学键如下图所示,关于乙醇在各种反应中断裂键的说法错误的是( )
A. 和浓H2SO4共热到140℃时仅有键②断裂 B. 和浓H2SO4共热到170℃时键②和⑤断裂
C. 和金属钠反应时键①断裂 D. 在Ag催化下与O2反应时键①和③断裂
12.如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
A. 若x轴为原子序数,y轴表示的可能是第一电离能
B. 若x轴为原子序数,y轴表示的可能是原子半径
C. 若x轴为最高正化合价,y轴表示的可能是电负性
D. 若x轴为族序数,y轴表示的可能是0.1 mol·L-1最高价氧化物对应水化物溶液的pH
13.某有机物(X)的结构简式如图,下列关于它的说法错误的是( )
A. 分别与足量的 、氢气反应,最多能消耗 、 氢气
B.与等量X反应时,所需 、 的物质的量之比是
C.X遇 溶液能发生显色反应
D.一定条件下,X能发生取代、水解、氧化、加成、加聚、缩聚等反应
14.实验室回收废水中苯酚的过程如图所示。下列分析错误的是( )
A.操作Ⅰ为萃取,分液,萃取剂也可以用选用
B.苯酚钠是离子化合物,在苯中的溶解度比在水中的小
C.苯酚沾到皮肤上,需用NaOH溶液清洗后,再用大量水不断冲洗
D.通过操作Ⅱ,苯可循环使用,三步操作均需要分液漏斗
15.某反应由两步反应 构成,它的反应能量曲线如图 、 、 、 表示活化能 。下列有关叙述正确的是
A. 相同条件下 反应的速率小于 的速率 B. 两步反应均为吸热反应
C. A,B,C中物质B最稳定 D. 整个反应的
16.已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮,如:
现有化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,且峰面积之比为9:6:1,满足条件的烯烃经O3氧化后,在Zn存在下水解的产物共可能有几种(不考虑立体异构)( )
A. 2种 B. 4种 C. 5种 D. 6种
17.下列说法正确的是( )
A. 天然气和液化石油气的主要成分都是甲烷
B. 乙醇的沸点比丙烷高,是因为乙醇分子间存在氢键
C. 福尔马林有一定毒性,不能作消毒剂和防腐剂
D. 苯酚有毒,不慎沾到皮肤上,可以用氢氧化钠溶液处理
18.密闭容器中进行的可逆反应: 在不同温度( 和 )及压强( 和 )下,混合气体中B的质量分数 与反应时间(t)的关系如图所示。下列判断正确的是( )
A. , , ,正反应为吸热反应
B. , , ,正反应为吸热反应
C. , , ,正反应为吸热反应
D. , , ,正反应为放热反应
19.下列化学用语的表述错误的是( )
A. 重铬酸钾的化学式:K2Cr2O7 B. NH3分子的球棍模型:
C. 铝原子的结构示意图: D. N2的电子式:
20.在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g) 3Z(g) H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
A. 升高温度,平衡常数增大
B. W点X的正反应速率等于M点X的正反应速率
C. Q点时,Y的转化率最大
D. 恒温下,平衡时再充入适量Z,则达到新平衡时Z的体积分数比原平衡时大
二、解答题
21.为了预防碘缺乏病,国家规定每千克食盐中应含40~50mg的碘酸钾.为检验某种食盐产品是否合格,某同学取食盐样品428g,设法溶解出其中全部的碘酸钾,将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去.试通过计算说明该加碘盐是否为合格产品.有关反应如下:
IO3-+5I-+6H+===3I2+3H2O,
I2+2S2O32-===2I-+S4O62-.
三、综合题
22.水的电离平衡曲线如图所示:
(1)若以A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点(横纵坐标都是10﹣6 , )则此时水的离子积从 变到 , 造成水的离子积变化的原因是 .
(2)已知25℃时,0.1L 0.1mol L﹣1的NaA溶液的pH=10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为 .
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
(5)常温25℃时pH=2的硫酸升高到100℃时pH= 常温25℃时pH=12NaOH升高到100℃时pH= .
四、推断题
23.A,B,C,D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
(1)若A是淡黄色固体,C,D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途: .
(2)若B是气态氢化物,C,D是氧化物且会造成光化学烟雾污染.B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式: .
(3)若A是太阳能电池用的光伏材料.B可用于制造光导纤维,C,D为钠盐,且D是厨房中常用的物质.则C的电离方程式 写出④反应的化学方程式: .
五、实验探究题
24.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为 H1、 H2、 H3 , 则 H1、 H2、 H3的大小关系为________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3 , 又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.2 20.4 23.4
3 20.4 20.6 23.6
4 20.1 20.3 26.9
依据该学生的实验数据计算,该实验测得的中和热 H________(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量________ (填“相等、不相等”),所求中和热________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
答案解析部分
一、单选题
1.【答案】 D
2.【答案】 D
3.【答案】 D
4.【答案】 D
5.【答案】 D
6.【答案】 C
7.【答案】 A
8.【答案】 C
9.【答案】 B
10.【答案】 D
11.【答案】 A
12.【答案】 C
13.【答案】 A
14.【答案】 C
15.【答案】 A
16.【答案】 C
17.【答案】 B
18.【答案】 B
19.【答案】 D
20.【答案】 C
二、解答题
21.【答案】 设碘酸钾的物质的量为n,由于IO3-+5I-+6H+===3I2+3H2O,I2+2S2O32--===2I-+S4O62-.则可联立得关系式:
IO3- ~ 6S2O32-
1 6
n 0.030mol/L×18.00mL×10-3L/mL
n(KIO3)=0.09×10-3mol.每千克食盐中KIO3为
×1000mg/g
=45mg/kg.所以该加碘盐是合格的.
三、综合题
22.【答案】 (1)10﹣14;10﹣12;水的电离为吸热反应,升高温度促进水电离
(2)c(Na+)>c(A﹣)>c(OH﹣)>c(H+)
(3)1:9
(4)a+b=13
(5)2;10
四、推断题
23.【答案】 (1)漂白、杀菌、消毒、作为硫酸的原料等
(2)4NH3+6NO 5N2+6H2O
(3)Na2SiO3═2Na++SiO32﹣;Na2SiO3+CO2+H2O═Na2CO3+H2SiO3↓
五、实验探究题
24.【答案】 (1)HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol
(2)△H1=△H2<△H3
(3)-51.8kJ/mol
(4)不相等;相等
(5)D
同课章节目录
