氧气的实验室制法
图片预览

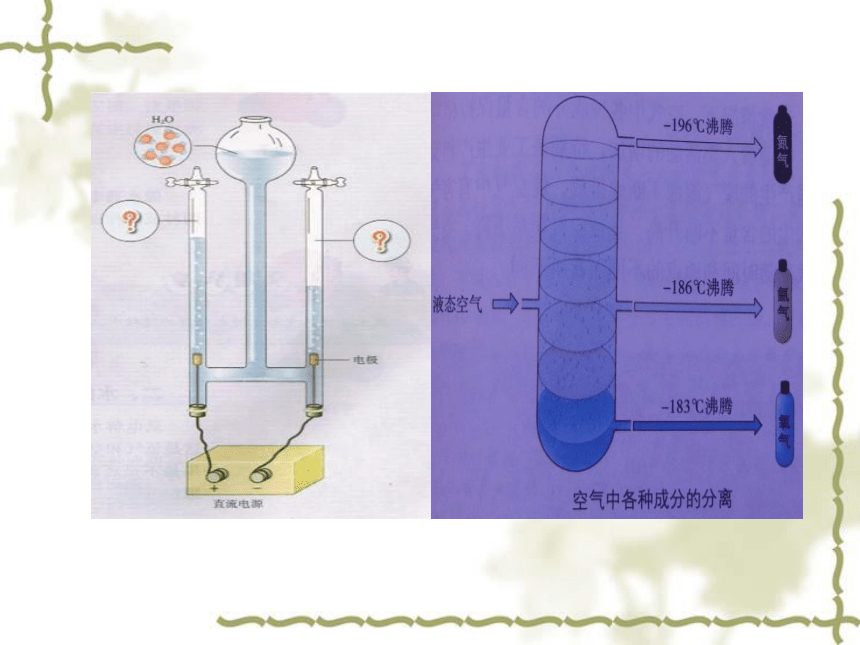



文档简介
课件19张PPT。
第四单元 第三节 氧气 第1课时
《氧气的实验室制法》 在实验室中我们怎样得到氧气呢?确定气体
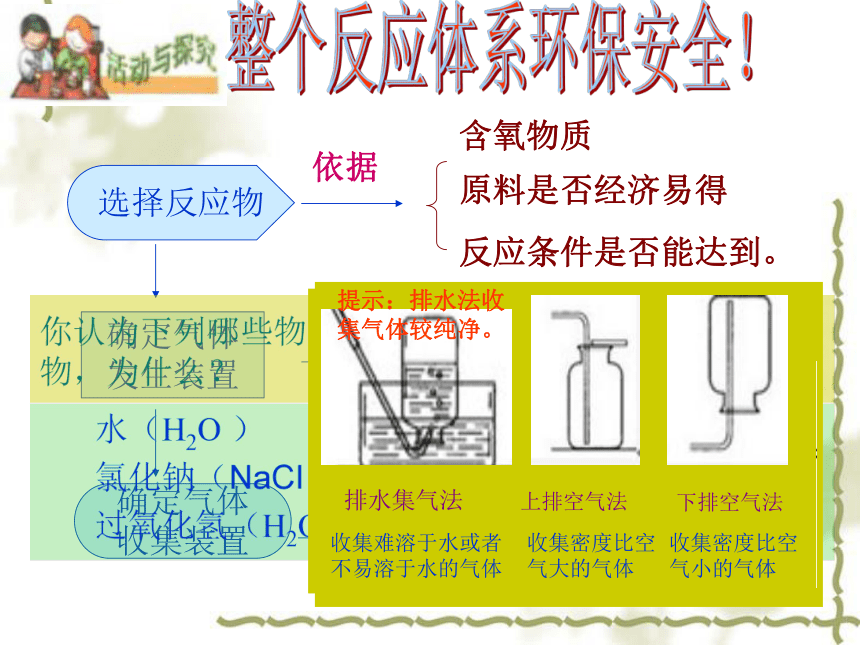
发生装置原料是否经济易得含氧物质选择反应物确定气体
收集装置气体发生装置容易装配容易控制实验条件气体密度水溶性整个反应体系环保安全!反应条件是否能达到。反应物状态排水集气法收集难溶于水或者不易溶于水的气体上排空气法收集密度比空气大的气体下排空气法收集密度比空气小的气体提示:排水法收集气体较纯净。
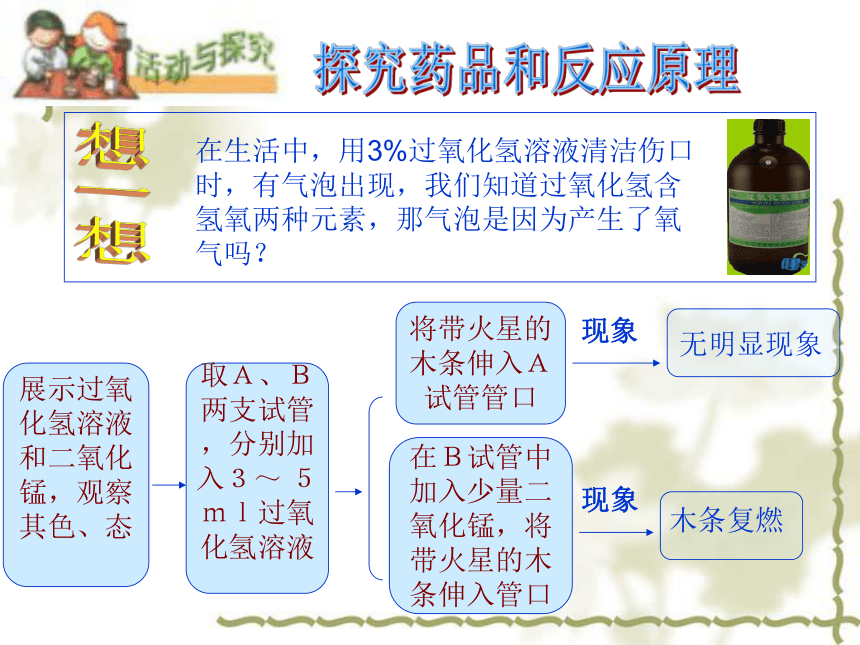
在生活中,用3%过氧化氢溶液清洁伤口时,有气泡出现,我们知道过氧化氢含氢氧两种元素,那气泡是因为产生了氧气吗?想一想探究药品和反应原理现象现象展示过氧
化氢溶液
和二氧化
锰,观察
其色、态
取A、B
两支试管
,分别加
入3~ 5
ml过氧
化氢溶液
将带火星的
木条伸入A
试管管口在B试管中
加入少量二
氧化锰,将
带火星的木
条伸入管口交流讨论:是什么物质产生的氧气?猜想:一、是过氧化氢产生的吗?二、是二氧化锰产生的吗?三、是过氧化氢和二氧化锰反应产生的吗?查阅资料:
1、过氧化氢(H2O2)溶液在常温或微热时就能分解产生氧气。
2、二氧化锰在加热到535℃也会分解。
3、酒精灯火焰温度一般在400 ℃~500℃。
4、过氧化氢生产能耗少,成本低,所用原料无毒害。结论:是过氧化氢产生的,实验室制取氧气通常选用过氧化氢溶液,在二氧化锰的作用下反应更快。交流与讨论 实验室通常用下图装置制取氧气,反应所需的过氧化氢溶液为什么要通过分液漏斗加入?用排水法收集氧气时应如何操作?制定实验步骤并进行实验安装好装置检查气密性装药品收集气体检验撤装置整理实验桌注意检查
方法1.验气
2.验满1.排水法
2.排空气法小结:过氧化氢溶液和二氧化锰混合可产生氧气,二氧化锰改变了过氧化氢溶液在常温时的反应速率,反应前后二氧化锰的化学性质没有改变,质量也没有增减。催化剂:能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
催化作用:催化剂所起的作用就是催化作用。4、要说某物质是催化剂,必须指明在哪个反应中。3、对某一个反应能起催化作用的,不一定只有一 种物质,也可能有多种物质。而一种催化剂也不一定只对一个反应起催化作用。 1、 过氧化氢制取氧气的反应,不使用催化剂时,反应仍能发生,使用催化剂,加快了化学反应速率。提醒注意2、催化剂的作用是加快或者减慢化学反应速率。知识拓展还有一些含有氧元素的物质,如高锰酸钾( KMnO4 )氯酸钾 (KClO3) 等也可以制氧气。 白色固体液体(或固-液)常温固体加热装置的选择依据反应物状态和反应条件ABCDA我们身边的催化剂多识一点我们的唾液里有大量的淀粉酶,是淀粉分解的催化剂。工业上生产硫酸使用五氧化二钒做催化剂。在灶具中加上催化燃烧剂,能使燃烧更充分。阅读课本第89页,形形色色的催化剂通过这节课的学习,你知道了什么?2.图2-11所示的装置,其中收集氧气时可选用( ) A.①和② B.②和③ C.①和④ D.①和⑤反馈练习1.下列物质不能用来制氧气的是 ( )
(A)二氧化锰 (B)过氧化氢
(C)氯化钠 (D)氧化镁CD4.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
(A)加热固体药品前
(B)与加热固体药品同时
(C)开始有气泡放出时
(D)气泡连续并均匀放出时D3、在化学反应中,催化剂( )
A.质量减少 B.能改变化学反应的速率
C.质量增加 D.在化学反应后化学性质发生了变化B请你设计一套实验室制取氧气的装置,画出装置图,写出化学反应原理和实验步骤。作业布置 根据你选的反应物
的状态和反应条件希望同学们这节课轻松愉快!
第四单元 第三节 氧气 第1课时
《氧气的实验室制法》 在实验室中我们怎样得到氧气呢?确定气体
发生装置原料是否经济易得含氧物质选择反应物确定气体
收集装置气体发生装置容易装配容易控制实验条件气体密度水溶性整个反应体系环保安全!反应条件是否能达到。反应物状态排水集气法收集难溶于水或者不易溶于水的气体上排空气法收集密度比空气大的气体下排空气法收集密度比空气小的气体提示:排水法收集气体较纯净。
在生活中,用3%过氧化氢溶液清洁伤口时,有气泡出现,我们知道过氧化氢含氢氧两种元素,那气泡是因为产生了氧气吗?想一想探究药品和反应原理现象现象展示过氧
化氢溶液
和二氧化
锰,观察
其色、态
取A、B
两支试管
,分别加
入3~ 5
ml过氧
化氢溶液
将带火星的
木条伸入A
试管管口在B试管中
加入少量二
氧化锰,将
带火星的木
条伸入管口交流讨论:是什么物质产生的氧气?猜想:一、是过氧化氢产生的吗?二、是二氧化锰产生的吗?三、是过氧化氢和二氧化锰反应产生的吗?查阅资料:
1、过氧化氢(H2O2)溶液在常温或微热时就能分解产生氧气。
2、二氧化锰在加热到535℃也会分解。
3、酒精灯火焰温度一般在400 ℃~500℃。
4、过氧化氢生产能耗少,成本低,所用原料无毒害。结论:是过氧化氢产生的,实验室制取氧气通常选用过氧化氢溶液,在二氧化锰的作用下反应更快。交流与讨论 实验室通常用下图装置制取氧气,反应所需的过氧化氢溶液为什么要通过分液漏斗加入?用排水法收集氧气时应如何操作?制定实验步骤并进行实验安装好装置检查气密性装药品收集气体检验撤装置整理实验桌注意检查
方法1.验气
2.验满1.排水法
2.排空气法小结:过氧化氢溶液和二氧化锰混合可产生氧气,二氧化锰改变了过氧化氢溶液在常温时的反应速率,反应前后二氧化锰的化学性质没有改变,质量也没有增减。催化剂:能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
催化作用:催化剂所起的作用就是催化作用。4、要说某物质是催化剂,必须指明在哪个反应中。3、对某一个反应能起催化作用的,不一定只有一 种物质,也可能有多种物质。而一种催化剂也不一定只对一个反应起催化作用。 1、 过氧化氢制取氧气的反应,不使用催化剂时,反应仍能发生,使用催化剂,加快了化学反应速率。提醒注意2、催化剂的作用是加快或者减慢化学反应速率。知识拓展还有一些含有氧元素的物质,如高锰酸钾( KMnO4 )氯酸钾 (KClO3) 等也可以制氧气。 白色固体液体(或固-液)常温固体加热装置的选择依据反应物状态和反应条件ABCDA我们身边的催化剂多识一点我们的唾液里有大量的淀粉酶,是淀粉分解的催化剂。工业上生产硫酸使用五氧化二钒做催化剂。在灶具中加上催化燃烧剂,能使燃烧更充分。阅读课本第89页,形形色色的催化剂通过这节课的学习,你知道了什么?2.图2-11所示的装置,其中收集氧气时可选用( ) A.①和② B.②和③ C.①和④ D.①和⑤反馈练习1.下列物质不能用来制氧气的是 ( )
(A)二氧化锰 (B)过氧化氢
(C)氯化钠 (D)氧化镁CD4.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
(A)加热固体药品前
(B)与加热固体药品同时
(C)开始有气泡放出时
(D)气泡连续并均匀放出时D3、在化学反应中,催化剂( )
A.质量减少 B.能改变化学反应的速率
C.质量增加 D.在化学反应后化学性质发生了变化B请你设计一套实验室制取氧气的装置,画出装置图,写出化学反应原理和实验步骤。作业布置 根据你选的反应物
的状态和反应条件希望同学们这节课轻松愉快!
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
