1.3常见的酸 练习题(含答案)
图片预览


文档简介
1.3 常见的酸
一、选择题
1.实验操作要注意安全,如果浓硫酸不慎飞溅到皮肤上我们可以用大量的( )冲洗, 最后用小苏打冲洗。
A.水 B.氢氧化钠溶液 C.稀盐酸 D.氯化钡溶液
2.除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是( )
选项 待提纯的物质 选用的试剂 操作方法
A MnO2(KCl) 水 溶解、过滤、结晶
B CO2(CO) 氧气 点燃
C Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥
D CuSO4(H2SO4) 氢氧化钠溶液 过滤
A.A B.B C.C D.D
3.“白醋”是食用醋之一,它是醋酸的稀溶液,小强准备在家中用实验的方法验证“白醋”具有酸的性质。请你说出小强选用实验试剂不正确的是:( )
A.食盐 B.纯碱 C.铁钉 D.石灰石
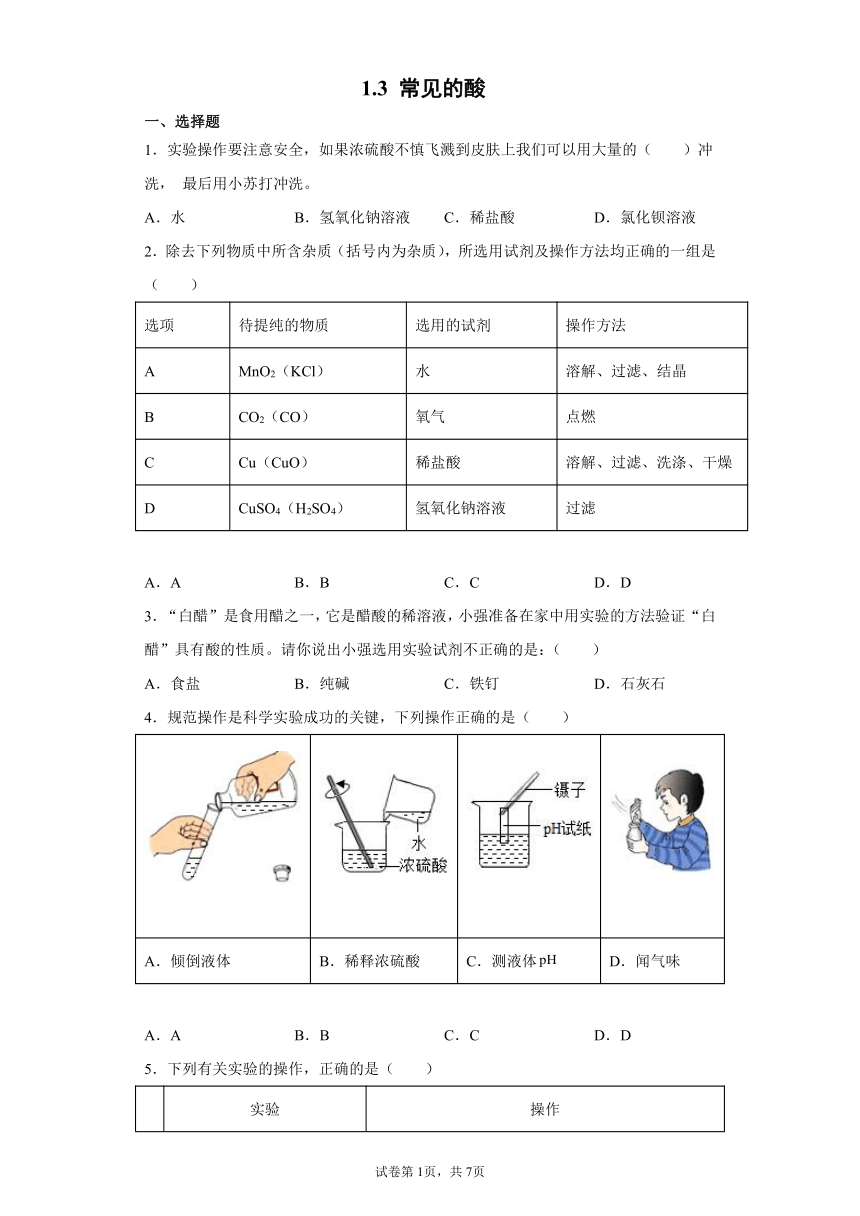
4.规范操作是科学实验成功的关键,下列操作正确的是( )
A.倾倒液体 B.稀释浓硫酸 C.测液体 D.闻气味
A.A B.B C.C D.D
5.下列有关实验的操作,正确的是( )
实验 操作
A 稀释浓硫酸 先将浓硫酸加入烧杯中,后沿烧杯壁注入蒸馏水
B 测溶液的 用洁净的玻璃棒蘸取被测溶液滴在试纸上,显色后与标准比色卡对照读出值
C 稀盐酸与石灰石反应制取纯净的 气体产物先通过浓硫酸,后通过硝酸银溶液
D 探究露置于空气中的氢氧化钠溶液是否变质 取少量溶液,向溶液中滴加酚酞试液
A.A B.B C.C D.D
6.硫酸是一种常见的酸。下列关于硫酸的说法中,正确的是( )
A.组成:硫酸溶液中有和两种微粒,且数目相同
B.性质:能与碱、多种金属和、等非金属氧化物反应
C.用途:可用于清除铁表面的氧化铁和生产化肥硫酸铵
D.检验:滴入氯化钡溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解
7.将稀硫酸分别滴入下列物质中,无明显现象的是( )
A.镁条 B.铜丝 C.BaCl2溶液 D.Na2CO3溶液
8.某课外兴趣小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成如图的函数图像,其中横坐标表示时间,纵坐标可以表示:①溶质的质量分数;②溶液的质量;③溶液的体积;④溶液中所含水的质量。其中正确的是( )
A.①② B.②③ C.②③④ D.①②③④
9.生锈(铁锈的主要成分是Fe2O3)的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内压强随时间的变化曲线如图所示。下列分析正确的是( )
A.ab段的化学反应:Fe+2HCl=FeCl2+H2↑
B.bc段的化学反应:Fe2O3+6HCl=2FeCl3+3H2O
C.影响cd段压强变化的主要因素是温度
D.d点时恰好完全反应,且d点温度高于a点
10.在稀硫酸除铁锈的实验中,发现生锈的铁钉表面有一些气泡产生。小明猜想气泡是硫酸与铁反应生成的,为了验证猜想,他应选择以下哪几个实验进行验证
A.①② B.①②③ C.①②④ D.①②③④
11.有一食品包装说明书中注明防腐剂是苯甲酸(C6H5COOH),小徐同学查资料得知苯甲酸的酸性比醋酸强,可用做食品防腐剂,下列对苯甲酸性质的推测中不合理的是( )
A.相同浓度的苯甲酸溶液的pH比醋酸的pH大
B.苯甲酸溶液的pH小于7
C.苯甲酸溶液能使紫色石蕊试液变红
D.苯甲酸溶液不能使无色酚酞试液变色
12.小科按图示操作进行酸的性质实验,下列有关分析正确的是
A.若X是稀硫酸,则a可能是紫色石蕊试液
B.若X是稀硫酸,则d一定是CuO固体
C.若X是稀盐酸,则c一定是单质
D.若b是Fe2O3,则黄色溶液一定是氯化铁
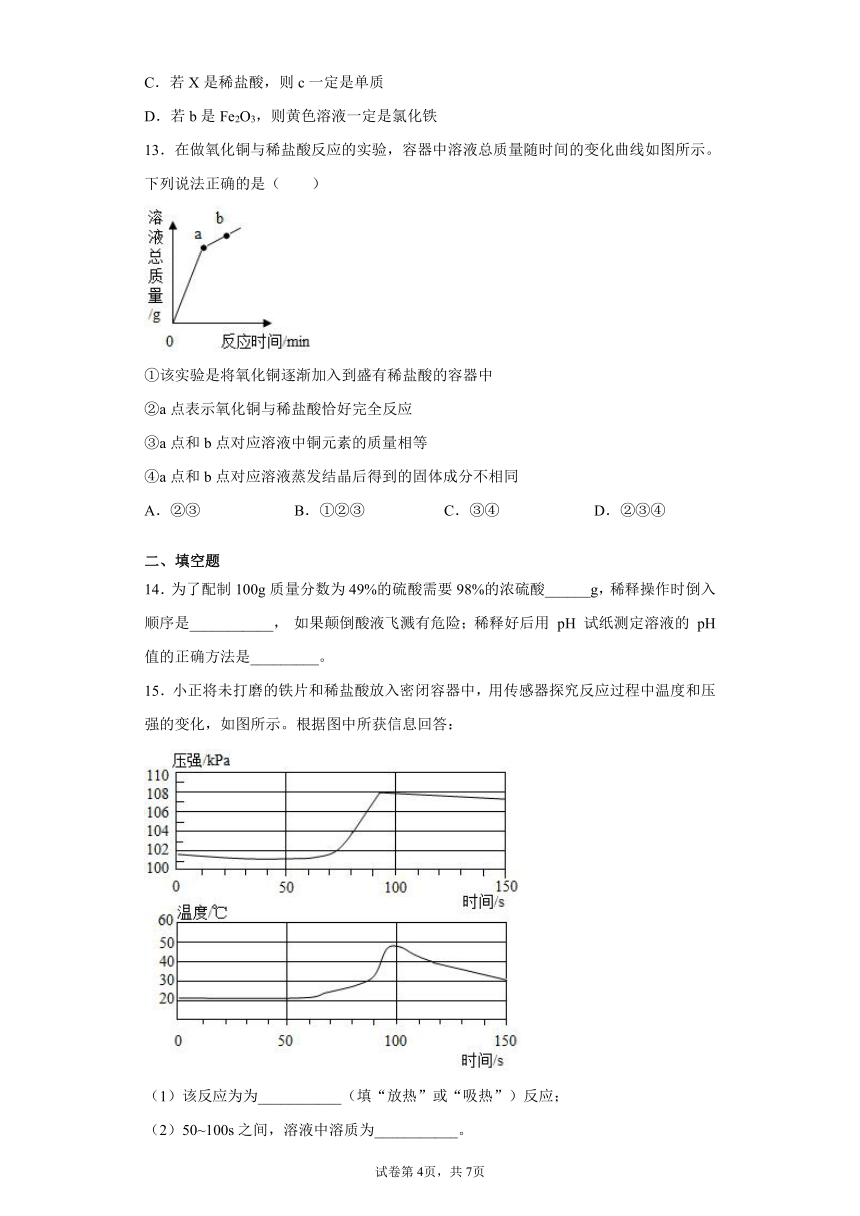
13.在做氧化铜与稀盐酸反应的实验,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是( )
①该实验是将氧化铜逐渐加入到盛有稀盐酸的容器中
②a点表示氧化铜与稀盐酸恰好完全反应
③a点和b点对应溶液中铜元素的质量相等
④a点和b点对应溶液蒸发结晶后得到的固体成分不相同
A.②③ B.①②③ C.③④ D.②③④
二、填空题
14.为了配制100g质量分数为49%的硫酸需要98%的浓硫酸______g,稀释操作时倒入顺序是___________, 如果颠倒酸液飞溅有危险;稀释好后用 pH 试纸测定溶液的 pH值的正确方法是_________。
15.小正将未打磨的铁片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如图所示。根据图中所获信息回答:
(1)该反应为为___________(填“放热”或“吸热”)反应;
(2)50~100s之间,溶液中溶质为___________。
16.小宁为验证稀硫酸的化学性质,分别将铁、氢氧化钠、氧化铜和氯化钡等固体药品加入到四支盛有稀硫酸的试管中。
(1)如图所示为加入某种固体药品后,溶液中主要离子种类及个数比变化的示意图(不考虑离子的大小关系),其中表示___________,表示___________(填离子符号)。则加入的固体药品可能是___________(填写序号)。
A.铁 B.氢氧化钠 C.氧化铜 D.氯化钡
(2)反应后的四支试管中只有一支为无色溶液,小宁只向试管中加入一种试剂就确定了溶质的成分,则加入的试剂及判断方法为___________。
17.将一定质量的浓盐酸盛于烧杯中,敞口放置在实验室安全之处。
(1)浓盐酸的质量和放置天数关系的曲线正确的是_______(填“甲”或“乙”)。
(2)把浓盐酸稀释后可用于去除铁制品表面的铁锈,去除铁锈的实验现象是_______。
三、探究题
18.为探究盐酸的化学性质,某化学小组做了如下实验:
(1)上述反应中无现象的为___________(填字母序号,下同),B试管中所发生反应的化学方程式为___________,C试管中发生的现象是___________。
(2)将反应后D和E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(假设与猜想)猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:NaCl、Ca(OH)2和HCl
猜想四:___________。
(讨论与交流)经讨论同学们一致认为猜想___________是错误的。
(实验与结论)
实验步骤 实验现象 实验结论
取少量滤液于试管中,滴加适量碳酸钠溶液 无现象 猜想四成立
取少量滤液于试管中,滴加适量___________ ___________
(拓展与迁移)稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在___________
19.利用如图所示实验装置(气密性良好),验证浓硫酸、浓盐酸的挥发性。其中甲、乙、丙三个广口瓶中依次装有浓硫酸、浓氨水、浓盐酸。已知:;为白色固体。
试验步骤 实验操作 实验现象
① 打开K1,关闭K2,缓慢拉注射器A活塞 甲中液面上方无明显现象
② 打开K2,关闭K1,缓慢拉注射器B活塞 丙中液面上方出现大量白烟
(1)该实验能够得出的结论是___________。
(2)若丙中发生化合反应,则白烟中物质的化学式为___________;从微观角度解释丙中出现白烟的原因是___________。
四、简答题
20.环保部门对一造纸厂排放的污水进行检测,发现其主要污染物为NaOH。为了测定污水中氢氧化钠的含量,他们首先把10g溶质质量分数为98%的浓硫酸稀释为质量分数为10%的稀硫酸,然后取100g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应)
(1)为了防止发生事故,在稀释浓硫酸时,正确的操作是:一定要将______沿着烧杯壁慢慢注入盛另一种液体的烧杯中, 并不断搅拌,使热量迅速扩散。
(2)把10g上述浓硫酸稀释为质量分数为10%的稀硫酸,所需水的质量是多少?
(3)污水中所含NaOH的质量分数是多少?
21.向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算:
(1)稀硫酸反应完时,产生氢气的质量为_______g
(2)消耗金属锌的质量是多少克_______?
(3)反应结束时溶液溶质的质量分数_______
试卷第1页,共3页
试卷第1页,共3页
参考答案
1-5 ACADB 6-10CBCCC 11-13AAA
14.50 把浓硫酸倒入水中 正确方法是用洁净的玻璃棒蘸取被测液体,滴在试纸上将显示的颜色与标准比色卡进行比较
15.放热 FeCl3、 FeCl2、 HCl
16.H+ SO42+ A,C 紫色石蕊试液,若石蕊试液变红,则溶质为Na2SO4和H2SO4;若石蕊试液为紫色,则溶质为Na2SO4;若石蕊试液变蓝,则溶质为Na2SO4和NaOH。
17.乙 红色固体逐渐减少,溶液变成黄色
18.D Fe+2HCl=FeCl2+H2↑ 固体消失,溶液变成黄色 NaCl和Na2CO3 三 稀盐酸 有气泡冒出 H+
19.盐酸易挥发,硫酸不易挥发 NH4Cl 分子是不断运动的,氨气分子和氯化氢分子相遇结合生成氯化铵
20.(1)浓硫酸;
(2)稀释稀硫酸的质量=,
所需水的质量=;
(3)设污水中所含NaOH的质量为x
x=4g
污水中所含NaOH的质量分数=
21.0.2 设参加反应锌的质量为x,生成硫酸锌的质量为y
解得:x=6.5g y=16.1g
消耗金属锌的质量是6.5g 反应结束时溶液溶质的质量分数=
答案第1页,共2页
一、选择题
1.实验操作要注意安全,如果浓硫酸不慎飞溅到皮肤上我们可以用大量的( )冲洗, 最后用小苏打冲洗。
A.水 B.氢氧化钠溶液 C.稀盐酸 D.氯化钡溶液
2.除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是( )
选项 待提纯的物质 选用的试剂 操作方法
A MnO2(KCl) 水 溶解、过滤、结晶
B CO2(CO) 氧气 点燃
C Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥
D CuSO4(H2SO4) 氢氧化钠溶液 过滤
A.A B.B C.C D.D
3.“白醋”是食用醋之一,它是醋酸的稀溶液,小强准备在家中用实验的方法验证“白醋”具有酸的性质。请你说出小强选用实验试剂不正确的是:( )
A.食盐 B.纯碱 C.铁钉 D.石灰石
4.规范操作是科学实验成功的关键,下列操作正确的是( )
A.倾倒液体 B.稀释浓硫酸 C.测液体 D.闻气味
A.A B.B C.C D.D
5.下列有关实验的操作,正确的是( )
实验 操作
A 稀释浓硫酸 先将浓硫酸加入烧杯中,后沿烧杯壁注入蒸馏水
B 测溶液的 用洁净的玻璃棒蘸取被测溶液滴在试纸上,显色后与标准比色卡对照读出值
C 稀盐酸与石灰石反应制取纯净的 气体产物先通过浓硫酸,后通过硝酸银溶液
D 探究露置于空气中的氢氧化钠溶液是否变质 取少量溶液,向溶液中滴加酚酞试液
A.A B.B C.C D.D
6.硫酸是一种常见的酸。下列关于硫酸的说法中,正确的是( )
A.组成:硫酸溶液中有和两种微粒,且数目相同
B.性质:能与碱、多种金属和、等非金属氧化物反应
C.用途:可用于清除铁表面的氧化铁和生产化肥硫酸铵
D.检验:滴入氯化钡溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解
7.将稀硫酸分别滴入下列物质中,无明显现象的是( )
A.镁条 B.铜丝 C.BaCl2溶液 D.Na2CO3溶液
8.某课外兴趣小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成如图的函数图像,其中横坐标表示时间,纵坐标可以表示:①溶质的质量分数;②溶液的质量;③溶液的体积;④溶液中所含水的质量。其中正确的是( )
A.①② B.②③ C.②③④ D.①②③④
9.生锈(铁锈的主要成分是Fe2O3)的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内压强随时间的变化曲线如图所示。下列分析正确的是( )
A.ab段的化学反应:Fe+2HCl=FeCl2+H2↑
B.bc段的化学反应:Fe2O3+6HCl=2FeCl3+3H2O
C.影响cd段压强变化的主要因素是温度
D.d点时恰好完全反应,且d点温度高于a点
10.在稀硫酸除铁锈的实验中,发现生锈的铁钉表面有一些气泡产生。小明猜想气泡是硫酸与铁反应生成的,为了验证猜想,他应选择以下哪几个实验进行验证
A.①② B.①②③ C.①②④ D.①②③④
11.有一食品包装说明书中注明防腐剂是苯甲酸(C6H5COOH),小徐同学查资料得知苯甲酸的酸性比醋酸强,可用做食品防腐剂,下列对苯甲酸性质的推测中不合理的是( )
A.相同浓度的苯甲酸溶液的pH比醋酸的pH大
B.苯甲酸溶液的pH小于7
C.苯甲酸溶液能使紫色石蕊试液变红
D.苯甲酸溶液不能使无色酚酞试液变色
12.小科按图示操作进行酸的性质实验,下列有关分析正确的是
A.若X是稀硫酸,则a可能是紫色石蕊试液
B.若X是稀硫酸,则d一定是CuO固体
C.若X是稀盐酸,则c一定是单质
D.若b是Fe2O3,则黄色溶液一定是氯化铁
13.在做氧化铜与稀盐酸反应的实验,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是( )
①该实验是将氧化铜逐渐加入到盛有稀盐酸的容器中
②a点表示氧化铜与稀盐酸恰好完全反应
③a点和b点对应溶液中铜元素的质量相等
④a点和b点对应溶液蒸发结晶后得到的固体成分不相同
A.②③ B.①②③ C.③④ D.②③④
二、填空题
14.为了配制100g质量分数为49%的硫酸需要98%的浓硫酸______g,稀释操作时倒入顺序是___________, 如果颠倒酸液飞溅有危险;稀释好后用 pH 试纸测定溶液的 pH值的正确方法是_________。
15.小正将未打磨的铁片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如图所示。根据图中所获信息回答:
(1)该反应为为___________(填“放热”或“吸热”)反应;
(2)50~100s之间,溶液中溶质为___________。
16.小宁为验证稀硫酸的化学性质,分别将铁、氢氧化钠、氧化铜和氯化钡等固体药品加入到四支盛有稀硫酸的试管中。
(1)如图所示为加入某种固体药品后,溶液中主要离子种类及个数比变化的示意图(不考虑离子的大小关系),其中表示___________,表示___________(填离子符号)。则加入的固体药品可能是___________(填写序号)。
A.铁 B.氢氧化钠 C.氧化铜 D.氯化钡
(2)反应后的四支试管中只有一支为无色溶液,小宁只向试管中加入一种试剂就确定了溶质的成分,则加入的试剂及判断方法为___________。
17.将一定质量的浓盐酸盛于烧杯中,敞口放置在实验室安全之处。
(1)浓盐酸的质量和放置天数关系的曲线正确的是_______(填“甲”或“乙”)。
(2)把浓盐酸稀释后可用于去除铁制品表面的铁锈,去除铁锈的实验现象是_______。
三、探究题
18.为探究盐酸的化学性质,某化学小组做了如下实验:
(1)上述反应中无现象的为___________(填字母序号,下同),B试管中所发生反应的化学方程式为___________,C试管中发生的现象是___________。
(2)将反应后D和E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(假设与猜想)猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:NaCl、Ca(OH)2和HCl
猜想四:___________。
(讨论与交流)经讨论同学们一致认为猜想___________是错误的。
(实验与结论)
实验步骤 实验现象 实验结论
取少量滤液于试管中,滴加适量碳酸钠溶液 无现象 猜想四成立
取少量滤液于试管中,滴加适量___________ ___________
(拓展与迁移)稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在___________
19.利用如图所示实验装置(气密性良好),验证浓硫酸、浓盐酸的挥发性。其中甲、乙、丙三个广口瓶中依次装有浓硫酸、浓氨水、浓盐酸。已知:;为白色固体。
试验步骤 实验操作 实验现象
① 打开K1,关闭K2,缓慢拉注射器A活塞 甲中液面上方无明显现象
② 打开K2,关闭K1,缓慢拉注射器B活塞 丙中液面上方出现大量白烟
(1)该实验能够得出的结论是___________。
(2)若丙中发生化合反应,则白烟中物质的化学式为___________;从微观角度解释丙中出现白烟的原因是___________。
四、简答题
20.环保部门对一造纸厂排放的污水进行检测,发现其主要污染物为NaOH。为了测定污水中氢氧化钠的含量,他们首先把10g溶质质量分数为98%的浓硫酸稀释为质量分数为10%的稀硫酸,然后取100g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应)
(1)为了防止发生事故,在稀释浓硫酸时,正确的操作是:一定要将______沿着烧杯壁慢慢注入盛另一种液体的烧杯中, 并不断搅拌,使热量迅速扩散。
(2)把10g上述浓硫酸稀释为质量分数为10%的稀硫酸,所需水的质量是多少?
(3)污水中所含NaOH的质量分数是多少?
21.向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算:
(1)稀硫酸反应完时,产生氢气的质量为_______g
(2)消耗金属锌的质量是多少克_______?
(3)反应结束时溶液溶质的质量分数_______
试卷第1页,共3页
试卷第1页,共3页
参考答案
1-5 ACADB 6-10CBCCC 11-13AAA
14.50 把浓硫酸倒入水中 正确方法是用洁净的玻璃棒蘸取被测液体,滴在试纸上将显示的颜色与标准比色卡进行比较
15.放热 FeCl3、 FeCl2、 HCl
16.H+ SO42+ A,C 紫色石蕊试液,若石蕊试液变红,则溶质为Na2SO4和H2SO4;若石蕊试液为紫色,则溶质为Na2SO4;若石蕊试液变蓝,则溶质为Na2SO4和NaOH。
17.乙 红色固体逐渐减少,溶液变成黄色
18.D Fe+2HCl=FeCl2+H2↑ 固体消失,溶液变成黄色 NaCl和Na2CO3 三 稀盐酸 有气泡冒出 H+
19.盐酸易挥发,硫酸不易挥发 NH4Cl 分子是不断运动的,氨气分子和氯化氢分子相遇结合生成氯化铵
20.(1)浓硫酸;
(2)稀释稀硫酸的质量=,
所需水的质量=;
(3)设污水中所含NaOH的质量为x
x=4g
污水中所含NaOH的质量分数=
21.0.2 设参加反应锌的质量为x,生成硫酸锌的质量为y
解得:x=6.5g y=16.1g
消耗金属锌的质量是6.5g 反应结束时溶液溶质的质量分数=
答案第1页,共2页
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
