第3章 物质的性质与转化 第3节第2课时氨的转化与生成课件2021-2022学年上学期高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第3章 物质的性质与转化 第3节第2课时氨的转化与生成课件2021-2022学年上学期高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1012.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-11 09:06:20 | ||
图片预览







文档简介
(共25张PPT)
第3节 氮的循环
第2课时 氨的转化与生成
学习目标
1、了解氨气和铵盐的主要性质,认识其在生产中的应用。
2、 掌握NH3的检验方法和NH3的实验室制备方法。
首次利用空气中的N2合成氨气并应用于氮肥工业。成为解救世界粮食危机的化学天才
建立了世界上第一支毒气部队(Cl2),整个一战中有130万人受到化学战的伤害,其中有9万人死亡
天使还是魔鬼?
1918年德国化学家哈伯被授予诺贝尔化学奖
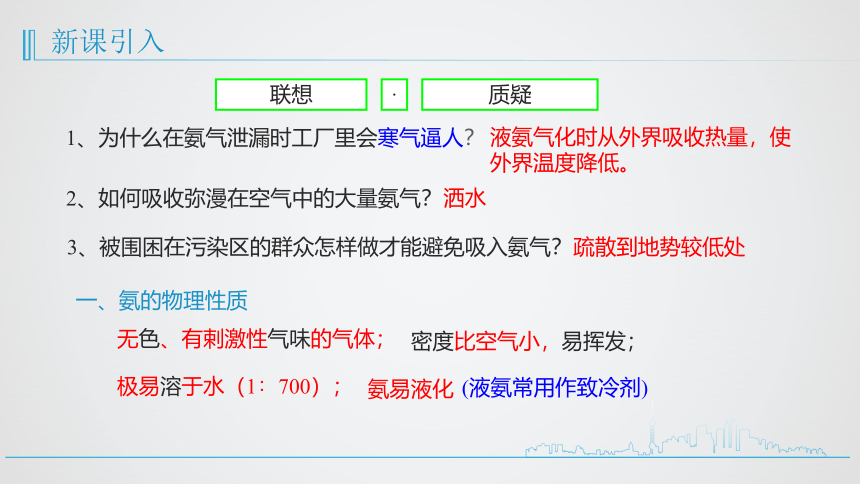
新课引入
直击
·
现场
2004年4月20日上午10时杭州市一制冷车间发生氨气泄漏事件,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,有大量白雾,厂区内寒气逼人。
市消防中心接到报案后立即制定方案,出动上百名消防队员,十余量消防车进行喷水作业?
新课引入
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能避免吸入氨气?
液氨气化时从外界吸收热量,使外界温度降低。
洒水
疏散到地势较低处
联想
·
质疑
新课引入
一、氨的物理性质
无色、有剌激性气味的气体;
密度比空气小,易挥发;
极易溶于水(1∶700);
(液氨常用作致冷剂)
氨易液化
二、氨的化学性质
(1)与水反应
一水合氨---弱碱
①不稳定,受热易分解
② 显碱性,酚酞变红或湿润红色石蕊试纸变蓝
检验氨气方法
常见气体中唯一的一种碱性气体
氨水(NH3溶于水)
知识拓展
1、氨水的成分
H2O、NH3、NH3·H2O、
2、氨水的性质
、OH- 、H+(极少)
NH3 + H2O NH3·H2O
+ OH-
NH3·H2O
NH3·H2O NH3↑+H2O
氨的转化与生成
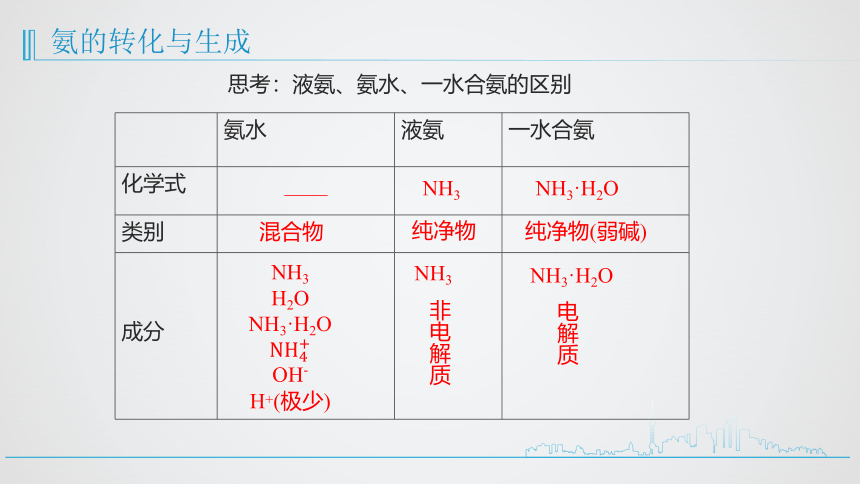
思考:液氨、氨水、一水合氨的区别
氨水 液氨 一水合氨
化学式
类别
成分
——
NH3
NH3·H2O
混合物
纯净物
纯净物(弱碱)
NH3
H2O
NH3·H2O
OH-
H+(极少)
NH3
NH3·H2O
非电解质
电解质
氨的转化与生成
实验1:喷泉实验
现象:烧杯里的溶液由玻璃管进入烧瓶,形成喷泉,烧瓶内的液体呈红色。
氨气
水
含有酚酞溶液的水
氨的转化与生成
(1)引发喷泉的操作是什么?为什么会形成喷泉?
挤压胶头滴管,使水进入烧瓶,打开止水夹。
由于氨气极易溶于水;氨气溶于水后,使得烧瓶内的压强减小;烧杯内的液体被压入烧瓶内形成喷泉。
(2)为什么烧瓶内液体呈红色?
氨气与水反应生成碱性物质,酚酞试液变红。
思考:
氨的转化与生成
(4)用氨做喷泉实验,结果实验失败,请你分析实验失败的可能原因?
氨气中含有大量的空气
收集氨气的烧瓶潮湿
装置漏气
(3)若所给装置没有胶头滴管应当如何引发?
先打开止水夹,然后用热毛巾捂住烧瓶。
氨的转化与生成
烧瓶中的气体减少,烧瓶内外产生压强差
NH3 HCl SO2 Cl2 CO2
700 500 40 2 1
(6)设计喷泉实验,可选用那些气体?
a. 易溶于水气体与水的组合:
NH3、HCl、SO2可与水配组成喷泉
b. 气体与溶液容易发生反应的组合:
CO2、Cl2等可以与NaOH溶液搭配组成喷泉
知识拓展
1体积水能溶解气体的体积
(5)喷泉实验成功的关键:
氨的转化与生成
1、能形成喷泉实验且最终几乎充满烧瓶的是下面哪一组( )
气体
液体
A
NO2
水
B
CO2
NaOH溶液
C
Cl2
饱和NaCl溶液
D
HCl
水
【随堂练习】
BD
氨的转化与生成
(2)与酸的反应
NH3 + HCl === NH4Cl
蘸有浓氨水和蘸有浓盐酸的玻璃棒相互靠近
思考:将浓盐酸改为浓硫酸、浓硝酸也会产生白烟吗?
在空气中相遇形成白烟
2NH3 + H2SO4 === (NH4)2SO4
NH3 + HNO3 === NH4NO3
与HCl、H2SO4、HNO3反应得铵盐
实验2:
浓氨水、浓盐酸、浓硝酸有挥发性,玻璃棒相互靠近而不接触时就有白烟,浓硫酸和氨气反应不产生白烟。
氨的转化与生成
(3)与氧气的反应:
4NH3 + 5O2 4NO + 6H2O
催化剂
△
还原剂
2、 写出工业上以N2为原料生产HNO3相关化学方程式。
2NO +O2 === 2NO2
3NO2 +H2O === 2HNO3 +NO
-3
+2
氧化产物
【随堂练习】
N2 + 3H2 2NH3
高温、高压
催化剂
4NH3 + 5O2 4NO + 6H2O
催化剂
△
氨的转化与生成
三、氨气的生成
(1)实验表明,通过加热碳酸氢铵、氯化铵等铵盐能够产生氨气。
方程式:
现象:
结论:
NH4Cl === NH3+ HCl
△
实验1:加热NH4Cl
固体逐渐减少,在试管上端内壁上有白色固体附着
受热时,氯化铵分解生成NH3、HCl;
冷却时,两者在管口又重新结合生成NH4Cl
氯化铵受热分解过程和碘的升华过程相同吗
NH4Cl由固体到气体,实际经历了化学变化,而I2的升华只是物质状态变化,是物理变化。
氨的转化与生成
方程式:
现象:
结论:
实验2:加热NH4HCO3
NH4HCO3 === NH3↑+CO2 ↑ + H2O
△
NH4HCO3分解产生NH3
试管中固体逐渐减少,试纸变蓝
是不是所有铵盐加热都生成NH3?
NH4NO3
氨的转化与生成
(2)与碱反应
方程式:
现象:
结论:
实验3:加热NH4Cl固体和NaOH溶液
+OH- === NH3↑ + H2O
△
NH4Cl和NaOH反应生成NH3
试管中产生刺激性气味气体,试纸变蓝
溶液中不加热?
=== NH3·H2O
、OH-不共存
不△ → NH3·H2O
△ → NH3
氨的转化与生成
药品:
NH4Cl晶体、Ca(OH)2固体
原理:
2NH4Cl+Ca(OH)2 === CaCl2+2H2O+2NH3↑
装置:
固+固,加热型(与氧气的制取装置相同)
收集:
向下排空气法
验满:
②蘸有浓HCl的玻璃棒接近
试管口产生白烟。
①湿润的红色石蕊试纸变蓝
(3)实验室制法
一定注意配平,
不要漏掉条件
a.试管口应该略向下倾斜
b.导管应该插入试管底部
防止对流,提高集气速度和纯度
c.棉花的作用:
氨的转化与生成
思考:(1)多余的氨气如何进行尾气处理?
水
CCl4
水
可以直接用水吸收,但要注意防止倒吸。
【随堂练习】
3、下列尾气处理装置中会引起倒吸的是( )
A
B
C
D
A
氨的转化与生成
(2)如何干燥氨气
碱石灰
无水CaCl2
浓硫酸
常见干燥剂
(NaOH和CaO的混合物)
知识拓展
浓硫酸和无水CaCl2均能与NH3反应
只有碱石灰可以干燥NH3
浓硫酸放在洗气瓶中
气体长管进短管出
碱石灰或无水CaCl2放在干燥管或U型管中
气体粗口进细口出
氨的转化与生成
(4)氨气的快速制法
①加热浓氨水
②将浓氨水滴到氢氧化钠固体(氧化钙、碱石灰)
(1)
(2)
氢氧化钠固体溶于水时,氧化钙与水反应时放热
NH3·H2O NH3↑+H2O
氨的转化与生成
4、试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是( )
A.加热,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的pH试纸放在试管口
C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
【随堂练习】
A
氨的转化与生成
(1)工业上:主要应用于氮肥工业和硝酸工业
铵态氮肥→主要成分
硝态氮肥→主要成分
有机态氮肥→尿素
(2)生活中:NH3沸点高易液化,常用作制冷剂。
四、氨的用途
氨的转化与生成
一、NH3的物理性质
无色、有刺激性气味的气体
比空气轻,易挥发
极易溶于水
二、NH3的化学性质
(1)NH3与水反应:
NH3 + H2O NH3·H2O + OH-
(2)NH3与酸反应:
NH3 + HCl === NH4Cl
(3)NH3与氧气反应:
4NH3 + 5O2 4NO + 6H2O
催化剂
△
三、NH3的生成
喷泉实验
小结
NH4Cl === NH3+ HCl
△
NH4HCO3 === NH3↑+CO2 ↑ + H2O
△
2NH4Cl+Ca(OH)2 === CaCl2+2H2O+2NH3↑
四、NH3的用途
本节内容结束
第3节 氮的循环
第2课时 氨的转化与生成
学习目标
1、了解氨气和铵盐的主要性质,认识其在生产中的应用。
2、 掌握NH3的检验方法和NH3的实验室制备方法。
首次利用空气中的N2合成氨气并应用于氮肥工业。成为解救世界粮食危机的化学天才
建立了世界上第一支毒气部队(Cl2),整个一战中有130万人受到化学战的伤害,其中有9万人死亡
天使还是魔鬼?
1918年德国化学家哈伯被授予诺贝尔化学奖
新课引入
直击
·
现场
2004年4月20日上午10时杭州市一制冷车间发生氨气泄漏事件,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,有大量白雾,厂区内寒气逼人。
市消防中心接到报案后立即制定方案,出动上百名消防队员,十余量消防车进行喷水作业?
新课引入
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能避免吸入氨气?
液氨气化时从外界吸收热量,使外界温度降低。
洒水
疏散到地势较低处
联想
·
质疑
新课引入
一、氨的物理性质
无色、有剌激性气味的气体;
密度比空气小,易挥发;
极易溶于水(1∶700);
(液氨常用作致冷剂)
氨易液化
二、氨的化学性质
(1)与水反应
一水合氨---弱碱
①不稳定,受热易分解
② 显碱性,酚酞变红或湿润红色石蕊试纸变蓝
检验氨气方法
常见气体中唯一的一种碱性气体
氨水(NH3溶于水)
知识拓展
1、氨水的成分
H2O、NH3、NH3·H2O、
2、氨水的性质
、OH- 、H+(极少)
NH3 + H2O NH3·H2O
+ OH-
NH3·H2O
NH3·H2O NH3↑+H2O
氨的转化与生成
思考:液氨、氨水、一水合氨的区别
氨水 液氨 一水合氨
化学式
类别
成分
——
NH3
NH3·H2O
混合物
纯净物
纯净物(弱碱)
NH3
H2O
NH3·H2O
OH-
H+(极少)
NH3
NH3·H2O
非电解质
电解质
氨的转化与生成
实验1:喷泉实验
现象:烧杯里的溶液由玻璃管进入烧瓶,形成喷泉,烧瓶内的液体呈红色。
氨气
水
含有酚酞溶液的水
氨的转化与生成
(1)引发喷泉的操作是什么?为什么会形成喷泉?
挤压胶头滴管,使水进入烧瓶,打开止水夹。
由于氨气极易溶于水;氨气溶于水后,使得烧瓶内的压强减小;烧杯内的液体被压入烧瓶内形成喷泉。
(2)为什么烧瓶内液体呈红色?
氨气与水反应生成碱性物质,酚酞试液变红。
思考:
氨的转化与生成
(4)用氨做喷泉实验,结果实验失败,请你分析实验失败的可能原因?
氨气中含有大量的空气
收集氨气的烧瓶潮湿
装置漏气
(3)若所给装置没有胶头滴管应当如何引发?
先打开止水夹,然后用热毛巾捂住烧瓶。
氨的转化与生成
烧瓶中的气体减少,烧瓶内外产生压强差
NH3 HCl SO2 Cl2 CO2
700 500 40 2 1
(6)设计喷泉实验,可选用那些气体?
a. 易溶于水气体与水的组合:
NH3、HCl、SO2可与水配组成喷泉
b. 气体与溶液容易发生反应的组合:
CO2、Cl2等可以与NaOH溶液搭配组成喷泉
知识拓展
1体积水能溶解气体的体积
(5)喷泉实验成功的关键:
氨的转化与生成
1、能形成喷泉实验且最终几乎充满烧瓶的是下面哪一组( )
气体
液体
A
NO2
水
B
CO2
NaOH溶液
C
Cl2
饱和NaCl溶液
D
HCl
水
【随堂练习】
BD
氨的转化与生成
(2)与酸的反应
NH3 + HCl === NH4Cl
蘸有浓氨水和蘸有浓盐酸的玻璃棒相互靠近
思考:将浓盐酸改为浓硫酸、浓硝酸也会产生白烟吗?
在空气中相遇形成白烟
2NH3 + H2SO4 === (NH4)2SO4
NH3 + HNO3 === NH4NO3
与HCl、H2SO4、HNO3反应得铵盐
实验2:
浓氨水、浓盐酸、浓硝酸有挥发性,玻璃棒相互靠近而不接触时就有白烟,浓硫酸和氨气反应不产生白烟。
氨的转化与生成
(3)与氧气的反应:
4NH3 + 5O2 4NO + 6H2O
催化剂
△
还原剂
2、 写出工业上以N2为原料生产HNO3相关化学方程式。
2NO +O2 === 2NO2
3NO2 +H2O === 2HNO3 +NO
-3
+2
氧化产物
【随堂练习】
N2 + 3H2 2NH3
高温、高压
催化剂
4NH3 + 5O2 4NO + 6H2O
催化剂
△
氨的转化与生成
三、氨气的生成
(1)实验表明,通过加热碳酸氢铵、氯化铵等铵盐能够产生氨气。
方程式:
现象:
结论:
NH4Cl === NH3+ HCl
△
实验1:加热NH4Cl
固体逐渐减少,在试管上端内壁上有白色固体附着
受热时,氯化铵分解生成NH3、HCl;
冷却时,两者在管口又重新结合生成NH4Cl
氯化铵受热分解过程和碘的升华过程相同吗
NH4Cl由固体到气体,实际经历了化学变化,而I2的升华只是物质状态变化,是物理变化。
氨的转化与生成
方程式:
现象:
结论:
实验2:加热NH4HCO3
NH4HCO3 === NH3↑+CO2 ↑ + H2O
△
NH4HCO3分解产生NH3
试管中固体逐渐减少,试纸变蓝
是不是所有铵盐加热都生成NH3?
NH4NO3
氨的转化与生成
(2)与碱反应
方程式:
现象:
结论:
实验3:加热NH4Cl固体和NaOH溶液
+OH- === NH3↑ + H2O
△
NH4Cl和NaOH反应生成NH3
试管中产生刺激性气味气体,试纸变蓝
溶液中不加热?
=== NH3·H2O
、OH-不共存
不△ → NH3·H2O
△ → NH3
氨的转化与生成
药品:
NH4Cl晶体、Ca(OH)2固体
原理:
2NH4Cl+Ca(OH)2 === CaCl2+2H2O+2NH3↑
装置:
固+固,加热型(与氧气的制取装置相同)
收集:
向下排空气法
验满:
②蘸有浓HCl的玻璃棒接近
试管口产生白烟。
①湿润的红色石蕊试纸变蓝
(3)实验室制法
一定注意配平,
不要漏掉条件
a.试管口应该略向下倾斜
b.导管应该插入试管底部
防止对流,提高集气速度和纯度
c.棉花的作用:
氨的转化与生成
思考:(1)多余的氨气如何进行尾气处理?
水
CCl4
水
可以直接用水吸收,但要注意防止倒吸。
【随堂练习】
3、下列尾气处理装置中会引起倒吸的是( )
A
B
C
D
A
氨的转化与生成
(2)如何干燥氨气
碱石灰
无水CaCl2
浓硫酸
常见干燥剂
(NaOH和CaO的混合物)
知识拓展
浓硫酸和无水CaCl2均能与NH3反应
只有碱石灰可以干燥NH3
浓硫酸放在洗气瓶中
气体长管进短管出
碱石灰或无水CaCl2放在干燥管或U型管中
气体粗口进细口出
氨的转化与生成
(4)氨气的快速制法
①加热浓氨水
②将浓氨水滴到氢氧化钠固体(氧化钙、碱石灰)
(1)
(2)
氢氧化钠固体溶于水时,氧化钙与水反应时放热
NH3·H2O NH3↑+H2O
氨的转化与生成
4、试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是( )
A.加热,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的pH试纸放在试管口
C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
【随堂练习】
A
氨的转化与生成
(1)工业上:主要应用于氮肥工业和硝酸工业
铵态氮肥→主要成分
硝态氮肥→主要成分
有机态氮肥→尿素
(2)生活中:NH3沸点高易液化,常用作制冷剂。
四、氨的用途
氨的转化与生成
一、NH3的物理性质
无色、有刺激性气味的气体
比空气轻,易挥发
极易溶于水
二、NH3的化学性质
(1)NH3与水反应:
NH3 + H2O NH3·H2O + OH-
(2)NH3与酸反应:
NH3 + HCl === NH4Cl
(3)NH3与氧气反应:
4NH3 + 5O2 4NO + 6H2O
催化剂
△
三、NH3的生成
喷泉实验
小结
NH4Cl === NH3+ HCl
△
NH4HCO3 === NH3↑+CO2 ↑ + H2O
△
2NH4Cl+Ca(OH)2 === CaCl2+2H2O+2NH3↑
四、NH3的用途
本节内容结束
