第2章第1节第1课时 烷烃的结构和性质 课件 2021-2022学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第2章第1节第1课时 烷烃的结构和性质 课件 2021-2022学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-11 11:00:20 | ||
图片预览






文档简介
(共21张PPT)
第2章 烃
第一节 烷烃
第1课时 烷烃的结构和性质
【思考】指出下列物质的主要成分
石蜡
(C18~C30的长链饱和烃)
(C15~C18的烷烃)
柴油
(丙烷和丁烷)
液化石油气
天然气
(甲烷)
(C17~C21的链烷烃)
凡士林
一.烃:
只含碳、氢两种元素的有机化合物
碳 氢
烃
烷烃
烯烃
炔烃
芳香烃
碳原子之间均以单键相连的烃,又叫饱和烃。
分子中含有碳碳双键的烃。
分子中含有碳碳三键的烃。
分子中含有苯环的烃。
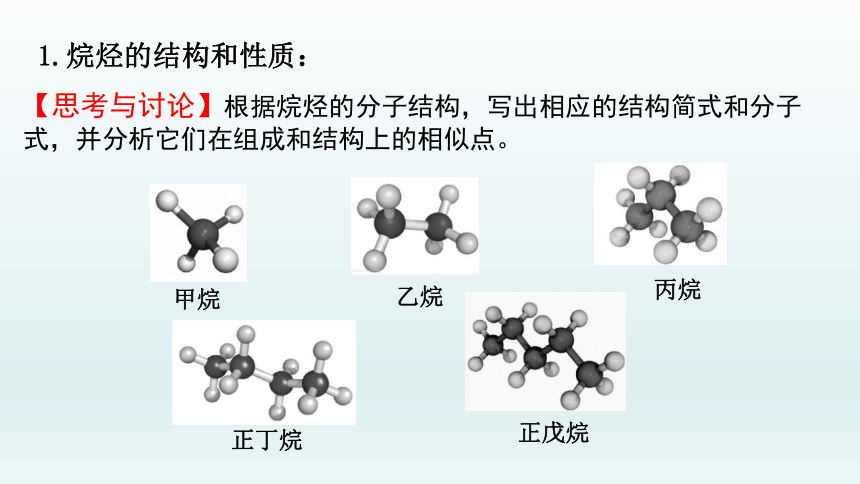
1.烷烃的结构和性质:
【思考与讨论】根据烷烃的分子结构,写出相应的结构简式和分子式,并分析它们在组成和结构上的相似点。
甲烷
乙烷
丙烷
正丁烷
正戊烷
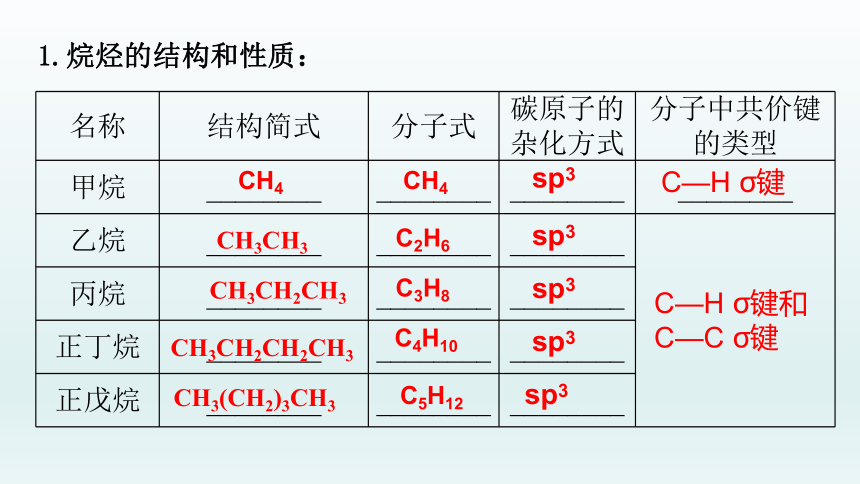
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷 ________ ________ ________ ________
乙烷 ________ ________ ________
丙烷 ________ ________ ________
正丁烷 ________ ________ ________
正戊烷 ________ ________ ________
1.烷烃的结构和性质:
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH4
CH3(CH2)3CH3
CH4
C2H6
C3H8
C4H10
C5H12
sp3
sp3
sp3
sp3
sp3
C—H σ键
C—H σ键和
C—C σ键
2.烷烃的结构特点:
⑴烷烃的结构与甲烷相似,碳原子都是sp3杂化;
⑵4个sp3杂化轨道伸向四面体4个顶点,分别与C或H结合形成σ键;
⑶烷烃分子中的共价键全部是单键,可以旋转。
⑷烷烃分子中的所有原子不可能共平面。
⑸链状烷烃的碳链为锯齿形,不是直线形。
⑹链烷烃通式:
CnH2n+2(n≥1)
相对分子质量是偶数(14n+2)
碳原子数不同的链烷烃之间都互为同系物。
含碳量最低的烷烃:
CH4
链烷烃CnH2n+2的共价键总数:
3n+1
2.烷烃的结构特点:
3.烷烃的物理性质
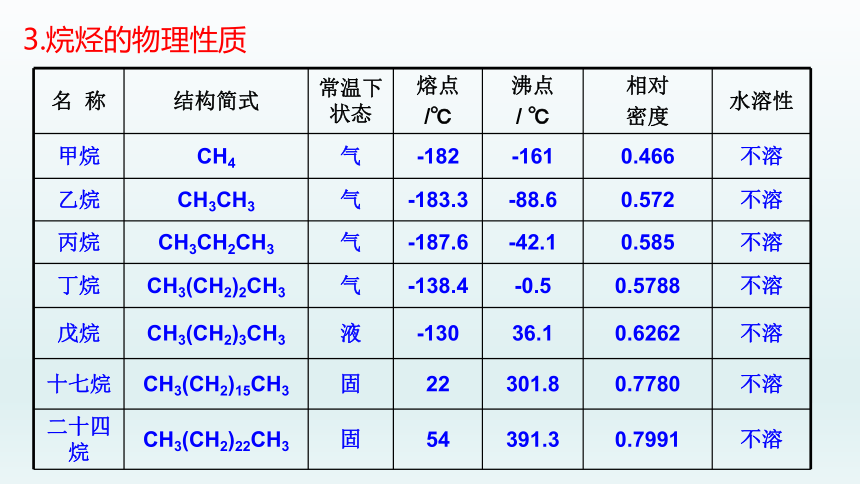
名 称 结构简式 常温下状态 熔点 /℃ 沸点 / ℃ 相对 密度 水溶性
甲烷 CH4 气 -182 -161 0.466 不溶
乙烷 CH3CH3 气 -183.3 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -187.6 -42.1 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -130 36.1 0.6262 不溶
十七烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
二十四烷 CH3(CH2)22CH3 固 54 391.3 0.7991 不溶
①聚集状态:常温常压下,
C4 以下的烷烃为气态; C5 ~ C16的烷烃为液态;
C17以上的烷烃为固态;
3.烷烃的物理性质
CnH2n+2(n≥1)状态:气 液 固
②熔、沸点:常温常压下,
烷烃中随相对分子质量增加,范德华力增大,熔沸点升高。
在烷烃的同分异构体中,直链烷烃的沸点比支链烷烃高,支链越多,沸点越低。
支链越多,分子之间接触面积越小,分子间作用力就越小,沸点越低。
新戊烷常温下为气态
3.烷烃的物理性质
③相对密度:
烷烃都比水轻,密度都小于1g/mL,随相对分子质量增加,烷烃的密度逐渐增加,但增值逐渐减小,最后接近0.8。
④溶解性:
烷烃都难溶于水,易溶于有机溶剂。
4.烷烃的化学性质
①因为烷烃中C—C键与C—H键的键能较大,所以通常状况下烷烃很稳定。
与强酸、强碱、强氧化剂如酸性KMnO4、氯水等不反应。
以甲烷通入酸性KMnO4溶液、溴的CCl4溶液为例
KMnO4溶液不褪色
溴的CCl4溶液不褪色
②但是烷烃具有可燃性——与O2发生氧化反应:
写出CnH2n+2与O2发生燃烧反应的化学方程式:
烷烃燃烧时放出大量热能,所以常用作内燃机的燃料。
写出甲烷、乙烷、辛烷燃烧的化学方程式:
4.烷烃的化学性质
【思考】设计实验证明甲烷由碳、氢两种元素组成。
③烷烃的裂化反应:
在高温和无氧条件下,使烷烃分子中的C—C键和C—H键断裂,从而裂解为小分子的反应。
CH3—CHCH2
丙烷
H
H
CH4 + CH2=CH2
H2 + CH3—CH=CH2
460℃
乙烯
丙烯
4.烷烃的化学性质
④烷烃的取代反应:
以甲烷与氯气为例
CH4分子的特点
正四面体结构
4个C-H是等同的
键长均为109.3 pm
键角均为109°28′
键能均为413.4 kJ/mol
球棍模型
109.5
4.烷烃的化学性质
④烷烃的取代反应:
以甲烷与氯气为例
①黄绿色变浅
②试管内壁有少量油状物生成
③试管中液面不断上升
加入石蕊试液溶液变红
⑤水槽中溶液有白色固体析出
CH4 + Cl2 CH3Cl + HCl
光照
小结:
甲烷与氯气光照条件下发生取代反应
CH3Cl + Cl2 CH2Cl2 + HCl
光照
CH2Cl2 + Cl2 CHCl3 + HCl
光照
CHCl3 + Cl2 CCl4 + HCl
光照
一氯甲烷(无色气体)
二氯甲烷(难溶于水的无色液体)
三氯甲烷又叫氯仿 (有机溶剂)
四氯化碳(有机溶剂、灭火剂)
【例1】氯气与乙烷在光照下发生取代反应,产物可能有哪些?
共9种
⑤甲烷的分解反应:
在隔绝空气、加热至1500℃的条件下,甲烷分解生成炭黑和氢气。
CH4
高温
C + 2H2
【课堂总结】
再 见
谢谢
第2章 烃
第一节 烷烃
第1课时 烷烃的结构和性质
【思考】指出下列物质的主要成分
石蜡
(C18~C30的长链饱和烃)
(C15~C18的烷烃)
柴油
(丙烷和丁烷)
液化石油气
天然气
(甲烷)
(C17~C21的链烷烃)
凡士林
一.烃:
只含碳、氢两种元素的有机化合物
碳 氢
烃
烷烃
烯烃
炔烃
芳香烃
碳原子之间均以单键相连的烃,又叫饱和烃。
分子中含有碳碳双键的烃。
分子中含有碳碳三键的烃。
分子中含有苯环的烃。
1.烷烃的结构和性质:
【思考与讨论】根据烷烃的分子结构,写出相应的结构简式和分子式,并分析它们在组成和结构上的相似点。
甲烷
乙烷
丙烷
正丁烷
正戊烷
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷 ________ ________ ________ ________
乙烷 ________ ________ ________
丙烷 ________ ________ ________
正丁烷 ________ ________ ________
正戊烷 ________ ________ ________
1.烷烃的结构和性质:
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH4
CH3(CH2)3CH3
CH4
C2H6
C3H8
C4H10
C5H12
sp3
sp3
sp3
sp3
sp3
C—H σ键
C—H σ键和
C—C σ键
2.烷烃的结构特点:
⑴烷烃的结构与甲烷相似,碳原子都是sp3杂化;
⑵4个sp3杂化轨道伸向四面体4个顶点,分别与C或H结合形成σ键;
⑶烷烃分子中的共价键全部是单键,可以旋转。
⑷烷烃分子中的所有原子不可能共平面。
⑸链状烷烃的碳链为锯齿形,不是直线形。
⑹链烷烃通式:
CnH2n+2(n≥1)
相对分子质量是偶数(14n+2)
碳原子数不同的链烷烃之间都互为同系物。
含碳量最低的烷烃:
CH4
链烷烃CnH2n+2的共价键总数:
3n+1
2.烷烃的结构特点:
3.烷烃的物理性质
名 称 结构简式 常温下状态 熔点 /℃ 沸点 / ℃ 相对 密度 水溶性
甲烷 CH4 气 -182 -161 0.466 不溶
乙烷 CH3CH3 气 -183.3 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -187.6 -42.1 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -130 36.1 0.6262 不溶
十七烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
二十四烷 CH3(CH2)22CH3 固 54 391.3 0.7991 不溶
①聚集状态:常温常压下,
C4 以下的烷烃为气态; C5 ~ C16的烷烃为液态;
C17以上的烷烃为固态;
3.烷烃的物理性质
CnH2n+2(n≥1)状态:气 液 固
②熔、沸点:常温常压下,
烷烃中随相对分子质量增加,范德华力增大,熔沸点升高。
在烷烃的同分异构体中,直链烷烃的沸点比支链烷烃高,支链越多,沸点越低。
支链越多,分子之间接触面积越小,分子间作用力就越小,沸点越低。
新戊烷常温下为气态
3.烷烃的物理性质
③相对密度:
烷烃都比水轻,密度都小于1g/mL,随相对分子质量增加,烷烃的密度逐渐增加,但增值逐渐减小,最后接近0.8。
④溶解性:
烷烃都难溶于水,易溶于有机溶剂。
4.烷烃的化学性质
①因为烷烃中C—C键与C—H键的键能较大,所以通常状况下烷烃很稳定。
与强酸、强碱、强氧化剂如酸性KMnO4、氯水等不反应。
以甲烷通入酸性KMnO4溶液、溴的CCl4溶液为例
KMnO4溶液不褪色
溴的CCl4溶液不褪色
②但是烷烃具有可燃性——与O2发生氧化反应:
写出CnH2n+2与O2发生燃烧反应的化学方程式:
烷烃燃烧时放出大量热能,所以常用作内燃机的燃料。
写出甲烷、乙烷、辛烷燃烧的化学方程式:
4.烷烃的化学性质
【思考】设计实验证明甲烷由碳、氢两种元素组成。
③烷烃的裂化反应:
在高温和无氧条件下,使烷烃分子中的C—C键和C—H键断裂,从而裂解为小分子的反应。
CH3—CHCH2
丙烷
H
H
CH4 + CH2=CH2
H2 + CH3—CH=CH2
460℃
乙烯
丙烯
4.烷烃的化学性质
④烷烃的取代反应:
以甲烷与氯气为例
CH4分子的特点
正四面体结构
4个C-H是等同的
键长均为109.3 pm
键角均为109°28′
键能均为413.4 kJ/mol
球棍模型
109.5
4.烷烃的化学性质
④烷烃的取代反应:
以甲烷与氯气为例
①黄绿色变浅
②试管内壁有少量油状物生成
③试管中液面不断上升
加入石蕊试液溶液变红
⑤水槽中溶液有白色固体析出
CH4 + Cl2 CH3Cl + HCl
光照
小结:
甲烷与氯气光照条件下发生取代反应
CH3Cl + Cl2 CH2Cl2 + HCl
光照
CH2Cl2 + Cl2 CHCl3 + HCl
光照
CHCl3 + Cl2 CCl4 + HCl
光照
一氯甲烷(无色气体)
二氯甲烷(难溶于水的无色液体)
三氯甲烷又叫氯仿 (有机溶剂)
四氯化碳(有机溶剂、灭火剂)
【例1】氯气与乙烷在光照下发生取代反应,产物可能有哪些?
共9种
⑤甲烷的分解反应:
在隔绝空气、加热至1500℃的条件下,甲烷分解生成炭黑和氢气。
CH4
高温
C + 2H2
【课堂总结】
再 见
谢谢
