江苏省南京市重点中学2021-2022学年高二上学期合格性考试第一次模考化学试卷(word版含答案)
文档属性
| 名称 | 江苏省南京市重点中学2021-2022学年高二上学期合格性考试第一次模考化学试卷(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 457.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-10 23:20:36 | ||
图片预览


文档简介
南京市重点中学2021-2022学年第一学期合格性考试第一次模考
高二化学
考试时间:50分钟 满分:100分
可能用到的相对原子质量:H 1 C 12 O 16 Na 23
选择题(共84分)
一、选择题(本大题共28小题,每小题3分,共84分)
1.2021年5月22日,中国第一辆火星车“祝融号”成功“打卡”火星表面。火星车上通常会用到耐高温材料,下列物质中属于耐高温材料的是
A.不锈钢 B.铝合金 C.钠钾合金 D.高温结构陶瓷
2.2020年11月,我国“奋斗者”号载人潜水器(如图),成功坐底马里亚纳海沟。潜水器外壳使用的钛合金可能具有的性质是
A. 耐高压 B. 易与海水反应
C. 硬度小 D. 易与氧气反应
3.下列化合物的俗称错误的是
A.NaOH——烧碱 B.Na2CO3——小苏打
C.CH3COOH——冰醋酸 D.CuSO4·5H2O——胆矾
4.下列物质属于电解质的是
A. 水银 B. 淀粉溶液 C. 氯化镁 D. 稀硫酸
5. 当光束通过下列分散系时,能观察到丁达尔效应的是
A. NaCl溶液 B. 蔗糖溶液 C. CuSO4溶液 D. AgI胶体
6.在制作印刷电路板的过程中常发生反应Cu+2FeCl3=CuCl2+2FeCl2,其反应类型为
A. 化合反应 B. 分解反应 C. 氧化还原反应 D. 复分解反应
7.我国清代《本草纲目拾遗》中记载了药物“鼻冲水”,“贮以玻璃瓶。紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅。”,“鼻冲水”是指
A. 酒精 B. 氨水 C. 烧碱 D. 硫酸
8.下列物质中,含离子键的是
A.CO2 B.KCl C.HCl D.CH4
9.西汉淮南王刘安的《淮南万毕术》中描述:曾青得铁则化为铜,该过程中Cu元素化合价
A.升高 B.不变 C.降低 D.无法判断
10.化学实验中,分液操作一定用到的仪器是
A. B. C. D.
11.从石油原料到口罩的生产过程中涉及的下列变化不属于化学变化的是
A B C D
石油催化裂解得到丙烯 丙烯催化聚合生成聚丙烯 聚丙烯熔融后喷丝压成熔喷布 利用环氧乙烷与微生物蛋白质发生烷基化反应消毒
12.下列化学用语表示正确的是
A.乙醇的结构式:C2H6O B.氯化氢的电子式:
C. CaCl2的电离方程式:CaCl2=Ca2++Cl22-
D.Mg2+的结构示意图:
13.Cr2O毒性较强,常用NaHSO3处理工业废水中的Cr2O,反应的离子方程式为5H++Cr2O+3HSO=2Cr3++3SO+4H2O。下列关于该反应的说法正确的是
A. Cr2O在反应中表现氧化性 B. Cr3+是氧化反应的产物
C. HSO发生还原反应 D. 生成1mol Cr3+时转移6mol电子
14.某溶液中存在、、、四种金属阳离子,向其中加入过量氢氧化钠溶液并充分搅拌,再加入过量盐酸后,大量减少的离子是
A. B. C. D.
15.实验室配制250 mL 0.1mol/L的Na2CO3溶液,无需用到的仪器是
A. B. C. D.
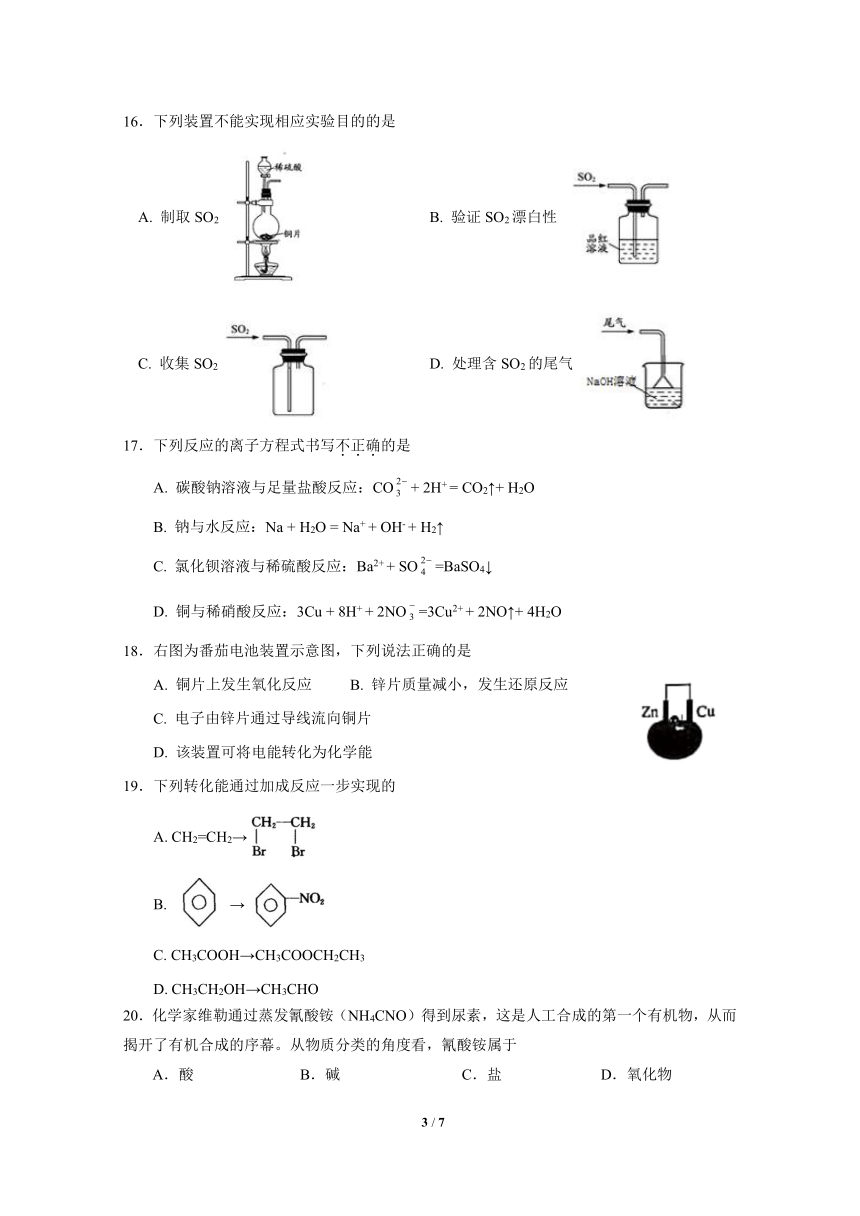
16.下列装置不能实现相应实验目的的是
A. 制取SO2 B. 验证SO2漂白性
C. 收集SO2 D. 处理含SO2的尾气
17.下列反应的离子方程式书写不正确的是
A. 碳酸钠溶液与足量盐酸反应:CO+ 2H+ = CO2↑+ H2O
B. 钠与水反应:Na + H2O = Na+ + OH- + H2↑
C. 氯化钡溶液与稀硫酸反应:Ba2+ + SO=BaSO4↓
D. 铜与稀硝酸反应:3Cu + 8H+ + 2NO=3Cu2+ + 2NO↑+ 4H2O
18.右图为番茄电池装置示意图,下列说法正确的是
A. 铜片上发生氧化反应 B. 锌片质量减小,发生还原反应
C. 电子由锌片通过导线流向铜片
D. 该装置可将电能转化为化学能
下列转化能通过加成反应一步实现的
A. CH2=CH2→
B. →
C. CH3COOH→CH3COOCH2CH3
D. CH3CH2OH→CH3CHO
20.化学家维勒通过蒸发氰酸铵(NH4CNO)得到尿素,这是人工合成的第一个有机物,从而揭开了有机合成的序幕。从物质分类的角度看,氰酸铵属于
A.酸 B.碱 C.盐 D.氧化物
21.放射性同位素 131 I ,其左上角数字“131”表示
A. 质量数 B. 中子数 C. 质子数 D. 电子数
22.分解水获得H2的能量变化如图所示,下列说法正确的是
A. 分解水属于吸热反应 B. 断开H—O键放出能量
C. 形成H—H键吸收能量 D. 反应物的总能量大于生成物的总能量
23.在工业上合成氨反应:N2+3H2 2NH3,欲增大反应速率,下列措施可行的是
A. 降低温度 B. 减小压强 C. 减小H2的浓度 D. 使用催化剂
24.进行实验时应高度重视实验安全,下列操作符合实验安全要求的是
A.金属钠、镁着火时用水或二氧化碳扑灭
B.点燃H2等可燃性气体前,先检验其纯度
C.浓NaOH溶液沾到手上立刻用盐酸冲洗
D.灼烧样品后的瓷坩埚直接放在冷水中降温
25. X、Y、Z、W属于1~20号主族元素且原子序数依次增大。X元素的单质是空气中含量最多的气体,Y原子最外层电子数是其内层电子数的3倍,Z原子最外层电子数与其电子层数相等,W元素原子最外层只有一个电子。下列说法正确的是
A. 金属性:Z>W
B. 简单气态氢化物的热稳定性:X>Y
C. 电解熔融的Z2Y3可制取Z单质
D. 原子半径:r(X)<r(Y)<r(Z)
26.下列实验操作中,主要不是从安全因素考虑的是
A.点燃氢气前一定要检验氢气的纯度
B.未使用完的金属钠要放回原试剂瓶中
C.用氢气还原氧化铜时,要先通一会儿氢气,再加热
D.配制0.5 mol·L-1的氯化钠溶液时,不能在容量瓶中直接溶解
27.对印刷电路板制作过程中(2FeCl3+Cu=2FeCl2+CuCl2)产生废液X进行回收处理,流程如图所示。下列说法不正确的是
A. 废液X中n(Fe2+) ∶n(Cu2+)=2∶1
B. 1molFeCl3与Cu完全反应,转移电子数为2mol
C. 若向溶液A中、溶液B中分别加入少量铁粉,铁粉均有减少
D. 实验室中进行操作①②时,需用到的玻璃仪器有烧杯、漏斗和玻璃棒
28.下列“实验结论”与“实验操作及现象”不相符的一组是
选项 实验操作及现象 实验结论
A 向KI―淀粉溶液中滴加氯水,溶液变成蓝色 氧化性:Cl2>I2
B 向蔗糖中滴加浓硫酸,蔗糖变黑 浓硫酸有吸水性
C 向某盐溶液中滴加KSCN溶液,溶液变为红色 该溶液中含有Fe3+
D 向某盐溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 该溶液中含有
非选择题(共16分)
二、非选择题(本大题共2小题,共16分)
29. (6分)图1是自然界中硫元素的存在示意图,图2表示硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
图1 自然界中硫元素的存在示意图 图2 硫元素的价类二维图
(1) 图1中能与水反应生成强酸的物质的化学式为 。
(2) 煤的燃烧会产生大量SO2造成环境污染,下列关于SO2治理措施不可行的是 。
A. 在燃煤中添加生石灰固硫
B. 用活性炭吸附烟气中的SO2
C. 将煤燃烧产生的尾气排放到高空
D. 用氨水吸收烟气中的SO2
(3) Cu和M的浓溶液反应生成Z的化学方程式为 。
(4) Na2SO3溶液易变质,实验室验证Na2SO3溶液已变质的操作和现象是 。
30. (10分)侯氏制碱法的主要产品是Na2CO3(可能含有碳酸氢钠杂质)。某兴趣小组为测定制得纯碱样品中碳酸钠的质量分数,设计了如下所示的实验方案:
方案一:采用如图所示实验装置,加热m g样品至恒重,测定相关数据。
方案二:称量3.600 g样品,配制成100 mL溶液;取其中20.00 mL溶液置于锥形瓶中,滴加甲基橙做指示剂;用 1 moL·L-1 的盐酸标准溶液滴定,达滴定终点时消耗盐酸体积为13.00 mL。
回答下列问题:
(1) 方案一中:
①X气体选择N2、不选空气的原因是 。
②仪器a的名称是 。
③实验需先通一段时间X气体,再加热样品。若要准确计算样品中碳酸钠的质量分数,还需要提供一个数据,它可以是 (填标号)。
A. 加热前后,甲装置的质量变化
B. 加热前后,乙、丙装置的质量变化总和
C. 加热前后,a处的质量变化
(2) 方案二中:
①发生反应的化学程式是 (写出一种即可)。
②根据该实验方案计算样品中碳酸钠的质量分数,写出计算过程(结果保留一位小数)。
化学参考答案
一、 选择题:每小题3分,共计84分
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D A B C D C B B C D C D A C
15 16 17 18 19 20 21 22 23 24 25 26 27 28
A A B C A C A A D B C D B B
二、 非选择题:本大题共2小题,共计16分
29. (6分)
(1) SO3 (1分)
(2) C (1分)
(3) Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (2分)
(4) 取少量溶液于试管中,加入过量稀盐酸酸化,再滴入氯化钡溶液,观察到产生白色沉淀 (2分)
30. (10分)
(1) ①空气中含有的CO2、H2O等会影响实验数据测定结果准确性 (1分)
②球形干燥管 (1分)
③A或B (2分)
(2) ①Na2CO3+2HCl2NaCl+H2O+CO2↑或NaHCO3+HClNaCl+H2O+CO2↑(2分)
②设3.600 g样品中含有Na2CO3 x mol;NaHCO3 y mol (1分)
列方程组: 106x+84y=3.600
2x+y=0.013× (1分)
解方程组: x=0.03 mol
y=0.005 mol (1分)
样品中Na2CO3的质量分数为 0.03×106÷3.600×100%=88.3% (1分)
说明:①本卷中所有合理答案均参照给分
②化学方程式或离子方程式中,缺少条件、符号或未配平合计扣1分,化学式错误或漏写不给分
③计算过程中可以不带单位,有效数字暂不作要求
2 / 2
高二化学
考试时间:50分钟 满分:100分
可能用到的相对原子质量:H 1 C 12 O 16 Na 23
选择题(共84分)
一、选择题(本大题共28小题,每小题3分,共84分)
1.2021年5月22日,中国第一辆火星车“祝融号”成功“打卡”火星表面。火星车上通常会用到耐高温材料,下列物质中属于耐高温材料的是
A.不锈钢 B.铝合金 C.钠钾合金 D.高温结构陶瓷
2.2020年11月,我国“奋斗者”号载人潜水器(如图),成功坐底马里亚纳海沟。潜水器外壳使用的钛合金可能具有的性质是
A. 耐高压 B. 易与海水反应
C. 硬度小 D. 易与氧气反应
3.下列化合物的俗称错误的是
A.NaOH——烧碱 B.Na2CO3——小苏打
C.CH3COOH——冰醋酸 D.CuSO4·5H2O——胆矾
4.下列物质属于电解质的是
A. 水银 B. 淀粉溶液 C. 氯化镁 D. 稀硫酸
5. 当光束通过下列分散系时,能观察到丁达尔效应的是
A. NaCl溶液 B. 蔗糖溶液 C. CuSO4溶液 D. AgI胶体
6.在制作印刷电路板的过程中常发生反应Cu+2FeCl3=CuCl2+2FeCl2,其反应类型为
A. 化合反应 B. 分解反应 C. 氧化还原反应 D. 复分解反应
7.我国清代《本草纲目拾遗》中记载了药物“鼻冲水”,“贮以玻璃瓶。紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅。”,“鼻冲水”是指
A. 酒精 B. 氨水 C. 烧碱 D. 硫酸
8.下列物质中,含离子键的是
A.CO2 B.KCl C.HCl D.CH4
9.西汉淮南王刘安的《淮南万毕术》中描述:曾青得铁则化为铜,该过程中Cu元素化合价
A.升高 B.不变 C.降低 D.无法判断
10.化学实验中,分液操作一定用到的仪器是
A. B. C. D.
11.从石油原料到口罩的生产过程中涉及的下列变化不属于化学变化的是
A B C D
石油催化裂解得到丙烯 丙烯催化聚合生成聚丙烯 聚丙烯熔融后喷丝压成熔喷布 利用环氧乙烷与微生物蛋白质发生烷基化反应消毒
12.下列化学用语表示正确的是
A.乙醇的结构式:C2H6O B.氯化氢的电子式:
C. CaCl2的电离方程式:CaCl2=Ca2++Cl22-
D.Mg2+的结构示意图:
13.Cr2O毒性较强,常用NaHSO3处理工业废水中的Cr2O,反应的离子方程式为5H++Cr2O+3HSO=2Cr3++3SO+4H2O。下列关于该反应的说法正确的是
A. Cr2O在反应中表现氧化性 B. Cr3+是氧化反应的产物
C. HSO发生还原反应 D. 生成1mol Cr3+时转移6mol电子
14.某溶液中存在、、、四种金属阳离子,向其中加入过量氢氧化钠溶液并充分搅拌,再加入过量盐酸后,大量减少的离子是
A. B. C. D.
15.实验室配制250 mL 0.1mol/L的Na2CO3溶液,无需用到的仪器是
A. B. C. D.
16.下列装置不能实现相应实验目的的是
A. 制取SO2 B. 验证SO2漂白性
C. 收集SO2 D. 处理含SO2的尾气
17.下列反应的离子方程式书写不正确的是
A. 碳酸钠溶液与足量盐酸反应:CO+ 2H+ = CO2↑+ H2O
B. 钠与水反应:Na + H2O = Na+ + OH- + H2↑
C. 氯化钡溶液与稀硫酸反应:Ba2+ + SO=BaSO4↓
D. 铜与稀硝酸反应:3Cu + 8H+ + 2NO=3Cu2+ + 2NO↑+ 4H2O
18.右图为番茄电池装置示意图,下列说法正确的是
A. 铜片上发生氧化反应 B. 锌片质量减小,发生还原反应
C. 电子由锌片通过导线流向铜片
D. 该装置可将电能转化为化学能
下列转化能通过加成反应一步实现的
A. CH2=CH2→
B. →
C. CH3COOH→CH3COOCH2CH3
D. CH3CH2OH→CH3CHO
20.化学家维勒通过蒸发氰酸铵(NH4CNO)得到尿素,这是人工合成的第一个有机物,从而揭开了有机合成的序幕。从物质分类的角度看,氰酸铵属于
A.酸 B.碱 C.盐 D.氧化物
21.放射性同位素 131 I ,其左上角数字“131”表示
A. 质量数 B. 中子数 C. 质子数 D. 电子数
22.分解水获得H2的能量变化如图所示,下列说法正确的是
A. 分解水属于吸热反应 B. 断开H—O键放出能量
C. 形成H—H键吸收能量 D. 反应物的总能量大于生成物的总能量
23.在工业上合成氨反应:N2+3H2 2NH3,欲增大反应速率,下列措施可行的是
A. 降低温度 B. 减小压强 C. 减小H2的浓度 D. 使用催化剂
24.进行实验时应高度重视实验安全,下列操作符合实验安全要求的是
A.金属钠、镁着火时用水或二氧化碳扑灭
B.点燃H2等可燃性气体前,先检验其纯度
C.浓NaOH溶液沾到手上立刻用盐酸冲洗
D.灼烧样品后的瓷坩埚直接放在冷水中降温
25. X、Y、Z、W属于1~20号主族元素且原子序数依次增大。X元素的单质是空气中含量最多的气体,Y原子最外层电子数是其内层电子数的3倍,Z原子最外层电子数与其电子层数相等,W元素原子最外层只有一个电子。下列说法正确的是
A. 金属性:Z>W
B. 简单气态氢化物的热稳定性:X>Y
C. 电解熔融的Z2Y3可制取Z单质
D. 原子半径:r(X)<r(Y)<r(Z)
26.下列实验操作中,主要不是从安全因素考虑的是
A.点燃氢气前一定要检验氢气的纯度
B.未使用完的金属钠要放回原试剂瓶中
C.用氢气还原氧化铜时,要先通一会儿氢气,再加热
D.配制0.5 mol·L-1的氯化钠溶液时,不能在容量瓶中直接溶解
27.对印刷电路板制作过程中(2FeCl3+Cu=2FeCl2+CuCl2)产生废液X进行回收处理,流程如图所示。下列说法不正确的是
A. 废液X中n(Fe2+) ∶n(Cu2+)=2∶1
B. 1molFeCl3与Cu完全反应,转移电子数为2mol
C. 若向溶液A中、溶液B中分别加入少量铁粉,铁粉均有减少
D. 实验室中进行操作①②时,需用到的玻璃仪器有烧杯、漏斗和玻璃棒
28.下列“实验结论”与“实验操作及现象”不相符的一组是
选项 实验操作及现象 实验结论
A 向KI―淀粉溶液中滴加氯水,溶液变成蓝色 氧化性:Cl2>I2
B 向蔗糖中滴加浓硫酸,蔗糖变黑 浓硫酸有吸水性
C 向某盐溶液中滴加KSCN溶液,溶液变为红色 该溶液中含有Fe3+
D 向某盐溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 该溶液中含有
非选择题(共16分)
二、非选择题(本大题共2小题,共16分)
29. (6分)图1是自然界中硫元素的存在示意图,图2表示硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
图1 自然界中硫元素的存在示意图 图2 硫元素的价类二维图
(1) 图1中能与水反应生成强酸的物质的化学式为 。
(2) 煤的燃烧会产生大量SO2造成环境污染,下列关于SO2治理措施不可行的是 。
A. 在燃煤中添加生石灰固硫
B. 用活性炭吸附烟气中的SO2
C. 将煤燃烧产生的尾气排放到高空
D. 用氨水吸收烟气中的SO2
(3) Cu和M的浓溶液反应生成Z的化学方程式为 。
(4) Na2SO3溶液易变质,实验室验证Na2SO3溶液已变质的操作和现象是 。
30. (10分)侯氏制碱法的主要产品是Na2CO3(可能含有碳酸氢钠杂质)。某兴趣小组为测定制得纯碱样品中碳酸钠的质量分数,设计了如下所示的实验方案:
方案一:采用如图所示实验装置,加热m g样品至恒重,测定相关数据。
方案二:称量3.600 g样品,配制成100 mL溶液;取其中20.00 mL溶液置于锥形瓶中,滴加甲基橙做指示剂;用 1 moL·L-1 的盐酸标准溶液滴定,达滴定终点时消耗盐酸体积为13.00 mL。
回答下列问题:
(1) 方案一中:
①X气体选择N2、不选空气的原因是 。
②仪器a的名称是 。
③实验需先通一段时间X气体,再加热样品。若要准确计算样品中碳酸钠的质量分数,还需要提供一个数据,它可以是 (填标号)。
A. 加热前后,甲装置的质量变化
B. 加热前后,乙、丙装置的质量变化总和
C. 加热前后,a处的质量变化
(2) 方案二中:
①发生反应的化学程式是 (写出一种即可)。
②根据该实验方案计算样品中碳酸钠的质量分数,写出计算过程(结果保留一位小数)。
化学参考答案
一、 选择题:每小题3分,共计84分
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D A B C D C B B C D C D A C
15 16 17 18 19 20 21 22 23 24 25 26 27 28
A A B C A C A A D B C D B B
二、 非选择题:本大题共2小题,共计16分
29. (6分)
(1) SO3 (1分)
(2) C (1分)
(3) Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (2分)
(4) 取少量溶液于试管中,加入过量稀盐酸酸化,再滴入氯化钡溶液,观察到产生白色沉淀 (2分)
30. (10分)
(1) ①空气中含有的CO2、H2O等会影响实验数据测定结果准确性 (1分)
②球形干燥管 (1分)
③A或B (2分)
(2) ①Na2CO3+2HCl2NaCl+H2O+CO2↑或NaHCO3+HClNaCl+H2O+CO2↑(2分)
②设3.600 g样品中含有Na2CO3 x mol;NaHCO3 y mol (1分)
列方程组: 106x+84y=3.600
2x+y=0.013× (1分)
解方程组: x=0.03 mol
y=0.005 mol (1分)
样品中Na2CO3的质量分数为 0.03×106÷3.600×100%=88.3% (1分)
说明:①本卷中所有合理答案均参照给分
②化学方程式或离子方程式中,缺少条件、符号或未配平合计扣1分,化学式错误或漏写不给分
③计算过程中可以不带单位,有效数字暂不作要求
2 / 2
同课章节目录
