苏教-选修6-铝及其化合物的性质2
图片预览





文档简介
课件14张PPT。
专题2 物质性质的探究 课题1 铝及其化合物的性质《实验化学》1、铝与稀酸的离子方程式
2、铝与氢氧化钠反应的离子方程式
3、铝热反应
4、氧化铝与强酸的离子方程式
5、氧化铝与强碱的离子方程式
6、实验室用氨水与铝盐制氢氧化铝离子方程式
7、氢氧化铝与强酸的离子方程式
8、氢氧化铝与强碱的离子方程式
9、碘离子与双氧水的反应
10、草酸铵检验钙离子的离子方程式
11、硫氰化钾检验铁离子的离子方程式
12、铁离子与氨水的显色反应
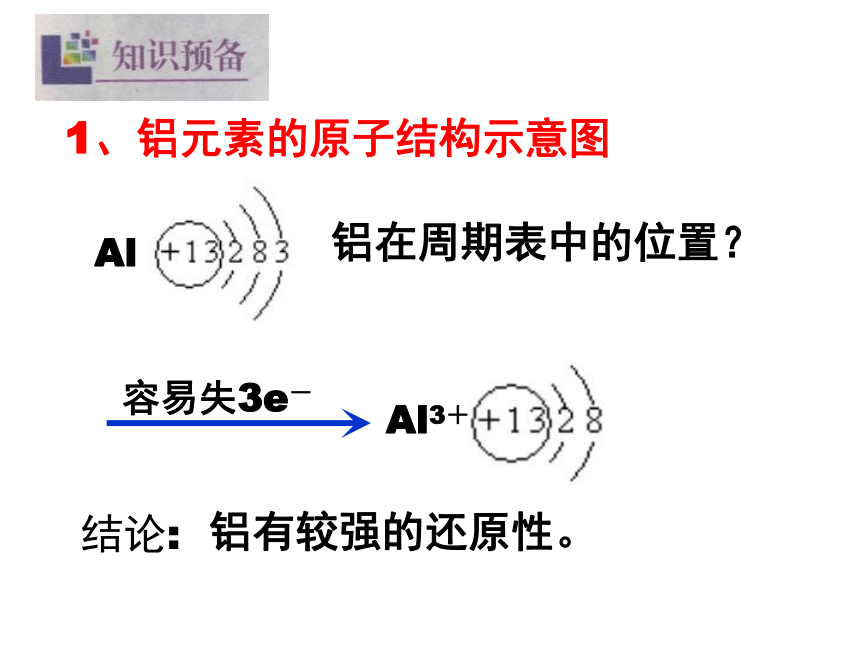
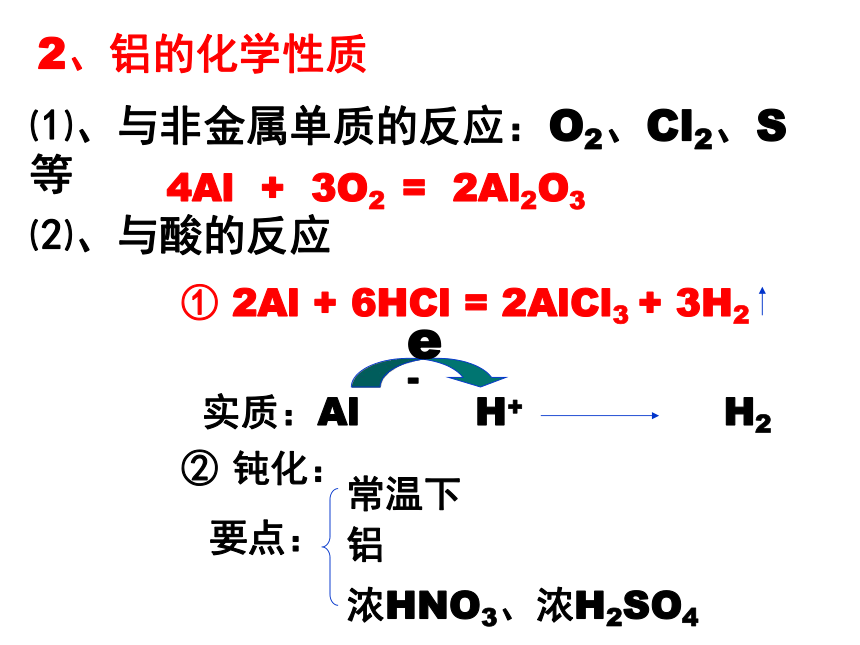
13、铜离子与氨水的显色反应完成下列反应方程式1、铝元素的原子结构示意图Al 结论:铝有较强的还原性。Al3+铝在周期表中的位置?⑴、与非金属单质的反应:O2、Cl2、S等4Al + 3O2 = 2Al2O3⑵、与酸的反应② 钝化:2、铝的化学性质(3)与强碱溶液的反应2Al+6H2O= 2Al(OH)3+3H2↑Al(OH)3+NaOH=NaAlO2+2H2O2Al+2NaOH+2H2O=2NaAlO2+3H2↑(4)与金属氧化物的反应:铝热反应(5)与不活泼金属的可溶性盐的反应:2Al+3CuSO4=Al2(SO4)3+3Cu氧化铝的化学性质两性氧化物3、氧化铝和氢氧化铝的两性两性氧化物:与碱反应生成盐和水,与酸反应生
成盐和水的氧化物。Al2O3+2NaOH+3H2O=2NaAl(OH)4Al2O3+2OH--+3H2O = 2Al(OH)4--氢氧化铝的化学性质(1)两性氢氧化物:与碱反应生成盐和水,与酸反
应生成盐和水的氢氧化物。3NaAlO2 +AlCl3 +6H2O=4Al(OH)3↓+3NaCl(2)受热分解3AlO2-- +Al3+ +6H2O=4Al(OH)3↓4、可溶性铝盐的性质AlCl3、KAl(SO4)2·12H2O实验1、铝与氧气反应的实验探究 在氧气中燃烧,并产生耀眼的白光。第二: 氧气的浓度偏低或氧气的量不足而导致燃烧现象不明显。第三:铝箔与氧气的接触面积太少.第一: 铝是活泼金属,在空气中能与氧气生成一种致密的氧化铝保护层,使氧气不能继续与铝发生反应,实验2、铝表面氧化膜的实验研究如何设计实验证明铝表面存在氧化膜?书P21如何除去铝片表面的氧化膜?方法1、用砂纸除去氧化膜
将一片擦去氧化膜的铝片放入20mL0.5mol/L的CuSO4溶液中,观察铝片表面现象 出现一层海绵状暗红色物质,产生气泡,溶液温度升高2Al+3CuSO4=Al2(SO4)3+3Cu方法2、用NaOH溶液除去氧化膜铝片,如何增强铝片表面的氧化膜的保护作用?方法:将另一擦去氧化膜的铝片放入盛有
浓硝酸的试管中 3、铝配合物的生成实验现象:无明显现象
原因之一: 中学阶段的铵盐均易溶于水,故(NH4)3AlF6也易溶于水.AlCl3+6NH4F=(NH4)3AlF6+3NH4Cl原因之二: 课本第21页的”信息提示”中有离子方程式:Al3++6F-=AlF63- 溶液中铝离子浓度很小,不会与氨水反应生成Al(OH)3沉淀实验4: 培养明矾晶体 实验四的注意事项: ①、配制的明矾溶液一定要饱和,每次把母液配成30~40℃的溶液,有利于晶核的快速长大,不至于晶体在室温升高时溶解。否则晶核会被溶解。 ②、选取形状完整的小晶体作为晶核。 ③、溶液饱和度太大产生不规则小晶体附在原晶核之上,晶体不透明;饱和度太低,成长缓慢或溶解。拓展课题2-1 铝热反应1.将两张圆形滤纸分别折叠成漏斗状,在其中一只纸漏斗的底部剪一个小孔,用水润湿,再与另一个纸漏斗套在一起,有孔纸漏斗置于内层(使纸漏斗每边都有4层),架在铁架台的铁圈上,其下方放置盛有细沙的蒸发皿或铁盘。
2.将5g干燥的氧化铁粉末、2g铝粉均匀混合后放在纸漏斗里,在混合物的上面加少量氯酸钾,再在混合物中间插一根镁条。点燃镁条,观察实验现象。
3.设计实验,检验从纸漏斗下端落下的金属是否为铁。助燃用镁燃烧放出的热量引发铝热反应
2、铝与氢氧化钠反应的离子方程式
3、铝热反应
4、氧化铝与强酸的离子方程式
5、氧化铝与强碱的离子方程式
6、实验室用氨水与铝盐制氢氧化铝离子方程式
7、氢氧化铝与强酸的离子方程式
8、氢氧化铝与强碱的离子方程式
9、碘离子与双氧水的反应
10、草酸铵检验钙离子的离子方程式
11、硫氰化钾检验铁离子的离子方程式
12、铁离子与氨水的显色反应
13、铜离子与氨水的显色反应完成下列反应方程式1、铝元素的原子结构示意图Al 结论:铝有较强的还原性。Al3+铝在周期表中的位置?⑴、与非金属单质的反应:O2、Cl2、S等4Al + 3O2 = 2Al2O3⑵、与酸的反应② 钝化:2、铝的化学性质(3)与强碱溶液的反应2Al+6H2O= 2Al(OH)3+3H2↑Al(OH)3+NaOH=NaAlO2+2H2O2Al+2NaOH+2H2O=2NaAlO2+3H2↑(4)与金属氧化物的反应:铝热反应(5)与不活泼金属的可溶性盐的反应:2Al+3CuSO4=Al2(SO4)3+3Cu氧化铝的化学性质两性氧化物3、氧化铝和氢氧化铝的两性两性氧化物:与碱反应生成盐和水,与酸反应生
成盐和水的氧化物。Al2O3+2NaOH+3H2O=2NaAl(OH)4Al2O3+2OH--+3H2O = 2Al(OH)4--氢氧化铝的化学性质(1)两性氢氧化物:与碱反应生成盐和水,与酸反
应生成盐和水的氢氧化物。3NaAlO2 +AlCl3 +6H2O=4Al(OH)3↓+3NaCl(2)受热分解3AlO2-- +Al3+ +6H2O=4Al(OH)3↓4、可溶性铝盐的性质AlCl3、KAl(SO4)2·12H2O实验1、铝与氧气反应的实验探究 在氧气中燃烧,并产生耀眼的白光。第二: 氧气的浓度偏低或氧气的量不足而导致燃烧现象不明显。第三:铝箔与氧气的接触面积太少.第一: 铝是活泼金属,在空气中能与氧气生成一种致密的氧化铝保护层,使氧气不能继续与铝发生反应,实验2、铝表面氧化膜的实验研究如何设计实验证明铝表面存在氧化膜?书P21如何除去铝片表面的氧化膜?方法1、用砂纸除去氧化膜
将一片擦去氧化膜的铝片放入20mL0.5mol/L的CuSO4溶液中,观察铝片表面现象 出现一层海绵状暗红色物质,产生气泡,溶液温度升高2Al+3CuSO4=Al2(SO4)3+3Cu方法2、用NaOH溶液除去氧化膜铝片,如何增强铝片表面的氧化膜的保护作用?方法:将另一擦去氧化膜的铝片放入盛有
浓硝酸的试管中 3、铝配合物的生成实验现象:无明显现象
原因之一: 中学阶段的铵盐均易溶于水,故(NH4)3AlF6也易溶于水.AlCl3+6NH4F=(NH4)3AlF6+3NH4Cl原因之二: 课本第21页的”信息提示”中有离子方程式:Al3++6F-=AlF63- 溶液中铝离子浓度很小,不会与氨水反应生成Al(OH)3沉淀实验4: 培养明矾晶体 实验四的注意事项: ①、配制的明矾溶液一定要饱和,每次把母液配成30~40℃的溶液,有利于晶核的快速长大,不至于晶体在室温升高时溶解。否则晶核会被溶解。 ②、选取形状完整的小晶体作为晶核。 ③、溶液饱和度太大产生不规则小晶体附在原晶核之上,晶体不透明;饱和度太低,成长缓慢或溶解。拓展课题2-1 铝热反应1.将两张圆形滤纸分别折叠成漏斗状,在其中一只纸漏斗的底部剪一个小孔,用水润湿,再与另一个纸漏斗套在一起,有孔纸漏斗置于内层(使纸漏斗每边都有4层),架在铁架台的铁圈上,其下方放置盛有细沙的蒸发皿或铁盘。
2.将5g干燥的氧化铁粉末、2g铝粉均匀混合后放在纸漏斗里,在混合物的上面加少量氯酸钾,再在混合物中间插一根镁条。点燃镁条,观察实验现象。
3.设计实验,检验从纸漏斗下端落下的金属是否为铁。助燃用镁燃烧放出的热量引发铝热反应
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
