2022年浙江省中考科学一轮复习 第35课时 水和溶液(课件 64张PPT)
文档属性
| 名称 | 2022年浙江省中考科学一轮复习 第35课时 水和溶液(课件 64张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-01-11 20:49:39 | ||
图片预览





文档简介
(共64张PPT)
第35课时 水和溶液
●知识体系梳理
●重难考点精讲
●当堂限时训练
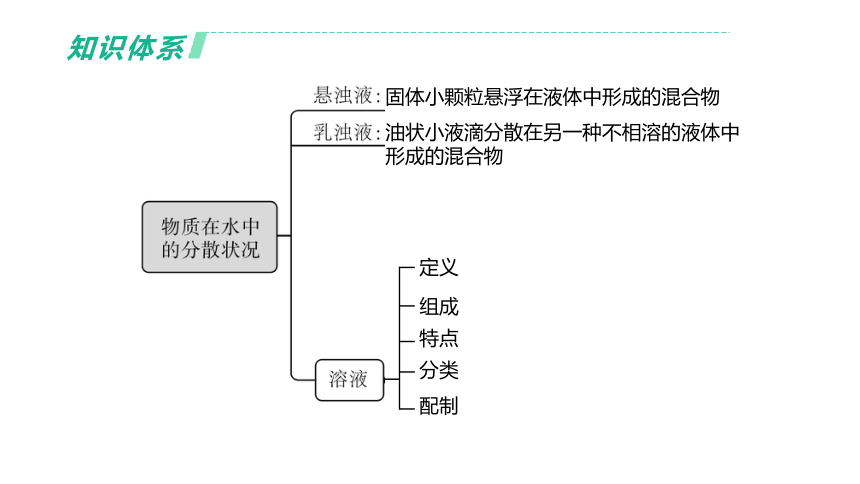
知识体系
固体小颗粒悬浮在液体中形成的混合物
油状小液滴分散在另一种不相溶的液体中
形成的混合物
定义
组成
特点
分类
配制
均一
稳定
混合物
组成
性质
温度
溶剂
温度
溶剂
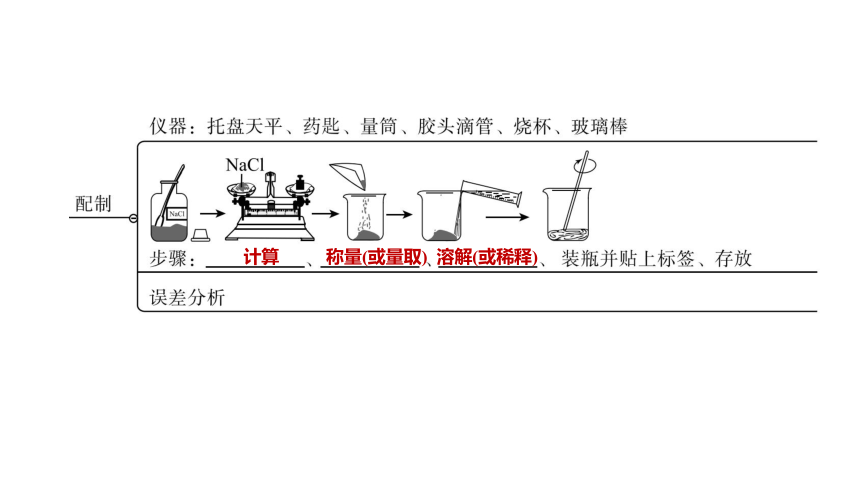
计算
称量(或量取)
溶解(或稀释)
重点梳理
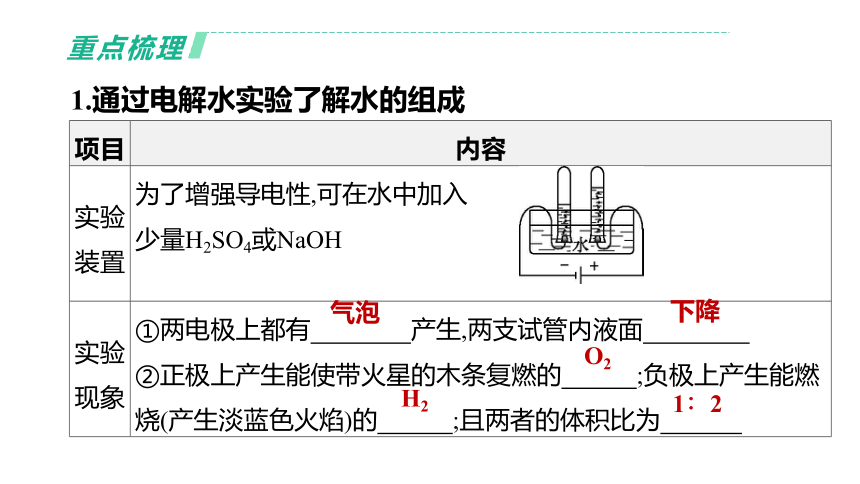
1.通过电解水实验了解水的组成
项目 内容
实验装置 为了增强导电性,可在水中加入
少量H2SO4或NaOH
实验现象 ①两电极上都有 产生,两支试管内液面
②正极上产生能使带火星的木条复燃的 ;负极上产生能燃烧(产生淡蓝色火焰)的 ;且两者的体积比为
气泡
下降
O2
H2
1∶2
(续表)
项目 内容
实验结论 ①水在通电条件下生成氢气和氧气:
2H2O 2H2↑+O2↑
②宏观:水是由氢、氧两种元素组成的
③微观:水分子是由氢、氧两种原子构成的
④验证了在化学变化中,分子可以分成原子,而原子不可分
⑤证明了化学反应的实质是分子分裂成原子,原子重新结合成新的分子
2.水的主要性质
物理性质 常温下是无色无味的液体,沸点是① ℃(1标准大气压下),熔点是② ℃;4 ℃时,密度是③ g/cm3,结冰后密度④ ,比热容是⑤ J/(kg·℃);能溶解很多物质,是良好的溶剂(其他常见的溶剂有⑥ 、
⑦ 等)
化学性质 (1)在常温下化学性质稳定
(2)在通电条件下分解:2H2O 2H2↑+O2↑
100
0
1
变小
4.2×103
酒精
丙酮
化学性质 (3)某些非金属氧化物+水→酸:CO2+H2O === H2CO3
能与水反应生成酸的氧化物还有⑧ 等
(4)某些金属氧化物+水→碱:CaO+H2O === Ca(OH)2
能与水反应生成碱的氧化物还有⑨ 等
(5)CuSO4+5H2O === CuSO4·5H2O,白色粉末变蓝,可用于检验水
(6)参与光合作用
(续表)
SO2、SO3
K2O、Na2O、BaO
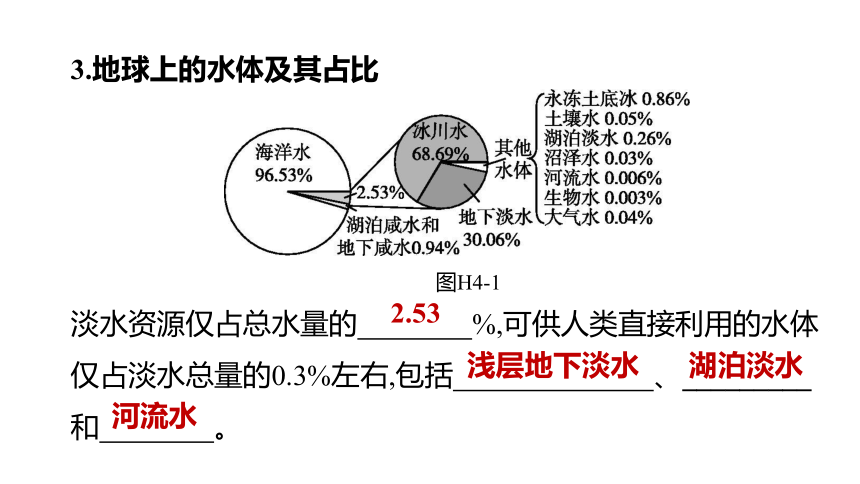
3.地球上的水体及其占比
图H4-1
淡水资源仅占总水量的 %,可供人类直接利用的水体仅占淡水总量的0.3%左右,包括 、_________
和 。
2.53
浅层地下淡水
湖泊淡水
河流水
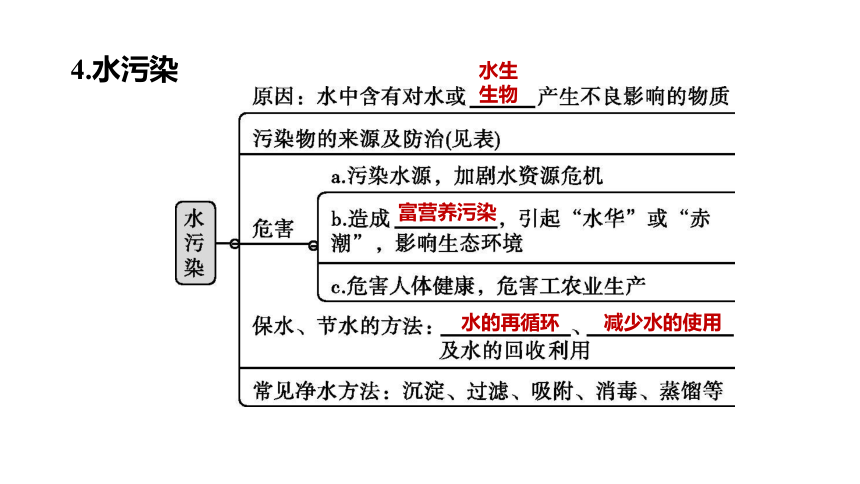
4.水污染
水生
生物
富营养污染
水的再循环
减少水的使用
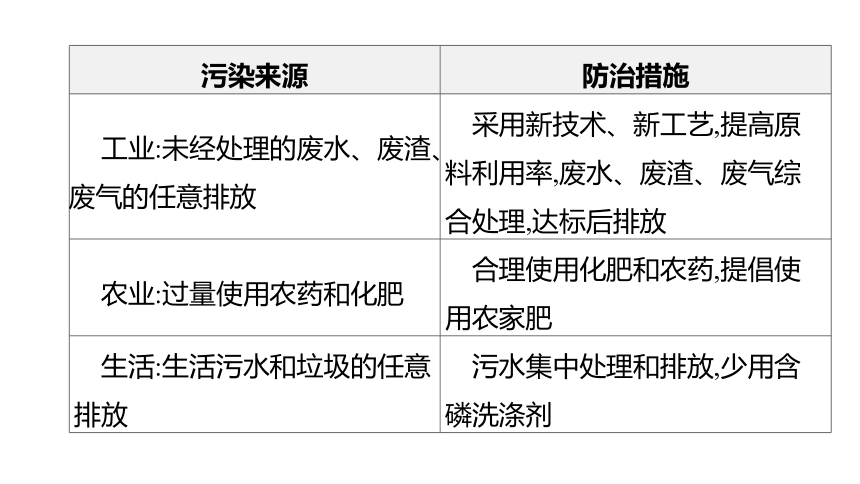
污染来源 防治措施
工业:未经处理的废水、废渣、废气的任意排放 采用新技术、新工艺,提高原料利用率,废水、废渣、废气综合处理,达标后排放
农业:过量使用农药和化肥 合理使用化肥和农药,提倡使用农家肥
生活:生活污水和垃圾的任意排放 污水集中处理和排放,少用含磷洗涤剂
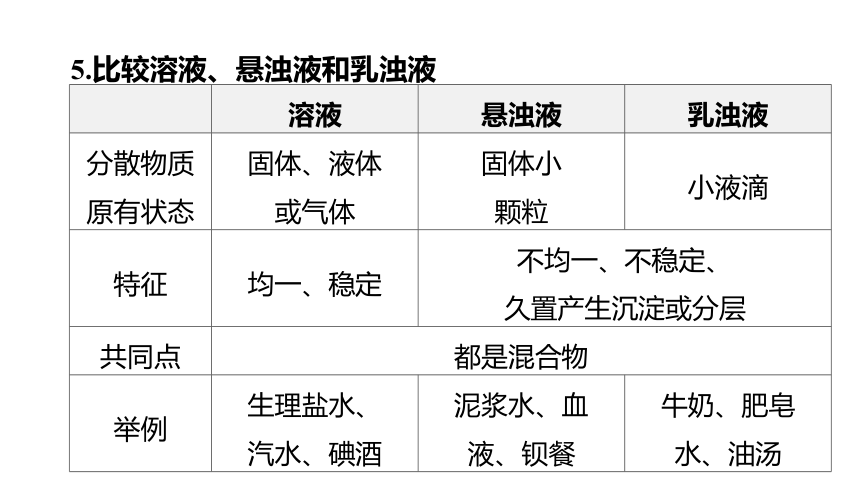
5.比较溶液、悬浊液和乳浊液
溶液 悬浊液 乳浊液
分散物质 原有状态 固体、液体 或气体 固体小 颗粒 小液滴
特征 均一、稳定 不均一、不稳定、 久置产生沉淀或分层
共同点 都是混合物
举例 生理盐水、 汽水、碘酒 泥浆水、血 液、钡餐 牛奶、肥皂
水、油汤
6.饱和溶液和不饱和溶液的判断及转化
(1)判断方法: 。
继续加入少量相同溶质,看是否能继续溶解
不饱和
溶液
饱和溶
液
(2)相互转化的方法(对大多数溶质为固体的溶液而言)
一般规律:对大多数溶解度随温度升高而增大的物质(如KNO3)
(3)结晶
①蒸发结晶法:适用于溶解度受温度变化较小的物质,如氯化钠。
②降温结晶法:适用于溶解度随温度升高而增大,且溶解度受温度变化较大的物质,如硝酸钾。
7.溶解性和溶解度
定性
温度
溶剂
饱和
质量
溶质
溶剂
增大
减小
会查阅溶解度表:
熟石灰在20 ℃时的溶解度为 g。
温度/℃ 0 20 40 60
溶解度/g 0.173 0.165 0.121 0.076
硝酸铵
氢氧化钠
氯化钠
0.165
8.配制一定溶质质量分数的氯化钠溶液时的误差分析
溶质质量分数 误差分析 可能的原因
偏大 溶液中水的 质量偏小 量取水时俯视读数
量取的水倒入烧杯时有水溅出
溶液中氯化钠 质量偏大 砝码生锈或沾有油污等
偏小 溶液中氯化钠 质量偏小 氯化钠中含有杂质
氯化钠倒入烧杯时纸片上有残留
溶液中水的 质量偏大 量取水时仰视读数
烧杯内原有少量水
9.溶液的溶质质量分数的计算
(1)溶质的质量分数是溶液组成的 表示方法,可以用小数或百分数表示。
(2)①所有溶液:溶质的质量分数=×100%。
②饱和溶液:溶质的质量分数=×100%。
定量
③已知溶液密度和体积时:
溶质的质量分数=×100%。
④溶质的质量= × 。
⑤溶液的质量=
⑥溶液稀释:根据稀释前后 质量不变,可得:
m浓溶液×a%=m稀溶液×b%。
溶液的质量
溶质的质量分数
溶质
考点1 水的组成和主要性质
对点练习
图35-2
1.[2019·杭州]如图35-2是教材中用来表示电解水过程的示意图(其中“ ”“ ” 分别表示H原子和O原子)。分析示意图,可作出的正确判断是 ( )
A.常温常压下水可以发生分解反应
B.电解水的最终产物是H、O原子
C.H原子是图示微粒中的最小微粒
D.O原子只有在通电条件下才能转化为O2分子
图35-2
[答案] C
2.[2017·杭州]小金在做电解水实验时,先在
水中加入少量含酚酞的硫酸钠溶液(硫酸钠
溶液呈中性),再通直流电一段时间,现象如
图35-3所示。则下列说法正确的是( )
A.用燃着的木条检验气体a,发现木条上火焰熄灭
B.在酒精灯火焰上检验气体b,气体b不能燃烧
C.与电源负极相连的电极附近的溶液中存在大量OH-
D.在此反应中化学能转化为电能
图35-3
C
3.水与我们生命、生活息息相关。下列关于水的认识正确的是 ( )
A.冰的密度小于水的密度
B.水结冰时要吸收热量
C.无色无味的水即可以放心饮用
D.水能溶解所有的物质
A
考点2 水资源和水污染
4.2021年3月22日是第29个世界水日,今年的主题是“珍惜水、爱护水”。下列对于水的认识正确的是 ( )
A.用废水浇灌农田以降低成本
B.地球上的淡水资源有限
C.明矾用于自来水杀菌、消毒
D.经自来水厂处理后的生活用水是纯净物
B
5.[2015·绍兴]五水共治指的是治污水、防洪水、排涝水、保供水、抓节水。绍兴市近几年在污染治理方面取得了显著成效,全市工业废水排污达标率100%,生活用水也得到了很好的治理。下列对生活污水的处理,你认为合理的是 (填序号)。
A.洗脸、厨房用水等可以用来冲洗马桶
B.用“洁厕灵”清洗洁具后的冲刷液不能用来直接灌溉农田
C.全面规划,合理布局,进行区域性综合治理
ABC
考点3 溶液、悬浊液和乳浊液
6.[2020·重庆A]化学让我们鉴赏了溶液的颜色美,下列物质加入水中能形成有色溶液的是 ( )
A.碳酸钙 B.高锰酸钾
C.植物油 D.氯化钠
B
7.下列有关溶液的说法正确的是 ( )
A.溶液都是无色、澄清、透明的
B.固体物质的水溶液下层比上层密度大
C.一种溶液中各部分的浓度和性质都是一样的
D.静止后有沉淀析出的混合物一定是溶液
C
考点4 饱和溶液和不饱和溶液、溶解度、溶解度表
8.[2018·杭州]下列操作均在室温下进行,且不考虑水分的蒸发。则溶液中溶质的溶解度和溶质质量分数都发生变化的是 ( )
A.将一定量硝酸钾不饱和溶液升温10 ℃
B.将一定量饱和石灰水升温10 ℃
C.取一定量蔗糖不饱和溶液向其中加入少量蔗糖
D.取一定量氯化钠饱和溶液向其中加入少量水
B
9.[2019·嘉兴]20 ℃时,把36 g氯化钠放入64 g水中,使其充分溶解(20 ℃时氯化钠的溶解度为36 g)。对所得溶液的有关说法错误的是 ( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl-个数一定相等
C.溶液质量为100 g
D.溶质与溶剂质量比为9∶25
C
10.[2021·丽水]20 ℃时,
取一定质量的固体硝酸
钾于烧杯中,把100 g水
平均分成四份依次加入烧杯,不断搅拌,
使之充分溶解,实验过程如图35-4所示。下列分析正确的是 ( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
图35-4
B
11.[2020·嘉兴]某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是 ( )
A.变大 不变 B.变大 变小
C.不变 变大 D.不变 不变
D
12.[2021·杭州]已知:(1)20 ℃时,溶解度在10 g以上的物质称为易溶物质;溶解度在1~10 g的物质为可溶物质;溶解度在0.01~1 g的物质为微溶物质;溶解度小于0.01 g的物质为难溶物质。
(2)20 ℃时几种物质的溶解度如下:
下列说法正确的是 ( )
A.20 ℃时氢氧化钙是难溶物质
B.20 ℃时可以配制出20%的硝酸钾溶液
C.20 ℃时氯酸钾是易溶物质
D.20 ℃时硝酸钾的溶解度比氯化钠大
物质 名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度/g 36.0 0.165 7.4 31.6
B
考点5 溶液的溶质质量分数、配制一定溶质质量分数的溶液
13.有100 g 10%的盐酸,要使其溶质质量分数增大一倍,应采取的方法是 ( )
A.把溶液倒掉一半
B.溶质的质量增大一倍
C.将100 g 10%的盐酸与200 g 25%的盐酸混合
D.蒸发掉溶剂的质量是原溶液质量的一半
C
14.小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图35-5所示的实验:
(1)操作中不规范的步骤是 (填序号)。
(2)改正后,图示实验中正确的操作顺序是 (填序号)。
图35-5
③
②①④③⑤
(3)⑤中玻璃棒作用是 。
(4)小丽发现图示实验操作步骤不完整,应补充的是_________
。
图35-5
搅拌,加速溶解
装瓶贴标
签
例1 [改编]如图35-6所示是电解水的
实验过程,请回答下列问题。
(1)实验原理:发生反应的化学方程式为
,该反应的基本
类型是 ,电解过程中 能
转化为 能,电极X为电源的 极。
重点一
电解水实验
图35-6
分解反应
电
化学
负
(2)实验现象:①玻璃管 (填“a”或“b”)中
产生的气体能使带火星的木条复燃;②将燃着
的木条放在玻璃管 (填“a”或“b”)尖嘴处,
打开活塞,观察到气体燃烧并产生淡蓝色火焰,
证明该气体是 ,它是高效清洁能源物质,但目前工业上并不采用该方法制取它,原因是 (写一点);③正极产生了8 mL气体,则负极产生的气体体积约为 mL;④通电后中间球形容器内液面上升,其原因是___________________
。
b
a
氢气
耗能过高(或制取成本高,合理即可)
16
a、b玻璃管产生气
体,压强增大,水被压入中间球形容器内
(3)实验结论或推论:①宏观:水是由
和 组成的化合物
(理论依据是____________________
);②微观:
一个水分子是由 和
构成的,该变化中 (填“分子”或“原子”)种类发生了变化;③水中氢元素和氧元素的质量比是 。
图35-6
氢元素
氧元素
质量守恒定律(或化学
反应前后元素种类不变)
两个氢原子
一个氧原子
分子
1∶8
(4)拓展分析:①如图35-7所示能正确反映电解水过程中生成气体的质量或体积关系的是 (填序号)。若发现两侧玻璃管内气体体积比略大于2∶1,则可能的原因是__________
。
图35-7
B
氧气在水
中的溶解度大于氢气在水中的溶解度(合理即可)
②电解水过程可用图35-8表示,粒子变化的先后顺序是
(填序号)。
图35-8
dcab
③混有一定量空气或氧气的氢气遇明火可能
会发生爆炸,因此点燃氢气前一定要 。
Ⅰ.用拇指堵住集满氢气的试管口。
Ⅱ.靠近火焰,移开拇指点火,点燃前试管口朝
下的原因是 。
Ⅲ.发出尖锐的爆鸣声表示气体不纯,声音很小表示气体较纯。
图35-9
验纯
氢气的密度比空气小
不能加入NaCl增强水的导电性的理由是__________________
。为了
,可向水中加入少量稀硫酸,硫酸不发生反应,实验结束后,剩下的溶液与原溶液相比,发生改变的是 。
A.水的质量 B.溶质的质量
C.溶液的总质量 D.溶质的质量分数
加氯化钠会产生氯
气,干扰实验结果(或氯化钠参加反应,合理即可)
增强导电性
ACD
例2 [2021·绍兴]物质的溶解度不同,用途也不同。请据表回答:
表一 物质的溶解度(20 ℃)
表二 物质在水中的溶解性等级
重点二
饱和溶液和不饱和溶液、溶解度、溶解度表
物质 NaOH Ca(OH)2 CaCO3 CaSO3
溶解度/g 109 0.165 0.001 4 0.004 3
20 ℃时的溶解度/g >10 1~10 0.01~1 <0.01
等级 易溶 可溶 微溶 难溶
(1)实验中一般用氢氧化钠溶液吸收二氧化碳,而不用澄清石灰水来吸收二氧化碳,主要原因是氢氧化钙 于水,吸收效果不好。
物质 NaOH Ca(OH)2 CaCO3 CaSO3
溶解度/g 109 0.165 0.001 4 0.004 3
表一 物质的溶解度(20 ℃)
表二 物质在水中的溶解性等级
20 ℃时的溶解度/g >10 1~10 0.01~1 <0.01
等级 易溶 可溶 微溶 难溶
微溶
(2)实验中一般用澄清石灰水检验二氧化碳,但是根据上表可知能使澄清石灰水变浑浊的不一定是二氧化碳,也可能是二氧化硫,请用化学方程式说明: 。
物质 NaOH Ca(OH)2 CaCO3 CaSO3
溶解度/g 109 0.165 0.001 4 0.004 3
表一 物质的溶解度(20 ℃)
表二 物质在水中的溶解性等级
20 ℃时的溶解度/g >10 1~10 0.01~1 <0.01
等级 易溶 可溶 微溶 难溶
SO2+Ca(OH)2===CaSO3↓+H2O
(3)20 ℃时,饱和氢氧化钠溶液的溶质质量分数为 (精确到0.1%)。
物质 NaOH Ca(OH)2 CaCO3 CaSO3
溶解度/g 109 0.165 0.001 4 0.004 3
表一 物质的溶解度(20 ℃)
表二 物质在水中的溶解性等级
20 ℃时的溶解度/g >10 1~10 0.01~1 <0.01
等级 易溶 可溶 微溶 难溶
52.2%
例3 [改编]配制溶质质量分数为6%的氯化钠溶液的过程如图35-10所示,请回答:
重点三
配制一定溶质质量分数的溶液
图35-10
(1)图中操作不规范的步骤是 (填序号,下同),改正后,配制氯化钠溶液正确的操作顺序是 。
①
②①⑤③④
(2)称量:取氯化钠固体时,广口瓶的瓶塞应 (填“正放”或“倒放”)在桌面上;在使用天平时,药品放在 盘,砝码放在
盘,氯化钠不能直接放在托盘上,应铺上一张称量纸;称量时若托盘天平指针偏左,应该进行的操作是____________________
;量取水时所用到的仪器: 。
图35-10
倒放
左
右
减少固体质量,直至天
平平衡
量筒、胶头滴管
(3)溶解过程中玻璃棒的作用是 。
(4)配制好的溶液存放在 (填“广口瓶”或“细口瓶”)中;存放溶液时,为确保数据准确,试剂瓶用蒸馏水清洗后,_______
(填“能”或“不能”)立即倒入所配溶液封存。
将上述实验配制好的溶液装瓶后贴上标签,在标签上填写:
。
搅拌,加速溶解
细口瓶
不能
氯化钠溶液6%
(5)对配制的溶液进行
检测发现溶质的质量
分数偏小,其原因可能
有 (填序号,下同);
若发现溶质的质量分数偏大,其原因可能有 。
A.称量时,药品与砝码放反了,且使用了游码
B.装瓶时,有少量溶液洒出 C.氯化钠固体不纯
D.配制溶液的烧杯内壁沾有水 E.量取水时量筒内事先有少量水
F.将量筒中的水倒入烧杯时有水溅出
图35-10
ACD
F
(6)把50 g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
100
例4 [2020·杭州]小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是 ( )
A.10 ℃时硝酸钾的溶解度为40 g
B.②所得溶液一定是60 ℃时硝酸钾的饱和溶液
重点四
溶解度与溶质的质量分数的计算
序号 温度/ ℃ 水的质量/g 加入硝酸钾的 质量/g 所得溶液的质量/g
① 10 100 40 120.9
② 60 100 40 140
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10 ℃,则溶液的溶质质量分数会减小
序号 温度/ ℃ 水的质量/g 加入硝酸钾的 质量/g 所得溶液的质量/g
① 10 100 40 120.9
② 60 100 40 140
[答案] D
【变式】[2019·杭州]如图H4-11所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态。分析实验过程,可以作出的正确判断是 ( )
A.在①→②过程中,氯化钠的
质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
图35-11
D
1.[改编]小金用加入少量Na2SO4的水进行电解水实验,从该实验中不能获取的信息是 ( )
A.常温下,纯水的导电能力弱
B.负极产生气体的速率比正极快
C.正、负两极所得气体的质量比约为1∶2
D.水由氢元素和氧元素组成
C
2.[2019·温州]如图35-12,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据的是 ( )
A.砂糖水颜色很深
B.砂糖水味道很甜
C.砂糖溶解得很快
D.砂糖固体有剩余
图35-12
D
3.[2020·衢州]一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图35-13所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是 ( )
A.溶液质量不变
B.溶液的溶质质量分数变小
C.硝酸钾的溶解度变大
D.原溶液一定是饱和溶液
图35-13
B
4.在25 ℃时,向饱和的澄清石灰水中加入少量氧化钙,恢复到25 ℃时,关于该溶液的下列说法中正确的是 ( )
A.溶质质量不变
B.溶质质量减少
C.溶质质量分数减小
D.溶质质量分数变大
B
5.[2017·杭州]硫酸镁在工农业以及医疗上有广泛应用,其溶解度如下表所示。则下列说法正确的是 ( )
A.硫酸镁的溶解度随温度升高而增大
B.10 ℃时,27.7 g硫酸镁和72.3 g水可配制成质量分数为27.7%的硫酸镁溶液
C.50 ℃时,100 g硫酸镁饱和溶液中溶质和溶剂的质量比为49∶100
D.70 ℃时的硫酸镁饱和溶液升温至90 ℃,溶液的溶质质量分数增大
温度/℃ 10 30 50 70 90
溶解度/g 27.7 39.3 49.0 54.1 51.1
C
6.[2020·泰安]农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100 g该溶液的过程如图35-14所示。下列说法不正确的是 ( )
A.实验操作顺序为
④②①⑤③
B.②中需称量NaCl的质量为16.0 g
C.选用100 mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
图35-14
D
7.[2021·金华]常温下,取100 g质量分数为5%的NaCl溶液,先按实验1将NaCl溶液分成两等份,再进行实验2操作,如图35-15所示。
回答下列问题。
(1)配制100 g质量分数为5%的
NaCl溶液,不需要用到的仪器是
(填序号)。
A.集气瓶 B.烧杯 C.玻璃棒 D.量筒
图35-15
A
(2)完成实验2操作后,比较甲、乙两只烧杯中溶液的溶质质量分数,其大小关系是甲 (填“大于”“小于”或“等于”)乙。
图35-15
小于
第35课时 水和溶液
●知识体系梳理
●重难考点精讲
●当堂限时训练
知识体系
固体小颗粒悬浮在液体中形成的混合物
油状小液滴分散在另一种不相溶的液体中
形成的混合物
定义
组成
特点
分类
配制
均一
稳定
混合物
组成
性质
温度
溶剂
温度
溶剂
计算
称量(或量取)
溶解(或稀释)
重点梳理
1.通过电解水实验了解水的组成
项目 内容
实验装置 为了增强导电性,可在水中加入
少量H2SO4或NaOH
实验现象 ①两电极上都有 产生,两支试管内液面
②正极上产生能使带火星的木条复燃的 ;负极上产生能燃烧(产生淡蓝色火焰)的 ;且两者的体积比为
气泡
下降
O2
H2
1∶2
(续表)
项目 内容
实验结论 ①水在通电条件下生成氢气和氧气:
2H2O 2H2↑+O2↑
②宏观:水是由氢、氧两种元素组成的
③微观:水分子是由氢、氧两种原子构成的
④验证了在化学变化中,分子可以分成原子,而原子不可分
⑤证明了化学反应的实质是分子分裂成原子,原子重新结合成新的分子
2.水的主要性质
物理性质 常温下是无色无味的液体,沸点是① ℃(1标准大气压下),熔点是② ℃;4 ℃时,密度是③ g/cm3,结冰后密度④ ,比热容是⑤ J/(kg·℃);能溶解很多物质,是良好的溶剂(其他常见的溶剂有⑥ 、
⑦ 等)
化学性质 (1)在常温下化学性质稳定
(2)在通电条件下分解:2H2O 2H2↑+O2↑
100
0
1
变小
4.2×103
酒精
丙酮
化学性质 (3)某些非金属氧化物+水→酸:CO2+H2O === H2CO3
能与水反应生成酸的氧化物还有⑧ 等
(4)某些金属氧化物+水→碱:CaO+H2O === Ca(OH)2
能与水反应生成碱的氧化物还有⑨ 等
(5)CuSO4+5H2O === CuSO4·5H2O,白色粉末变蓝,可用于检验水
(6)参与光合作用
(续表)
SO2、SO3
K2O、Na2O、BaO
3.地球上的水体及其占比
图H4-1
淡水资源仅占总水量的 %,可供人类直接利用的水体仅占淡水总量的0.3%左右,包括 、_________
和 。
2.53
浅层地下淡水
湖泊淡水
河流水
4.水污染
水生
生物
富营养污染
水的再循环
减少水的使用
污染来源 防治措施
工业:未经处理的废水、废渣、废气的任意排放 采用新技术、新工艺,提高原料利用率,废水、废渣、废气综合处理,达标后排放
农业:过量使用农药和化肥 合理使用化肥和农药,提倡使用农家肥
生活:生活污水和垃圾的任意排放 污水集中处理和排放,少用含磷洗涤剂
5.比较溶液、悬浊液和乳浊液
溶液 悬浊液 乳浊液
分散物质 原有状态 固体、液体 或气体 固体小 颗粒 小液滴
特征 均一、稳定 不均一、不稳定、 久置产生沉淀或分层
共同点 都是混合物
举例 生理盐水、 汽水、碘酒 泥浆水、血 液、钡餐 牛奶、肥皂
水、油汤
6.饱和溶液和不饱和溶液的判断及转化
(1)判断方法: 。
继续加入少量相同溶质,看是否能继续溶解
不饱和
溶液
饱和溶
液
(2)相互转化的方法(对大多数溶质为固体的溶液而言)
一般规律:对大多数溶解度随温度升高而增大的物质(如KNO3)
(3)结晶
①蒸发结晶法:适用于溶解度受温度变化较小的物质,如氯化钠。
②降温结晶法:适用于溶解度随温度升高而增大,且溶解度受温度变化较大的物质,如硝酸钾。
7.溶解性和溶解度
定性
温度
溶剂
饱和
质量
溶质
溶剂
增大
减小
会查阅溶解度表:
熟石灰在20 ℃时的溶解度为 g。
温度/℃ 0 20 40 60
溶解度/g 0.173 0.165 0.121 0.076
硝酸铵
氢氧化钠
氯化钠
0.165
8.配制一定溶质质量分数的氯化钠溶液时的误差分析
溶质质量分数 误差分析 可能的原因
偏大 溶液中水的 质量偏小 量取水时俯视读数
量取的水倒入烧杯时有水溅出
溶液中氯化钠 质量偏大 砝码生锈或沾有油污等
偏小 溶液中氯化钠 质量偏小 氯化钠中含有杂质
氯化钠倒入烧杯时纸片上有残留
溶液中水的 质量偏大 量取水时仰视读数
烧杯内原有少量水
9.溶液的溶质质量分数的计算
(1)溶质的质量分数是溶液组成的 表示方法,可以用小数或百分数表示。
(2)①所有溶液:溶质的质量分数=×100%。
②饱和溶液:溶质的质量分数=×100%。
定量
③已知溶液密度和体积时:
溶质的质量分数=×100%。
④溶质的质量= × 。
⑤溶液的质量=
⑥溶液稀释:根据稀释前后 质量不变,可得:
m浓溶液×a%=m稀溶液×b%。
溶液的质量
溶质的质量分数
溶质
考点1 水的组成和主要性质
对点练习
图35-2
1.[2019·杭州]如图35-2是教材中用来表示电解水过程的示意图(其中“ ”“ ” 分别表示H原子和O原子)。分析示意图,可作出的正确判断是 ( )
A.常温常压下水可以发生分解反应
B.电解水的最终产物是H、O原子
C.H原子是图示微粒中的最小微粒
D.O原子只有在通电条件下才能转化为O2分子
图35-2
[答案] C
2.[2017·杭州]小金在做电解水实验时,先在
水中加入少量含酚酞的硫酸钠溶液(硫酸钠
溶液呈中性),再通直流电一段时间,现象如
图35-3所示。则下列说法正确的是( )
A.用燃着的木条检验气体a,发现木条上火焰熄灭
B.在酒精灯火焰上检验气体b,气体b不能燃烧
C.与电源负极相连的电极附近的溶液中存在大量OH-
D.在此反应中化学能转化为电能
图35-3
C
3.水与我们生命、生活息息相关。下列关于水的认识正确的是 ( )
A.冰的密度小于水的密度
B.水结冰时要吸收热量
C.无色无味的水即可以放心饮用
D.水能溶解所有的物质
A
考点2 水资源和水污染
4.2021年3月22日是第29个世界水日,今年的主题是“珍惜水、爱护水”。下列对于水的认识正确的是 ( )
A.用废水浇灌农田以降低成本
B.地球上的淡水资源有限
C.明矾用于自来水杀菌、消毒
D.经自来水厂处理后的生活用水是纯净物
B
5.[2015·绍兴]五水共治指的是治污水、防洪水、排涝水、保供水、抓节水。绍兴市近几年在污染治理方面取得了显著成效,全市工业废水排污达标率100%,生活用水也得到了很好的治理。下列对生活污水的处理,你认为合理的是 (填序号)。
A.洗脸、厨房用水等可以用来冲洗马桶
B.用“洁厕灵”清洗洁具后的冲刷液不能用来直接灌溉农田
C.全面规划,合理布局,进行区域性综合治理
ABC
考点3 溶液、悬浊液和乳浊液
6.[2020·重庆A]化学让我们鉴赏了溶液的颜色美,下列物质加入水中能形成有色溶液的是 ( )
A.碳酸钙 B.高锰酸钾
C.植物油 D.氯化钠
B
7.下列有关溶液的说法正确的是 ( )
A.溶液都是无色、澄清、透明的
B.固体物质的水溶液下层比上层密度大
C.一种溶液中各部分的浓度和性质都是一样的
D.静止后有沉淀析出的混合物一定是溶液
C
考点4 饱和溶液和不饱和溶液、溶解度、溶解度表
8.[2018·杭州]下列操作均在室温下进行,且不考虑水分的蒸发。则溶液中溶质的溶解度和溶质质量分数都发生变化的是 ( )
A.将一定量硝酸钾不饱和溶液升温10 ℃
B.将一定量饱和石灰水升温10 ℃
C.取一定量蔗糖不饱和溶液向其中加入少量蔗糖
D.取一定量氯化钠饱和溶液向其中加入少量水
B
9.[2019·嘉兴]20 ℃时,把36 g氯化钠放入64 g水中,使其充分溶解(20 ℃时氯化钠的溶解度为36 g)。对所得溶液的有关说法错误的是 ( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl-个数一定相等
C.溶液质量为100 g
D.溶质与溶剂质量比为9∶25
C
10.[2021·丽水]20 ℃时,
取一定质量的固体硝酸
钾于烧杯中,把100 g水
平均分成四份依次加入烧杯,不断搅拌,
使之充分溶解,实验过程如图35-4所示。下列分析正确的是 ( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
图35-4
B
11.[2020·嘉兴]某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是 ( )
A.变大 不变 B.变大 变小
C.不变 变大 D.不变 不变
D
12.[2021·杭州]已知:(1)20 ℃时,溶解度在10 g以上的物质称为易溶物质;溶解度在1~10 g的物质为可溶物质;溶解度在0.01~1 g的物质为微溶物质;溶解度小于0.01 g的物质为难溶物质。
(2)20 ℃时几种物质的溶解度如下:
下列说法正确的是 ( )
A.20 ℃时氢氧化钙是难溶物质
B.20 ℃时可以配制出20%的硝酸钾溶液
C.20 ℃时氯酸钾是易溶物质
D.20 ℃时硝酸钾的溶解度比氯化钠大
物质 名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度/g 36.0 0.165 7.4 31.6
B
考点5 溶液的溶质质量分数、配制一定溶质质量分数的溶液
13.有100 g 10%的盐酸,要使其溶质质量分数增大一倍,应采取的方法是 ( )
A.把溶液倒掉一半
B.溶质的质量增大一倍
C.将100 g 10%的盐酸与200 g 25%的盐酸混合
D.蒸发掉溶剂的质量是原溶液质量的一半
C
14.小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图35-5所示的实验:
(1)操作中不规范的步骤是 (填序号)。
(2)改正后,图示实验中正确的操作顺序是 (填序号)。
图35-5
③
②①④③⑤
(3)⑤中玻璃棒作用是 。
(4)小丽发现图示实验操作步骤不完整,应补充的是_________
。
图35-5
搅拌,加速溶解
装瓶贴标
签
例1 [改编]如图35-6所示是电解水的
实验过程,请回答下列问题。
(1)实验原理:发生反应的化学方程式为
,该反应的基本
类型是 ,电解过程中 能
转化为 能,电极X为电源的 极。
重点一
电解水实验
图35-6
分解反应
电
化学
负
(2)实验现象:①玻璃管 (填“a”或“b”)中
产生的气体能使带火星的木条复燃;②将燃着
的木条放在玻璃管 (填“a”或“b”)尖嘴处,
打开活塞,观察到气体燃烧并产生淡蓝色火焰,
证明该气体是 ,它是高效清洁能源物质,但目前工业上并不采用该方法制取它,原因是 (写一点);③正极产生了8 mL气体,则负极产生的气体体积约为 mL;④通电后中间球形容器内液面上升,其原因是___________________
。
b
a
氢气
耗能过高(或制取成本高,合理即可)
16
a、b玻璃管产生气
体,压强增大,水被压入中间球形容器内
(3)实验结论或推论:①宏观:水是由
和 组成的化合物
(理论依据是____________________
);②微观:
一个水分子是由 和
构成的,该变化中 (填“分子”或“原子”)种类发生了变化;③水中氢元素和氧元素的质量比是 。
图35-6
氢元素
氧元素
质量守恒定律(或化学
反应前后元素种类不变)
两个氢原子
一个氧原子
分子
1∶8
(4)拓展分析:①如图35-7所示能正确反映电解水过程中生成气体的质量或体积关系的是 (填序号)。若发现两侧玻璃管内气体体积比略大于2∶1,则可能的原因是__________
。
图35-7
B
氧气在水
中的溶解度大于氢气在水中的溶解度(合理即可)
②电解水过程可用图35-8表示,粒子变化的先后顺序是
(填序号)。
图35-8
dcab
③混有一定量空气或氧气的氢气遇明火可能
会发生爆炸,因此点燃氢气前一定要 。
Ⅰ.用拇指堵住集满氢气的试管口。
Ⅱ.靠近火焰,移开拇指点火,点燃前试管口朝
下的原因是 。
Ⅲ.发出尖锐的爆鸣声表示气体不纯,声音很小表示气体较纯。
图35-9
验纯
氢气的密度比空气小
不能加入NaCl增强水的导电性的理由是__________________
。为了
,可向水中加入少量稀硫酸,硫酸不发生反应,实验结束后,剩下的溶液与原溶液相比,发生改变的是 。
A.水的质量 B.溶质的质量
C.溶液的总质量 D.溶质的质量分数
加氯化钠会产生氯
气,干扰实验结果(或氯化钠参加反应,合理即可)
增强导电性
ACD
例2 [2021·绍兴]物质的溶解度不同,用途也不同。请据表回答:
表一 物质的溶解度(20 ℃)
表二 物质在水中的溶解性等级
重点二
饱和溶液和不饱和溶液、溶解度、溶解度表
物质 NaOH Ca(OH)2 CaCO3 CaSO3
溶解度/g 109 0.165 0.001 4 0.004 3
20 ℃时的溶解度/g >10 1~10 0.01~1 <0.01
等级 易溶 可溶 微溶 难溶
(1)实验中一般用氢氧化钠溶液吸收二氧化碳,而不用澄清石灰水来吸收二氧化碳,主要原因是氢氧化钙 于水,吸收效果不好。
物质 NaOH Ca(OH)2 CaCO3 CaSO3
溶解度/g 109 0.165 0.001 4 0.004 3
表一 物质的溶解度(20 ℃)
表二 物质在水中的溶解性等级
20 ℃时的溶解度/g >10 1~10 0.01~1 <0.01
等级 易溶 可溶 微溶 难溶
微溶
(2)实验中一般用澄清石灰水检验二氧化碳,但是根据上表可知能使澄清石灰水变浑浊的不一定是二氧化碳,也可能是二氧化硫,请用化学方程式说明: 。
物质 NaOH Ca(OH)2 CaCO3 CaSO3
溶解度/g 109 0.165 0.001 4 0.004 3
表一 物质的溶解度(20 ℃)
表二 物质在水中的溶解性等级
20 ℃时的溶解度/g >10 1~10 0.01~1 <0.01
等级 易溶 可溶 微溶 难溶
SO2+Ca(OH)2===CaSO3↓+H2O
(3)20 ℃时,饱和氢氧化钠溶液的溶质质量分数为 (精确到0.1%)。
物质 NaOH Ca(OH)2 CaCO3 CaSO3
溶解度/g 109 0.165 0.001 4 0.004 3
表一 物质的溶解度(20 ℃)
表二 物质在水中的溶解性等级
20 ℃时的溶解度/g >10 1~10 0.01~1 <0.01
等级 易溶 可溶 微溶 难溶
52.2%
例3 [改编]配制溶质质量分数为6%的氯化钠溶液的过程如图35-10所示,请回答:
重点三
配制一定溶质质量分数的溶液
图35-10
(1)图中操作不规范的步骤是 (填序号,下同),改正后,配制氯化钠溶液正确的操作顺序是 。
①
②①⑤③④
(2)称量:取氯化钠固体时,广口瓶的瓶塞应 (填“正放”或“倒放”)在桌面上;在使用天平时,药品放在 盘,砝码放在
盘,氯化钠不能直接放在托盘上,应铺上一张称量纸;称量时若托盘天平指针偏左,应该进行的操作是____________________
;量取水时所用到的仪器: 。
图35-10
倒放
左
右
减少固体质量,直至天
平平衡
量筒、胶头滴管
(3)溶解过程中玻璃棒的作用是 。
(4)配制好的溶液存放在 (填“广口瓶”或“细口瓶”)中;存放溶液时,为确保数据准确,试剂瓶用蒸馏水清洗后,_______
(填“能”或“不能”)立即倒入所配溶液封存。
将上述实验配制好的溶液装瓶后贴上标签,在标签上填写:
。
搅拌,加速溶解
细口瓶
不能
氯化钠溶液6%
(5)对配制的溶液进行
检测发现溶质的质量
分数偏小,其原因可能
有 (填序号,下同);
若发现溶质的质量分数偏大,其原因可能有 。
A.称量时,药品与砝码放反了,且使用了游码
B.装瓶时,有少量溶液洒出 C.氯化钠固体不纯
D.配制溶液的烧杯内壁沾有水 E.量取水时量筒内事先有少量水
F.将量筒中的水倒入烧杯时有水溅出
图35-10
ACD
F
(6)把50 g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
100
例4 [2020·杭州]小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是 ( )
A.10 ℃时硝酸钾的溶解度为40 g
B.②所得溶液一定是60 ℃时硝酸钾的饱和溶液
重点四
溶解度与溶质的质量分数的计算
序号 温度/ ℃ 水的质量/g 加入硝酸钾的 质量/g 所得溶液的质量/g
① 10 100 40 120.9
② 60 100 40 140
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10 ℃,则溶液的溶质质量分数会减小
序号 温度/ ℃ 水的质量/g 加入硝酸钾的 质量/g 所得溶液的质量/g
① 10 100 40 120.9
② 60 100 40 140
[答案] D
【变式】[2019·杭州]如图H4-11所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态。分析实验过程,可以作出的正确判断是 ( )
A.在①→②过程中,氯化钠的
质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
图35-11
D
1.[改编]小金用加入少量Na2SO4的水进行电解水实验,从该实验中不能获取的信息是 ( )
A.常温下,纯水的导电能力弱
B.负极产生气体的速率比正极快
C.正、负两极所得气体的质量比约为1∶2
D.水由氢元素和氧元素组成
C
2.[2019·温州]如图35-12,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据的是 ( )
A.砂糖水颜色很深
B.砂糖水味道很甜
C.砂糖溶解得很快
D.砂糖固体有剩余
图35-12
D
3.[2020·衢州]一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图35-13所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是 ( )
A.溶液质量不变
B.溶液的溶质质量分数变小
C.硝酸钾的溶解度变大
D.原溶液一定是饱和溶液
图35-13
B
4.在25 ℃时,向饱和的澄清石灰水中加入少量氧化钙,恢复到25 ℃时,关于该溶液的下列说法中正确的是 ( )
A.溶质质量不变
B.溶质质量减少
C.溶质质量分数减小
D.溶质质量分数变大
B
5.[2017·杭州]硫酸镁在工农业以及医疗上有广泛应用,其溶解度如下表所示。则下列说法正确的是 ( )
A.硫酸镁的溶解度随温度升高而增大
B.10 ℃时,27.7 g硫酸镁和72.3 g水可配制成质量分数为27.7%的硫酸镁溶液
C.50 ℃时,100 g硫酸镁饱和溶液中溶质和溶剂的质量比为49∶100
D.70 ℃时的硫酸镁饱和溶液升温至90 ℃,溶液的溶质质量分数增大
温度/℃ 10 30 50 70 90
溶解度/g 27.7 39.3 49.0 54.1 51.1
C
6.[2020·泰安]农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100 g该溶液的过程如图35-14所示。下列说法不正确的是 ( )
A.实验操作顺序为
④②①⑤③
B.②中需称量NaCl的质量为16.0 g
C.选用100 mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
图35-14
D
7.[2021·金华]常温下,取100 g质量分数为5%的NaCl溶液,先按实验1将NaCl溶液分成两等份,再进行实验2操作,如图35-15所示。
回答下列问题。
(1)配制100 g质量分数为5%的
NaCl溶液,不需要用到的仪器是
(填序号)。
A.集气瓶 B.烧杯 C.玻璃棒 D.量筒
图35-15
A
(2)完成实验2操作后,比较甲、乙两只烧杯中溶液的溶质质量分数,其大小关系是甲 (填“大于”“小于”或“等于”)乙。
图35-15
小于
同课章节目录
