2022年浙江省中考科学一轮复习 第39课时 盐和化肥(课件 46张PPT)
文档属性
| 名称 | 2022年浙江省中考科学一轮复习 第39课时 盐和化肥(课件 46张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-01-11 20:52:00 | ||
图片预览






文档简介
(共46张PPT)
第39课时 盐和化肥
●知识体系梳理
●重难考点精讲
●当堂限时训练
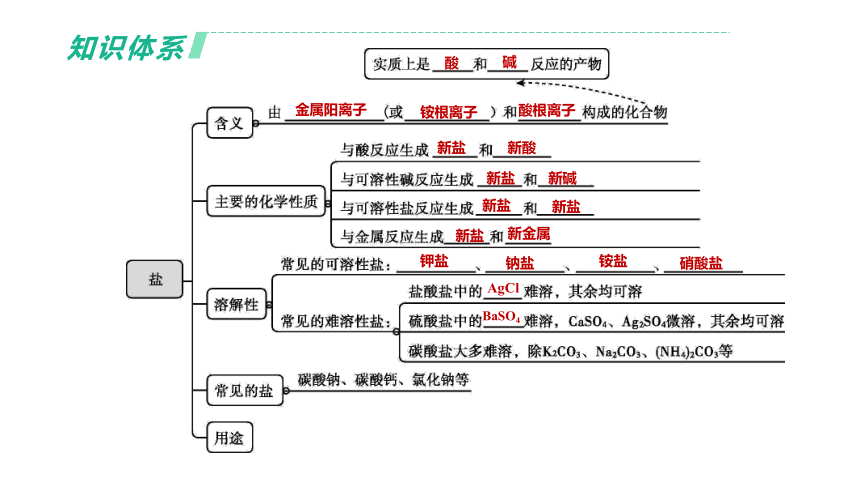
知识体系
金属阳离子
铵根离子
酸根离子
酸
碱
新盐
新酸
新盐
新碱
新盐
新盐
新盐
新金属
钾盐
钠盐
铵盐
硝酸盐
AgCl
BaSO4
重点梳理
1.纯碱、碳酸钙、氯化钠的主要性质和用途
常见的盐
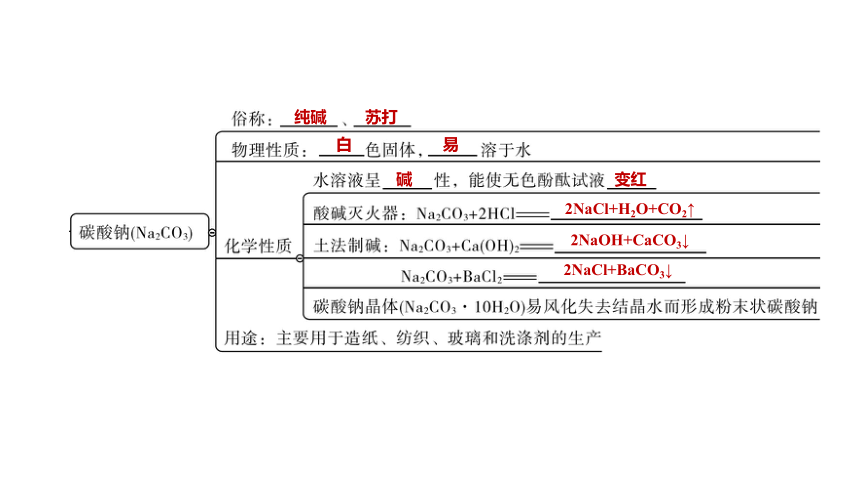
碳酸钠(Na2CO3)
碳酸钙(CaCO3)
氯化钠(NaCl)
纯碱
苏打
白
易
碱
变红
2NaCl+H2O+CO2↑
2NaOH+CaCO3↓
2NaCl+BaCO3↓
白
难
CaCO3+2HCl === CaCl2+H2O+CO2↑
食盐
易
AgCl↓+NaNO3
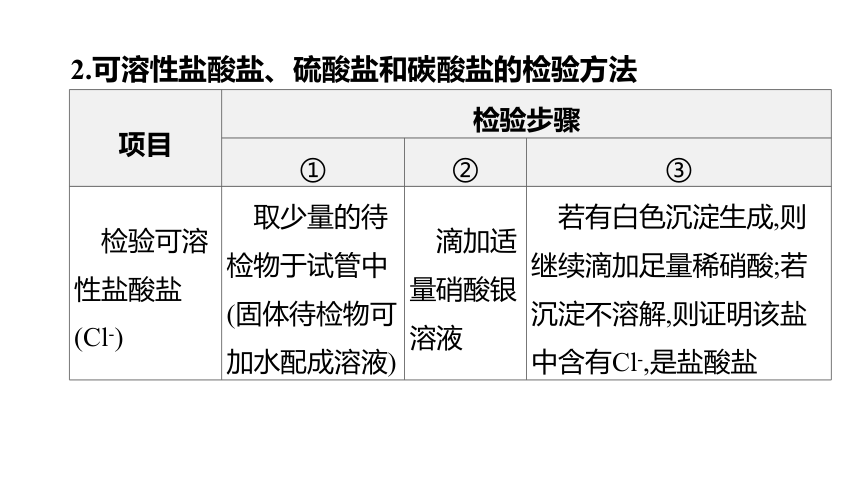
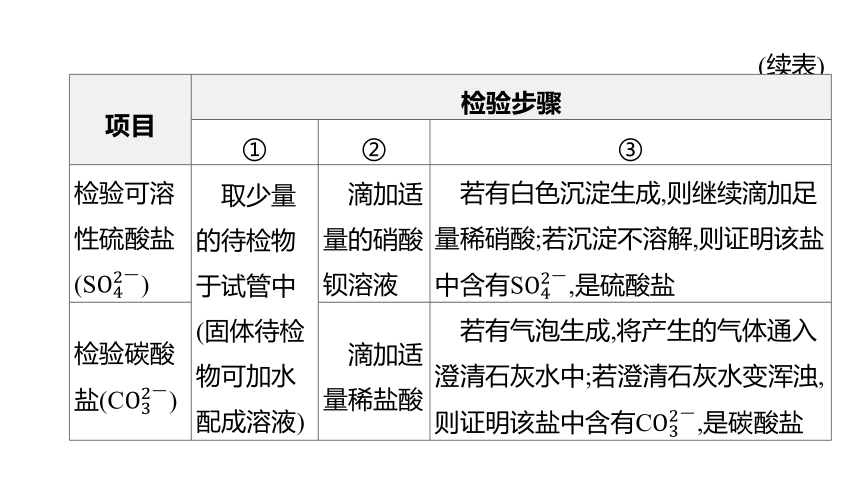
2.可溶性盐酸盐、硫酸盐和碳酸盐的检验方法
项目 检验步骤
① ② ③
检验可溶性盐酸盐(Cl-) 取少量的待检物于试管中 (固体待检物可加水配成溶液) 滴加适量硝酸银溶液 若有白色沉淀生成,则继续滴加足量稀硝酸;若沉淀不溶解,则证明该盐中含有Cl-,是盐酸盐
(续表)
项目 检验步骤
① ② ③
检验可溶性硫酸盐(S) 取少量的待检物于试管中 (固体待检物可加水配成溶液) 滴加适量的硝酸钡溶液 若有白色沉淀生成,则继续滴加足量稀硝酸;若沉淀不溶解,则证明该盐中含有S,是硫酸盐
检验碳酸盐(C) 滴加适量稀盐酸 若有气泡生成,将产生的气体通入澄清石灰水中;若澄清石灰水变浑浊,则证明该盐中含有C,是碳酸盐
考点1 常见盐的性质及其用途
1.下列关于碳酸钙的说法错误的是 ( )
A.大理石的主要成分是碳酸钙
B.实验室常用碳酸钙与稀硫酸反应制取CO2
C.碳酸钙可用作补钙剂
D.石灰浆粉刷墙壁,“出汗”后变成碳酸钙
对点练习
B
2.[2020·台州]厨房里有两瓶白色固体,分别为食盐(主要成分为NaCl)和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是 。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是 。
方案二:加水溶解,分别滴加_____________________________
溶液,有沉淀产生的是纯碱。
食盐
纯碱
氯化钙(或含Ba2+、Ca2+的可溶
性盐或碱均可)
考点2 酸碱盐的综合题
3.[2020·嘉兴]学习了物质分类与转化规律后,
某同学绘制了部分物质间相互反应的关系图
(图39-1)。图中阴影部分表示相邻两类物质
的反应,其中不能用于制取ZnCl2的是 ( )
A.① B.②
C.③ D.④
图39-1
C
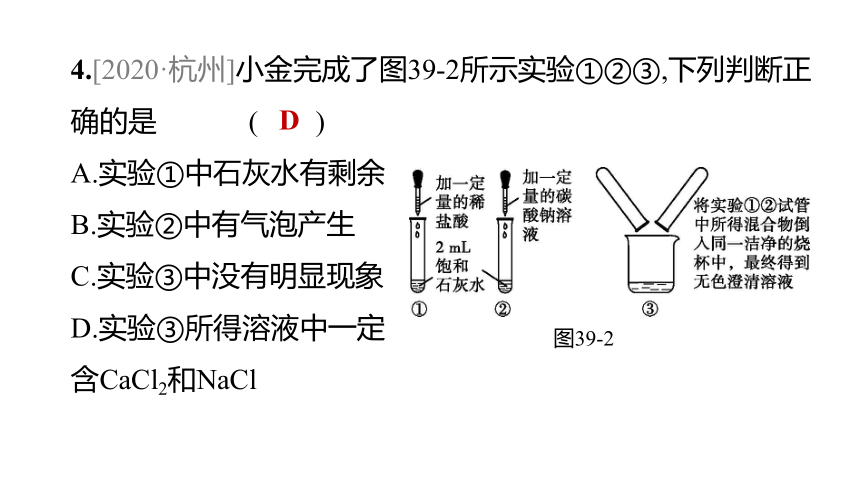
4.[2020·杭州]小金完成了图39-2所示实验①②③,下列判断正确的是 ( )
A.实验①中石灰水有剩余
B.实验②中有气泡产生
C.实验③中没有明显现象
D.实验③所得溶液中一定
含CaCl2和NaCl
图39-2
D
5.[2020·金华] “飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令”游戏规则,进行物质间转化的接龙比赛,其比赛规则是从同一物质开始进行转化,接龙物质不能重复且必须含有指定元素,以转化路径长且正确者为比赛胜者。某两场比赛的过程记录如下(“→”表示某一种物质经一步反应可转化为另一种物质)。
(1)指定元素:氢元素 起始物质:HCl 比赛胜者:乙同学
甲同学:HCl→H2O 乙同学:HCl→H2O→
乙同学在方框中应填物质的化学式是___________________________
(写一种即可)。
Ca(OH)2(或H2等,合理即可)
(2)指定元素:钡元素 起始物质:BaO 比赛胜者:丁同学
丙同学:BaO→Ba(OH)2→BaSO4
下列能使丁同学获胜的方案有 (填序号)。
A.BaO→BaSO4→Ba(OH)2→BaCO3
B.BaO→BaCl2→Ba(NO3)2→BaSO4
C.BaO→Ba(OH)2→BaCO3→BaCl2→Ba(NO3)2→BaSO4
D.BaO→BaCl2→BaCO3→Ba(NO3)2→Ba(OH)2→BaSO4
BC
6. [2020·湖州]小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,试管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2不能完全溶于水所致。但随后小明通过实验证实了沉淀不是MgCl2。你认为小明的实验操作是
。
取少量沉淀于试管中,加入足量水
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释:______________________________
。
镁和水反应,生成的氢氧化镁覆盖在镁条表面阻止了反应的进行
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀。小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并生成氯化镁、硝酸镁和水的碱式氯化镁[Mg(OH)Cl]。请你设计实验验证沉淀中含有氯元素:______________________________________
_______________________________________________。
取沉淀洗涤干净后,加稀硝酸溶解,再加硝酸银溶液,若有白色沉淀生成,则证明沉淀中含有氯元素
7.[2021·杭州]某种粗盐水中有少量含S、K+的杂质,小金用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
(1)固体A是 (填化学式)。
图39-3
BaSO4
(2)加碳酸钠溶液时发生反应的化学方程式为
。
(3)若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净的氯化钠,理由是
。
BaCl2+Na2CO3===BaCO3↓+2NaCl
钾离子未除去
考点3 有关盐的定量测定
8.[2017·杭州]测定BaCl2·xH2O中结晶水数目的过程如图39-4所示:
(1)写出此过程中生成沉淀的化学方程式:
。
图39-4
BaCl2+H2SO4 === BaSO4↓+2HCl
(2)在灼烧过程中,如果空气不充足和温度过高,会有部分沉淀物质转化为BaS,这会使x的测定结果 (填“偏大”“偏小”或“不变”)。
图39-4
偏大
考点4 化肥
9.[2021·杭州三区期末]氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品,可作为化肥,其水溶液呈酸性。下列关于氯化铵的说法,正确的是( )
A.氯化铵是一种复合肥料
B.氯化铵能促使农作物籽粒饱满
C.氯化铵溶液能使紫色石蕊变蓝
D.氯化铵溶液的pH<7
D
例1 某学校的课外活动小组要测定某块盐碱地中的NaCl、Na2SO4、Na2CO3的含量,为盐碱地的改造提供依据。下面是他们的测定步骤:
Ⅰ.确定要测定地块的采样点。
Ⅱ.将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液。
重点一
盐的主要化学性质
Ⅲ.对所取滤液进行如图39-5所示实验(实验过程中所加试剂均是足量的,得到的所有沉淀中的阴离子都来自原土壤滤出液中):
Ⅳ.称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量。
图39-5
(1)上述实验中试剂A的化学式是 ,试剂B的化学式是 ,气体和试剂C反应的化学方程式是
。
(2)若上述实验中试剂A为氯化钡溶液,则按上述实验步骤最终测得土壤中 的含量偏高。
图39-5
Ba(NO3)2
HNO3(或HCl)
CO2+Ba(OH)2 === BaCO3↓+H2O
NaCl(或氯化钠)
【变式】 “低钠盐”可以控制钠的摄入量从而防治高血压等疾病。制备“低钠盐”在食盐中按照配方比例添加食用KCl。国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2)。
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%。该样品a的水溶液中,含量最多的离子是 (填离子符号)。
Cl-
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种)。请设计实验方案,完成下列表格。
限选试剂:BaCl2溶液、NaOH溶液、AgNO3溶液、蒸馏水。
实验操作 预期现象及结论
步骤1:取少量样品b于烧杯中,____________ ___________________ 样品溶解,形成无色溶液
步骤2:取少量步骤1形成的溶液于试管中,再滴加少量NaOH溶液,振荡 ,说明样品b中添加了镁盐
步骤3:________________________________ ______________________________________ ________________________
_________________________
_________________________
加足量蒸馏
水,并用玻璃棒搅拌
有白色沉淀生成
取少量步骤1形成的溶液于试管中,再滴加少量的BaCl2溶液,振荡
若有白色沉淀产生,则添加
的是MgSO4;若无明显现象,
则添加的是MgCl2
例2 Na2CO3是一种常见的盐,多角度看物质可以提高对该物质的认识。
(1)Na2CO3俗称 。
(2)从类别看,Na2CO3可以看作是某种碱和某种氧化物反应的产物。该反应的化学方程式为 。
(3)从用途看,Na2CO3可制备某些物质,如Na2CO3+M→NaOH+N,写出该反应的化学方程式:__________________________________。
重点二
食盐、纯碱、碳酸钙的主要性质及用途
纯碱、苏打
2NaOH+CO2=== Na2CO3+H2O
Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH
(4)从组成看,Na2CO3、NaCl均属于钠盐,NaCl溶于水显中性,但Na2CO3溶于水显碱性。请完善实验方案,探析上述性质差异的初步原因:
实验步骤 实验现象 实验结论
取适量NaCl溶液于试管中,滴加石蕊试液,振荡 ①______________ Na+和Cl-与溶液的酸碱性无关
取适量滴有酚酞试液的Na2CO3溶液少许于试管中,滴加② ③ ________________ ④___________
_____________
_____________
无明显现象
过量CaCl2溶液(合理即可)
产生白色沉淀,
溶液红色消失
Na2CO3溶
于水呈碱性与
C有关
1.下列物质的名称、俗称与用途对应正确的是( )
选项 物质名称 俗称 用途
A 碳酸钠 火碱 制造玻璃
B 碳酸钙 生石灰 制取二氧化碳
C 氢氧化钙 消石灰 作干燥剂
D 氯化钠 食盐 制备纯碱
D
2.实验表明,用碱性溶液浸泡新鲜的蔬菜,能有效除去蔬菜上的残留农药,从而降低对人体的损害。根据上述原理,对刚买回来的蔬菜,你认为应浸泡在哪种溶液中 ( )
A.白酒 B.食醋
C.烧碱溶液 D.碳酸钠溶液
D
3.玲玲猜测一瓶久置于空气中的NaOH溶液中可能含有了Na2CO3,她设计的下列实验能对此猜测提供有力实证的是 ( )
A.滴加适量CuSO4溶液
B.滴加酚酞试液
C.滴加足量稀盐酸
D.滴加石蕊试液
C
4.“部分酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,下表是截取溶解性表中的一部分,有关①处物质的说法不正确的是 ( )
A.①处物质的化学式是FeCl2
B.①处物质的名称是氯化铁
C.①处物质可溶于水
D.①处物质类别属于盐
阴离子 阳离子 OH- Cl-
… … …
Fe2+ 不 ①
… … …
B
5.[2021·杭州江干期末]甲、乙、丙、丁、
戊分别是Fe2O3、H2SO4、Ba(OH)2溶液、
Na2CO3溶液、CO2中的一种。如图39-6中
横线表示相邻物质可以相互反应,丙与甲、乙、丁均能反应生成白色沉淀,甲、丙产生的白色沉淀能和丁溶液反应。下列说法正确的是( )
A.甲一定是Na2CO3溶液 B.丁和戊反应后溶液一定呈黄色
C.乙与戊一定都是氧化物
D.丙与丁反应生成的沉淀一定溶于稀硝酸
图39-6
B
6.化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,将其任意编号为A、B、C、D、E,然后两两混合进行实验,其部分实验现象如下表(说明:硫酸钙视为可溶物)。
(1)写出溶液A中溶质的化学式: 。
实验 A+B B+C B+D C+D
现象 产生沉淀 产生气体 产生沉淀 产生沉淀
Ca(OH)2
(2)写出溶液A与B反应的化学方程式:
。
(3)写出溶液C和D反应的化学方程式:
。
实验 A+B B+C B+D C+D
现象 产生沉淀 产生气体 产生沉淀 产生沉淀
Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH
BaCl2+H2SO4===BaSO4↓+2HCl
7.[2021·杭州滨江一模]如图39-7甲所示,向盛有CuO的试管中加入一定量的稀硫酸,CuO全部溶解并得到蓝色溶液;继续向试管中加入一定量的BaCl2溶液,观察到有白色沉淀生成。试管静置后,向上层清液中继续滴加NaOH溶液,又有沉淀生成,且新生成的沉淀质量跟滴加的NaOH溶液质量的关系如图乙所示。
图39-7
(1)写出CuO全部溶解的化学方程式:
。
(2)图乙中A点对应溶液中溶质所有可能的组成有___________
。
图39-7
CuO+H2SO4 === CuSO4+H2O
氯化钠;硫
酸钠和氯化钠;氯化钠和氯化钡
8.[2021·湖州南浔一模]已知碳酸钠溶
液呈碱性,随着盐酸的滴入溶液碱性减
弱(pH变小),反应存在两个过程:先发生
Na2CO3+HCl === NaHCO3+NaCl,后发生
NaHCO3+HCl === NaCl+CO2↑+H2O。向碳酸钠溶液中滴入盐酸的反应过程中C、HC和H2CO3含量变化如图39-8所示。据图回答下列问题。
图39-8
(1)加入盐酸使溶液pH为10时,混合液中含碳元素的离子有 。
(2)曲线0~B段混合溶液中发生反应的化学方程式为
。
C、HC
Na2CO3+HCl===NaHCO3+NaCl
图39-8
(3)混合溶液中当pH=8时没有逸出CO2
气体,而pH=6时开始逸出CO2气体,这是
为什么 __________________________
_________________________________
_________________________________
。
图39-8
pH=8时碳酸钠和稀盐酸恰好完全反应生成碳酸氢钠和氯化钠,而pH=6时碳酸氢钠和盐酸开始反应生成二氧化碳
9.[2021·绍兴柯桥一模]某小组同学利用pH传感器对碳酸氢钠、碳酸钠的某些性质进行以下探究。25 ℃时,向等体积、含等量碳元素的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的盐酸,用pH传感器测得pH变化与时间的关系如图39-9甲、乙所示。将图乙的阴影部分与图甲进行叠加,发现两者基本重合。回答下列问题。
图39-9
(1)开始实验时NaHCO3溶液呈 (填“碱性”“酸性”或“中性”)。
(2)a点的溶质为 (填化学式)。
图39-9
碱性
HCl、NaCl
(3)依据实验获取的信息,你说说如何区分NaHCO3溶液和Na2CO3溶液:_________________________________________
____________________________________________________
。
图39-9
取适量溶液于试管中,逐滴滴加稀盐酸,如果立即产生气泡,说明是碳酸氢钠溶液,如果一段时间后产生气泡,说明是碳酸钠溶液
(4)含有等量碳元素的NaHCO3和Na2CO3溶液,加入足量的盐酸,产生二氧化碳的质量 。
A.碳酸氢钠多 B.碳酸钠多
C.两者一样多 D.无法确定
图39-9
C
10.[2016·丽水]我国著名化工专家侯德榜创立了“侯氏制碱法”,促进了我国民族工业的发展。其生产原理是在氯化钠饱和溶液中通入氨气,再通入二氧化碳,使溶解度较小的碳酸氢钠从溶液中以沉淀的形式析出:NaCl+NH3+CO2+H2O===NH4Cl+
NaHCO3↓。过滤出碳酸氢钠晶体,再受热分解得到产品:
(1)“侯氏制碱法”制得的“碱”是 (写化学式)。
Na2CO3
(2)根据化学方程式计算,5.85 t NaCl可制得8.4 t NaHCO3,实际上从反应后的混合物溶液中析出NaHCO3晶体的质量_______
(填“大于”“小于”或“等于”)8.4 t。
小于
第39课时 盐和化肥
●知识体系梳理
●重难考点精讲
●当堂限时训练
知识体系
金属阳离子
铵根离子
酸根离子
酸
碱
新盐
新酸
新盐
新碱
新盐
新盐
新盐
新金属
钾盐
钠盐
铵盐
硝酸盐
AgCl
BaSO4
重点梳理
1.纯碱、碳酸钙、氯化钠的主要性质和用途
常见的盐
碳酸钠(Na2CO3)
碳酸钙(CaCO3)
氯化钠(NaCl)
纯碱
苏打
白
易
碱
变红
2NaCl+H2O+CO2↑
2NaOH+CaCO3↓
2NaCl+BaCO3↓
白
难
CaCO3+2HCl === CaCl2+H2O+CO2↑
食盐
易
AgCl↓+NaNO3
2.可溶性盐酸盐、硫酸盐和碳酸盐的检验方法
项目 检验步骤
① ② ③
检验可溶性盐酸盐(Cl-) 取少量的待检物于试管中 (固体待检物可加水配成溶液) 滴加适量硝酸银溶液 若有白色沉淀生成,则继续滴加足量稀硝酸;若沉淀不溶解,则证明该盐中含有Cl-,是盐酸盐
(续表)
项目 检验步骤
① ② ③
检验可溶性硫酸盐(S) 取少量的待检物于试管中 (固体待检物可加水配成溶液) 滴加适量的硝酸钡溶液 若有白色沉淀生成,则继续滴加足量稀硝酸;若沉淀不溶解,则证明该盐中含有S,是硫酸盐
检验碳酸盐(C) 滴加适量稀盐酸 若有气泡生成,将产生的气体通入澄清石灰水中;若澄清石灰水变浑浊,则证明该盐中含有C,是碳酸盐
考点1 常见盐的性质及其用途
1.下列关于碳酸钙的说法错误的是 ( )
A.大理石的主要成分是碳酸钙
B.实验室常用碳酸钙与稀硫酸反应制取CO2
C.碳酸钙可用作补钙剂
D.石灰浆粉刷墙壁,“出汗”后变成碳酸钙
对点练习
B
2.[2020·台州]厨房里有两瓶白色固体,分别为食盐(主要成分为NaCl)和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是 。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是 。
方案二:加水溶解,分别滴加_____________________________
溶液,有沉淀产生的是纯碱。
食盐
纯碱
氯化钙(或含Ba2+、Ca2+的可溶
性盐或碱均可)
考点2 酸碱盐的综合题
3.[2020·嘉兴]学习了物质分类与转化规律后,
某同学绘制了部分物质间相互反应的关系图
(图39-1)。图中阴影部分表示相邻两类物质
的反应,其中不能用于制取ZnCl2的是 ( )
A.① B.②
C.③ D.④
图39-1
C
4.[2020·杭州]小金完成了图39-2所示实验①②③,下列判断正确的是 ( )
A.实验①中石灰水有剩余
B.实验②中有气泡产生
C.实验③中没有明显现象
D.实验③所得溶液中一定
含CaCl2和NaCl
图39-2
D
5.[2020·金华] “飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令”游戏规则,进行物质间转化的接龙比赛,其比赛规则是从同一物质开始进行转化,接龙物质不能重复且必须含有指定元素,以转化路径长且正确者为比赛胜者。某两场比赛的过程记录如下(“→”表示某一种物质经一步反应可转化为另一种物质)。
(1)指定元素:氢元素 起始物质:HCl 比赛胜者:乙同学
甲同学:HCl→H2O 乙同学:HCl→H2O→
乙同学在方框中应填物质的化学式是___________________________
(写一种即可)。
Ca(OH)2(或H2等,合理即可)
(2)指定元素:钡元素 起始物质:BaO 比赛胜者:丁同学
丙同学:BaO→Ba(OH)2→BaSO4
下列能使丁同学获胜的方案有 (填序号)。
A.BaO→BaSO4→Ba(OH)2→BaCO3
B.BaO→BaCl2→Ba(NO3)2→BaSO4
C.BaO→Ba(OH)2→BaCO3→BaCl2→Ba(NO3)2→BaSO4
D.BaO→BaCl2→BaCO3→Ba(NO3)2→Ba(OH)2→BaSO4
BC
6. [2020·湖州]小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,试管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2不能完全溶于水所致。但随后小明通过实验证实了沉淀不是MgCl2。你认为小明的实验操作是
。
取少量沉淀于试管中,加入足量水
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释:______________________________
。
镁和水反应,生成的氢氧化镁覆盖在镁条表面阻止了反应的进行
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀。小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并生成氯化镁、硝酸镁和水的碱式氯化镁[Mg(OH)Cl]。请你设计实验验证沉淀中含有氯元素:______________________________________
_______________________________________________。
取沉淀洗涤干净后,加稀硝酸溶解,再加硝酸银溶液,若有白色沉淀生成,则证明沉淀中含有氯元素
7.[2021·杭州]某种粗盐水中有少量含S、K+的杂质,小金用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
(1)固体A是 (填化学式)。
图39-3
BaSO4
(2)加碳酸钠溶液时发生反应的化学方程式为
。
(3)若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净的氯化钠,理由是
。
BaCl2+Na2CO3===BaCO3↓+2NaCl
钾离子未除去
考点3 有关盐的定量测定
8.[2017·杭州]测定BaCl2·xH2O中结晶水数目的过程如图39-4所示:
(1)写出此过程中生成沉淀的化学方程式:
。
图39-4
BaCl2+H2SO4 === BaSO4↓+2HCl
(2)在灼烧过程中,如果空气不充足和温度过高,会有部分沉淀物质转化为BaS,这会使x的测定结果 (填“偏大”“偏小”或“不变”)。
图39-4
偏大
考点4 化肥
9.[2021·杭州三区期末]氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品,可作为化肥,其水溶液呈酸性。下列关于氯化铵的说法,正确的是( )
A.氯化铵是一种复合肥料
B.氯化铵能促使农作物籽粒饱满
C.氯化铵溶液能使紫色石蕊变蓝
D.氯化铵溶液的pH<7
D
例1 某学校的课外活动小组要测定某块盐碱地中的NaCl、Na2SO4、Na2CO3的含量,为盐碱地的改造提供依据。下面是他们的测定步骤:
Ⅰ.确定要测定地块的采样点。
Ⅱ.将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液。
重点一
盐的主要化学性质
Ⅲ.对所取滤液进行如图39-5所示实验(实验过程中所加试剂均是足量的,得到的所有沉淀中的阴离子都来自原土壤滤出液中):
Ⅳ.称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量。
图39-5
(1)上述实验中试剂A的化学式是 ,试剂B的化学式是 ,气体和试剂C反应的化学方程式是
。
(2)若上述实验中试剂A为氯化钡溶液,则按上述实验步骤最终测得土壤中 的含量偏高。
图39-5
Ba(NO3)2
HNO3(或HCl)
CO2+Ba(OH)2 === BaCO3↓+H2O
NaCl(或氯化钠)
【变式】 “低钠盐”可以控制钠的摄入量从而防治高血压等疾病。制备“低钠盐”在食盐中按照配方比例添加食用KCl。国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2)。
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%。该样品a的水溶液中,含量最多的离子是 (填离子符号)。
Cl-
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种)。请设计实验方案,完成下列表格。
限选试剂:BaCl2溶液、NaOH溶液、AgNO3溶液、蒸馏水。
实验操作 预期现象及结论
步骤1:取少量样品b于烧杯中,____________ ___________________ 样品溶解,形成无色溶液
步骤2:取少量步骤1形成的溶液于试管中,再滴加少量NaOH溶液,振荡 ,说明样品b中添加了镁盐
步骤3:________________________________ ______________________________________ ________________________
_________________________
_________________________
加足量蒸馏
水,并用玻璃棒搅拌
有白色沉淀生成
取少量步骤1形成的溶液于试管中,再滴加少量的BaCl2溶液,振荡
若有白色沉淀产生,则添加
的是MgSO4;若无明显现象,
则添加的是MgCl2
例2 Na2CO3是一种常见的盐,多角度看物质可以提高对该物质的认识。
(1)Na2CO3俗称 。
(2)从类别看,Na2CO3可以看作是某种碱和某种氧化物反应的产物。该反应的化学方程式为 。
(3)从用途看,Na2CO3可制备某些物质,如Na2CO3+M→NaOH+N,写出该反应的化学方程式:__________________________________。
重点二
食盐、纯碱、碳酸钙的主要性质及用途
纯碱、苏打
2NaOH+CO2=== Na2CO3+H2O
Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH
(4)从组成看,Na2CO3、NaCl均属于钠盐,NaCl溶于水显中性,但Na2CO3溶于水显碱性。请完善实验方案,探析上述性质差异的初步原因:
实验步骤 实验现象 实验结论
取适量NaCl溶液于试管中,滴加石蕊试液,振荡 ①______________ Na+和Cl-与溶液的酸碱性无关
取适量滴有酚酞试液的Na2CO3溶液少许于试管中,滴加② ③ ________________ ④___________
_____________
_____________
无明显现象
过量CaCl2溶液(合理即可)
产生白色沉淀,
溶液红色消失
Na2CO3溶
于水呈碱性与
C有关
1.下列物质的名称、俗称与用途对应正确的是( )
选项 物质名称 俗称 用途
A 碳酸钠 火碱 制造玻璃
B 碳酸钙 生石灰 制取二氧化碳
C 氢氧化钙 消石灰 作干燥剂
D 氯化钠 食盐 制备纯碱
D
2.实验表明,用碱性溶液浸泡新鲜的蔬菜,能有效除去蔬菜上的残留农药,从而降低对人体的损害。根据上述原理,对刚买回来的蔬菜,你认为应浸泡在哪种溶液中 ( )
A.白酒 B.食醋
C.烧碱溶液 D.碳酸钠溶液
D
3.玲玲猜测一瓶久置于空气中的NaOH溶液中可能含有了Na2CO3,她设计的下列实验能对此猜测提供有力实证的是 ( )
A.滴加适量CuSO4溶液
B.滴加酚酞试液
C.滴加足量稀盐酸
D.滴加石蕊试液
C
4.“部分酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,下表是截取溶解性表中的一部分,有关①处物质的说法不正确的是 ( )
A.①处物质的化学式是FeCl2
B.①处物质的名称是氯化铁
C.①处物质可溶于水
D.①处物质类别属于盐
阴离子 阳离子 OH- Cl-
… … …
Fe2+ 不 ①
… … …
B
5.[2021·杭州江干期末]甲、乙、丙、丁、
戊分别是Fe2O3、H2SO4、Ba(OH)2溶液、
Na2CO3溶液、CO2中的一种。如图39-6中
横线表示相邻物质可以相互反应,丙与甲、乙、丁均能反应生成白色沉淀,甲、丙产生的白色沉淀能和丁溶液反应。下列说法正确的是( )
A.甲一定是Na2CO3溶液 B.丁和戊反应后溶液一定呈黄色
C.乙与戊一定都是氧化物
D.丙与丁反应生成的沉淀一定溶于稀硝酸
图39-6
B
6.化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,将其任意编号为A、B、C、D、E,然后两两混合进行实验,其部分实验现象如下表(说明:硫酸钙视为可溶物)。
(1)写出溶液A中溶质的化学式: 。
实验 A+B B+C B+D C+D
现象 产生沉淀 产生气体 产生沉淀 产生沉淀
Ca(OH)2
(2)写出溶液A与B反应的化学方程式:
。
(3)写出溶液C和D反应的化学方程式:
。
实验 A+B B+C B+D C+D
现象 产生沉淀 产生气体 产生沉淀 产生沉淀
Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH
BaCl2+H2SO4===BaSO4↓+2HCl
7.[2021·杭州滨江一模]如图39-7甲所示,向盛有CuO的试管中加入一定量的稀硫酸,CuO全部溶解并得到蓝色溶液;继续向试管中加入一定量的BaCl2溶液,观察到有白色沉淀生成。试管静置后,向上层清液中继续滴加NaOH溶液,又有沉淀生成,且新生成的沉淀质量跟滴加的NaOH溶液质量的关系如图乙所示。
图39-7
(1)写出CuO全部溶解的化学方程式:
。
(2)图乙中A点对应溶液中溶质所有可能的组成有___________
。
图39-7
CuO+H2SO4 === CuSO4+H2O
氯化钠;硫
酸钠和氯化钠;氯化钠和氯化钡
8.[2021·湖州南浔一模]已知碳酸钠溶
液呈碱性,随着盐酸的滴入溶液碱性减
弱(pH变小),反应存在两个过程:先发生
Na2CO3+HCl === NaHCO3+NaCl,后发生
NaHCO3+HCl === NaCl+CO2↑+H2O。向碳酸钠溶液中滴入盐酸的反应过程中C、HC和H2CO3含量变化如图39-8所示。据图回答下列问题。
图39-8
(1)加入盐酸使溶液pH为10时,混合液中含碳元素的离子有 。
(2)曲线0~B段混合溶液中发生反应的化学方程式为
。
C、HC
Na2CO3+HCl===NaHCO3+NaCl
图39-8
(3)混合溶液中当pH=8时没有逸出CO2
气体,而pH=6时开始逸出CO2气体,这是
为什么 __________________________
_________________________________
_________________________________
。
图39-8
pH=8时碳酸钠和稀盐酸恰好完全反应生成碳酸氢钠和氯化钠,而pH=6时碳酸氢钠和盐酸开始反应生成二氧化碳
9.[2021·绍兴柯桥一模]某小组同学利用pH传感器对碳酸氢钠、碳酸钠的某些性质进行以下探究。25 ℃时,向等体积、含等量碳元素的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的盐酸,用pH传感器测得pH变化与时间的关系如图39-9甲、乙所示。将图乙的阴影部分与图甲进行叠加,发现两者基本重合。回答下列问题。
图39-9
(1)开始实验时NaHCO3溶液呈 (填“碱性”“酸性”或“中性”)。
(2)a点的溶质为 (填化学式)。
图39-9
碱性
HCl、NaCl
(3)依据实验获取的信息,你说说如何区分NaHCO3溶液和Na2CO3溶液:_________________________________________
____________________________________________________
。
图39-9
取适量溶液于试管中,逐滴滴加稀盐酸,如果立即产生气泡,说明是碳酸氢钠溶液,如果一段时间后产生气泡,说明是碳酸钠溶液
(4)含有等量碳元素的NaHCO3和Na2CO3溶液,加入足量的盐酸,产生二氧化碳的质量 。
A.碳酸氢钠多 B.碳酸钠多
C.两者一样多 D.无法确定
图39-9
C
10.[2016·丽水]我国著名化工专家侯德榜创立了“侯氏制碱法”,促进了我国民族工业的发展。其生产原理是在氯化钠饱和溶液中通入氨气,再通入二氧化碳,使溶解度较小的碳酸氢钠从溶液中以沉淀的形式析出:NaCl+NH3+CO2+H2O===NH4Cl+
NaHCO3↓。过滤出碳酸氢钠晶体,再受热分解得到产品:
(1)“侯氏制碱法”制得的“碱”是 (写化学式)。
Na2CO3
(2)根据化学方程式计算,5.85 t NaCl可制得8.4 t NaHCO3,实际上从反应后的混合物溶液中析出NaHCO3晶体的质量_______
(填“大于”“小于”或“等于”)8.4 t。
小于
同课章节目录
