陕西省榆林市2021-2022学年高二上学期期末考试化学试题(Word版含答案)
文档属性
| 名称 | 陕西省榆林市2021-2022学年高二上学期期末考试化学试题(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-11 00:00:00 | ||
图片预览




文档简介
榆林市2021-2022学年高二上学期期末考试
化学
注意事项:
1.本试卷满分100分,答题时间100分钟;
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
第I卷(选择题 共48分)
一、选择题(本大题共16小题,每小题3分,计48分。每小题只有一个选项是符合题意的)
1. 我国毛笔的制作技艺属于国家非物质文化遗产,相传古人制作该毛笔的过程为“以枯木为管,鹿毛为柱,羊毛为被(外衣)”,则下列说法正确的是
A. 枯木的主要成分为蛋白质
B. 鹿毛、羊毛均只含有C、H、O三种元素
C. 枯木、鹿毛的主要成分互为同分异构体
D. 采用灼烧法可以区分枯木、毛笔的“外衣”
2. 下列有机物的系统命名正确的是
A. 对二甲苯
B. 2-甲基-4-己烯
C. 2,5-二甲基-3-乙基己烷
D 1,4-二甲基丁烷
3. 下列事实中,与盐类水解无关的是
A. 溶液呈酸性
B. 溶液可除去铁制品表面的锈斑
C. 溶液蒸干后得不到固体
D. 长期施用化肥会使土壤酸性增大,发生板结
4. 在四个不同容器中、不同条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A. v(H2)=0.01mol·L-1·s-1 B. v(NH3)=0.25mol·L-1·min-1
C. v(H2)=0.3mol·L-1·min-1 D. v(N2)=0.1mol·L-1·min-1
5. 让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=S2(g)+2H2O(g) ΔH2
③H2S(g)+O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A. ΔH4=(ΔH1+ΔH2-3ΔH3) B. ΔH4=(3ΔH3-ΔH1-ΔH2)
C. ΔH4=(ΔH1-ΔH2+3ΔH3) D. ΔH4=(ΔH1-ΔH2-3ΔH3)
6. 下列卤代烃,既能发生水解反应,又能发生消去反应且只能得到两种单烯烃的是
A. B.
C. D.
7. 从柑桔中可提炼出苧烯()。下列关于苧烯的说法中正确的是
A. 不溶于水,1mol苧烯与氢气反应,最多消耗2molH2
B. 分子式为C10H15
C. 与1,3-丁二烯互为同系物
D. 与过量Br2的CCl4溶液反应的产物可能为
8. 某反应历程包含两个基元反应,能量变化如图所示(E为正值,单位:)。下列说法正确的是
A. 该总反应的活化能
B. 对于的反应,必须加热才能进行
C. 该总反应的焓变
D. 此条件下,基元反应的反应速率第二个大于第一个
9. 下列实验装置符合实验目的是( )
目的 粗铜的精炼 验证NaCl溶液(含酚酞)的产物 在铁制品上镀铜 构成原电池
装置
选项 A B C D
A. A B. B C. C D. D
10. 实验室利用如图装置制取有机物,下列说法错误的是( )
A. 根据温度计读数的不同,可制取乙烯和乙醚
B. b为恒压滴液漏斗,其优点是便于液体顺利滴下
C. 将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D. 浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
11. 莽草酸是一种合成治疗禽流感药物达菲的原料;鞣酸存在于苹果、生石榴等植物中。下列说法正确的是
A. 两种酸都能与溴水反应,反应类型相同
B. 鞣酸分子中,可能在同一平面上的原子最多有14个
C. 鞣酸分子与莽草酸分子相比,多了两个碳碳双键
D. 中和等物质的量的莽草酸、鞣酸,消耗NaOH的物质的量之比为1:4
12. 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示,下列与此原理有关说法正确的是
A. 输送暖气的管道更容易发生此类腐蚀
B. 正极反应:+9H++8e-=HS-+4H2O
C. 这种情况下,Fe腐蚀的最终产物为Fe2O3 xH2O
D. 管道上刷富锌油漆可以延缓管道的腐蚀
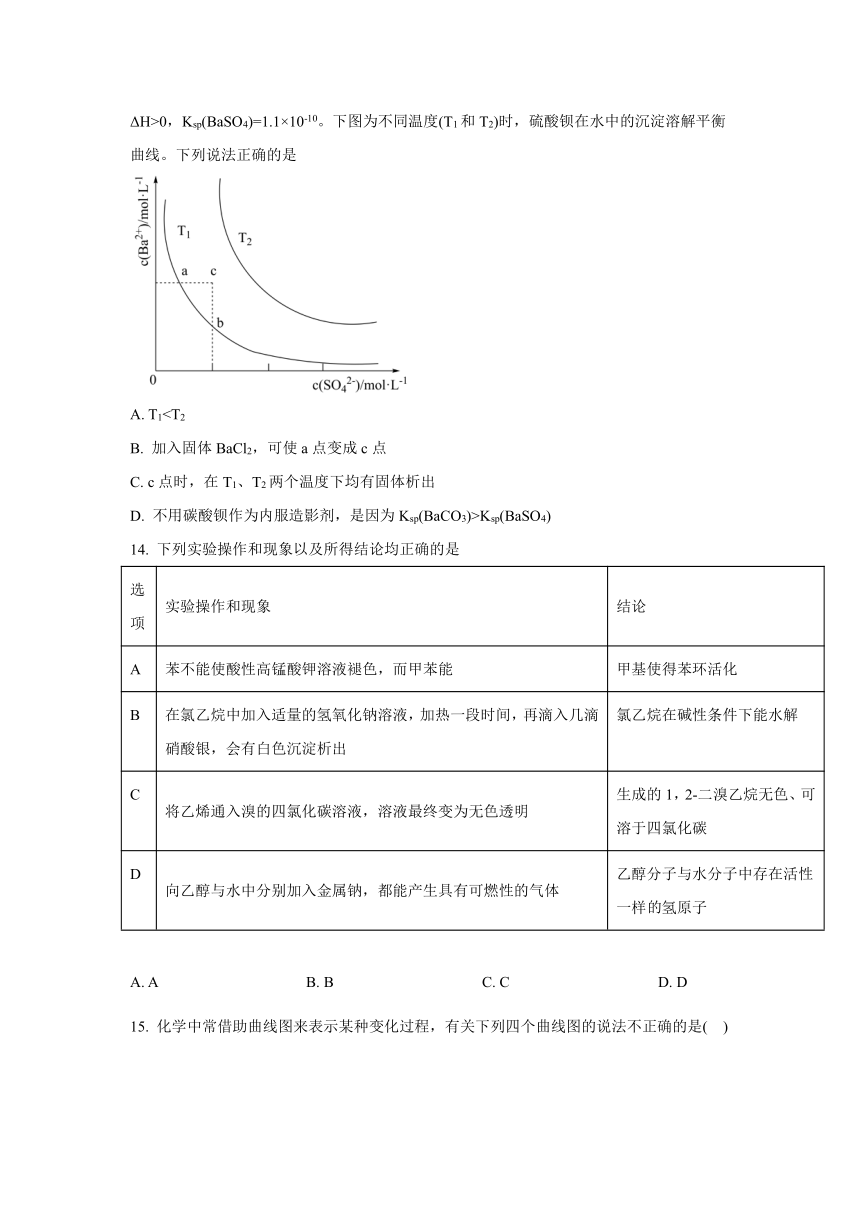
13. 医院中常用硫酸钡作为内服造影剂,即钡餐,已知BaSO4(s) Ba2+(aq)+SO (aq) ΔH>0,Ksp(BaSO4)=1.1×10-10。下图为不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线。下列说法正确的是
A. T1B. 加入固体BaCl2,可使a点变成c点
C. c点时,在T1、T2两个温度下均有固体析出
D. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
14. 下列实验操作和现象以及所得结论均正确的是
选项 实验操作和现象 结论
A 苯不能使酸性高锰酸钾溶液褪色,而甲苯能 甲基使得苯环活化
B 在氯乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银,会有白色沉淀析出 氯乙烷在碱性条件下能水解
C 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
D 向乙醇与水中分别加入金属钠,都能产生具有可燃性的气体 乙醇分子与水分子中存在活性一样氢原子
A. A B. B C. C D. D
15. 化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
A. 对反应:aA(s)+2B(g) xC(g),根据图①可以求出x=2
B. 图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C. 图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大
D. 升高温度,图④表示的反应中反应物的转化率增大
16. 用0.10 mol·L—1NaOH溶液滴定20.0mL 0.10 mol·L—1H2A溶液,溶液pH和温度随的变化曲线如图所示,下列说法不正确的
A. Z点为第二反应终点
B. 25℃,H2A的电离常数Ka2=10—9.7
C. 当=1时,c(Na+)=c(H2A)+c(HA—)+c(A2—)
D. 从W至Z点,Kw增大,且c(H+)—c(OH—)=2c(A2—)+c(HA—)—c(Na+)
第II卷(非选择题 共52分)
二、非选择题(本大题共5小题,计52分)
17. 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为___________。
②0.01 mol·L-1的NH3·H2O的pH=___________。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH___________(填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为___________。
(2)甲酸钠(HCOONa)属于_______(填“强”或“弱”)电解质,HCOONa溶液呈碱性原因是_________(用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=_______mol·L-1。
18. 用酸碱中和滴定法测定某烧碱的纯度。
I.滴定管的使用:
(1)如图是滴定管中液面,其读数为___________mL。
II.配制待测液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
III.滴定:
(2)①盛装0.2000mol·L-1盐酸标准液应用下图的___________(填“甲”或“乙”)滴定管。
②滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂;滴定过程中眼睛应注视_____,当____时为滴定终点。
③有关数据记录如下:
滴定序号 待测液体积(mL) 消耗盐酸标准液的体积(mL)
滴定前 滴定后
1 20.00 0.50 20.70
2 20.00 6.00 26.00
3 20.00 1.00 21.10
IV.纯度计算:
(3)烧碱样品的纯度为___________(精确到0.1%)。
(4)对下列几种情况的讨论(填“偏高”、“偏低”或“无影响”):
①若用蒸馏水冲洗锥形瓶,会使测定结果___________。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果___________。
③若滴定前仰视读数,滴定后俯视读数,会使测定结果___________。
19. 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x为电解水,装置y为燃料电池。
①太阳能电池的能量转化形式为___________(填字母)。
A.化学能转化为电能 B.电能转化为化学能 C.光能转化为电能
②装置x工作时,产生O2的电极为___________极。
③装置y工作时,若电解质溶液稀硫酸,则正极反应式为___________。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:___________。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的,镍电极有气泡产生。已知Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在___________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是___________。
20. 我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。当前,科学家成功利用CO2和H2合成了CH3CH2OH、CH3OH,这对节能减排、降低碳排放具有重大意义。回答下列问题:
(1)一定压强下,测得某密闭容器中由CO2和H2制备CH3CH2OH的实验数据中,起始投料比、温度与CO2转化率的关系如图所示。
已知:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH。
①每生成0.2molCH3CH2OH产生的热量为akJ(a为正值),则ΔH=_______kJ·mol-1(用含a的代数式表示)。
②在上述条件下,发生该反应适宜的温度为_______(填“500”、“600”、“700”或“800”)K,判断的理由为________。
③某温度下,向2L恒容密闭容器中充入2molH2和1molCO2,2min末反应达到平衡,此时测得反应前后的总压强之比为5:3,则CO2的平衡转化率为_____,0~2min内,v(CH3CH2OH)=______ mol·L-1·min-1。
(2)对于CO2和H2合成CH3CH2OH的反应,下列说法正确的是___________(填字母)。
a.混合气体的平均相对分子质量不再发生改变时,该反应达到平衡
b.加入合适的催化剂,正、逆反应速率均增大,同时CH3CH2OH的产率也提高
c.H2的物质的量分数不再发生改变时,该反应达到平衡
d.增大压强,可提高CO2的转化率,同时平衡常数也增大
(3)将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49kJ·mol-1,测得CO2的平衡转化率随温度、压强的变化如图所示。
①Y表示___________(填“温度”或“压强”),X1___________(填“>”、“=”或“<”)X2。
②若M点对应平衡压强为10MPa,则对应的平衡常数KP=___________(精确到0.01,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
21. 一种用于治疗高血脂的新药I的合成路线如图:
已知:①RCHO+CH3CHO;
②→RCHO。
回答下列问题:
(1)B的化学名称为___________;H的分子式为___________。
(2)E的结构简式为___________;G中所含官能团的名称是___________。
(3)②的反应类型是___________。写出反应①的化学方程式___________。
(4)化合物W比C多一个“CH2”,能同时满足①遇FeCl3溶液显紫色、②属于芳香族化合物、③能发生银镜反应条件的W的结构有___________种(不考虑立体异构,填字母)。
a.10 b.12 c.13 d.14
(5)设计用乙醇为原料制备CH2=CH-CH=CH2的合成路线(其他无机试剂任选)___________。
榆林市2021-2022学年高二上学期期末考试
化学 答案版
注意事项:
1.本试卷满分100分,答题时间100分钟;
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
第I卷(选择题 共48分)
一、选择题(本大题共16小题,每小题3分,计48分。每小题只有一个选项是符合题意的)
1. 我国毛笔的制作技艺属于国家非物质文化遗产,相传古人制作该毛笔的过程为“以枯木为管,鹿毛为柱,羊毛为被(外衣)”,则下列说法正确的是
A. 枯木的主要成分为蛋白质
B. 鹿毛、羊毛均只含有C、H、O三种元素
C. 枯木、鹿毛的主要成分互为同分异构体
D. 采用灼烧法可以区分枯木、毛笔的“外衣”
答案 D
2. 下列有机物的系统命名正确的是
A. 对二甲苯
B. 2-甲基-4-己烯
C. 2,5-二甲基-3-乙基己烷
D 1,4-二甲基丁烷
答案 C
3. 下列事实中,与盐类水解无关的是
A. 溶液呈酸性
B. 溶液可除去铁制品表面的锈斑
C. 溶液蒸干后得不到固体
D. 长期施用化肥会使土壤酸性增大,发生板结
答案 A
4. 在四个不同容器中、不同条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A. v(H2)=0.01mol·L-1·s-1 B. v(NH3)=0.25mol·L-1·min-1
C. v(H2)=0.3mol·L-1·min-1 D. v(N2)=0.1mol·L-1·min-1
答案 A
5. 让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=S2(g)+2H2O(g) ΔH2
③H2S(g)+O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A. ΔH4=(ΔH1+ΔH2-3ΔH3) B. ΔH4=(3ΔH3-ΔH1-ΔH2)
C. ΔH4=(ΔH1-ΔH2+3ΔH3) D. ΔH4=(ΔH1-ΔH2-3ΔH3)
答案 A
6. 下列卤代烃,既能发生水解反应,又能发生消去反应且只能得到两种单烯烃的是
A. B.
C. D.
答案 B
7. 从柑桔中可提炼出苧烯()。下列关于苧烯的说法中正确的是
A. 不溶于水,1mol苧烯与氢气反应,最多消耗2molH2
B. 分子式为C10H15
C. 与1,3-丁二烯互为同系物
D. 与过量Br2的CCl4溶液反应的产物可能为
答案 A
8. 某反应历程包含两个基元反应,能量变化如图所示(E为正值,单位:)。下列说法正确的是
A. 该总反应的活化能
B. 对于的反应,必须加热才能进行
C. 该总反应的焓变
D. 此条件下,基元反应的反应速率第二个大于第一个
答案 C
9. 下列实验装置符合实验目的是( )
目的 粗铜的精炼 验证NaCl溶液(含酚酞)的产物 在铁制品上镀铜 构成原电池
装置
选项 A B C D
A. A B. B C. C D. D
答案 D
10. 实验室利用如图装置制取有机物,下列说法错误的是( )
A. 根据温度计读数的不同,可制取乙烯和乙醚
B. b为恒压滴液漏斗,其优点是便于液体顺利滴下
C. 将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D. 浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
答案 C
11. 莽草酸是一种合成治疗禽流感药物达菲的原料;鞣酸存在于苹果、生石榴等植物中。下列说法正确的是
A. 两种酸都能与溴水反应,反应类型相同
B. 鞣酸分子中,可能在同一平面上的原子最多有14个
C. 鞣酸分子与莽草酸分子相比,多了两个碳碳双键
D. 中和等物质的量的莽草酸、鞣酸,消耗NaOH的物质的量之比为1:4
答案 D
12. 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示,下列与此原理有关说法正确的是
A. 输送暖气的管道更容易发生此类腐蚀
B. 正极反应:+9H++8e-=HS-+4H2O
C. 这种情况下,Fe腐蚀的最终产物为Fe2O3 xH2O
D. 管道上刷富锌油漆可以延缓管道的腐蚀
答案 D
13. 医院中常用硫酸钡作为内服造影剂,即钡餐,已知BaSO4(s) Ba2+(aq)+SO (aq) ΔH>0,Ksp(BaSO4)=1.1×10-10。下图为不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线。下列说法正确的是
A. T1B. 加入固体BaCl2,可使a点变成c点
C. c点时,在T1、T2两个温度下均有固体析出
D. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
答案 A
14. 下列实验操作和现象以及所得结论均正确的是
选项 实验操作和现象 结论
A 苯不能使酸性高锰酸钾溶液褪色,而甲苯能 甲基使得苯环活化
B 在氯乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银,会有白色沉淀析出 氯乙烷在碱性条件下能水解
C 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
D 向乙醇与水中分别加入金属钠,都能产生具有可燃性的气体 乙醇分子与水分子中存在活性一样氢原子
A. A B. B C. C D. D
答案 C
15. 化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
A. 对反应:aA(s)+2B(g) xC(g),根据图①可以求出x=2
B. 图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C. 图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大
D. 升高温度,图④表示的反应中反应物的转化率增大
答案 B
16. 用0.10 mol·L—1NaOH溶液滴定20.0mL 0.10 mol·L—1H2A溶液,溶液pH和温度随的变化曲线如图所示,下列说法不正确的
A. Z点为第二反应终点
B. 25℃,H2A的电离常数Ka2=10—9.7
C. 当=1时,c(Na+)=c(H2A)+c(HA—)+c(A2—)
D. 从W至Z点,Kw增大,且c(H+)—c(OH—)=2c(A2—)+c(HA—)—c(Na+)
答案 B
第II卷(非选择题 共52分)
二、非选择题(本大题共5小题,计52分)
17. 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为___________。
②0.01 mol·L-1的NH3·H2O的pH=___________。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH___________(填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为___________。
(2)甲酸钠(HCOONa)属于_______(填“强”或“弱”)电解质,HCOONa溶液呈碱性原因是_________(用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=_______mol·L-1。
答案 (1) ①. NH3·H2O +OH- ②. 10.6 ③. = ④. c()=c(CH3COO-)>c(H+)=c(OH-)
(2) ①. 强 ②. HCOO-+H2O HCOOH+OH- ③. 0.01
18. 用酸碱中和滴定法测定某烧碱的纯度。
I.滴定管的使用:
(1)如图是滴定管中液面,其读数为___________mL。
II.配制待测液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
III.滴定:
(2)①盛装0.2000mol·L-1盐酸标准液应用下图的___________(填“甲”或“乙”)滴定管。
②滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂;滴定过程中眼睛应注视_____,当____时为滴定终点。
③有关数据记录如下:
滴定序号 待测液体积(mL) 消耗盐酸标准液的体积(mL)
滴定前 滴定后
1 20.00 0.50 20.70
2 20.00 6.00 26.00
3 20.00 1.00 21.10
IV.纯度计算:
(3)烧碱样品的纯度为___________(精确到0.1%)。
(4)对下列几种情况的讨论(填“偏高”、“偏低”或“无影响”):
①若用蒸馏水冲洗锥形瓶,会使测定结果___________。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果___________。
③若滴定前仰视读数,滴定后俯视读数,会使测定结果___________。
答案 (1)22.60
(2) ①. 甲 ②. 锥形瓶内溶液颜色变化 ③. 当滴入最后一滴盐酸标准液时,溶液恰好由黄色变为橙色,且半分钟内不变色
(3)94.6% (4) ①. 无影响 ②. 偏高 ③. 偏低
19. 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x为电解水,装置y为燃料电池。
①太阳能电池的能量转化形式为___________(填字母)。
A.化学能转化为电能 B.电能转化为化学能 C.光能转化为电能
②装置x工作时,产生O2的电极为___________极。
③装置y工作时,若电解质溶液稀硫酸,则正极反应式为___________。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:___________。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的,镍电极有气泡产生。已知Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在___________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是___________。
答案 (1) ①. C ②. 阳 ③. O2+4e-+4H+=2H2O
(2)H2+2OH--2e-=2H2O
(3) ①. 阳极室 ②. 防止Na2FeO4与H2反应使产率降低
20. 我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。当前,科学家成功利用CO2和H2合成了CH3CH2OH、CH3OH,这对节能减排、降低碳排放具有重大意义。回答下列问题:
(1)一定压强下,测得某密闭容器中由CO2和H2制备CH3CH2OH的实验数据中,起始投料比、温度与CO2转化率的关系如图所示。
已知:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH。
①每生成0.2molCH3CH2OH产生的热量为akJ(a为正值),则ΔH=_______kJ·mol-1(用含a的代数式表示)。
②在上述条件下,发生该反应适宜的温度为_______(填“500”、“600”、“700”或“800”)K,判断的理由为________。
③某温度下,向2L恒容密闭容器中充入2molH2和1molCO2,2min末反应达到平衡,此时测得反应前后的总压强之比为5:3,则CO2的平衡转化率为_____,0~2min内,v(CH3CH2OH)=______ mol·L-1·min-1。
(2)对于CO2和H2合成CH3CH2OH的反应,下列说法正确的是___________(填字母)。
a.混合气体的平均相对分子质量不再发生改变时,该反应达到平衡
b.加入合适的催化剂,正、逆反应速率均增大,同时CH3CH2OH的产率也提高
c.H2的物质的量分数不再发生改变时,该反应达到平衡
d.增大压强,可提高CO2的转化率,同时平衡常数也增大
(3)将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49kJ·mol-1,测得CO2的平衡转化率随温度、压强的变化如图所示。
①Y表示___________(填“温度”或“压强”),X1___________(填“>”、“=”或“<”)X2。
②若M点对应平衡压强为10MPa,则对应的平衡常数KP=___________(精确到0.01,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
答案 (1) ①. -5a ②. 500 ③. 相同投料比时,500K的CO2转化率最大 ④. 60% ⑤. 0.075
(2)ac (3) ①. 温度 ②. < ③. 0.85
21. 一种用于治疗高血脂的新药I的合成路线如图:
已知:①RCHO+CH3CHO;
②→RCHO。
回答下列问题:
(1)B的化学名称为___________;H的分子式为___________。
(2)E的结构简式为___________;G中所含官能团的名称是___________。
(3)②的反应类型是___________。写出反应①的化学方程式___________。
(4)化合物W比C多一个“CH2”,能同时满足①遇FeCl3溶液显紫色、②属于芳香族化合物、③能发生银镜反应条件的W的结构有___________种(不考虑立体异构,填字母)。
a.10 b.12 c.13 d.14
(5)设计用乙醇为原料制备CH2=CH-CH=CH2的合成路线(其他无机试剂任选)___________。
答案 (1) ①. 苯甲醛 ②. C10H22O3
(2) ①. HCHO ②. 羟基、醛基
(3) ①. 酯化反应或取代反应 ②. +Cl2+HCl
(4)c (5)CH3CH2OHCH3CHOCH3CH(OH)CH2CHOCH3CH(OH)CH2CH2OHCH2=CH-CH=CH2
化学
注意事项:
1.本试卷满分100分,答题时间100分钟;
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
第I卷(选择题 共48分)
一、选择题(本大题共16小题,每小题3分,计48分。每小题只有一个选项是符合题意的)
1. 我国毛笔的制作技艺属于国家非物质文化遗产,相传古人制作该毛笔的过程为“以枯木为管,鹿毛为柱,羊毛为被(外衣)”,则下列说法正确的是
A. 枯木的主要成分为蛋白质
B. 鹿毛、羊毛均只含有C、H、O三种元素
C. 枯木、鹿毛的主要成分互为同分异构体
D. 采用灼烧法可以区分枯木、毛笔的“外衣”
2. 下列有机物的系统命名正确的是
A. 对二甲苯
B. 2-甲基-4-己烯
C. 2,5-二甲基-3-乙基己烷
D 1,4-二甲基丁烷
3. 下列事实中,与盐类水解无关的是
A. 溶液呈酸性
B. 溶液可除去铁制品表面的锈斑
C. 溶液蒸干后得不到固体
D. 长期施用化肥会使土壤酸性增大,发生板结
4. 在四个不同容器中、不同条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A. v(H2)=0.01mol·L-1·s-1 B. v(NH3)=0.25mol·L-1·min-1
C. v(H2)=0.3mol·L-1·min-1 D. v(N2)=0.1mol·L-1·min-1
5. 让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=S2(g)+2H2O(g) ΔH2
③H2S(g)+O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A. ΔH4=(ΔH1+ΔH2-3ΔH3) B. ΔH4=(3ΔH3-ΔH1-ΔH2)
C. ΔH4=(ΔH1-ΔH2+3ΔH3) D. ΔH4=(ΔH1-ΔH2-3ΔH3)
6. 下列卤代烃,既能发生水解反应,又能发生消去反应且只能得到两种单烯烃的是
A. B.
C. D.
7. 从柑桔中可提炼出苧烯()。下列关于苧烯的说法中正确的是
A. 不溶于水,1mol苧烯与氢气反应,最多消耗2molH2
B. 分子式为C10H15
C. 与1,3-丁二烯互为同系物
D. 与过量Br2的CCl4溶液反应的产物可能为
8. 某反应历程包含两个基元反应,能量变化如图所示(E为正值,单位:)。下列说法正确的是
A. 该总反应的活化能
B. 对于的反应,必须加热才能进行
C. 该总反应的焓变
D. 此条件下,基元反应的反应速率第二个大于第一个
9. 下列实验装置符合实验目的是( )
目的 粗铜的精炼 验证NaCl溶液(含酚酞)的产物 在铁制品上镀铜 构成原电池
装置
选项 A B C D
A. A B. B C. C D. D
10. 实验室利用如图装置制取有机物,下列说法错误的是( )
A. 根据温度计读数的不同,可制取乙烯和乙醚
B. b为恒压滴液漏斗,其优点是便于液体顺利滴下
C. 将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D. 浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
11. 莽草酸是一种合成治疗禽流感药物达菲的原料;鞣酸存在于苹果、生石榴等植物中。下列说法正确的是
A. 两种酸都能与溴水反应,反应类型相同
B. 鞣酸分子中,可能在同一平面上的原子最多有14个
C. 鞣酸分子与莽草酸分子相比,多了两个碳碳双键
D. 中和等物质的量的莽草酸、鞣酸,消耗NaOH的物质的量之比为1:4
12. 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示,下列与此原理有关说法正确的是
A. 输送暖气的管道更容易发生此类腐蚀
B. 正极反应:+9H++8e-=HS-+4H2O
C. 这种情况下,Fe腐蚀的最终产物为Fe2O3 xH2O
D. 管道上刷富锌油漆可以延缓管道的腐蚀
13. 医院中常用硫酸钡作为内服造影剂,即钡餐,已知BaSO4(s) Ba2+(aq)+SO (aq) ΔH>0,Ksp(BaSO4)=1.1×10-10。下图为不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线。下列说法正确的是
A. T1
C. c点时,在T1、T2两个温度下均有固体析出
D. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
14. 下列实验操作和现象以及所得结论均正确的是
选项 实验操作和现象 结论
A 苯不能使酸性高锰酸钾溶液褪色,而甲苯能 甲基使得苯环活化
B 在氯乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银,会有白色沉淀析出 氯乙烷在碱性条件下能水解
C 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
D 向乙醇与水中分别加入金属钠,都能产生具有可燃性的气体 乙醇分子与水分子中存在活性一样氢原子
A. A B. B C. C D. D
15. 化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
A. 对反应:aA(s)+2B(g) xC(g),根据图①可以求出x=2
B. 图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C. 图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大
D. 升高温度,图④表示的反应中反应物的转化率增大
16. 用0.10 mol·L—1NaOH溶液滴定20.0mL 0.10 mol·L—1H2A溶液,溶液pH和温度随的变化曲线如图所示,下列说法不正确的
A. Z点为第二反应终点
B. 25℃,H2A的电离常数Ka2=10—9.7
C. 当=1时,c(Na+)=c(H2A)+c(HA—)+c(A2—)
D. 从W至Z点,Kw增大,且c(H+)—c(OH—)=2c(A2—)+c(HA—)—c(Na+)
第II卷(非选择题 共52分)
二、非选择题(本大题共5小题,计52分)
17. 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为___________。
②0.01 mol·L-1的NH3·H2O的pH=___________。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH___________(填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为___________。
(2)甲酸钠(HCOONa)属于_______(填“强”或“弱”)电解质,HCOONa溶液呈碱性原因是_________(用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=_______mol·L-1。
18. 用酸碱中和滴定法测定某烧碱的纯度。
I.滴定管的使用:
(1)如图是滴定管中液面,其读数为___________mL。
II.配制待测液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
III.滴定:
(2)①盛装0.2000mol·L-1盐酸标准液应用下图的___________(填“甲”或“乙”)滴定管。
②滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂;滴定过程中眼睛应注视_____,当____时为滴定终点。
③有关数据记录如下:
滴定序号 待测液体积(mL) 消耗盐酸标准液的体积(mL)
滴定前 滴定后
1 20.00 0.50 20.70
2 20.00 6.00 26.00
3 20.00 1.00 21.10
IV.纯度计算:
(3)烧碱样品的纯度为___________(精确到0.1%)。
(4)对下列几种情况的讨论(填“偏高”、“偏低”或“无影响”):
①若用蒸馏水冲洗锥形瓶,会使测定结果___________。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果___________。
③若滴定前仰视读数,滴定后俯视读数,会使测定结果___________。
19. 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x为电解水,装置y为燃料电池。
①太阳能电池的能量转化形式为___________(填字母)。
A.化学能转化为电能 B.电能转化为化学能 C.光能转化为电能
②装置x工作时,产生O2的电极为___________极。
③装置y工作时,若电解质溶液稀硫酸,则正极反应式为___________。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:___________。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的,镍电极有气泡产生。已知Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在___________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是___________。
20. 我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。当前,科学家成功利用CO2和H2合成了CH3CH2OH、CH3OH,这对节能减排、降低碳排放具有重大意义。回答下列问题:
(1)一定压强下,测得某密闭容器中由CO2和H2制备CH3CH2OH的实验数据中,起始投料比、温度与CO2转化率的关系如图所示。
已知:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH。
①每生成0.2molCH3CH2OH产生的热量为akJ(a为正值),则ΔH=_______kJ·mol-1(用含a的代数式表示)。
②在上述条件下,发生该反应适宜的温度为_______(填“500”、“600”、“700”或“800”)K,判断的理由为________。
③某温度下,向2L恒容密闭容器中充入2molH2和1molCO2,2min末反应达到平衡,此时测得反应前后的总压强之比为5:3,则CO2的平衡转化率为_____,0~2min内,v(CH3CH2OH)=______ mol·L-1·min-1。
(2)对于CO2和H2合成CH3CH2OH的反应,下列说法正确的是___________(填字母)。
a.混合气体的平均相对分子质量不再发生改变时,该反应达到平衡
b.加入合适的催化剂,正、逆反应速率均增大,同时CH3CH2OH的产率也提高
c.H2的物质的量分数不再发生改变时,该反应达到平衡
d.增大压强,可提高CO2的转化率,同时平衡常数也增大
(3)将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49kJ·mol-1,测得CO2的平衡转化率随温度、压强的变化如图所示。
①Y表示___________(填“温度”或“压强”),X1___________(填“>”、“=”或“<”)X2。
②若M点对应平衡压强为10MPa,则对应的平衡常数KP=___________(精确到0.01,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
21. 一种用于治疗高血脂的新药I的合成路线如图:
已知:①RCHO+CH3CHO;
②→RCHO。
回答下列问题:
(1)B的化学名称为___________;H的分子式为___________。
(2)E的结构简式为___________;G中所含官能团的名称是___________。
(3)②的反应类型是___________。写出反应①的化学方程式___________。
(4)化合物W比C多一个“CH2”,能同时满足①遇FeCl3溶液显紫色、②属于芳香族化合物、③能发生银镜反应条件的W的结构有___________种(不考虑立体异构,填字母)。
a.10 b.12 c.13 d.14
(5)设计用乙醇为原料制备CH2=CH-CH=CH2的合成路线(其他无机试剂任选)___________。
榆林市2021-2022学年高二上学期期末考试
化学 答案版
注意事项:
1.本试卷满分100分,答题时间100分钟;
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
第I卷(选择题 共48分)
一、选择题(本大题共16小题,每小题3分,计48分。每小题只有一个选项是符合题意的)
1. 我国毛笔的制作技艺属于国家非物质文化遗产,相传古人制作该毛笔的过程为“以枯木为管,鹿毛为柱,羊毛为被(外衣)”,则下列说法正确的是
A. 枯木的主要成分为蛋白质
B. 鹿毛、羊毛均只含有C、H、O三种元素
C. 枯木、鹿毛的主要成分互为同分异构体
D. 采用灼烧法可以区分枯木、毛笔的“外衣”
答案 D
2. 下列有机物的系统命名正确的是
A. 对二甲苯
B. 2-甲基-4-己烯
C. 2,5-二甲基-3-乙基己烷
D 1,4-二甲基丁烷
答案 C
3. 下列事实中,与盐类水解无关的是
A. 溶液呈酸性
B. 溶液可除去铁制品表面的锈斑
C. 溶液蒸干后得不到固体
D. 长期施用化肥会使土壤酸性增大,发生板结
答案 A
4. 在四个不同容器中、不同条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A. v(H2)=0.01mol·L-1·s-1 B. v(NH3)=0.25mol·L-1·min-1
C. v(H2)=0.3mol·L-1·min-1 D. v(N2)=0.1mol·L-1·min-1
答案 A
5. 让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=S2(g)+2H2O(g) ΔH2
③H2S(g)+O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A. ΔH4=(ΔH1+ΔH2-3ΔH3) B. ΔH4=(3ΔH3-ΔH1-ΔH2)
C. ΔH4=(ΔH1-ΔH2+3ΔH3) D. ΔH4=(ΔH1-ΔH2-3ΔH3)
答案 A
6. 下列卤代烃,既能发生水解反应,又能发生消去反应且只能得到两种单烯烃的是
A. B.
C. D.
答案 B
7. 从柑桔中可提炼出苧烯()。下列关于苧烯的说法中正确的是
A. 不溶于水,1mol苧烯与氢气反应,最多消耗2molH2
B. 分子式为C10H15
C. 与1,3-丁二烯互为同系物
D. 与过量Br2的CCl4溶液反应的产物可能为
答案 A
8. 某反应历程包含两个基元反应,能量变化如图所示(E为正值,单位:)。下列说法正确的是
A. 该总反应的活化能
B. 对于的反应,必须加热才能进行
C. 该总反应的焓变
D. 此条件下,基元反应的反应速率第二个大于第一个
答案 C
9. 下列实验装置符合实验目的是( )
目的 粗铜的精炼 验证NaCl溶液(含酚酞)的产物 在铁制品上镀铜 构成原电池
装置
选项 A B C D
A. A B. B C. C D. D
答案 D
10. 实验室利用如图装置制取有机物,下列说法错误的是( )
A. 根据温度计读数的不同,可制取乙烯和乙醚
B. b为恒压滴液漏斗,其优点是便于液体顺利滴下
C. 将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D. 浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
答案 C
11. 莽草酸是一种合成治疗禽流感药物达菲的原料;鞣酸存在于苹果、生石榴等植物中。下列说法正确的是
A. 两种酸都能与溴水反应,反应类型相同
B. 鞣酸分子中,可能在同一平面上的原子最多有14个
C. 鞣酸分子与莽草酸分子相比,多了两个碳碳双键
D. 中和等物质的量的莽草酸、鞣酸,消耗NaOH的物质的量之比为1:4
答案 D
12. 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示,下列与此原理有关说法正确的是
A. 输送暖气的管道更容易发生此类腐蚀
B. 正极反应:+9H++8e-=HS-+4H2O
C. 这种情况下,Fe腐蚀的最终产物为Fe2O3 xH2O
D. 管道上刷富锌油漆可以延缓管道的腐蚀
答案 D
13. 医院中常用硫酸钡作为内服造影剂,即钡餐,已知BaSO4(s) Ba2+(aq)+SO (aq) ΔH>0,Ksp(BaSO4)=1.1×10-10。下图为不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线。下列说法正确的是
A. T1
C. c点时,在T1、T2两个温度下均有固体析出
D. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
答案 A
14. 下列实验操作和现象以及所得结论均正确的是
选项 实验操作和现象 结论
A 苯不能使酸性高锰酸钾溶液褪色,而甲苯能 甲基使得苯环活化
B 在氯乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银,会有白色沉淀析出 氯乙烷在碱性条件下能水解
C 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
D 向乙醇与水中分别加入金属钠,都能产生具有可燃性的气体 乙醇分子与水分子中存在活性一样氢原子
A. A B. B C. C D. D
答案 C
15. 化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
A. 对反应:aA(s)+2B(g) xC(g),根据图①可以求出x=2
B. 图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C. 图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大
D. 升高温度,图④表示的反应中反应物的转化率增大
答案 B
16. 用0.10 mol·L—1NaOH溶液滴定20.0mL 0.10 mol·L—1H2A溶液,溶液pH和温度随的变化曲线如图所示,下列说法不正确的
A. Z点为第二反应终点
B. 25℃,H2A的电离常数Ka2=10—9.7
C. 当=1时,c(Na+)=c(H2A)+c(HA—)+c(A2—)
D. 从W至Z点,Kw增大,且c(H+)—c(OH—)=2c(A2—)+c(HA—)—c(Na+)
答案 B
第II卷(非选择题 共52分)
二、非选择题(本大题共5小题,计52分)
17. 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为___________。
②0.01 mol·L-1的NH3·H2O的pH=___________。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH___________(填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为___________。
(2)甲酸钠(HCOONa)属于_______(填“强”或“弱”)电解质,HCOONa溶液呈碱性原因是_________(用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=_______mol·L-1。
答案 (1) ①. NH3·H2O +OH- ②. 10.6 ③. = ④. c()=c(CH3COO-)>c(H+)=c(OH-)
(2) ①. 强 ②. HCOO-+H2O HCOOH+OH- ③. 0.01
18. 用酸碱中和滴定法测定某烧碱的纯度。
I.滴定管的使用:
(1)如图是滴定管中液面,其读数为___________mL。
II.配制待测液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
III.滴定:
(2)①盛装0.2000mol·L-1盐酸标准液应用下图的___________(填“甲”或“乙”)滴定管。
②滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂;滴定过程中眼睛应注视_____,当____时为滴定终点。
③有关数据记录如下:
滴定序号 待测液体积(mL) 消耗盐酸标准液的体积(mL)
滴定前 滴定后
1 20.00 0.50 20.70
2 20.00 6.00 26.00
3 20.00 1.00 21.10
IV.纯度计算:
(3)烧碱样品的纯度为___________(精确到0.1%)。
(4)对下列几种情况的讨论(填“偏高”、“偏低”或“无影响”):
①若用蒸馏水冲洗锥形瓶,会使测定结果___________。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果___________。
③若滴定前仰视读数,滴定后俯视读数,会使测定结果___________。
答案 (1)22.60
(2) ①. 甲 ②. 锥形瓶内溶液颜色变化 ③. 当滴入最后一滴盐酸标准液时,溶液恰好由黄色变为橙色,且半分钟内不变色
(3)94.6% (4) ①. 无影响 ②. 偏高 ③. 偏低
19. 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x为电解水,装置y为燃料电池。
①太阳能电池的能量转化形式为___________(填字母)。
A.化学能转化为电能 B.电能转化为化学能 C.光能转化为电能
②装置x工作时,产生O2的电极为___________极。
③装置y工作时,若电解质溶液稀硫酸,则正极反应式为___________。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:___________。
(3)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的,镍电极有气泡产生。已知Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在___________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是___________。
答案 (1) ①. C ②. 阳 ③. O2+4e-+4H+=2H2O
(2)H2+2OH--2e-=2H2O
(3) ①. 阳极室 ②. 防止Na2FeO4与H2反应使产率降低
20. 我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。当前,科学家成功利用CO2和H2合成了CH3CH2OH、CH3OH,这对节能减排、降低碳排放具有重大意义。回答下列问题:
(1)一定压强下,测得某密闭容器中由CO2和H2制备CH3CH2OH的实验数据中,起始投料比、温度与CO2转化率的关系如图所示。
已知:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH。
①每生成0.2molCH3CH2OH产生的热量为akJ(a为正值),则ΔH=_______kJ·mol-1(用含a的代数式表示)。
②在上述条件下,发生该反应适宜的温度为_______(填“500”、“600”、“700”或“800”)K,判断的理由为________。
③某温度下,向2L恒容密闭容器中充入2molH2和1molCO2,2min末反应达到平衡,此时测得反应前后的总压强之比为5:3,则CO2的平衡转化率为_____,0~2min内,v(CH3CH2OH)=______ mol·L-1·min-1。
(2)对于CO2和H2合成CH3CH2OH的反应,下列说法正确的是___________(填字母)。
a.混合气体的平均相对分子质量不再发生改变时,该反应达到平衡
b.加入合适的催化剂,正、逆反应速率均增大,同时CH3CH2OH的产率也提高
c.H2的物质的量分数不再发生改变时,该反应达到平衡
d.增大压强,可提高CO2的转化率,同时平衡常数也增大
(3)将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49kJ·mol-1,测得CO2的平衡转化率随温度、压强的变化如图所示。
①Y表示___________(填“温度”或“压强”),X1___________(填“>”、“=”或“<”)X2。
②若M点对应平衡压强为10MPa,则对应的平衡常数KP=___________(精确到0.01,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
答案 (1) ①. -5a ②. 500 ③. 相同投料比时,500K的CO2转化率最大 ④. 60% ⑤. 0.075
(2)ac (3) ①. 温度 ②. < ③. 0.85
21. 一种用于治疗高血脂的新药I的合成路线如图:
已知:①RCHO+CH3CHO;
②→RCHO。
回答下列问题:
(1)B的化学名称为___________;H的分子式为___________。
(2)E的结构简式为___________;G中所含官能团的名称是___________。
(3)②的反应类型是___________。写出反应①的化学方程式___________。
(4)化合物W比C多一个“CH2”,能同时满足①遇FeCl3溶液显紫色、②属于芳香族化合物、③能发生银镜反应条件的W的结构有___________种(不考虑立体异构,填字母)。
a.10 b.12 c.13 d.14
(5)设计用乙醇为原料制备CH2=CH-CH=CH2的合成路线(其他无机试剂任选)___________。
答案 (1) ①. 苯甲醛 ②. C10H22O3
(2) ①. HCHO ②. 羟基、醛基
(3) ①. 酯化反应或取代反应 ②. +Cl2+HCl
(4)c (5)CH3CH2OHCH3CHOCH3CH(OH)CH2CHOCH3CH(OH)CH2CH2OHCH2=CH-CH=CH2
同课章节目录
