山东省聊城临清二中高中化学课件 4-1 开发利用金属矿物和海水资源
文档属性
| 名称 | 山东省聊城临清二中高中化学课件 4-1 开发利用金属矿物和海水资源 |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-12 13:26:31 | ||
图片预览










文档简介
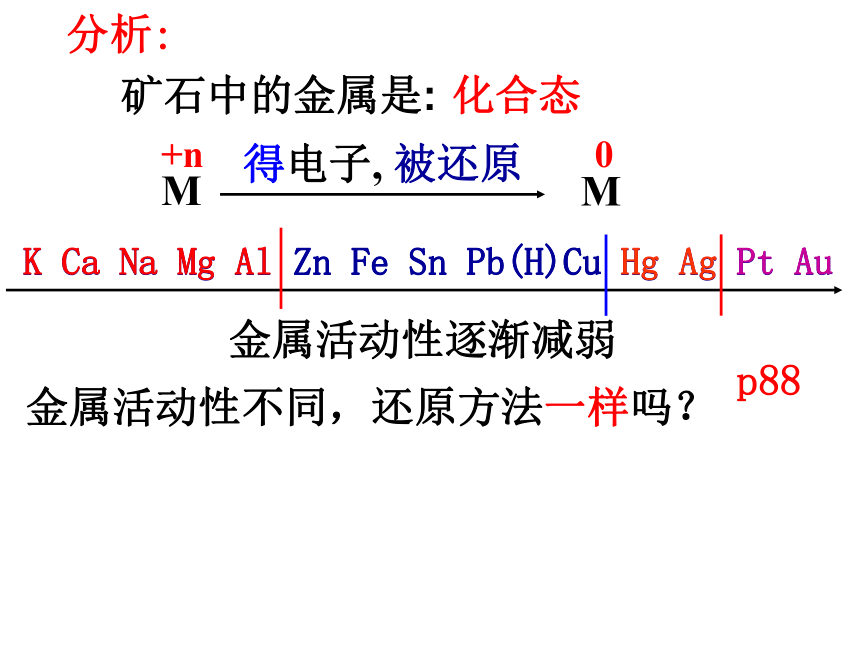
课件46张PPT。第 四 章化学与自然资源的开发利用第 一 节开发利用金属矿物和海水资源一、金属矿物的开发利用 我国21世纪初可持续发展的总体目标是:可持续发展能力不断增强,经济结构调整取得显著成效,人口总量得到有效控制,生态环境明显改善,资源利用率显著提高,促进人与自然的和谐,推动整个社会走上生产发展、生活富裕、生态良好的文明发展道路。自然资源与可持续发展 金属的冶炼自然界中的金属大都以化合态存在用化学的方法把化合态的金属变成游离态要考虑的问题矿石的富集合适的冶炼方法如何精炼矿石中的金属是:分析:得电子, 被还原化合态K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au金属活动性逐渐减弱K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au金属活动性不同,还原方法一样吗?p88(1)热分解法:适用于金属活动性顺序表中氢以后的金属冶炼。 Hg Ag
(2)热还原法:适用于金属活动性顺序表中部的金属冶炼 Zn Fe Sn Pb (H) Cu
(3)电解法:适用于钾、钠、钙、铝等活泼金属的冶炼。 K Ca Na Mg Al
(4) 物理提取法:适用于极不活泼的金属的冶炼。Pt Au简单,实用,节省的原则1.热分解法 有些不活泼金属仅用热分解法就能制得。 在金属活动性顺序表中,位于氢后面的某些金属的氧化物受热就能分解。冶炼方法的选择原则:2.热还原法
多数金属的冶炼过程属于热还原法
常用的还原剂有焦炭、一氧化碳、氢气
和活泼金属等3.电解法
在金属活动性顺序中,钾、钠、钙、铝等几种金属的还原性很强,这些金属都很容易失去电子,因此不能用一般的方法和还原剂使其从化合物中还原出来,而只能用通电分解其熔融盐或氧化物的方法来冶炼。K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag电解法热还原法不同金属冶炼方法的选择K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag 同种金属可以有不同的冶炼方法: 如 Mg 既可用还原法, 也可用电解法, 根据其不同用途选择不同的冶炼方法。 活泼 中等活泼 不活泼(C、CO、H2、Al等)(氧化物、氯化物)(氧化物)练 习1.下列各组金属最适合用 H2 或 CO 把它
从化合物中还原出来的是
A. Ca、Mg B. Al、Fe
C. Fe、Cu D. Hg、Ag 2.列金属氧化物不能用焦炭还原的是 解题思路: 碳的还原性一般介于A1~Zn 之间, 故一般比碳还原性强的金属,不能用碳还原。A. CaO B. Ag2O C. CuO D. Fe2O3CA3、下列各种冶炼方法中,可以制得相应金属
的是( )
A、加热氧化铝 B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
4、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
① Na ② Zn
③ Hg ④ Au
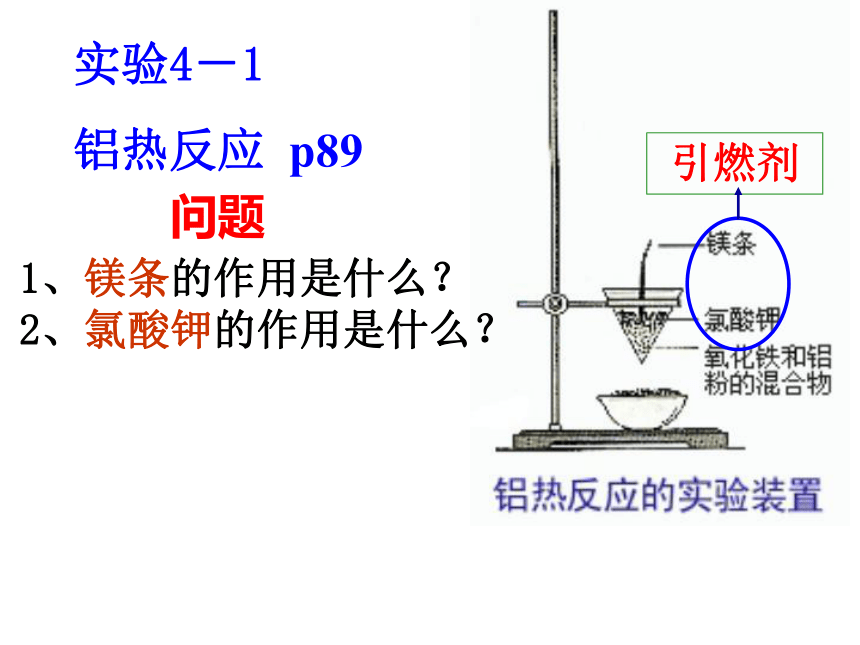
C电解法加热还原法加热分解法物理提取法实验4-1
铝热反应 p891、镁条的作用是什么?
2、氯酸钾的作用是什么?问题引燃剂反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。铝热剂反应现象:剧烈反应,发出强光,纸漏 斗被烧穿,沙子上落有黑色铁珠。结论:铝是常用的还原剂,在一定的条件下与某些金属氧化物反应,把其中的金属还原成单质。其它铝热反应 铝热反应的应用????????铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等等高熔点金属K Ca Na Mg Al︱Zn Fe Sn Pb (H) Cu ︱Hg Ag︱Pt Au 电解法热还原法热分解法 物理
提取法(C、CO、H2、Al等)不同金属冶炼方法的选择归纳:▲ 金属的回收和资源保护 p89回收金属的意义:
(1)节约矿物资源;(2)节约能源;
(3)减少环境污染。二、海水资源的开发利用 从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中是“历史留给人类的资源储备”海洋是美丽的,
也是富饶的 海洋生物资源含80多种元素,以氢、氧、
氯、钠、镁、硫、钙、钾等
较多。被称为“元素的故乡”。海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。氘有50亿吨足够人类用上千万年海水中的化学资源海洋中的矿产资源海水资源的广泛性:◆海洋约占地球表面积71%
海洋中的资源
◆动物:(鱼类、海狮、海马、贝类……
◆植物:(海草、海带…………
◆矿物:(各种盐、NaCl、MgCl2 ……….
海底金属结核矿、石油
◆(水资源及各种溶解的盐类)海水中的水1.3×109 亿吨
占地球总水量97%(3% 在陆地、淡水)
海水中除了水以外,还含有80多种元素,有的含量很大(如NaCl )有的含量很少(如Au)
海水资源的多样性:◆海水中溶解和悬浮大量的无机物和有机物
◆按含量计:含O、H 及 Cl、Na、S、C、F、
B、Br、Sr共13种元素的质量占总水量的
99%,其余1%为70多种含量微少的元素。海水资源的分散性:◆海水因为量太大、面太广,大多数元素尽管
量很大但由于太分散 ,含量极微少
◆如:海水中金元素总含量约为50000000t(5千
万吨)但一顿海水中只含金元素0.000004g(10亿分之四克)
(百分之0.000004克)海水综合利用的重要方向 海水综合利用的重要方向是:海水淡化同
化工生产结合、同能源技术结合。如从海水中
制得的氯化钠除食用外,还用作工业原料,如
生产烧碱、纯碱、金属钠以及氯气、盐酸、漂
白粉等含氯化工产品。从海水中制取镁、钾、
溴及其化工产品,是在传统制盐工业上的发展。
从海水中获得其他物质和能量具有广阔的前景。
例如,铀和重水目前是核能开发中的重要原料,
从海水中提取铀和重水对一个国家来说具有战
略意义。化学在开发海洋药物方面也将发挥越
来越大的作用。潮汐能、波浪能等也是越来越
受到重视和开发的新型能源。海水资源的利用: 主要有:
1.海水中水资源的利用
海水的淡化(咸水 → 淡水)
2.直接利用海水进行循环冷却(作冷却
用水)海水的淡化: (1)海水淡化的途径:
◆从海水中提取淡水
◆从海水中分离出盐
(2)海水淡化的方法:p90
◆蒸 馏 法(最先使用,技术成熟,但成
本高)
◆电渗析法(成本低,但未能大量生产)
◆离子交换法(目前正迅速发展,但需要
不断更新离子交换树脂)蒸馏法所用的装置及原理 ◆原理: 加热到水的沸点,使水汽化变成水蒸气,再冷凝得淡水。进冷却水 出煮
海为
盐海水浓缩过滤蒸发结晶过量食盐的提取
海水的综合利用(1)海水制盐——生产 NaCl (2) NaCl的水溶液制 NaOH (3)制金属 Na(4)制 Na2CO32 NaOH + CO2 = Na2CO3 + H2O 海水
蒸发母液?Mg(OH)2① MgCl2 + Ca(OH)2 = Mg(OH)2↓+ CaCl2◆从海水中制金属镁② Mg(OH)2 + 2HCl = MgCl2 + H2O①②③海水中提取溴的实验实验方法:
(1)用蒸馏法将海水浓缩。用硫酸将浓缩的
海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴
离子转化为溴单质。
(3)向含溴单质的水溶液中通入空气和水蒸
气,将溴单质吹入盛有二氧化硫溶液的
吸收塔内。转化为氢溴酸
(4)向吸收塔中溶液内通入适量的氯气。最
后经蒸馏可得液溴 (用CCl4萃取)海水中提取溴实验的方程式2NaBr + Cl2 = Br2 + 2NaCl 上面置换反应得到的 Br2 的浓度
很低,难以收集,用空气吹出 Br2 后
用 SO2 吸收,使溴得到富集, Br2 + SO2 + 2H2O = 2HBr + H2SO42HBr + Cl2 = Br2 + 2HCl如何证明海带中存在碘元素? [实验4-2] (一)实验方法:
(1)称取3g干海带,用刷子把干海带表面的附着物刷净
(不要用水洗,有 I-)。 将海带剪碎,用酒精润
湿(便于灼烧)后,放在坩埚中。 (2)用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,
停止加热,冷却。 (3)将海带灰转移到小烧杯中,向烧杯中加入10ml蒸馏
水,搅拌,煮沸2min-3min,使可溶物溶解,过滤。 (4)向滤液中滴入几滴硫酸,再加入约1ml H2O2溶液,
观察现象。取少量上述滤液,滴加几滴淀粉溶液,
观察现象。
(二)实验现象:
加入H2O2溶液后,溶液颜色变为深黄
色;加入淀粉溶液后,溶液又变为深蓝色。(三) 化学方程式:
2KI + H2O2 + H2SO4 = I2+ K2SO4 + 2H2O 海水综合利用联合工业体系一例 p92 由于镁很活泼,是还原性很强的金属,所以加热时能与许多气体物质反应。如空气、二氧化碳、氮气等,但不与氢气和稀有气体反应。练 习镁粉是焰火、闪光粉中不可缺少的原料,工业制造镁粉是镁蒸气在气体中冷却,下列可做冷却剂的是(1)空气 (2)CO2 (3)Ar (4)H2 (5)N2 A.(1)(2)? B.(2)(3) C.(3)(4)? D.(4)(5)???C2.下列叙述中所描述的物质一定是金属元
素的是
A.易失去电子的物
B.原子最外层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外层上只有
2个电子的元素D3.铝加入下列物质中会产生气体的是
A.熔融NaOH???? B.KOH溶液
C.Na2O2 固体??? D.Na2O2和水
4.铝热剂中铝的作用是
A.催化剂?????? B.氧化剂?????
C.还原剂?????? D.填充剂B DC5.下列冶炼金属的反应,一定是置换反应
的是
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁 C6.下列说法中不正确的是
A.金属的冶炼原理,就是利用氧化还原反应
原理,用还原剂在一定条件下将金属从矿
石中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,都是被还原
D.金属单质被发现和应用得越早,其活动性一
般较弱A B 7.下列冶炼金属的反应,一定是分解反应
的是( )
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁 A B8.列金属冶炼方法与其他三种不同的是
A.Fe B.K C.Mg D.Al A9.下列海洋资源中属于可再生资源的是
A.海底石油、天然气 B.潮汐能
C.滨海砂矿 D.锰结核10.下列哪种方法不能实现海水的淡化
A.蒸馏法 B.电渗析法
C.离子交换法 D.电解法 B D11.下列属于海水化学资源利用的是
A.海水淡化 B.海水提盐
C.海水提溴 D.海水发电12.用 H2 做还原剂和用金属做还原剂相比
较,所得金属的纯度
A.用 H2 高 B.用金属的高
C. 二者相同 D.无法比较 用 H2 还原的产物是金属和水,水受热挥发,只得到金属;用金属还原所得的是混合物(金属与金属的化合物)。B C A
(2)热还原法:适用于金属活动性顺序表中部的金属冶炼 Zn Fe Sn Pb (H) Cu
(3)电解法:适用于钾、钠、钙、铝等活泼金属的冶炼。 K Ca Na Mg Al
(4) 物理提取法:适用于极不活泼的金属的冶炼。Pt Au简单,实用,节省的原则1.热分解法 有些不活泼金属仅用热分解法就能制得。 在金属活动性顺序表中,位于氢后面的某些金属的氧化物受热就能分解。冶炼方法的选择原则:2.热还原法
多数金属的冶炼过程属于热还原法
常用的还原剂有焦炭、一氧化碳、氢气
和活泼金属等3.电解法
在金属活动性顺序中,钾、钠、钙、铝等几种金属的还原性很强,这些金属都很容易失去电子,因此不能用一般的方法和还原剂使其从化合物中还原出来,而只能用通电分解其熔融盐或氧化物的方法来冶炼。K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag电解法热还原法不同金属冶炼方法的选择K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag 同种金属可以有不同的冶炼方法: 如 Mg 既可用还原法, 也可用电解法, 根据其不同用途选择不同的冶炼方法。 活泼 中等活泼 不活泼(C、CO、H2、Al等)(氧化物、氯化物)(氧化物)练 习1.下列各组金属最适合用 H2 或 CO 把它
从化合物中还原出来的是
A. Ca、Mg B. Al、Fe
C. Fe、Cu D. Hg、Ag 2.列金属氧化物不能用焦炭还原的是 解题思路: 碳的还原性一般介于A1~Zn 之间, 故一般比碳还原性强的金属,不能用碳还原。A. CaO B. Ag2O C. CuO D. Fe2O3CA3、下列各种冶炼方法中,可以制得相应金属
的是( )
A、加热氧化铝 B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
4、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
① Na ② Zn
③ Hg ④ Au
C电解法加热还原法加热分解法物理提取法实验4-1
铝热反应 p891、镁条的作用是什么?
2、氯酸钾的作用是什么?问题引燃剂反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。铝热剂反应现象:剧烈反应,发出强光,纸漏 斗被烧穿,沙子上落有黑色铁珠。结论:铝是常用的还原剂,在一定的条件下与某些金属氧化物反应,把其中的金属还原成单质。其它铝热反应 铝热反应的应用????????铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等等高熔点金属K Ca Na Mg Al︱Zn Fe Sn Pb (H) Cu ︱Hg Ag︱Pt Au 电解法热还原法热分解法 物理
提取法(C、CO、H2、Al等)不同金属冶炼方法的选择归纳:▲ 金属的回收和资源保护 p89回收金属的意义:
(1)节约矿物资源;(2)节约能源;
(3)减少环境污染。二、海水资源的开发利用 从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中是“历史留给人类的资源储备”海洋是美丽的,
也是富饶的 海洋生物资源含80多种元素,以氢、氧、
氯、钠、镁、硫、钙、钾等
较多。被称为“元素的故乡”。海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。氘有50亿吨足够人类用上千万年海水中的化学资源海洋中的矿产资源海水资源的广泛性:◆海洋约占地球表面积71%
海洋中的资源
◆动物:(鱼类、海狮、海马、贝类……
◆植物:(海草、海带…………
◆矿物:(各种盐、NaCl、MgCl2 ……….
海底金属结核矿、石油
◆(水资源及各种溶解的盐类)海水中的水1.3×109 亿吨
占地球总水量97%(3% 在陆地、淡水)
海水中除了水以外,还含有80多种元素,有的含量很大(如NaCl )有的含量很少(如Au)
海水资源的多样性:◆海水中溶解和悬浮大量的无机物和有机物
◆按含量计:含O、H 及 Cl、Na、S、C、F、
B、Br、Sr共13种元素的质量占总水量的
99%,其余1%为70多种含量微少的元素。海水资源的分散性:◆海水因为量太大、面太广,大多数元素尽管
量很大但由于太分散 ,含量极微少
◆如:海水中金元素总含量约为50000000t(5千
万吨)但一顿海水中只含金元素0.000004g(10亿分之四克)
(百分之0.000004克)海水综合利用的重要方向 海水综合利用的重要方向是:海水淡化同
化工生产结合、同能源技术结合。如从海水中
制得的氯化钠除食用外,还用作工业原料,如
生产烧碱、纯碱、金属钠以及氯气、盐酸、漂
白粉等含氯化工产品。从海水中制取镁、钾、
溴及其化工产品,是在传统制盐工业上的发展。
从海水中获得其他物质和能量具有广阔的前景。
例如,铀和重水目前是核能开发中的重要原料,
从海水中提取铀和重水对一个国家来说具有战
略意义。化学在开发海洋药物方面也将发挥越
来越大的作用。潮汐能、波浪能等也是越来越
受到重视和开发的新型能源。海水资源的利用: 主要有:
1.海水中水资源的利用
海水的淡化(咸水 → 淡水)
2.直接利用海水进行循环冷却(作冷却
用水)海水的淡化: (1)海水淡化的途径:
◆从海水中提取淡水
◆从海水中分离出盐
(2)海水淡化的方法:p90
◆蒸 馏 法(最先使用,技术成熟,但成
本高)
◆电渗析法(成本低,但未能大量生产)
◆离子交换法(目前正迅速发展,但需要
不断更新离子交换树脂)蒸馏法所用的装置及原理 ◆原理: 加热到水的沸点,使水汽化变成水蒸气,再冷凝得淡水。进冷却水 出煮
海为
盐海水浓缩过滤蒸发结晶过量食盐的提取
海水的综合利用(1)海水制盐——生产 NaCl (2) NaCl的水溶液制 NaOH (3)制金属 Na(4)制 Na2CO32 NaOH + CO2 = Na2CO3 + H2O 海水
蒸发母液?Mg(OH)2① MgCl2 + Ca(OH)2 = Mg(OH)2↓+ CaCl2◆从海水中制金属镁② Mg(OH)2 + 2HCl = MgCl2 + H2O①②③海水中提取溴的实验实验方法:
(1)用蒸馏法将海水浓缩。用硫酸将浓缩的
海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴
离子转化为溴单质。
(3)向含溴单质的水溶液中通入空气和水蒸
气,将溴单质吹入盛有二氧化硫溶液的
吸收塔内。转化为氢溴酸
(4)向吸收塔中溶液内通入适量的氯气。最
后经蒸馏可得液溴 (用CCl4萃取)海水中提取溴实验的方程式2NaBr + Cl2 = Br2 + 2NaCl 上面置换反应得到的 Br2 的浓度
很低,难以收集,用空气吹出 Br2 后
用 SO2 吸收,使溴得到富集, Br2 + SO2 + 2H2O = 2HBr + H2SO42HBr + Cl2 = Br2 + 2HCl如何证明海带中存在碘元素? [实验4-2] (一)实验方法:
(1)称取3g干海带,用刷子把干海带表面的附着物刷净
(不要用水洗,有 I-)。 将海带剪碎,用酒精润
湿(便于灼烧)后,放在坩埚中。 (2)用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,
停止加热,冷却。 (3)将海带灰转移到小烧杯中,向烧杯中加入10ml蒸馏
水,搅拌,煮沸2min-3min,使可溶物溶解,过滤。 (4)向滤液中滴入几滴硫酸,再加入约1ml H2O2溶液,
观察现象。取少量上述滤液,滴加几滴淀粉溶液,
观察现象。
(二)实验现象:
加入H2O2溶液后,溶液颜色变为深黄
色;加入淀粉溶液后,溶液又变为深蓝色。(三) 化学方程式:
2KI + H2O2 + H2SO4 = I2+ K2SO4 + 2H2O 海水综合利用联合工业体系一例 p92 由于镁很活泼,是还原性很强的金属,所以加热时能与许多气体物质反应。如空气、二氧化碳、氮气等,但不与氢气和稀有气体反应。练 习镁粉是焰火、闪光粉中不可缺少的原料,工业制造镁粉是镁蒸气在气体中冷却,下列可做冷却剂的是(1)空气 (2)CO2 (3)Ar (4)H2 (5)N2 A.(1)(2)? B.(2)(3) C.(3)(4)? D.(4)(5)???C2.下列叙述中所描述的物质一定是金属元
素的是
A.易失去电子的物
B.原子最外层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外层上只有
2个电子的元素D3.铝加入下列物质中会产生气体的是
A.熔融NaOH???? B.KOH溶液
C.Na2O2 固体??? D.Na2O2和水
4.铝热剂中铝的作用是
A.催化剂?????? B.氧化剂?????
C.还原剂?????? D.填充剂B DC5.下列冶炼金属的反应,一定是置换反应
的是
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁 C6.下列说法中不正确的是
A.金属的冶炼原理,就是利用氧化还原反应
原理,用还原剂在一定条件下将金属从矿
石中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,都是被还原
D.金属单质被发现和应用得越早,其活动性一
般较弱A B 7.下列冶炼金属的反应,一定是分解反应
的是( )
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁 A B8.列金属冶炼方法与其他三种不同的是
A.Fe B.K C.Mg D.Al A9.下列海洋资源中属于可再生资源的是
A.海底石油、天然气 B.潮汐能
C.滨海砂矿 D.锰结核10.下列哪种方法不能实现海水的淡化
A.蒸馏法 B.电渗析法
C.离子交换法 D.电解法 B D11.下列属于海水化学资源利用的是
A.海水淡化 B.海水提盐
C.海水提溴 D.海水发电12.用 H2 做还原剂和用金属做还原剂相比
较,所得金属的纯度
A.用 H2 高 B.用金属的高
C. 二者相同 D.无法比较 用 H2 还原的产物是金属和水,水受热挥发,只得到金属;用金属还原所得的是混合物(金属与金属的化合物)。B C A
