山东省聊城临清二中高中化学课件 第一章第三节化学键(3)
文档属性
| 名称 | 山东省聊城临清二中高中化学课件 第一章第三节化学键(3) |  | |
| 格式 | zip | ||
| 文件大小 | 205.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-12 13:49:24 | ||
图片预览





文档简介
课件12张PPT。第三节 化 学 键(3)第一章 物质结构元素周期律学习目标:
1、了解分子间作用力和氢键的涵义。
2、了解分子间作用力和氢键对物质
熔、沸点的影响规律以及氢键对某些物质
的溶解性的影响。
重点:
分子间作用力和氢键的涵义。
难点:
分子间作用力和氢键对物质熔、沸点
的影响规律。化学键:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。复习化学键离子键金属键共价键非极性键极性键 由阴阳离子之间通过静电作用所形成的化学键叫离子键 原子之间通过共用电子对所形成的化学键叫共价键问题??分子间是否存在相互作用呢?
物质为什么会有三态变化?
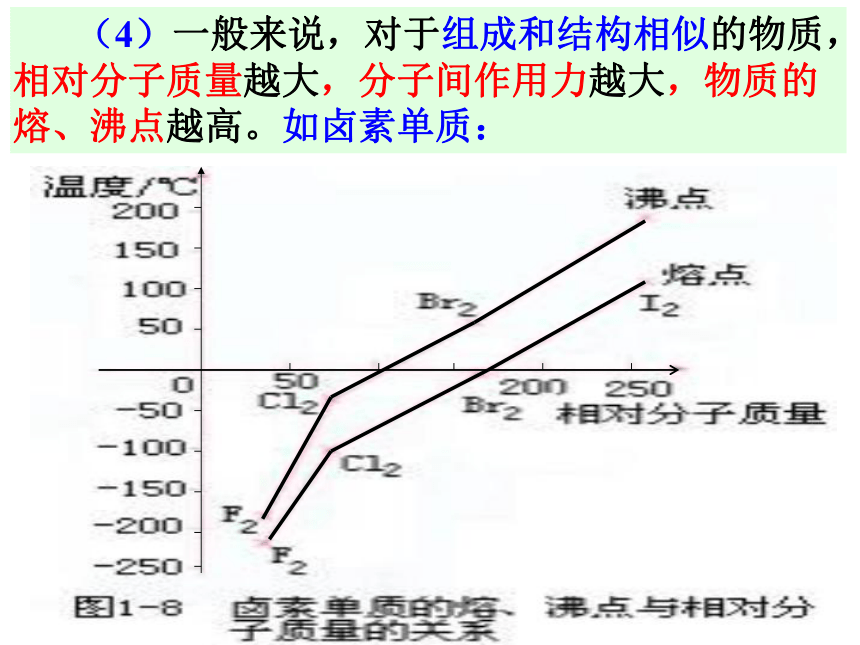
不同物质为什么熔、沸点不同?存在不同温度下分子具有不同能量相互作用的大小不同四、分子间作用力和氢键1、分子间作用力 定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。 (1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。 (2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。 (3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。 (4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:又如气态氢化物:但是: 为什么HF、H2O和NH3的沸点会反常呢?讨论:2、氢键 定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。(1)氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴, (2)形成条件:氢原子与得电子能力很强、原子半径很小的原子形成的分子之间。如HF、H2O、NH3等分子间易形成氢键。(3)特征:具有方向性。(4)结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键思考:为什么冰会浮在水面上?
雪花为什么是六角形的?讨论 :如果水分子之间没有氢键存在,
地球上 将会是什么面貌?(5)结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。原子分子离子宏观 物质或范德华力得失电子范德华力
氢键共价键金属键或共价键离子键离子晶体分子晶体原子晶体金属晶体作业 :P . 23 1、2
思考:5小结:有几种形成方式?
1、了解分子间作用力和氢键的涵义。
2、了解分子间作用力和氢键对物质
熔、沸点的影响规律以及氢键对某些物质
的溶解性的影响。
重点:
分子间作用力和氢键的涵义。
难点:
分子间作用力和氢键对物质熔、沸点
的影响规律。化学键:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。复习化学键离子键金属键共价键非极性键极性键 由阴阳离子之间通过静电作用所形成的化学键叫离子键 原子之间通过共用电子对所形成的化学键叫共价键问题??分子间是否存在相互作用呢?
物质为什么会有三态变化?
不同物质为什么熔、沸点不同?存在不同温度下分子具有不同能量相互作用的大小不同四、分子间作用力和氢键1、分子间作用力 定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。 (1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。 (2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。 (3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。 (4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:又如气态氢化物:但是: 为什么HF、H2O和NH3的沸点会反常呢?讨论:2、氢键 定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。(1)氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴, (2)形成条件:氢原子与得电子能力很强、原子半径很小的原子形成的分子之间。如HF、H2O、NH3等分子间易形成氢键。(3)特征:具有方向性。(4)结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键思考:为什么冰会浮在水面上?
雪花为什么是六角形的?讨论 :如果水分子之间没有氢键存在,
地球上 将会是什么面貌?(5)结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。原子分子离子宏观 物质或范德华力得失电子范德华力
氢键共价键金属键或共价键离子键离子晶体分子晶体原子晶体金属晶体作业 :P . 23 1、2
思考:5小结:有几种形成方式?
