山东省聊城临清二中高中化学课件 化学能与电能第二课时
文档属性
| 名称 | 山东省聊城临清二中高中化学课件 化学能与电能第二课时 |

|
|
| 格式 | zip | ||
| 文件大小 | 647.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-12 00:00:00 | ||
图片预览






文档简介
课件20张PPT。第二节 化学能与电能课本习题第七题:由题中数据可得出以下结论
1、某一反应如果正反应方向是放热,则逆反应方向为吸热,且放热和吸热的数值相等。
2、同一化学反应放出的热量大小与参加反应的反应物的物质的量成正比。
3、某一化学反应放出的热量大小与物质的状态有关。化
学
能
与
电
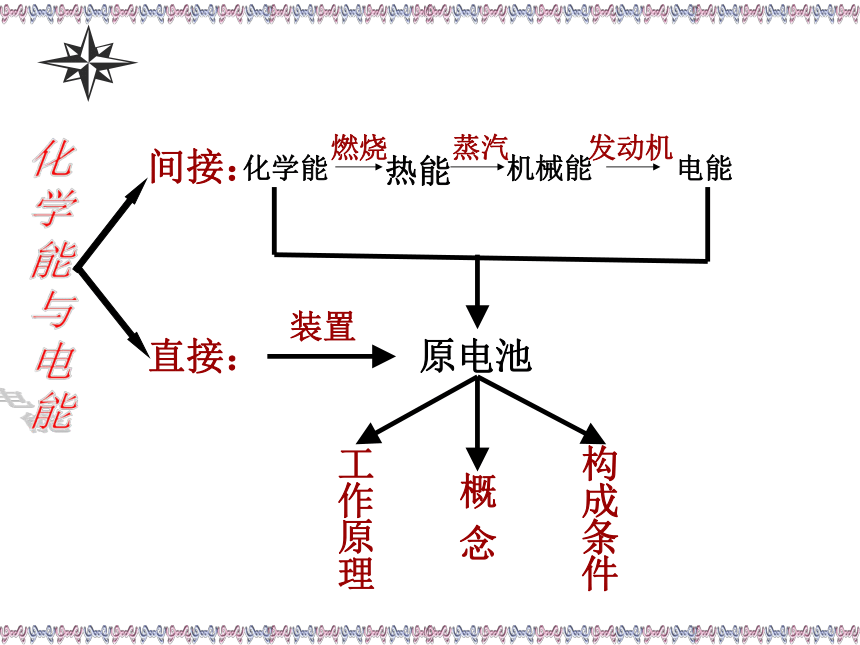
能间接:直接:装置原电池概
念构成条件工作原理把化学能转变为电能的装置化学能直接转变为电能能自发地发生氧化还原反应两极一液一连线负极:还原性相对较强的材料正极:还原性相对较弱的材料活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
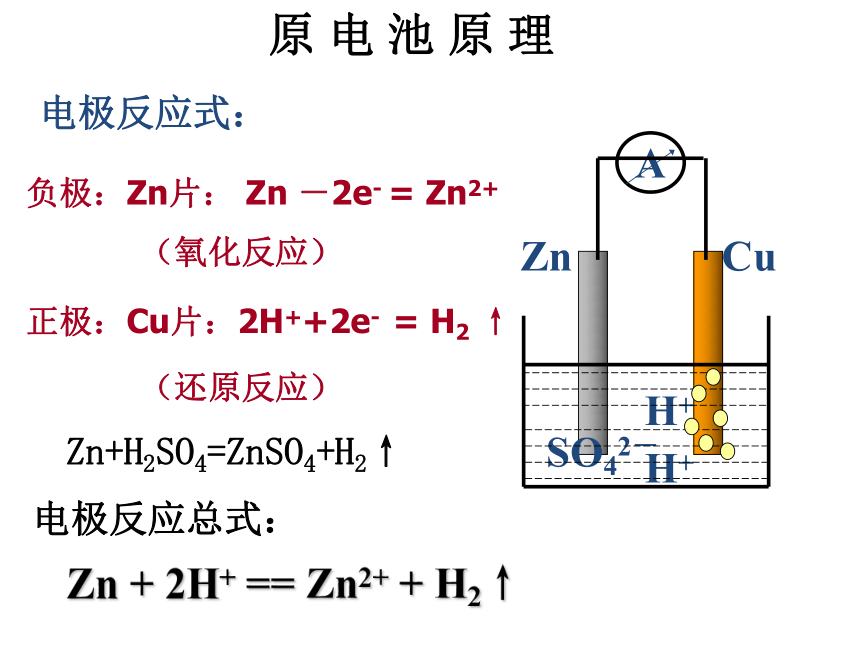
原 电 池 原 理电极反应式:负极:Zn片: Zn -2e- = Zn2+(氧化反应)正极:Cu片:2H++2e- = H2 ↑(还原反应)Zn+H2SO4=ZnSO4+H2↑电极反应总式:Zn + 2H+ == Zn2+ + H2↑ 外电路:电子由负极流向正极,
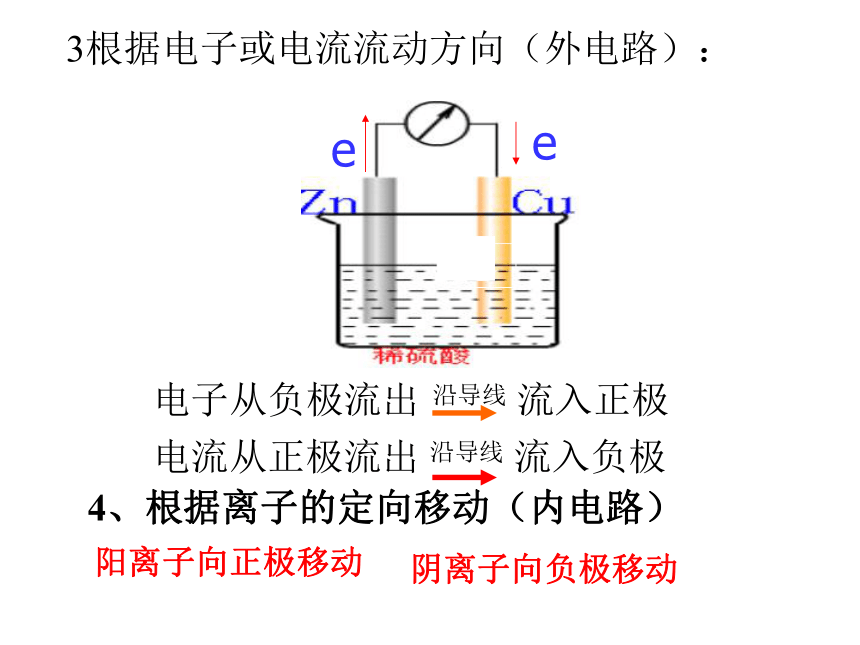
电流由正极流向负极
内电路:阴离子移向负极,阳离
子移向正极,电流由负
极流向正极
电荷流向电流流向:负极正极原电池电极名称的确定方法①根据电极材料的性质确定。通常是活泼金属是负极,不活泼金属、碳棒、化合物是正极。②根据电极反应的本身确定。失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极练习:银锌电池是广泛用作各种电子仪器的电源,它的反应可表示为:Ag2O+Zn+H2O = 2Ag+2Zn(OH)2请判断此电池中,负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.ZnD3根据电子或电流流动方向(外电路):ee4、根据离子的定向移动(内电路)阳离子向正极移动阴离子向负极移动5、根据离子方程式判断(负极)(在正极)练习1:下列装置哪些可以形成原电池?Zn CuFe C(石墨) Zn CuZn ZnFe 陶瓷Fe CuSi C(石墨) 稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C DZn Cu稀H2SO4 CuSO4溶液 酒精 稀H2SO4
E F G H H2SO4 (aq) CuSO4 (aq)负极( ): .
正极( ): .
总反应式: .负极( ): .
正极( ): .
总反应式: .练习2:请在图上标出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式. AgFeZn Zn-2e - = Zn2+
Cu Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ CuFe Fe-2e - = Fe 2+
Ag 2H++2e - = H2↑
Fe+2H+ = Fe 2+ +H2↑ 请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: . 1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不活泼的其他金属 拓 展: Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu 思 考 题请根据反应
2Fe3+ + Fe = 3 Fe 2+
设计原电池,你有哪些可行方案?Fe-Cu FeCl3Fe-C Fe(NO3)3Fe-Ag Fe(SO4)3 把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B练 习二、发展中的化学电源2、充电电池充电电池又称二次电池,它在放电时所进行的氧化还原反应,在充电时又逆向进行,使生成物恢复原状,如此充放电可循环进行,至一定周期后终止。(1)铅蓄电池(2)镍-镉碱性蓄电池 P38(3)新一代可充电的绿色电池——锂离子电池
特点:高能电池,电压高,质量轻,贮存时间长等。
用途:电脑、手表、心脏起搏器等。(3)燃料电池氢氧燃料电池:
负极:
2H2+4OH— -4e— =4H2O
(氧化反应)
正极:
O2+H2O+4e—=4OH—(还原反应)
总反应:2H2+O2=2H2O
1、某一反应如果正反应方向是放热,则逆反应方向为吸热,且放热和吸热的数值相等。
2、同一化学反应放出的热量大小与参加反应的反应物的物质的量成正比。
3、某一化学反应放出的热量大小与物质的状态有关。化
学
能
与
电
能间接:直接:装置原电池概
念构成条件工作原理把化学能转变为电能的装置化学能直接转变为电能能自发地发生氧化还原反应两极一液一连线负极:还原性相对较强的材料正极:还原性相对较弱的材料活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
原 电 池 原 理电极反应式:负极:Zn片: Zn -2e- = Zn2+(氧化反应)正极:Cu片:2H++2e- = H2 ↑(还原反应)Zn+H2SO4=ZnSO4+H2↑电极反应总式:Zn + 2H+ == Zn2+ + H2↑ 外电路:电子由负极流向正极,
电流由正极流向负极
内电路:阴离子移向负极,阳离
子移向正极,电流由负
极流向正极
电荷流向电流流向:负极正极原电池电极名称的确定方法①根据电极材料的性质确定。通常是活泼金属是负极,不活泼金属、碳棒、化合物是正极。②根据电极反应的本身确定。失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极练习:银锌电池是广泛用作各种电子仪器的电源,它的反应可表示为:Ag2O+Zn+H2O = 2Ag+2Zn(OH)2请判断此电池中,负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.ZnD3根据电子或电流流动方向(外电路):ee4、根据离子的定向移动(内电路)阳离子向正极移动阴离子向负极移动5、根据离子方程式判断(负极)(在正极)练习1:下列装置哪些可以形成原电池?Zn CuFe C(石墨) Zn CuZn ZnFe 陶瓷Fe CuSi C(石墨) 稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C DZn Cu稀H2SO4 CuSO4溶液 酒精 稀H2SO4
E F G H H2SO4 (aq) CuSO4 (aq)负极( ): .
正极( ): .
总反应式: .负极( ): .
正极( ): .
总反应式: .练习2:请在图上标出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式. AgFeZn Zn-2e - = Zn2+
Cu Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ CuFe Fe-2e - = Fe 2+
Ag 2H++2e - = H2↑
Fe+2H+ = Fe 2+ +H2↑ 请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: . 1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不活泼的其他金属 拓 展: Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu 思 考 题请根据反应
2Fe3+ + Fe = 3 Fe 2+
设计原电池,你有哪些可行方案?Fe-Cu FeCl3Fe-C Fe(NO3)3Fe-Ag Fe(SO4)3 把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B练 习二、发展中的化学电源2、充电电池充电电池又称二次电池,它在放电时所进行的氧化还原反应,在充电时又逆向进行,使生成物恢复原状,如此充放电可循环进行,至一定周期后终止。(1)铅蓄电池(2)镍-镉碱性蓄电池 P38(3)新一代可充电的绿色电池——锂离子电池
特点:高能电池,电压高,质量轻,贮存时间长等。
用途:电脑、手表、心脏起搏器等。(3)燃料电池氢氧燃料电池:
负极:
2H2+4OH— -4e— =4H2O
(氧化反应)
正极:
O2+H2O+4e—=4OH—(还原反应)
总反应:2H2+O2=2H2O
