山东省聊城临清二中高中化学课件 元素周期表(第二课时)
文档属性
| 名称 | 山东省聊城临清二中高中化学课件 元素周期表(第二课时) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-12 14:16:21 | ||
图片预览






文档简介
课件20张PPT。复习提问1、具有真正意义上的元素周期表是有哪位化学家发现的 ( )
A.门捷列夫(俄国) B.纽兰兹(英国)
C.迈尔(德国) D.尚古多(法国)
2、不能作为元素周期表中元素排列顺序的依据的是( )
A.原子的核电荷数 B.原子的核外电子数
C.原子的质子数 D.原子的中子数
AD3、请仔细观察元素周期表,你可以发现其中有___个横行,也就是有___个周期,短周期指______周期,长周期 周期。元素周期表有____个纵行,分为 ___个族,其中___个主族,___个副族,__个第Ⅷ族,__个0族,0族即是______元素。由短周期和长周期共同构成的族是 。七七一二三四五六十八十六七七一稀有气体主族和零族4、默写1~20号元素原子序数、元素符号和元素名称
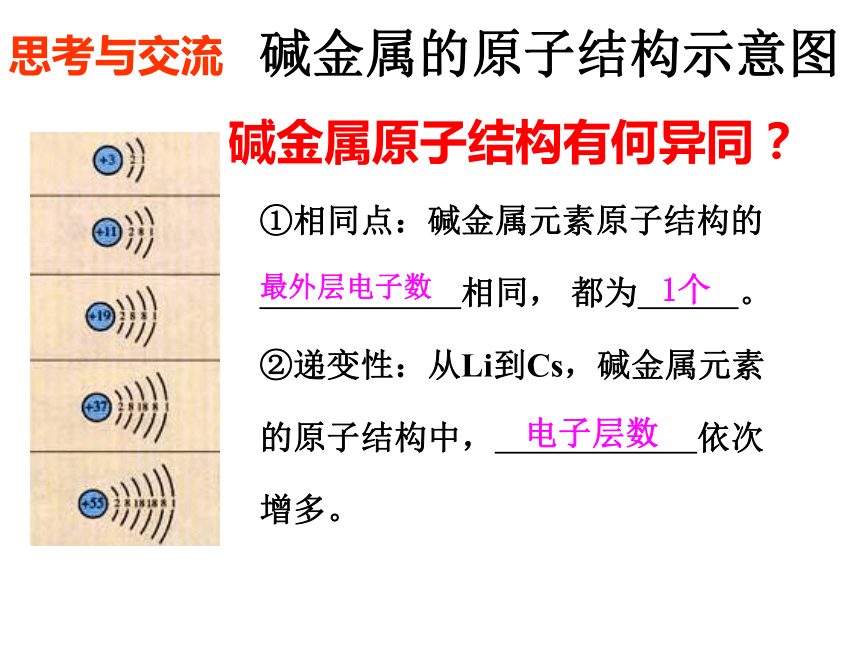
一锂钠钾铷铯 3 1119 37 551 1 1 1 2 3 4二、 元 素的性质与原子结构1 、碱金属: 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)放射性元素碱金属的原子结构碱金属的原子结构示意图 碱金属原子结构有何异同?①相同点:碱金属元素原子结构的
相同, 都为 。
②递变性:从Li到Cs,碱金属元素
的原子结构中, 依次
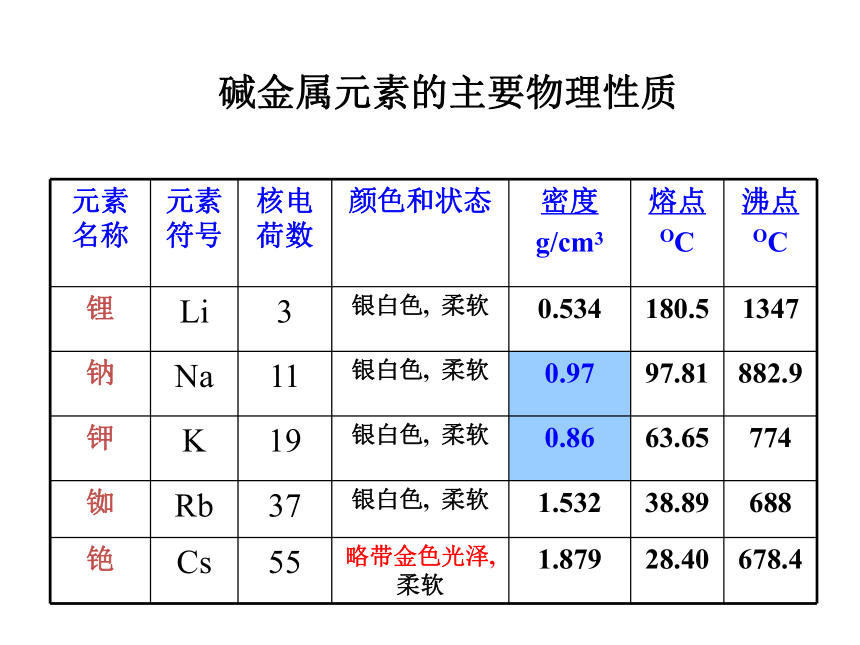
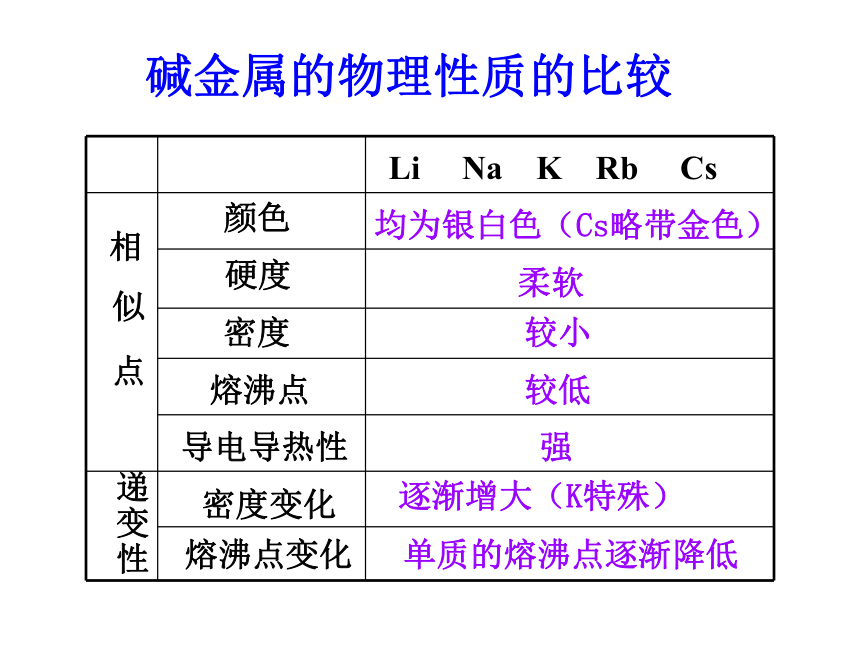
增多。最外层电子数1个电子层数思考与交流 碱金属元素的主要物理性质碱金属的物理性质的比较相
似
点递变性颜色硬度密度熔沸点导电导热性密度变化熔沸点变化Li Na K Rb Cs均为银白色(Cs略带金色)柔软较小较低强逐渐增大(K特殊)单质的熔沸点逐渐降低思考:
如何通过实验验证碱金属化学性质的相似性和不同点? (1)与氧气的反应;
(2)与水的反应;实验:
(1)钾与O2的反应;
现象:金属钾被加热后慢慢熔成金属小球,并且剧
烈燃烧,发出紫色火光(透过蓝色钴玻璃)。
(2)钾与H2O的反应;
现象:金属钾浮在水面上,剧烈反应,听到微弱的
爆鸣声,并且出现紫色的火光(透过蓝色钴玻璃) 。 根据实验讨论钠与钾的性质有什么相似性和不同性。你认为元素的性质与他们的原子结构有关系吗?其余碱金属的性质又如何? 思考 钠与钾都能与氧气、水发生反应,但反应的剧烈程度不同碱金属元素在化学性质上的规律(1)相似性:均能与氧气、与水反应,表现出金属性(还原性); 4Li + O2 ==== 2Li2O
2Na + O2 ==== Na2O2
2Na + 2H2O === 2NaOH + H2↑
2K + 2H2O === 2KOH + H2↑(请大家书写出Rb、Cs与水反应的化学方程式)△△2M + 2H2O === 2MOH + H2↑与O2反应反应不如钠剧烈,生成Li2O点燃剧烈燃烧,生成Na2O2燃烧更加剧烈生成比过氧化物复杂的氧化物遇空气立即燃烧,生成更复杂的氧化物遇空气立即燃烧,生成更复杂的氧化物LiNaKRbCs与H2O反应剧烈,生成H2更剧烈,生成H2轻微的爆炸,生成H2遇水立即燃烧,爆炸结论碱金属的化学性质遇水立即燃烧,爆炸(2)递变性:与氧气、与水反应的剧烈程度有所不同;在同一族中,自上而下反应的剧烈程度逐渐增大. Li Na K Rb Cs1.相似性:小结: 碱金属的原子结构2.递变性:(电子层数的影响大于核电荷数的影响)最外层上都只有一个电子 例:已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?金属性 Na〉Mg〉Al比较元素的金属性强弱有哪些方法??1单质与水(酸)反应置换出氢的难易程度2最高价氧化物的水化物(氢氧化物)的碱性强弱3单质间的置换反应卤素单质的物理性质卤族元素在物理性质上的规律 浏览P8资料片卡中卤素单质的物理性质表,并总结规律:结论:
(1)颜色 ——
(2)状态 ——
(3)密度 ——
(4)熔沸点 ——逐渐增大(自上而下)逐渐升高(自上而下)科学探究 —— 卤族元素的性质浏览P7的卤族元素的原子结构,并思考:
卤素(ⅦA族)的原子结构有什么共同之处吗? 最外层都有7个电子,化学性质相似;
随着核电荷数的增加,原子的电子层数递增,原子核对最外层电子的引力逐渐减弱,得电子的能力逐渐减弱,非金属性逐渐减弱。
理论分析实
验
验
证思考:
如何通过实验验证卤素化学性质的相似性和不同点? (1)与氢气的反应;
(2)相互间的置换反应;阅读卤素单质与氢气反应的表格:与氢气的反应光
卤素单质与氢气反应规律:即:卤素单质与氢气反应
剧烈程度:F2>Cl2>Br2>I2
生成氢化物稳定性:HF>HCl>HBr>HI
逐渐减弱逐渐减弱反应通式:X2 + H2 === 2HX比较元素的非金属性强弱有哪些方法??1与氢气生成气态氢化物的难易程度以及氢化物的稳定性强弱2最高价氧化物的水化物的酸性强弱3单质间的置换反应总结:
至此我们可以看到同一主族元素,无论是金属还是非金属在性质方面都具有一定的相似性和递变性。失电子的能力逐渐增强
得电子的能力逐渐减弱
还原性逐渐增强
氧化性逐渐减弱
金属性逐渐增强
非金属性逐渐减弱
A.门捷列夫(俄国) B.纽兰兹(英国)
C.迈尔(德国) D.尚古多(法国)
2、不能作为元素周期表中元素排列顺序的依据的是( )
A.原子的核电荷数 B.原子的核外电子数
C.原子的质子数 D.原子的中子数
AD3、请仔细观察元素周期表,你可以发现其中有___个横行,也就是有___个周期,短周期指______周期,长周期 周期。元素周期表有____个纵行,分为 ___个族,其中___个主族,___个副族,__个第Ⅷ族,__个0族,0族即是______元素。由短周期和长周期共同构成的族是 。七七一二三四五六十八十六七七一稀有气体主族和零族4、默写1~20号元素原子序数、元素符号和元素名称
一锂钠钾铷铯 3 1119 37 551 1 1 1 2 3 4二、 元 素的性质与原子结构1 、碱金属: 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)放射性元素碱金属的原子结构碱金属的原子结构示意图 碱金属原子结构有何异同?①相同点:碱金属元素原子结构的
相同, 都为 。
②递变性:从Li到Cs,碱金属元素
的原子结构中, 依次
增多。最外层电子数1个电子层数思考与交流 碱金属元素的主要物理性质碱金属的物理性质的比较相
似
点递变性颜色硬度密度熔沸点导电导热性密度变化熔沸点变化Li Na K Rb Cs均为银白色(Cs略带金色)柔软较小较低强逐渐增大(K特殊)单质的熔沸点逐渐降低思考:
如何通过实验验证碱金属化学性质的相似性和不同点? (1)与氧气的反应;
(2)与水的反应;实验:
(1)钾与O2的反应;
现象:金属钾被加热后慢慢熔成金属小球,并且剧
烈燃烧,发出紫色火光(透过蓝色钴玻璃)。
(2)钾与H2O的反应;
现象:金属钾浮在水面上,剧烈反应,听到微弱的
爆鸣声,并且出现紫色的火光(透过蓝色钴玻璃) 。 根据实验讨论钠与钾的性质有什么相似性和不同性。你认为元素的性质与他们的原子结构有关系吗?其余碱金属的性质又如何? 思考 钠与钾都能与氧气、水发生反应,但反应的剧烈程度不同碱金属元素在化学性质上的规律(1)相似性:均能与氧气、与水反应,表现出金属性(还原性); 4Li + O2 ==== 2Li2O
2Na + O2 ==== Na2O2
2Na + 2H2O === 2NaOH + H2↑
2K + 2H2O === 2KOH + H2↑(请大家书写出Rb、Cs与水反应的化学方程式)△△2M + 2H2O === 2MOH + H2↑与O2反应反应不如钠剧烈,生成Li2O点燃剧烈燃烧,生成Na2O2燃烧更加剧烈生成比过氧化物复杂的氧化物遇空气立即燃烧,生成更复杂的氧化物遇空气立即燃烧,生成更复杂的氧化物LiNaKRbCs与H2O反应剧烈,生成H2更剧烈,生成H2轻微的爆炸,生成H2遇水立即燃烧,爆炸结论碱金属的化学性质遇水立即燃烧,爆炸(2)递变性:与氧气、与水反应的剧烈程度有所不同;在同一族中,自上而下反应的剧烈程度逐渐增大. Li Na K Rb Cs1.相似性:小结: 碱金属的原子结构2.递变性:(电子层数的影响大于核电荷数的影响)最外层上都只有一个电子 例:已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?金属性 Na〉Mg〉Al比较元素的金属性强弱有哪些方法??1单质与水(酸)反应置换出氢的难易程度2最高价氧化物的水化物(氢氧化物)的碱性强弱3单质间的置换反应卤素单质的物理性质卤族元素在物理性质上的规律 浏览P8资料片卡中卤素单质的物理性质表,并总结规律:结论:
(1)颜色 ——
(2)状态 ——
(3)密度 ——
(4)熔沸点 ——逐渐增大(自上而下)逐渐升高(自上而下)科学探究 —— 卤族元素的性质浏览P7的卤族元素的原子结构,并思考:
卤素(ⅦA族)的原子结构有什么共同之处吗? 最外层都有7个电子,化学性质相似;
随着核电荷数的增加,原子的电子层数递增,原子核对最外层电子的引力逐渐减弱,得电子的能力逐渐减弱,非金属性逐渐减弱。
理论分析实
验
验
证思考:
如何通过实验验证卤素化学性质的相似性和不同点? (1)与氢气的反应;
(2)相互间的置换反应;阅读卤素单质与氢气反应的表格:与氢气的反应光
卤素单质与氢气反应规律:即:卤素单质与氢气反应
剧烈程度:F2>Cl2>Br2>I2
生成氢化物稳定性:HF>HCl>HBr>HI
逐渐减弱逐渐减弱反应通式:X2 + H2 === 2HX比较元素的非金属性强弱有哪些方法??1与氢气生成气态氢化物的难易程度以及氢化物的稳定性强弱2最高价氧化物的水化物的酸性强弱3单质间的置换反应总结:
至此我们可以看到同一主族元素,无论是金属还是非金属在性质方面都具有一定的相似性和递变性。失电子的能力逐渐增强
得电子的能力逐渐减弱
还原性逐渐增强
氧化性逐渐减弱
金属性逐渐增强
非金属性逐渐减弱
