湖南省长沙市长沙县、望城区、浏阳市2021-2022学年高二上学期期末调研考试化学试题(Word版含答案)
文档属性
| 名称 | 湖南省长沙市长沙县、望城区、浏阳市2021-2022学年高二上学期期末调研考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 961.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-15 14:51:00 | ||
图片预览



文档简介
长沙市长沙县、望城区、浏阳市2021-2022学年高二上学期期末调研考试
化学
友情提示:
1.本试卷分试题和答题卡两部分,共10页.满分100分,时量75分钟,
2.答案一律在答题卡上书写,在试题卷上作答无效.
3.可能用到的相对原子质量:C-12 Na-23 S-32 O-16 C1-35.5 Cu-64 H-1
━、选择题:本题共10小题,每小题3分,共30分,在每小题给出的四个选项中,只有一项符合题目要求.
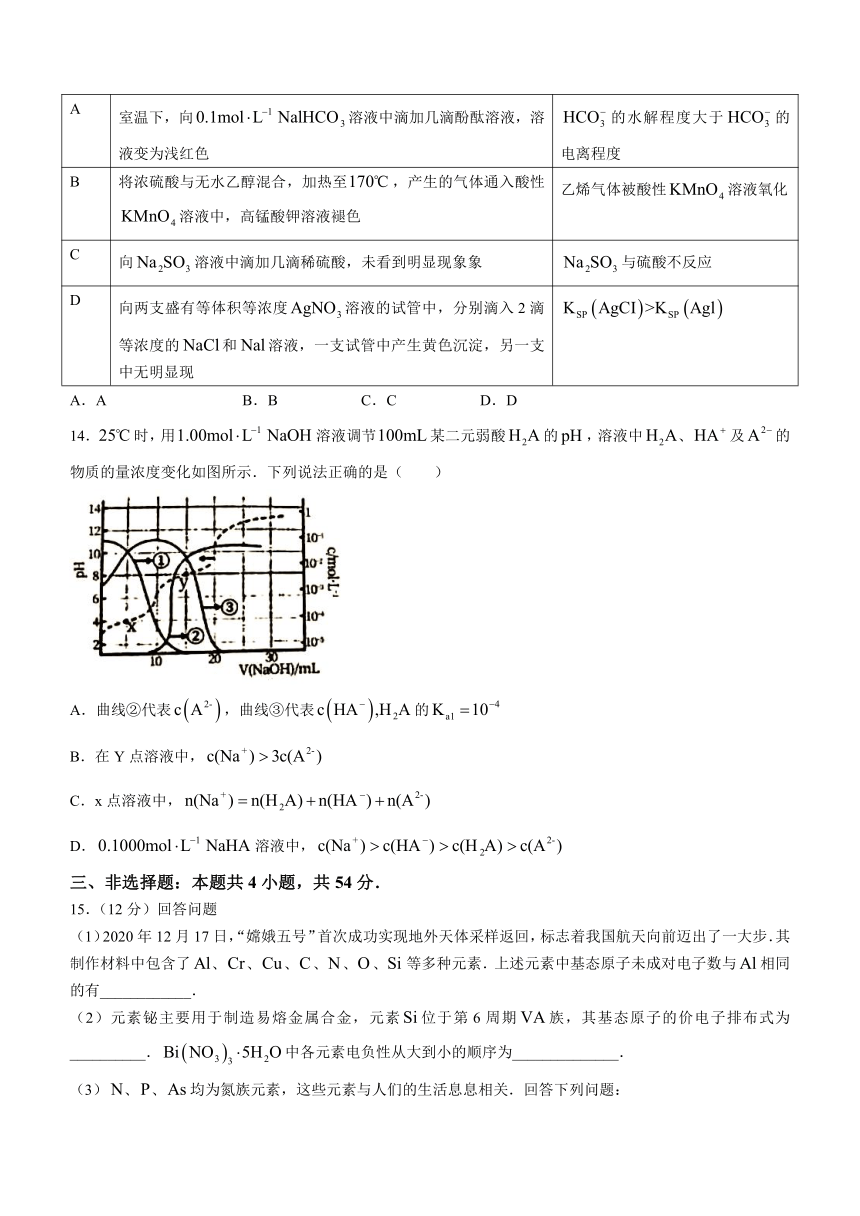
1.下列反应的的是( )
A.乙醇燃烧 B.胆矾受热分解失去结晶水 C.电解氧化铝 D.高温下木炭还原二氧化碳
2.某科研人员提出与在羟基磷灰石表面催化氧化生成的历程示意图如下(图中只画出了的部分结构).下列说法正确的是( )
A.催化剂没有参与反应 B.在反应过程中,键部分断裂
C.分子中的氧原子全部来自 D.该反应可表示为:
3.下列说法不正确的是能量( )
A.图甲中,曲线Ⅱ表示反应时加入了催化剂
B,图乙中分子发生了有效碰撞
C.加入催化剂,增大了单位体积内反应物分子中活化分子的数目,使得单位时间内有效碰撞的次数增加
D.溶液和溶液的反应的活化能接近于零
4.化学在生活中的应用随处可见,下列措施不是为了改变化学反应速率的是( )
A.将食物存放在冰箱中 B.加工馒头时添加膨松剂
C.糕点包装袋内放置除氧剂 D.冶铁时将铁矿石粉碎
5.溶液中,由于的水解,使得.如果要使更接近于,可采取的措施是( )
A.加入少量氢氧化钠 B.加入少量水 C.加入少量盐酸 D.加热
6.下列过程中的化学反应,相应的离子方程式正确的是( )
A.用稀氢碘酸溶液除去铁制品表面的铁锈:
B.溶于过量氨水:
C.加入溶液中,固体变黑:
D.通入漂白粉溶液中产生白色浑浊:
7.微生物燃料电池可以净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中浓度与去除率的关系.下列说法不正确的是( )
A.N为电池正极,被还原
B.该电池工作时,M极的电极反应式为
C.浓度较大时,可能会造成还原菌失去活性
D.当M极产生气体(标准状况)时,有电子从N极进入溶液
8.下列说法中正确的是( )
A.多电子原子的所有电子在同一区域里运动
B.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
C.处于最低能量的原子叫基态原子
D.同一原子中,所能容纳的电子数越来越多
9.下列关于原子结构、原子轨道的说法正确的是( )
A.N能层中有四个能级,共16个轨道,可容纳32种运动状态的电子
B.在K能层中,有自旋相反的两条轨道
C.s电子绕核运动,其轨道为球面,而p电子在哑铃形曲面上运动
D.114号元素是位于p区的金属元素,价电子排布式为
10.氨分子的空间结构是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化类型不同,为杂化,而是杂化
B.分子中氮原子形成3个杂化轨道,分子中碳原子形成4个杂化轨道
C.分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.分子中氮元素的电负性比分子中碳元素的电负性大
二、选择题:本题共4小题,每小题4分,共16分.在每小题给出的四个选项中,有一个或两个选项符合题目要求.全部选对的得4分,选对但不全的得2分,有选错的得0分.
11.利用超分子可以对一些物质进行分离,例如利用杯酚(杯酚用“”表示)分离和的过程如图所示.下列说法正确的是( )
A.“杯酚”能够循环使用
B.能溶于甲苯,不溶于甲苯
C.“杯酚”与之间通过共价键形成超分子
D.“杯酚”与可能是借助分子间作用力形成超分子
12.下列说法不正确的是( )
A.自发进行的反应不需要任何条件,就可以发生反应
B.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
C.一个化学反应能否实际进行,除了要考虑反应的自发性,还应该考虑反应速率
D.的反应在任何温度下都能自发进行
13.室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 室温下,向溶液中滴加几滴酚酞溶液,溶液变为浅红色 的水解程度大于的电离程度
B 将浓硫酸与无水乙醇混合,加热至,产生的气体通入酸性溶液中,高锰酸钾溶液褪色 乙烯气体被酸性溶液氧化
C 向溶液中滴加几滴稀硫酸,未看到明显现象象 与硫酸不反应
D 向两支盛有等体积等浓度溶液的试管中,分别滴入2滴等浓度的和溶液,一支试管中产生黄色沉淀,另一支中无明显现
A.A B.B C.C D.D
14.时,用溶液调节某二元弱酸的,溶液中及的物质的量浓度变化如图所示.下列说法正确的是( )
A.曲线②代表,曲线③代表的
B.在Y点溶液中,
C.x点溶液中,
D.溶液中,
三、非选择题:本题共4小题,共54分.
15.(12分)回答问题
(1)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步.其制作材料中包含了等多种元素.上述元素中基态原子未成对电子数与相同的有____________.
(2)元素铋主要用于制造易熔金属合金,元素位于第6周期族,其基态原子的价电子排布式为__________.中各元素电负性从大到小的顺序为______________.
(3)均为氮族元素,这些元素与人们的生活息息相关.回答下列问题:
①下列状态的原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是___________(填序号,下同),未成对电子最多的是_____________.
a. b. c. d.
②与S是同周期中相邻的元素,第一电离能由大到小的顺序是_________.
16.(16分)为了验证和的氧化能力相对强弱,利用如图所示电池装置进行实验.
(1)用固体配制溶液,下列仪器中没有用到的是_______(填标号),需称取的质量为_________g
(2)电池装置中,盐桥中盛装浸有高浓度电解质溶液的琼脂,要求该电解质溶液中阴、阳离子扩散速率相近,即电迁移率尽可能相接近.已知的电迁移率分别为7.62、7.91、7.40,本实验盐桥中的电解质选择,而不选的可能原因是__________.
(3)根据电流表指针偏向知,电流由电极材料X流出,则电极材料X可能为_________.
(4)一段时间后,左侧溶液中浓度增大,右侧溶液中浓度减小.则电极的电极反应式为______.
(5)检验右侧电极室溶液中存在应选用_______溶液,由此可证明氧化性:______(填“大于”或“小于”).
(6)实验前通常将电极用特殊的酸腐蚀,造成接触面粗糙的目的是____________.
17.(12分)钪()是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用.钛铁矿的主要成分为(可表示为),还含有少量等氧化物,从钛铁矿中提取的流程如下:
已知:①当离子浓度减小至时可认为沉淀完全
②室温下,溶液中离子沉淀完全的如下表所示:
离子
沉淀完全的 3.2 9.0 1.05
③,
回答下列问题:
(1)“酸浸”后元素转化为,其水解反应的化学方程式是________________.
(2)“萃取”时,使用煤油作为萃取剂,一定条件下萃取率受振荡时间的影响如图,萃取时选择最佳的振荡时间为__________ .
(3)“洗钛”所得为橘黄色的稳定离子,的作用是______________.(写出两点)
(4)“酸溶”后滤液中存在的阳离子浓度均小于“除杂”过程中应控制的范围是____________.
(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物.其反应的化学方程式为_________________.
18.(14分)当今世界多国相继规划了碳达峰碳中和的时间节点.因此研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点.
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳.已知:
①
②
③
回答下列问题:
(1)______________.
(2)在恒压密闭容器中,加入和,发生上述反应.反应达平衡时,的转化率为,容器体积减小,则反应①的平衡常数__________.
(3)一定条件下,向恒容密闭容器中充入和(假设只发生反应③),相同时间内的转化率随温度变化如图所示:
①a点为图像中最高点,a点的转化率比c点高的原因是______________.
②平衡时测得生成甲醇,保持温度不变再通入和水蒸气,此时v(正)______v(逆)(填“>”,“<”,“=”).
Ⅱ.(4)捕碳技术(主要指捕获)在降低温室气体排放中具有重要的作用.下列物质中能作为捕碳剂的是________________.
A. B. C. D.
(5)工业生产尾气中的捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至后用氨水吸收过量的.所得溶液显________(填“酸性”、“碱性”或“中性”).烟气需冷却至左右的可能原因是____________.
已知:的的.
长沙市长沙县、望城区、浏阳市2021-2022学年高二上学期期末调研考试化学参考答案
一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项符合题目要求。
1-5 ADBBC 6-10 BDCAC
二、选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分
11-14 AD A AD AB
三、非选择题:本题共4小题,每空2分,共54分。
15.(12分)
(1)Cu (2) O>N>H>Bi
(3) ① cd d ② P>S>Si
16.(16分)
(1)③ 2.5 (2) 在酸性环境下可以和发生反应 (3)石墨、银、铂、金等(或惰性材料) (4) Cu-2e-=Cu2+ (5) 大于 (6) 增大接触面积,提高电极活性
17.(12分)
(1)TiOSO4+(x+1)H2O=TiO2·xH2O↓+H2SO4
(2)10
(3) 提供配位体,生成稳定配离子[TiO(H2O2)]2+进入水层,便于除钛;
将Fe2+氧化成Fe3+,便于后续调pH使Fe3+沉淀完全达到除铁目的
(4)3.2~3.7
(5)Sc2(C2O4)3 5H2OSc2O3+3CO2↑+3CO↑+5H2O↑
18.(14分)
(1)-49kJ·mol-1 (2) 0.6
(3)① a点为T2温度下的平衡点,反应为放热反应,升高温度平衡逆向移动,CO2转化率降低 ② <
(4)AB
(5) 碱性 降低吸收过程中氨水的挥发,促进氨水对CO2的吸收
化学
友情提示:
1.本试卷分试题和答题卡两部分,共10页.满分100分,时量75分钟,
2.答案一律在答题卡上书写,在试题卷上作答无效.
3.可能用到的相对原子质量:C-12 Na-23 S-32 O-16 C1-35.5 Cu-64 H-1
━、选择题:本题共10小题,每小题3分,共30分,在每小题给出的四个选项中,只有一项符合题目要求.
1.下列反应的的是( )
A.乙醇燃烧 B.胆矾受热分解失去结晶水 C.电解氧化铝 D.高温下木炭还原二氧化碳
2.某科研人员提出与在羟基磷灰石表面催化氧化生成的历程示意图如下(图中只画出了的部分结构).下列说法正确的是( )
A.催化剂没有参与反应 B.在反应过程中,键部分断裂
C.分子中的氧原子全部来自 D.该反应可表示为:
3.下列说法不正确的是能量( )
A.图甲中,曲线Ⅱ表示反应时加入了催化剂
B,图乙中分子发生了有效碰撞
C.加入催化剂,增大了单位体积内反应物分子中活化分子的数目,使得单位时间内有效碰撞的次数增加
D.溶液和溶液的反应的活化能接近于零
4.化学在生活中的应用随处可见,下列措施不是为了改变化学反应速率的是( )
A.将食物存放在冰箱中 B.加工馒头时添加膨松剂
C.糕点包装袋内放置除氧剂 D.冶铁时将铁矿石粉碎
5.溶液中,由于的水解,使得.如果要使更接近于,可采取的措施是( )
A.加入少量氢氧化钠 B.加入少量水 C.加入少量盐酸 D.加热
6.下列过程中的化学反应,相应的离子方程式正确的是( )
A.用稀氢碘酸溶液除去铁制品表面的铁锈:
B.溶于过量氨水:
C.加入溶液中,固体变黑:
D.通入漂白粉溶液中产生白色浑浊:
7.微生物燃料电池可以净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中浓度与去除率的关系.下列说法不正确的是( )
A.N为电池正极,被还原
B.该电池工作时,M极的电极反应式为
C.浓度较大时,可能会造成还原菌失去活性
D.当M极产生气体(标准状况)时,有电子从N极进入溶液
8.下列说法中正确的是( )
A.多电子原子的所有电子在同一区域里运动
B.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
C.处于最低能量的原子叫基态原子
D.同一原子中,所能容纳的电子数越来越多
9.下列关于原子结构、原子轨道的说法正确的是( )
A.N能层中有四个能级,共16个轨道,可容纳32种运动状态的电子
B.在K能层中,有自旋相反的两条轨道
C.s电子绕核运动,其轨道为球面,而p电子在哑铃形曲面上运动
D.114号元素是位于p区的金属元素,价电子排布式为
10.氨分子的空间结构是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化类型不同,为杂化,而是杂化
B.分子中氮原子形成3个杂化轨道,分子中碳原子形成4个杂化轨道
C.分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.分子中氮元素的电负性比分子中碳元素的电负性大
二、选择题:本题共4小题,每小题4分,共16分.在每小题给出的四个选项中,有一个或两个选项符合题目要求.全部选对的得4分,选对但不全的得2分,有选错的得0分.
11.利用超分子可以对一些物质进行分离,例如利用杯酚(杯酚用“”表示)分离和的过程如图所示.下列说法正确的是( )
A.“杯酚”能够循环使用
B.能溶于甲苯,不溶于甲苯
C.“杯酚”与之间通过共价键形成超分子
D.“杯酚”与可能是借助分子间作用力形成超分子
12.下列说法不正确的是( )
A.自发进行的反应不需要任何条件,就可以发生反应
B.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
C.一个化学反应能否实际进行,除了要考虑反应的自发性,还应该考虑反应速率
D.的反应在任何温度下都能自发进行
13.室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 室温下,向溶液中滴加几滴酚酞溶液,溶液变为浅红色 的水解程度大于的电离程度
B 将浓硫酸与无水乙醇混合,加热至,产生的气体通入酸性溶液中,高锰酸钾溶液褪色 乙烯气体被酸性溶液氧化
C 向溶液中滴加几滴稀硫酸,未看到明显现象象 与硫酸不反应
D 向两支盛有等体积等浓度溶液的试管中,分别滴入2滴等浓度的和溶液,一支试管中产生黄色沉淀,另一支中无明显现
A.A B.B C.C D.D
14.时,用溶液调节某二元弱酸的,溶液中及的物质的量浓度变化如图所示.下列说法正确的是( )
A.曲线②代表,曲线③代表的
B.在Y点溶液中,
C.x点溶液中,
D.溶液中,
三、非选择题:本题共4小题,共54分.
15.(12分)回答问题
(1)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步.其制作材料中包含了等多种元素.上述元素中基态原子未成对电子数与相同的有____________.
(2)元素铋主要用于制造易熔金属合金,元素位于第6周期族,其基态原子的价电子排布式为__________.中各元素电负性从大到小的顺序为______________.
(3)均为氮族元素,这些元素与人们的生活息息相关.回答下列问题:
①下列状态的原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是___________(填序号,下同),未成对电子最多的是_____________.
a. b. c. d.
②与S是同周期中相邻的元素,第一电离能由大到小的顺序是_________.
16.(16分)为了验证和的氧化能力相对强弱,利用如图所示电池装置进行实验.
(1)用固体配制溶液,下列仪器中没有用到的是_______(填标号),需称取的质量为_________g
(2)电池装置中,盐桥中盛装浸有高浓度电解质溶液的琼脂,要求该电解质溶液中阴、阳离子扩散速率相近,即电迁移率尽可能相接近.已知的电迁移率分别为7.62、7.91、7.40,本实验盐桥中的电解质选择,而不选的可能原因是__________.
(3)根据电流表指针偏向知,电流由电极材料X流出,则电极材料X可能为_________.
(4)一段时间后,左侧溶液中浓度增大,右侧溶液中浓度减小.则电极的电极反应式为______.
(5)检验右侧电极室溶液中存在应选用_______溶液,由此可证明氧化性:______(填“大于”或“小于”).
(6)实验前通常将电极用特殊的酸腐蚀,造成接触面粗糙的目的是____________.
17.(12分)钪()是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用.钛铁矿的主要成分为(可表示为),还含有少量等氧化物,从钛铁矿中提取的流程如下:
已知:①当离子浓度减小至时可认为沉淀完全
②室温下,溶液中离子沉淀完全的如下表所示:
离子
沉淀完全的 3.2 9.0 1.05
③,
回答下列问题:
(1)“酸浸”后元素转化为,其水解反应的化学方程式是________________.
(2)“萃取”时,使用煤油作为萃取剂,一定条件下萃取率受振荡时间的影响如图,萃取时选择最佳的振荡时间为__________ .
(3)“洗钛”所得为橘黄色的稳定离子,的作用是______________.(写出两点)
(4)“酸溶”后滤液中存在的阳离子浓度均小于“除杂”过程中应控制的范围是____________.
(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物.其反应的化学方程式为_________________.
18.(14分)当今世界多国相继规划了碳达峰碳中和的时间节点.因此研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点.
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳.已知:
①
②
③
回答下列问题:
(1)______________.
(2)在恒压密闭容器中,加入和,发生上述反应.反应达平衡时,的转化率为,容器体积减小,则反应①的平衡常数__________.
(3)一定条件下,向恒容密闭容器中充入和(假设只发生反应③),相同时间内的转化率随温度变化如图所示:
①a点为图像中最高点,a点的转化率比c点高的原因是______________.
②平衡时测得生成甲醇,保持温度不变再通入和水蒸气,此时v(正)______v(逆)(填“>”,“<”,“=”).
Ⅱ.(4)捕碳技术(主要指捕获)在降低温室气体排放中具有重要的作用.下列物质中能作为捕碳剂的是________________.
A. B. C. D.
(5)工业生产尾气中的捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至后用氨水吸收过量的.所得溶液显________(填“酸性”、“碱性”或“中性”).烟气需冷却至左右的可能原因是____________.
已知:的的.
长沙市长沙县、望城区、浏阳市2021-2022学年高二上学期期末调研考试化学参考答案
一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项符合题目要求。
1-5 ADBBC 6-10 BDCAC
二、选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分
11-14 AD A AD AB
三、非选择题:本题共4小题,每空2分,共54分。
15.(12分)
(1)Cu (2) O>N>H>Bi
(3) ① cd d ② P>S>Si
16.(16分)
(1)③ 2.5 (2) 在酸性环境下可以和发生反应 (3)石墨、银、铂、金等(或惰性材料) (4) Cu-2e-=Cu2+ (5) 大于 (6) 增大接触面积,提高电极活性
17.(12分)
(1)TiOSO4+(x+1)H2O=TiO2·xH2O↓+H2SO4
(2)10
(3) 提供配位体,生成稳定配离子[TiO(H2O2)]2+进入水层,便于除钛;
将Fe2+氧化成Fe3+,便于后续调pH使Fe3+沉淀完全达到除铁目的
(4)3.2~3.7
(5)Sc2(C2O4)3 5H2OSc2O3+3CO2↑+3CO↑+5H2O↑
18.(14分)
(1)-49kJ·mol-1 (2) 0.6
(3)① a点为T2温度下的平衡点,反应为放热反应,升高温度平衡逆向移动,CO2转化率降低 ② <
(4)AB
(5) 碱性 降低吸收过程中氨水的挥发,促进氨水对CO2的吸收
同课章节目录
