江西省上饶市2021-2022学年高二上学期期末质量检测化学试题(Word版含答案)
文档属性
| 名称 | 江西省上饶市2021-2022学年高二上学期期末质量检测化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 179.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-15 15:12:53 | ||
图片预览


文档简介
上饶市2021-2022学年高二上学期期末质量检测
化学试题卷
可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Fe-56 Cu-64
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16小题,每题3分,共48分,每题只有一个符合题意的选项)
1.化学与资源利用、环境保护及社会可持续发展密切相关,下列说法错误的是
A.明矾常用作净水剂,是因为明矾具有杀菌消毒的功能
B.研发催化剂将CO2还原为甲醇有利于促进碳中和
C.推广使用新能源汽车有利于减少雾霾
D.天和核心舱的可折叠柔性太阳翼电池能将光能转化为电能
2.下列有关化学反应原理的说法正确的是
A.强碱和强酸的中和反应的活化能很高,所以化学反应速率很大
B.升高温度,活化分子百分数增大,化学反应速率加快
C.使用催化剂,改变反应历程,降低反应的反应热
D.反应的自发性既能用于判断反应进行的方向,也能用于确定反应发生的速率
3.根据能量图,下列说法正确的是
A.是一个放热反应
B.2molAB(g)的总能量小于1mol A(g)和1molB(g)的总能量之和
C.形成1molAB(g)中的化学键需要放出号kJ的能量
D.1molA2(g)和1mol B2(g)的能量之和为akJ
4.将镁片、铝片用导线连接并插入NaOH溶液中,关于该装置的叙述正确的是
A.该装置将电能转化为化学能
B.该装置使用的铝片不需要处理表面的氧化膜
C.电子由镁片向铝片移动
D.NaOH溶液更换为任何电解质溶液,铝片上都发生氧化反应
5.下列有关说法正确的是
A.施肥时,草木灰和铵态氮肥混合施用可以增强肥效
B.已知 △H=-483.6kJ/mol,则氢气的燃烧热△H=-241.8kJ/mol
C.已知 △H1, △H2,则△H1<△H2
D.在一定温度和压强下,将0.5mol N2和1.5molH2置于密闭容器中反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为 △H=-38.6kJ/mol
6.今年京沪高铁迎来开通运营10周年。作为世界铁路历史上一次建成里程最长、标准最高的高速铁路,京沪高铁于2011年6月30日开通运营。10年来京沪高铁成为中国高铁的标杆和典范,京沪高铁用创新领跑中国速度。科研人员通过改良技术提高高铁速度,同样改变条件也能改变化学反应速率,下列措施对增大反应速率明显有效的是
A.对于反应,加入MnO2或升高温度
B.在K2SO4与BaCl2两溶液反应时,增大压强
C.Fe与稀硫酸反应制取氢气时,改用浓硫酸
D.Na与水反应时增大水的用量
7.下列说法正确的是
A.电解、电离、电镀、电化学腐蚀这些过程都需要通电后才能进行
B.298K时,能自发进行,则其△H<0
C.镀锌铁板是利用了外加电流的阴极保护法来达到防止腐蚀的目的
D.将纯水加热至较高温度,Kw变大、pH变小、呈酸性
8.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(H+)/c(OH-)=1012的水溶液中:、Al3+、、CI-
B.加入铝粉放出氢气的溶液中:Na+、、CI-、Mg2+
C.使甲基橙变红的溶液中:Fe2+、Na+、、
D.澄清透明的无色溶液中:Fe3+、Al3+、、Cl-
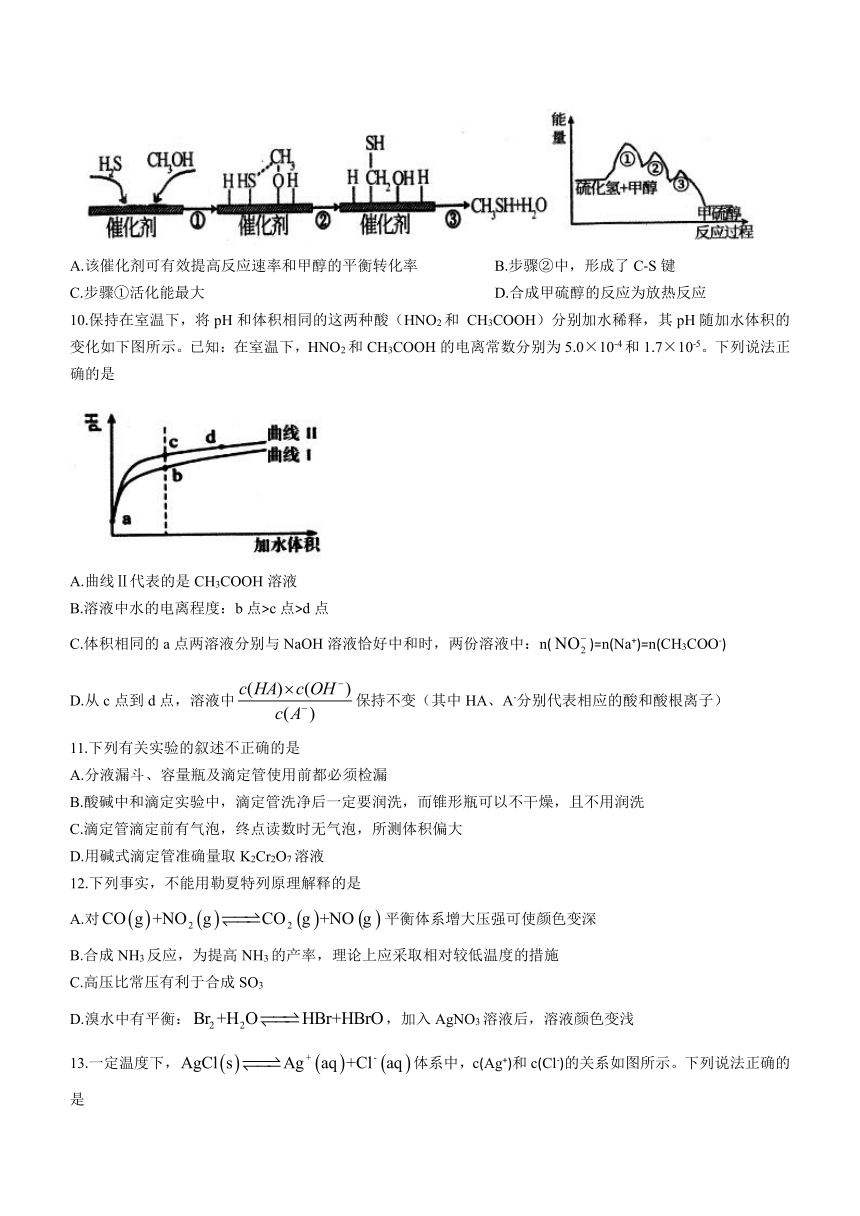
9.甲硫醇是一种重要的化工试剂。在一定温度下,硫化氢与甲醇合成甲硫醇的催化过程及能量变化如图所示。下列说法不正确的是
A.该催化剂可有效提高反应速率和甲醇的平衡转化率 B.步骤②中,形成了C-S键
C.步骤①活化能最大 D.合成甲硫醇的反应为放热反应
10.保持在室温下,将pH和体积相同的这两种酸(HNO2和 CH3COOH)分别加水稀释,其pH随加水体积的变化如下图所示。已知:在室温下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。下列说法正确的是
A.曲线Ⅱ代表的是CH3COOH溶液
B.溶液中水的电离程度:b点>c点>d点
C.体积相同的a点两溶液分别与NaOH溶液恰好中和时,两份溶液中:n()=n(Na+)=n(CH3COO-)
D.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子)
11.下列有关实验的叙述不正确的是
A.分液漏斗、容量瓶及滴定管使用前都必须检漏
B.酸碱中和滴定实验中,滴定管洗净后一定要润洗,而锥形瓶可以不干燥,且不用润洗
C.滴定管滴定前有气泡,终点读数时无气泡,所测体积偏大
D.用碱式滴定管准确量取K2Cr2O7溶液
12.下列事实,不能用勒夏特列原理解释的是
A.对平衡体系增大压强可使颜色变深
B.合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C.高压比常压有利于合成SO3
D.溴水中有平衡:,加入AgNO3溶液后,溶液颜色变浅
13.一定温度下,体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
A.a、b、c三点对应的Ksp不同
B.AgCl在c点的溶解度比b点的大
C.AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-)
D.b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化
14.对于可逆反应,在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.ν(A)=0.5mol·L-1·min-1 B.ν(B)=1.2mol·L-1·min-1
C.ν(C)=0.8mol·L-1·min-1 D.ν(D)=1.1mol·L-1·min-1
15.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应,经5min 后测得D的浓度为0.5mol·L-1,c(A):c(B)=3:5,用C的浓度变化表示的平均反应速率为0.1mol·L-1·min-1。下列有关结论正确的是
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2mol·L-1·min-1
C.反应开始前A的物质的量为3mol
D.5min时A的浓度为0.2mol·L-1
16.25C时,SO2与NaOH反应后的溶液中存在含硫微粒H2SO3、和,三者中各自所占的物质的量分数随溶液pH变化的关系如图所示。下列说法正确的是
A.a表示物质的量分数随溶液pH变化的曲线
B.pH-=8的溶液中:c()>c()
C.pH=7的溶液中:c(Na+)=c()+2c()
D.1mol/L的 NaHSO3溶液中存在:c(H2SO3)=c(H+)+c(OH-)+c()
第Ⅱ卷(非选择题 共52分)
二、非选择题(每空2分,共52分)
17.(12分)请回答下列问题:
(1)84消毒液是一种以 NaClO为主要成分的高效消毒剂,NaClO溶液呈 性(填“酸”“碱”或“中”),原因可用离子方程式表示为 。
(2)常温下,某柠檬水的pH为3,则其中的c(OH-)为 。
(3)浓度均为0.1mol/L的盐酸、硫酸和醋酸,其中pH最小的是 。
(4)在某温度下,向含有BaSO4固体的BaSO4饱和溶液中加入少量稀硫酸,则c(Ba2+) (填“增大”“减小”或“不变”,下同),Ksp 。
18.(14分)氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为: △H
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H N-H N-N NN
435.9KJ 390.8KJ 192.8KJ 945.8KJ
则△H= 。
(2)已知在400℃时,的K=0.5。
①在400℃时,的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应ν正(N2) ν逆(N2)(填“>”、“<”或“=”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡 移动(填“向左”、“向右”或“不”);反应速率将 (填“增大”、“减小”或“不变”)。
(3) H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中,投入H2NCOONH4(s),发生反应:,写出平衡常数的表达式K= ,下列能说明该反应达到平衡状态的是 (填序号)。
①NH3分子中断裂2NA个N-H键,同时CO2分子中形成2NA个C=O键
②混合气体的密度保持不变
③反应体系的总压强保持不变
④NH3和CO2的浓度之比保持不变
19.(14分)1.用50mL 0.50mol/L盐酸与50mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)大烧杯上如果不盖硬纸板,求得的中和热△H (填“偏大、偏小、无影响”);
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热△H 。(填“相等、不相等”)
Ⅱ.氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中Na2S2O3·5H2O的质量分数。实验步骤:称取6g粗品配制250mL的溶液待用。取25.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000mol·L-1I2的标准溶液进行滴定(依据反应为),消耗I2的标准溶液20.00mL。回答下列问题:
(1)判定滴定至终点的现象是 。
(2)粗品中Na2S2O3·5H2O的质量分数为 (保留三位有效数字)。
(3)若装I2的标准溶液的滴定管用水洗后,未用标准液润洗,则测定结果 (填“偏高”、“偏低”或“不变”)。
20.(12分)下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为KCl溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。
(1)若甲装置中进行粗铜的精炼,则 (填a或b)极为粗铜。
(2)乙池中c电极上发生的电极反应式为 ,d电极发生 反应(填“氧化”或“还原”)。
(3)丙装置可以制取KOH溶液,制得的KOH可以通过 口排出(填“g”或“h”)。
(4)当d电极消耗标准状况下2.24L O2时,丙装置中阳极室产生气体的质量为 g。
(5)若甲装置中a、b均为惰性电极,向甲所得溶液中加入0.5 mol CuO后恰好使溶液复原,则电路中转移的电子数目为 。
上饶市2021-2022学年高二上学期期末质量检测化学试卷答案
第Ⅰ卷 (共16个选择题,每小题3分,共48分)
1 2 3 4 5 6 7 8
A B C B C A B A
9 10 11 12 13 14 15 16
A D D A C D C C
第Ⅱ卷 (非选择题,每空2分,共52分)
17.(12分,每空2分)
(1)碱
(2)1.0×10-11mol·L-1
(3)硫酸
(4)减小 不变
18.(14分,每空2分)
(1)-91.3kJ·mol-1
(2)①2 ② =
③向左 减小
(3) ②③
19.(14分,每空2分)
I. (1)环形玻璃搅拌棒
(2)保温、隔热,减少实验过程中的热量损失
(3)偏大
(4)相等
II. (1)加入最后一滴I2标准溶液后,溶液由无色变为蓝,且半分钟内颜色不褪去。
(2)82.7%或0.827
(3)偏高
20.(12分,每空2分)
(1)a
(2) 还原
(3)h
(4)14.2
(5)6.02×1023(或NA)
化学试题卷
可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Fe-56 Cu-64
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16小题,每题3分,共48分,每题只有一个符合题意的选项)
1.化学与资源利用、环境保护及社会可持续发展密切相关,下列说法错误的是
A.明矾常用作净水剂,是因为明矾具有杀菌消毒的功能
B.研发催化剂将CO2还原为甲醇有利于促进碳中和
C.推广使用新能源汽车有利于减少雾霾
D.天和核心舱的可折叠柔性太阳翼电池能将光能转化为电能
2.下列有关化学反应原理的说法正确的是
A.强碱和强酸的中和反应的活化能很高,所以化学反应速率很大
B.升高温度,活化分子百分数增大,化学反应速率加快
C.使用催化剂,改变反应历程,降低反应的反应热
D.反应的自发性既能用于判断反应进行的方向,也能用于确定反应发生的速率
3.根据能量图,下列说法正确的是
A.是一个放热反应
B.2molAB(g)的总能量小于1mol A(g)和1molB(g)的总能量之和
C.形成1molAB(g)中的化学键需要放出号kJ的能量
D.1molA2(g)和1mol B2(g)的能量之和为akJ
4.将镁片、铝片用导线连接并插入NaOH溶液中,关于该装置的叙述正确的是
A.该装置将电能转化为化学能
B.该装置使用的铝片不需要处理表面的氧化膜
C.电子由镁片向铝片移动
D.NaOH溶液更换为任何电解质溶液,铝片上都发生氧化反应
5.下列有关说法正确的是
A.施肥时,草木灰和铵态氮肥混合施用可以增强肥效
B.已知 △H=-483.6kJ/mol,则氢气的燃烧热△H=-241.8kJ/mol
C.已知 △H1, △H2,则△H1<△H2
D.在一定温度和压强下,将0.5mol N2和1.5molH2置于密闭容器中反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为 △H=-38.6kJ/mol
6.今年京沪高铁迎来开通运营10周年。作为世界铁路历史上一次建成里程最长、标准最高的高速铁路,京沪高铁于2011年6月30日开通运营。10年来京沪高铁成为中国高铁的标杆和典范,京沪高铁用创新领跑中国速度。科研人员通过改良技术提高高铁速度,同样改变条件也能改变化学反应速率,下列措施对增大反应速率明显有效的是
A.对于反应,加入MnO2或升高温度
B.在K2SO4与BaCl2两溶液反应时,增大压强
C.Fe与稀硫酸反应制取氢气时,改用浓硫酸
D.Na与水反应时增大水的用量
7.下列说法正确的是
A.电解、电离、电镀、电化学腐蚀这些过程都需要通电后才能进行
B.298K时,能自发进行,则其△H<0
C.镀锌铁板是利用了外加电流的阴极保护法来达到防止腐蚀的目的
D.将纯水加热至较高温度,Kw变大、pH变小、呈酸性
8.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(H+)/c(OH-)=1012的水溶液中:、Al3+、、CI-
B.加入铝粉放出氢气的溶液中:Na+、、CI-、Mg2+
C.使甲基橙变红的溶液中:Fe2+、Na+、、
D.澄清透明的无色溶液中:Fe3+、Al3+、、Cl-
9.甲硫醇是一种重要的化工试剂。在一定温度下,硫化氢与甲醇合成甲硫醇的催化过程及能量变化如图所示。下列说法不正确的是
A.该催化剂可有效提高反应速率和甲醇的平衡转化率 B.步骤②中,形成了C-S键
C.步骤①活化能最大 D.合成甲硫醇的反应为放热反应
10.保持在室温下,将pH和体积相同的这两种酸(HNO2和 CH3COOH)分别加水稀释,其pH随加水体积的变化如下图所示。已知:在室温下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。下列说法正确的是
A.曲线Ⅱ代表的是CH3COOH溶液
B.溶液中水的电离程度:b点>c点>d点
C.体积相同的a点两溶液分别与NaOH溶液恰好中和时,两份溶液中:n()=n(Na+)=n(CH3COO-)
D.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子)
11.下列有关实验的叙述不正确的是
A.分液漏斗、容量瓶及滴定管使用前都必须检漏
B.酸碱中和滴定实验中,滴定管洗净后一定要润洗,而锥形瓶可以不干燥,且不用润洗
C.滴定管滴定前有气泡,终点读数时无气泡,所测体积偏大
D.用碱式滴定管准确量取K2Cr2O7溶液
12.下列事实,不能用勒夏特列原理解释的是
A.对平衡体系增大压强可使颜色变深
B.合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C.高压比常压有利于合成SO3
D.溴水中有平衡:,加入AgNO3溶液后,溶液颜色变浅
13.一定温度下,体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
A.a、b、c三点对应的Ksp不同
B.AgCl在c点的溶解度比b点的大
C.AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-)
D.b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化
14.对于可逆反应,在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.ν(A)=0.5mol·L-1·min-1 B.ν(B)=1.2mol·L-1·min-1
C.ν(C)=0.8mol·L-1·min-1 D.ν(D)=1.1mol·L-1·min-1
15.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应,经5min 后测得D的浓度为0.5mol·L-1,c(A):c(B)=3:5,用C的浓度变化表示的平均反应速率为0.1mol·L-1·min-1。下列有关结论正确的是
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2mol·L-1·min-1
C.反应开始前A的物质的量为3mol
D.5min时A的浓度为0.2mol·L-1
16.25C时,SO2与NaOH反应后的溶液中存在含硫微粒H2SO3、和,三者中各自所占的物质的量分数随溶液pH变化的关系如图所示。下列说法正确的是
A.a表示物质的量分数随溶液pH变化的曲线
B.pH-=8的溶液中:c()>c()
C.pH=7的溶液中:c(Na+)=c()+2c()
D.1mol/L的 NaHSO3溶液中存在:c(H2SO3)=c(H+)+c(OH-)+c()
第Ⅱ卷(非选择题 共52分)
二、非选择题(每空2分,共52分)
17.(12分)请回答下列问题:
(1)84消毒液是一种以 NaClO为主要成分的高效消毒剂,NaClO溶液呈 性(填“酸”“碱”或“中”),原因可用离子方程式表示为 。
(2)常温下,某柠檬水的pH为3,则其中的c(OH-)为 。
(3)浓度均为0.1mol/L的盐酸、硫酸和醋酸,其中pH最小的是 。
(4)在某温度下,向含有BaSO4固体的BaSO4饱和溶液中加入少量稀硫酸,则c(Ba2+) (填“增大”“减小”或“不变”,下同),Ksp 。
18.(14分)氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为: △H
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H N-H N-N NN
435.9KJ 390.8KJ 192.8KJ 945.8KJ
则△H= 。
(2)已知在400℃时,的K=0.5。
①在400℃时,的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应ν正(N2) ν逆(N2)(填“>”、“<”或“=”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡 移动(填“向左”、“向右”或“不”);反应速率将 (填“增大”、“减小”或“不变”)。
(3) H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中,投入H2NCOONH4(s),发生反应:,写出平衡常数的表达式K= ,下列能说明该反应达到平衡状态的是 (填序号)。
①NH3分子中断裂2NA个N-H键,同时CO2分子中形成2NA个C=O键
②混合气体的密度保持不变
③反应体系的总压强保持不变
④NH3和CO2的浓度之比保持不变
19.(14分)1.用50mL 0.50mol/L盐酸与50mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)大烧杯上如果不盖硬纸板,求得的中和热△H (填“偏大、偏小、无影响”);
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热△H 。(填“相等、不相等”)
Ⅱ.氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中Na2S2O3·5H2O的质量分数。实验步骤:称取6g粗品配制250mL的溶液待用。取25.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000mol·L-1I2的标准溶液进行滴定(依据反应为),消耗I2的标准溶液20.00mL。回答下列问题:
(1)判定滴定至终点的现象是 。
(2)粗品中Na2S2O3·5H2O的质量分数为 (保留三位有效数字)。
(3)若装I2的标准溶液的滴定管用水洗后,未用标准液润洗,则测定结果 (填“偏高”、“偏低”或“不变”)。
20.(12分)下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为KCl溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。
(1)若甲装置中进行粗铜的精炼,则 (填a或b)极为粗铜。
(2)乙池中c电极上发生的电极反应式为 ,d电极发生 反应(填“氧化”或“还原”)。
(3)丙装置可以制取KOH溶液,制得的KOH可以通过 口排出(填“g”或“h”)。
(4)当d电极消耗标准状况下2.24L O2时,丙装置中阳极室产生气体的质量为 g。
(5)若甲装置中a、b均为惰性电极,向甲所得溶液中加入0.5 mol CuO后恰好使溶液复原,则电路中转移的电子数目为 。
上饶市2021-2022学年高二上学期期末质量检测化学试卷答案
第Ⅰ卷 (共16个选择题,每小题3分,共48分)
1 2 3 4 5 6 7 8
A B C B C A B A
9 10 11 12 13 14 15 16
A D D A C D C C
第Ⅱ卷 (非选择题,每空2分,共52分)
17.(12分,每空2分)
(1)碱
(2)1.0×10-11mol·L-1
(3)硫酸
(4)减小 不变
18.(14分,每空2分)
(1)-91.3kJ·mol-1
(2)①2 ② =
③向左 减小
(3) ②③
19.(14分,每空2分)
I. (1)环形玻璃搅拌棒
(2)保温、隔热,减少实验过程中的热量损失
(3)偏大
(4)相等
II. (1)加入最后一滴I2标准溶液后,溶液由无色变为蓝,且半分钟内颜色不褪去。
(2)82.7%或0.827
(3)偏高
20.(12分,每空2分)
(1)a
(2) 还原
(3)h
(4)14.2
(5)6.02×1023(或NA)
同课章节目录
