四川省成都市2021-2022学年高二上学期期末考试化学试题(Word版含答案)
文档属性
| 名称 | 四川省成都市2021-2022学年高二上学期期末考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 977.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-15 15:31:26 | ||
图片预览




文档简介
成都市2021-2022学年高二上学期期末考试
化学
本试卷分选择题和非选择题两部分.第Ⅰ卷(选择题)1至5页,第Ⅱ卷(非选择题)6至8页,共8页,满分100分,考试时间90分钟.
注意事项:
1.答题前,务必将自己的姓名、考籍号填写在答题卡规定的位置上.
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦擦干净后,再选涂其它答案标号.
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上.
4.所有题目必须在答题卡上作答,在试题卷上答题无效.
5.考试结束后,只将答题卡交回.
可能用到的相对原子质量:H-1 O-16 Ca-40
第Ⅰ卷(选择题,共40分)
本卷共20题,每题2分,共40分.每题只有一个选项符合题意.
1.能源是国民经济和社会发展的重要物质基础,下列属于二次能源的是( )
A.煤炭 B.地热 C.电力 D.风能
2.下列过程在一定条件下能自发进行但不能用熵增解释的是( )
A.花香四溢 B.冰块融化 C.风化 D.水蒸气冷凝
3.向稀氨水中分别加入以下物质,水的电离平衡会正向移动的是( )
A. B.浓氨水 C. D.
4.下列溶液显酸性,解释其原因的化学用语错误的是( )
A.碳酸溶液:
B.硫酸溶液:
C.硫酸氢钠溶液:
D.溶液:
5.已知:反应.现分别取醋酸与溶液进行中和反应,用右图实验装置测定该反应的中和热,下列叙述正确的是( )
A.图中装置缺少铜丝搅拌棒 B.为了让反应充分进行,分三次倒入
C.该实验测定的反应热 D.用溶液更准确
6.以下应用与盐类水解无关的是( )
A.用热碱去除废铁屑表面油污 B.配制溶液时需将溶于浓溶液
C.用硫酸铝溶液和碳酸氢钠溶液混合灭火 D.用溶液刻蚀铜制电路板
7.键键能为,下列关于反应的能量变化叙述正确的是( )
A.断裂放出热量 B.a值由键能决定,与状态无关
C.光照和点燃条件下a的数值不同 D.使用催化剂不能改变
8.常温下,浓度均为的醋酸和盐酸溶液在水中的电离示意图如下图所示,下列描述错误的是( )
A.代表 B.冰醋酸是强电解质
C.:试剂试剂2 D.中和等体积两份溶液,耗碱量相同
9.已知热化学反应方程式:①
②
下列说法错误的是( )
A.反应①: B.的燃烧热是
C.C生成需要吸热 D.盖斯定律可间接获得不方便测量的反应热
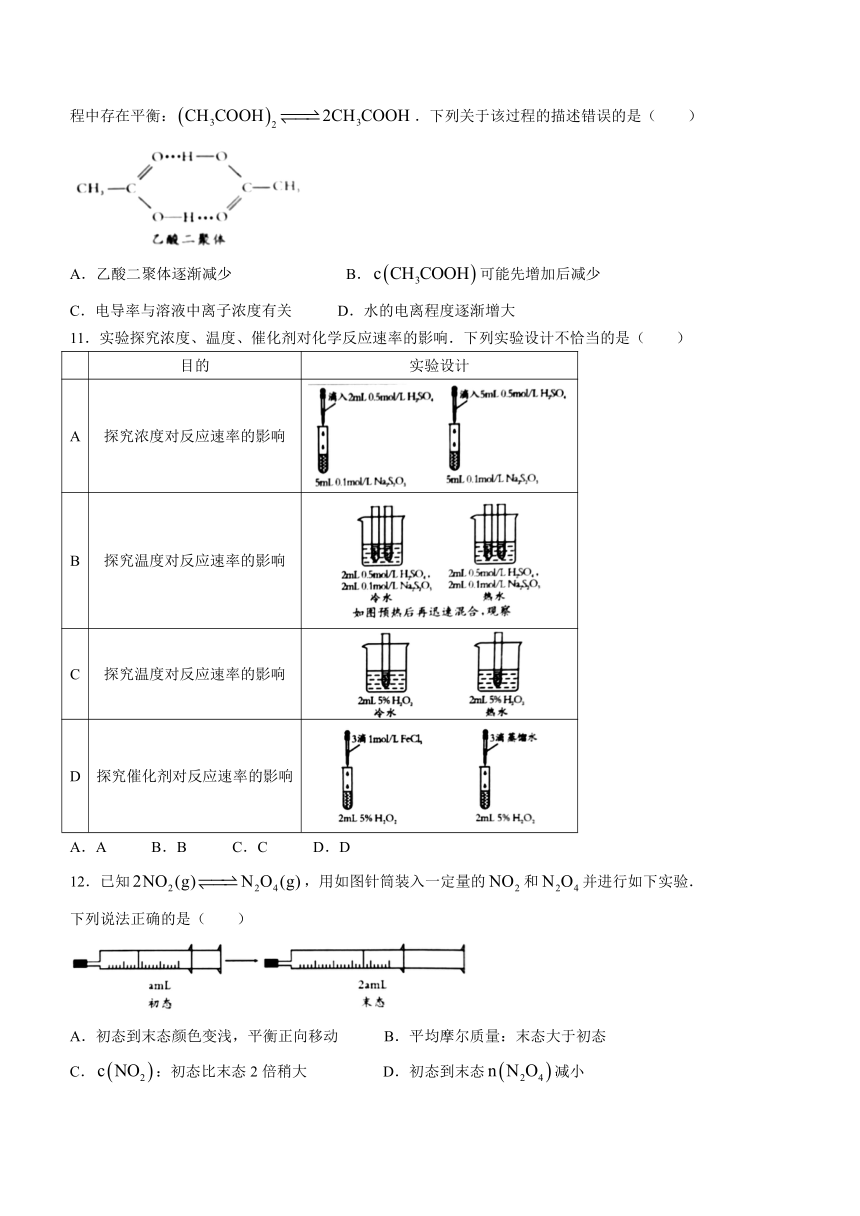
10.冰醋酸中乙酸分子间通过氢键结合为二聚体(如下图).常温下,向冰醋酸中逐滴加入蒸馏水的过程中存在平衡:.下列关于该过程的描述错误的是( )
A.乙酸二聚体逐渐减少 B.可能先增加后减少
C.电导率与溶液中离子浓度有关 D.水的电离程度逐渐增大
11.实验探究浓度、温度、催化剂对化学反应速率的影响.下列实验设计不恰当的是( )
目的 实验设计
A 探究浓度对反应速率的影响
B 探究温度对反应速率的影响
C 探究温度对反应速率的影响
D 探究催化剂对反应速率的影响
A.A B.B C.C D.D
12.已知,用如图针筒装入一定量的和并进行如下实验.
下列说法正确的是( )
A.初态到末态颜色变浅,平衡正向移动 B.平均摩尔质量:末态大于初态
C.:初态比末态2倍稍大 D.初态到末态减小
13.一定温度下,向密闭容器中充入和,其物质的量随时间的变化如图所示.下列说法正确的是( )
A.发生的反应为 B.改变条件重新达平衡后Y的体积分数变大
C.时改变的条件可能是加压 D.改变条件后,变小
14.滴定分析法是一种精度很高的定量分析法.以酚酞为指示剂,用标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是( )
A.用酸式滴定管盛装待测液 B.装液之前需润洗碱式滴定管
C.指示剂多加不影响测定结果 D.滴定终点时,溶液颜色由无色变为粉红色
15.某小组进行如下实验证明.下列相关叙述错误的是( )
A.试管Ⅰ中出现白色沉淀,试管Ⅱ沉淀转为蓝色
B.试管Ⅱ反应:
C.试管Ⅰ反应后上层清液中有
D.向试管Ⅰ中滴加过量溶液不影响结论
16.研究化学反应历程有利于调控化学反应速率.已知反应的反应进程和能量变化图如下:
ⅰ: 活化能
ⅱ: 活化能
活化能,下列叙述错误的是( )
A.反应ⅰ的 B.较小,则反应ⅰ平衡转化率小
C.反应ⅱ是决速步骤 D.分离的瞬间对反应ⅱ的正反应速率没有影响
17.与的配位平衡是研究化学热力学原理的重要载体.向溶液中加入溶液,溶液变红,t秒时测得溶液中,待稳定后将溶液均分于两支试管中,完成下列实验.
试管 操作 现象
Ⅰ 滴入溶液4滴 溶液红色加深
Ⅱ 加入饱和溶液4滴 溶液红色加深
下列说法正确的是( )
A.离子方程式:
B.t时间内,反应平均速率
C.试管Ⅰ溶液颜色加深说明该反应是可逆反应
D.将试管Ⅱ饱和溶液换为固体,现象相同
18.为不溶性固体,可用作白色颜料和阻燃剂,在实验室可利用的水解反应制取.为了得到较多的,操作时要将缓慢加入大量水中,反应后期还要加入少量氨水.下列叙述错误的是( )
A.水解总反应可表示为:
B.适当加热可使胶态聚沉,便于分离
C.大量的水和氨水都能促进水解
D.反应后可直接通过结晶得到固体
19.已知时,向溶液中逐滴加入的盐酸,滴入过程中,溶液中、分布系数【如的分布系数:】与的变化关系如图所示.
下列叙述错误的是( )
A.水的电离程度: B.的数量级是
C.时,
D.时,
20.硫化沉淀法处理酸性电镀废水中工艺如下,已知,,可溶于过量的溶液中.相关叙述错误的是( )
A.加入调同时避免生成
B.该过程需要控制不能碱性过强
C.加入混凝剂可提高的沉降速度
D.若电镀度水中含有,可直接加入将其全部转化为除去
第Ⅱ卷(非选择题,共60分)
21.(12分)在实验室探究温度对盐溶液和水的的影响,测得溶液、溶液以及的随温度变化的曲线如图所示.
回答下列问题:
(1)温度升高的减小,______(填“>”、“<”或“=”).
(2)加热溶液变小,试结合化学用语解释原因__________.
(3)常温时向溶液滴加2滴酚酞,现象是___________;恢复至室温与加热前相比________(填“增大”、“减小”或“不变”);计算时,的的值为_______(忽略水的电离及的二级水解).
(4)向加热前后的溶液中滴加盐酸酸化的溶液,发现加热后的溶液中产生的白色沉淀更多.试以此分析溶液随温度升高而降低的原因:①__________;②温度升高增大.
22.(12分)高炉炼铁过程存在的主要反应为:
①
②
法国科学家勒夏特列经过深入的研究,发现反应②是一个可逆反应,自上而下发生在高炉中有焦炭的地方.回答下列问题:
(1)高炉炼铁采用的冶炼方法是_________(填“湿法炼铁”或“热还原法”).
(2)反应②达到平衡的标志是________(填序号).
A. B.恒容体系中,压强不发生改变
C.测定 D.碳的质量不再改变
(3)在一定温度下,向某体积可变的恒压(压强为)密闭容器中充入与足量碳发生上述反应②,平衡体系中气体体积分数与温度关系如下图所示.
①反应______0(填“>”、“<”或“=”);该反应在______(填“高温”或“低温”)下自发进行.
②时的分压为________;
③时,该反应的平衡常数________(以分压表示,分压=总压×物质的量分数).
23.(13分)天然石灰石是生产水泥的重要原材料之一.对石灰石中含量的测定常用化还原滴定.简化流程如下:
回答下列问题:
(1)“溶解”时为增大浸出效率,可采取的措施是________(一条即可).
(2)加入稀盐酸溶解后,煮沸的目的是_________.
(3)“过滤”后还需用稀溶液洗涤沉淀三次,再用蒸馏水快速洗涤.结合,解释用稀溶液洗涤的原因______________.
(4)“滴定”:用一定浓度的稀硫酸将沉淀多次溶解(微溶于水,保证完全转化成),获得的溶液用标准溶液滴定.平行滴定三次,消耗溶液的平均体积为.
①滴定时需要用到的玻璃仪器有酸式滴定管、胶头滴管、烧杯、_________;
②滴定终点的现象为________;
③上述沉淀未洗净就滴定,结果可能________(用“偏大”、“偏小”、“不变”填空);
④样品中的钙含量为______%(列表达式即可.已知:样品质量,通常以的质量分数表示钙含量).
24.(13分)天然水加热时产生水垢.天然水中含与,热分解产物有、.回答下列问题:
(1)加热的化学方程式为__________;持续加热,沉淀可转换为,说明_______更难溶.
(2)浓缩海水得粗盐水中主要含有、、等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为________、________、________,过滤取滤液,加过量盐酸酸化后,蒸发结晶纯化.
(3)工业上通常用除去天然水中,已知某天然水中开始沉淀的为9.6,则溶液中的初始浓度是_______.
(4)工业上制备轻质氧化镁流程如下.轻质氧化镁相比重质氧化镁质量更轻,更加疏松多孔.
①水解过程加热的作用是________;
②不用重质而用轻质酸溶制备的原因是_____________.
25.(10分)烯烃是化工生产的重要原料,低碳烷烃脱氢制低碳烯烃对提高化石能源利用率有着重要作用.乙烷脱氢的反应为: 反应Ⅰ
(1)有关物质的燃烧热如下表.则_______.
物质
燃烧热/()
(2)在一定温度下,有利于提高平衡转化率的措施是__________(写一条).
(3)研究发现,向反应的恒容体系中充入一定量的发生反应:.相同条件下,充入和未充入时的平衡转化率()随温度变化曲线如下图.
①向恒容体系下充入的,达到A点,反应Ⅰ的平均反应速率______;
②图中C点与B点相同充料,则此时C点______(填“>”、“<”或“=”);B点的______C点的(填“>”、“<”或“=”).
③向反应中加入制备乙烯具有明显优势,其原因是____________.
成都市2021-2022学年高二上学期期末考试化学参考答案及评分意见
第Ⅰ卷(选择题,共40分)
1.C 2.D 3.A 4.A 5.C 6.D 7.D 8.B 9.C 10.D 11.A 12.D 13.C 14.C 15.D 16.B 17.C 18.D 19.C 20.D
21.(12分)
(1)=(2分)
(2)溶液中存在,该反应吸热,温度升高,平衡正向移动,增大,减小(2分,水解方程式1分,文字解释1分)
(3)溶液变红(2分) 不变(2分) 或(2分)
(4)加热过程中亚硫酸钠溶液被氧气氧化,使得减小,碱性减弱.(2分,写方程式也给分)
22.(12分)
(1)热还原法(2分)
(2)B D(2分,各1分,不全对扣1分)
(3)①>(2分) 高温(2分) ②(2分) ③(2分,没有单位扣1分)
23.(13分)
(1)将石灰石粉碎(或搅拌或适当升温或适当增大盐酸浓度等)(2分)
(2)除去生成的,避免生成(2分,各1分)
(3)沉淀时存在平衡,用溶液洗涤,使得平衡逆向移动,减少沉淀的溶解(2分)
4)①锥形瓶(1分)
②当滴入最后一滴标准液时,溶液恰好由无色变为紫红色,且30秒不复原(2分,变色1分,答到“最后一滴标准液”颜色“不恢复”1分)
③偏大(2分)
④(2分)
24.(13分)
(1)(2分) (2分)
(2)、、(3分,试剂正确1分,顺序正确2分,其它合理也可)
(3)(2分,没有单位扣1分)
(4)①促进水解(2分,其它合理也可)
②轻质更疏松多孔,与硫酸反应速度更快(2分,“接触面积更大”也可,只答“提高反应速率”给1分)
25.(10分)
(1)(2分)
(2)分离出产物、减压(其它合理即可)(2分)
(3)①0.01(2分) ②>(1分) <(1分)
③消耗产物中,促使反应正向进行,增大乙烷的平衡转化率(2分)
说明:
1.本试卷中其它合理答案,可参照此评分标准酌情给分.
2.方程式未写条件或条件不完全、不写“↓”或“↑”均扣一分,不配平不得分.
化学
本试卷分选择题和非选择题两部分.第Ⅰ卷(选择题)1至5页,第Ⅱ卷(非选择题)6至8页,共8页,满分100分,考试时间90分钟.
注意事项:
1.答题前,务必将自己的姓名、考籍号填写在答题卡规定的位置上.
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦擦干净后,再选涂其它答案标号.
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上.
4.所有题目必须在答题卡上作答,在试题卷上答题无效.
5.考试结束后,只将答题卡交回.
可能用到的相对原子质量:H-1 O-16 Ca-40
第Ⅰ卷(选择题,共40分)
本卷共20题,每题2分,共40分.每题只有一个选项符合题意.
1.能源是国民经济和社会发展的重要物质基础,下列属于二次能源的是( )
A.煤炭 B.地热 C.电力 D.风能
2.下列过程在一定条件下能自发进行但不能用熵增解释的是( )
A.花香四溢 B.冰块融化 C.风化 D.水蒸气冷凝
3.向稀氨水中分别加入以下物质,水的电离平衡会正向移动的是( )
A. B.浓氨水 C. D.
4.下列溶液显酸性,解释其原因的化学用语错误的是( )
A.碳酸溶液:
B.硫酸溶液:
C.硫酸氢钠溶液:
D.溶液:
5.已知:反应.现分别取醋酸与溶液进行中和反应,用右图实验装置测定该反应的中和热,下列叙述正确的是( )
A.图中装置缺少铜丝搅拌棒 B.为了让反应充分进行,分三次倒入
C.该实验测定的反应热 D.用溶液更准确
6.以下应用与盐类水解无关的是( )
A.用热碱去除废铁屑表面油污 B.配制溶液时需将溶于浓溶液
C.用硫酸铝溶液和碳酸氢钠溶液混合灭火 D.用溶液刻蚀铜制电路板
7.键键能为,下列关于反应的能量变化叙述正确的是( )
A.断裂放出热量 B.a值由键能决定,与状态无关
C.光照和点燃条件下a的数值不同 D.使用催化剂不能改变
8.常温下,浓度均为的醋酸和盐酸溶液在水中的电离示意图如下图所示,下列描述错误的是( )
A.代表 B.冰醋酸是强电解质
C.:试剂试剂2 D.中和等体积两份溶液,耗碱量相同
9.已知热化学反应方程式:①
②
下列说法错误的是( )
A.反应①: B.的燃烧热是
C.C生成需要吸热 D.盖斯定律可间接获得不方便测量的反应热
10.冰醋酸中乙酸分子间通过氢键结合为二聚体(如下图).常温下,向冰醋酸中逐滴加入蒸馏水的过程中存在平衡:.下列关于该过程的描述错误的是( )
A.乙酸二聚体逐渐减少 B.可能先增加后减少
C.电导率与溶液中离子浓度有关 D.水的电离程度逐渐增大
11.实验探究浓度、温度、催化剂对化学反应速率的影响.下列实验设计不恰当的是( )
目的 实验设计
A 探究浓度对反应速率的影响
B 探究温度对反应速率的影响
C 探究温度对反应速率的影响
D 探究催化剂对反应速率的影响
A.A B.B C.C D.D
12.已知,用如图针筒装入一定量的和并进行如下实验.
下列说法正确的是( )
A.初态到末态颜色变浅,平衡正向移动 B.平均摩尔质量:末态大于初态
C.:初态比末态2倍稍大 D.初态到末态减小
13.一定温度下,向密闭容器中充入和,其物质的量随时间的变化如图所示.下列说法正确的是( )
A.发生的反应为 B.改变条件重新达平衡后Y的体积分数变大
C.时改变的条件可能是加压 D.改变条件后,变小
14.滴定分析法是一种精度很高的定量分析法.以酚酞为指示剂,用标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是( )
A.用酸式滴定管盛装待测液 B.装液之前需润洗碱式滴定管
C.指示剂多加不影响测定结果 D.滴定终点时,溶液颜色由无色变为粉红色
15.某小组进行如下实验证明.下列相关叙述错误的是( )
A.试管Ⅰ中出现白色沉淀,试管Ⅱ沉淀转为蓝色
B.试管Ⅱ反应:
C.试管Ⅰ反应后上层清液中有
D.向试管Ⅰ中滴加过量溶液不影响结论
16.研究化学反应历程有利于调控化学反应速率.已知反应的反应进程和能量变化图如下:
ⅰ: 活化能
ⅱ: 活化能
活化能,下列叙述错误的是( )
A.反应ⅰ的 B.较小,则反应ⅰ平衡转化率小
C.反应ⅱ是决速步骤 D.分离的瞬间对反应ⅱ的正反应速率没有影响
17.与的配位平衡是研究化学热力学原理的重要载体.向溶液中加入溶液,溶液变红,t秒时测得溶液中,待稳定后将溶液均分于两支试管中,完成下列实验.
试管 操作 现象
Ⅰ 滴入溶液4滴 溶液红色加深
Ⅱ 加入饱和溶液4滴 溶液红色加深
下列说法正确的是( )
A.离子方程式:
B.t时间内,反应平均速率
C.试管Ⅰ溶液颜色加深说明该反应是可逆反应
D.将试管Ⅱ饱和溶液换为固体,现象相同
18.为不溶性固体,可用作白色颜料和阻燃剂,在实验室可利用的水解反应制取.为了得到较多的,操作时要将缓慢加入大量水中,反应后期还要加入少量氨水.下列叙述错误的是( )
A.水解总反应可表示为:
B.适当加热可使胶态聚沉,便于分离
C.大量的水和氨水都能促进水解
D.反应后可直接通过结晶得到固体
19.已知时,向溶液中逐滴加入的盐酸,滴入过程中,溶液中、分布系数【如的分布系数:】与的变化关系如图所示.
下列叙述错误的是( )
A.水的电离程度: B.的数量级是
C.时,
D.时,
20.硫化沉淀法处理酸性电镀废水中工艺如下,已知,,可溶于过量的溶液中.相关叙述错误的是( )
A.加入调同时避免生成
B.该过程需要控制不能碱性过强
C.加入混凝剂可提高的沉降速度
D.若电镀度水中含有,可直接加入将其全部转化为除去
第Ⅱ卷(非选择题,共60分)
21.(12分)在实验室探究温度对盐溶液和水的的影响,测得溶液、溶液以及的随温度变化的曲线如图所示.
回答下列问题:
(1)温度升高的减小,______(填“>”、“<”或“=”).
(2)加热溶液变小,试结合化学用语解释原因__________.
(3)常温时向溶液滴加2滴酚酞,现象是___________;恢复至室温与加热前相比________(填“增大”、“减小”或“不变”);计算时,的的值为_______(忽略水的电离及的二级水解).
(4)向加热前后的溶液中滴加盐酸酸化的溶液,发现加热后的溶液中产生的白色沉淀更多.试以此分析溶液随温度升高而降低的原因:①__________;②温度升高增大.
22.(12分)高炉炼铁过程存在的主要反应为:
①
②
法国科学家勒夏特列经过深入的研究,发现反应②是一个可逆反应,自上而下发生在高炉中有焦炭的地方.回答下列问题:
(1)高炉炼铁采用的冶炼方法是_________(填“湿法炼铁”或“热还原法”).
(2)反应②达到平衡的标志是________(填序号).
A. B.恒容体系中,压强不发生改变
C.测定 D.碳的质量不再改变
(3)在一定温度下,向某体积可变的恒压(压强为)密闭容器中充入与足量碳发生上述反应②,平衡体系中气体体积分数与温度关系如下图所示.
①反应______0(填“>”、“<”或“=”);该反应在______(填“高温”或“低温”)下自发进行.
②时的分压为________;
③时,该反应的平衡常数________(以分压表示,分压=总压×物质的量分数).
23.(13分)天然石灰石是生产水泥的重要原材料之一.对石灰石中含量的测定常用化还原滴定.简化流程如下:
回答下列问题:
(1)“溶解”时为增大浸出效率,可采取的措施是________(一条即可).
(2)加入稀盐酸溶解后,煮沸的目的是_________.
(3)“过滤”后还需用稀溶液洗涤沉淀三次,再用蒸馏水快速洗涤.结合,解释用稀溶液洗涤的原因______________.
(4)“滴定”:用一定浓度的稀硫酸将沉淀多次溶解(微溶于水,保证完全转化成),获得的溶液用标准溶液滴定.平行滴定三次,消耗溶液的平均体积为.
①滴定时需要用到的玻璃仪器有酸式滴定管、胶头滴管、烧杯、_________;
②滴定终点的现象为________;
③上述沉淀未洗净就滴定,结果可能________(用“偏大”、“偏小”、“不变”填空);
④样品中的钙含量为______%(列表达式即可.已知:样品质量,通常以的质量分数表示钙含量).
24.(13分)天然水加热时产生水垢.天然水中含与,热分解产物有、.回答下列问题:
(1)加热的化学方程式为__________;持续加热,沉淀可转换为,说明_______更难溶.
(2)浓缩海水得粗盐水中主要含有、、等离子.粗盐水精制食盐过程中,按除杂顺序写出除杂试剂的化学式为________、________、________,过滤取滤液,加过量盐酸酸化后,蒸发结晶纯化.
(3)工业上通常用除去天然水中,已知某天然水中开始沉淀的为9.6,则溶液中的初始浓度是_______.
(4)工业上制备轻质氧化镁流程如下.轻质氧化镁相比重质氧化镁质量更轻,更加疏松多孔.
①水解过程加热的作用是________;
②不用重质而用轻质酸溶制备的原因是_____________.
25.(10分)烯烃是化工生产的重要原料,低碳烷烃脱氢制低碳烯烃对提高化石能源利用率有着重要作用.乙烷脱氢的反应为: 反应Ⅰ
(1)有关物质的燃烧热如下表.则_______.
物质
燃烧热/()
(2)在一定温度下,有利于提高平衡转化率的措施是__________(写一条).
(3)研究发现,向反应的恒容体系中充入一定量的发生反应:.相同条件下,充入和未充入时的平衡转化率()随温度变化曲线如下图.
①向恒容体系下充入的,达到A点,反应Ⅰ的平均反应速率______;
②图中C点与B点相同充料,则此时C点______(填“>”、“<”或“=”);B点的______C点的(填“>”、“<”或“=”).
③向反应中加入制备乙烯具有明显优势,其原因是____________.
成都市2021-2022学年高二上学期期末考试化学参考答案及评分意见
第Ⅰ卷(选择题,共40分)
1.C 2.D 3.A 4.A 5.C 6.D 7.D 8.B 9.C 10.D 11.A 12.D 13.C 14.C 15.D 16.B 17.C 18.D 19.C 20.D
21.(12分)
(1)=(2分)
(2)溶液中存在,该反应吸热,温度升高,平衡正向移动,增大,减小(2分,水解方程式1分,文字解释1分)
(3)溶液变红(2分) 不变(2分) 或(2分)
(4)加热过程中亚硫酸钠溶液被氧气氧化,使得减小,碱性减弱.(2分,写方程式也给分)
22.(12分)
(1)热还原法(2分)
(2)B D(2分,各1分,不全对扣1分)
(3)①>(2分) 高温(2分) ②(2分) ③(2分,没有单位扣1分)
23.(13分)
(1)将石灰石粉碎(或搅拌或适当升温或适当增大盐酸浓度等)(2分)
(2)除去生成的,避免生成(2分,各1分)
(3)沉淀时存在平衡,用溶液洗涤,使得平衡逆向移动,减少沉淀的溶解(2分)
4)①锥形瓶(1分)
②当滴入最后一滴标准液时,溶液恰好由无色变为紫红色,且30秒不复原(2分,变色1分,答到“最后一滴标准液”颜色“不恢复”1分)
③偏大(2分)
④(2分)
24.(13分)
(1)(2分) (2分)
(2)、、(3分,试剂正确1分,顺序正确2分,其它合理也可)
(3)(2分,没有单位扣1分)
(4)①促进水解(2分,其它合理也可)
②轻质更疏松多孔,与硫酸反应速度更快(2分,“接触面积更大”也可,只答“提高反应速率”给1分)
25.(10分)
(1)(2分)
(2)分离出产物、减压(其它合理即可)(2分)
(3)①0.01(2分) ②>(1分) <(1分)
③消耗产物中,促使反应正向进行,增大乙烷的平衡转化率(2分)
说明:
1.本试卷中其它合理答案,可参照此评分标准酌情给分.
2.方程式未写条件或条件不完全、不写“↓”或“↑”均扣一分,不配平不得分.
同课章节目录
