安徽省淮北一中2012-2013学年上学期高二年级10月月考化学试卷(有答案)
文档属性
| 名称 | 安徽省淮北一中2012-2013学年上学期高二年级10月月考化学试卷(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 162.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-14 07:46:58 | ||
图片预览

文档简介
安徽省淮北一中2012-2013学年上学期高二年级10月月考化学试卷
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32
Mg 24 Al 27 Zn 65 Cu 64 Ag 108
第I卷(选择题共44分)
一、选择题(每题只有1个正确答案,每题2分,共44分)
1. 下列说法正确的是 ( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
2. 下列热化学方程式或离子方程式中,正确的是 ( )
A. 乙酸的标准燃烧热为870.3kJ?mol-1,则乙酸的燃烧热的热化学方程式可表示为:
CH3COOH (l)+2O2(g) ===2CO2(g)+2H2O(g) △H= -870.3kJ?mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),
放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)===2NH3(g) △H= -38.6 kJ?mol-1
C. 碳酸钠溶液中加入澄清的石灰水:Ca(OH)2 +CO32-===CaCO3 ↓+ 2OH-
D. 氧化铝溶于NaOH溶液: Al2O3 +2OH-+3H2O == 2[Al(OH)4]-
3. 已知下列热化学方程式:2H2O(g) ===2H2(g)+O2(g) ΔH=+483.6kJ/mol
2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6kJ/mol。当1g水由液态变为气态时,其热量变化是( )
①吸热 ②放热 ③2.44KJ ④88KJ
A.①④ B.②④ C.①③ D.②③
4. 25℃、101kPa 下:①2Na(s)+1/2O2(g) ===Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g) ===Na2O2(s) △H2=-511KJ/mol 下列说法正确的是( )
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101kPa 下,Na2O2(s)+2 Na(s)=== 2Na2O(s) △H= -317kJ/mol
5. 已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则C与1mol O2反应生成CO时的反应热ΔH为( )
A.-Y kJ/mol?? B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol ?
6. 已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)===Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为 ( )
A.-218 kJ/mol B.-109 kJ/mol C.+218 kJ/mol D.+109 kJ/mol
7. 根据以下3个热化学方程式: ( )
2H2S(g)+3O2(g) ===2SO2(g)+2H2O(l) ΔH=-Q1kJ·mol-1
2H2S(g)+O2(g) ===2S(s)+2H2O(l) ΔH=-Q2kJ·mol-1
2H2S(g)+O2(g) ===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>
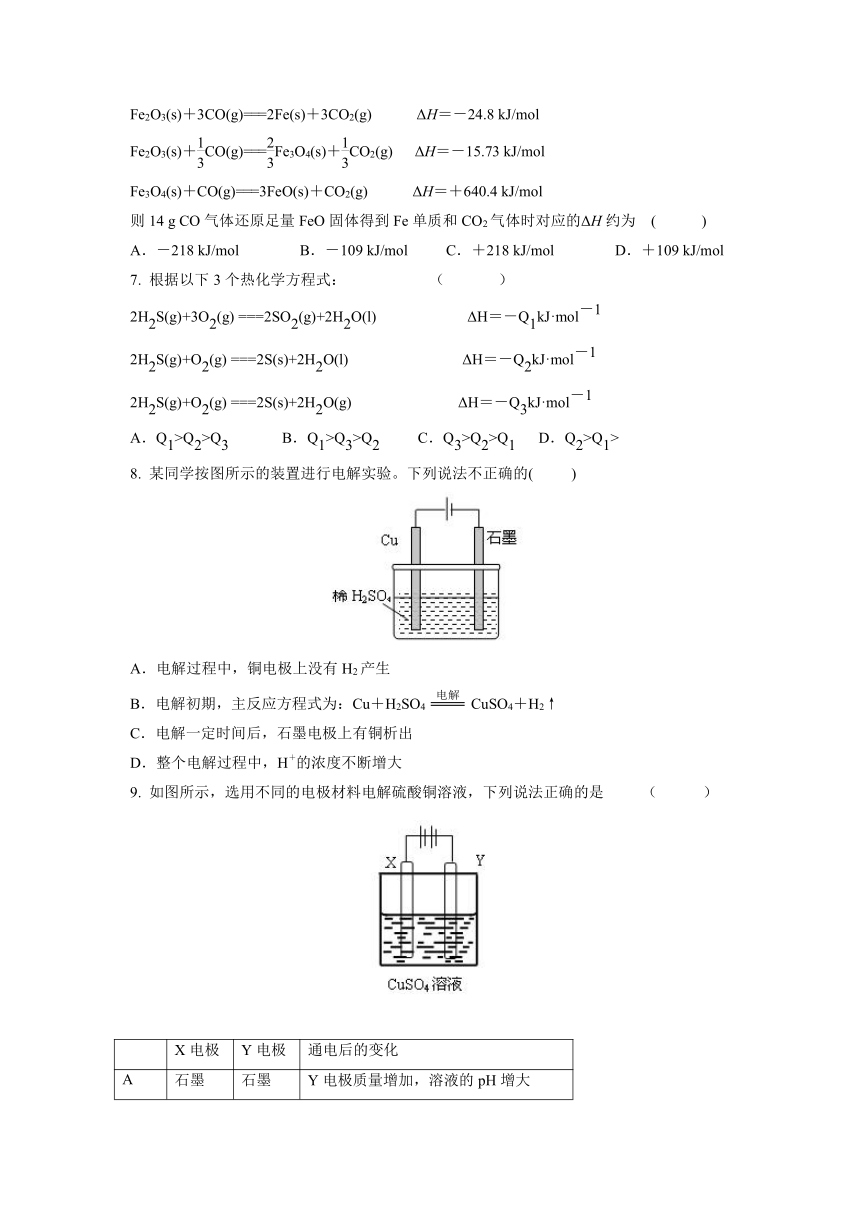
8. 某同学按图所示的装置进行电解实验。下列说法不正确的( )
A.电解过程中,铜电极上没有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
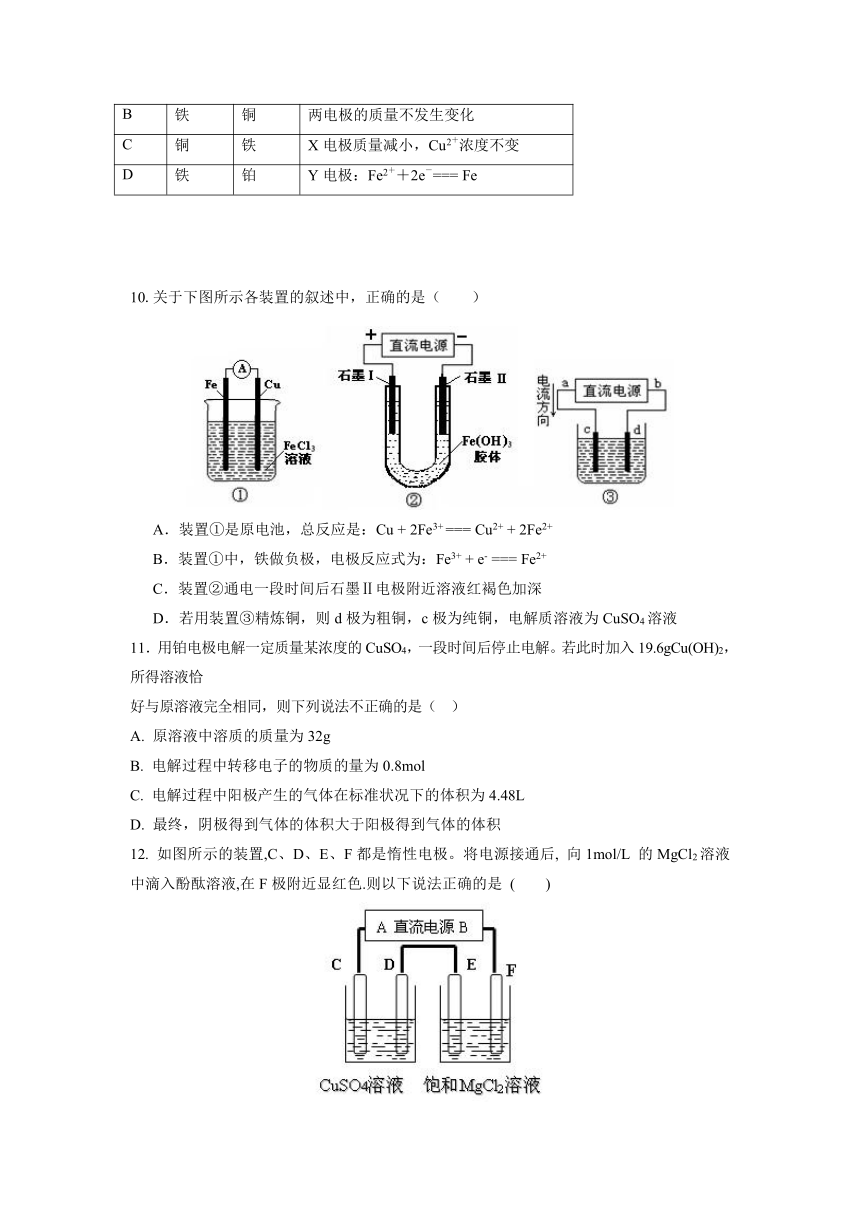
9. 如图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是 ( )
X电极
Y电极
通电后的变化
A
石墨
石墨
Y电极质量增加,溶液的pH增大
B
铁
铜
两电极的质量不发生变化
C
铜
铁
X电极质量减小,Cu2+浓度不变
D
铁
铂
Y电极:Fe2++2e-=== Fe
10.关于下图所示各装置的叙述中,正确的是( )
A.装置①是原电池,总反应是:Cu + 2Fe3+ === Cu2+ + 2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3+ + e- === Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
11.用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解。若此时加入19.6gCu(OH)2,所得溶液恰
好与原溶液完全相同,则下列说法不正确的是( )
A. 原溶液中溶质的质量为32g
B. 电解过程中转移电子的物质的量为0.8mol
C. 电解过程中阳极产生的气体在标准状况下的体积为4.48L
D. 最终,阴极得到气体的体积大于阳极得到气体的体积
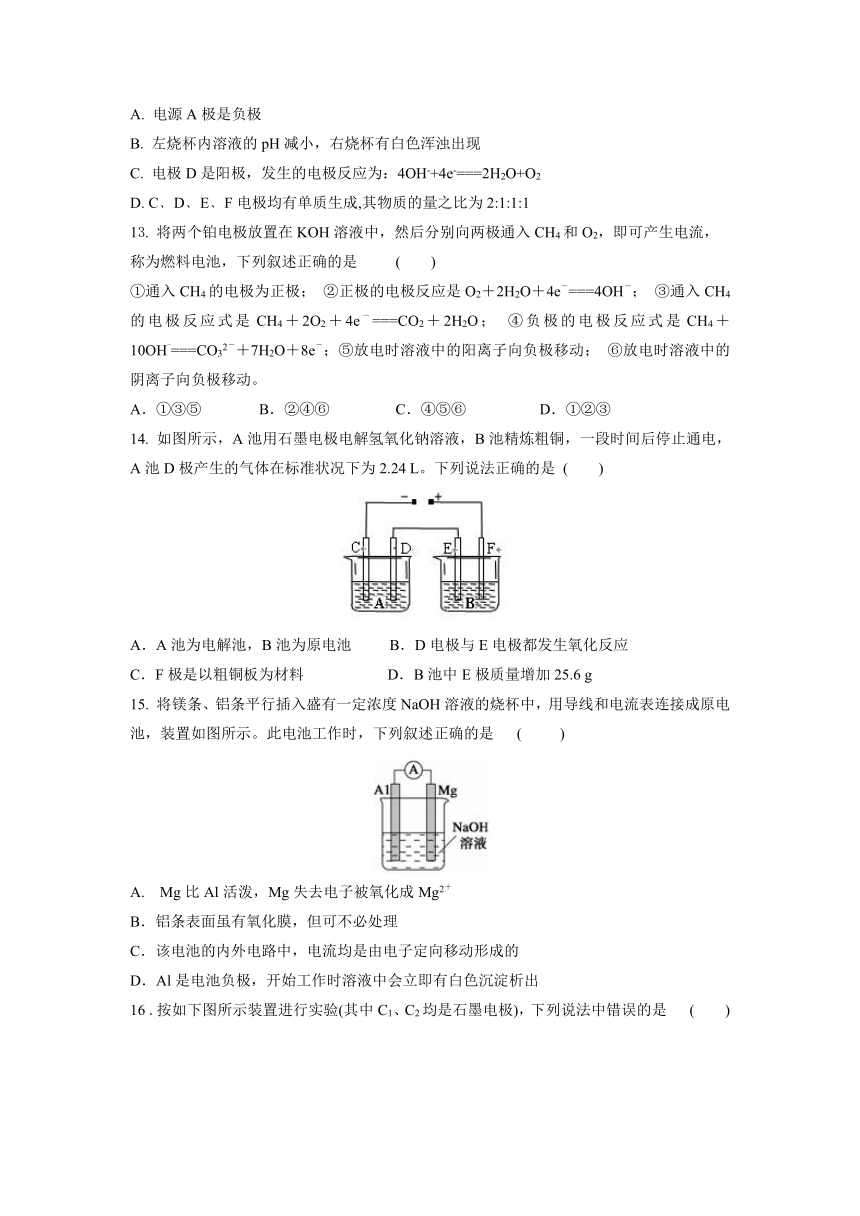
12. 如图所示的装置,C、D、E、F都是惰性电极。将电源接通后, 向1mol/L 的MgCl2溶液中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是 ( )
A. 电源A极是负极
B. 左烧杯内溶液的pH减小,右烧杯有白色浑浊出现
C. 电极D是阳极,发生的电极反应为:4OH-+4e-===2H2O+O2
D. C﹑D﹑E﹑F电极均有单质生成,其物质的量之比为2:1:1:1
13. 将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,
称为燃料电池,下列叙述正确的是 ( )
①通入CH4的电极为正极; ②正极的电极反应是O2+2H2O+4e-===4OH-; ③通入CH4的电极反应式是CH4+2O2+4e-===CO2+2H2O; ④负极的电极反应式是CH4+10OH-===CO32-+7H2O+8e-;⑤放电时溶液中的阳离子向负极移动; ⑥放电时溶液中的阴离子向负极移动。
A.①③⑤ B.②④⑥ C.④⑤⑥ D.①②③
14. 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是 ( )
A.A池为电解池,B池为原电池 B.D电极与E电极都发生氧化反应
C.F极是以粗铜板为材料 D.B池中E极质量增加25.6 g
15. 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是 ( )
A. Mg比Al活泼,Mg失去电子被氧化成Mg2+
B.铝条表面虽有氧化膜,但可不必处理
C.该电池的内外电路中,电流均是由电子定向移动形成的
D.Al是电池负极,开始工作时溶液中会立即有白色沉淀析出
16 .按如下图所示装置进行实验(其中C1、C2均是石墨电极),下列说法中错误的是 ( )
A.甲池中,Cu极上有气泡放出
B.发现a点附近显红色
C.电子走向Zn―→a―→b―→C2
D.乙池溶液的pH减小
17.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是 ( )
A.充电时阳极反应为:2Fe(OH)3+ 10 OH— ===2 FeO42—+ 8H2O+6e—
B.放电时负极反应为:3Zn +6OH— === 3Zn(OH)2+6e—
C.放电时正极附近溶液的PH增大
D.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
18.某溶液含有NaCl和H2SO4两种溶质,它们的物质的量之比为2:1,用石墨作电极电解
该混合溶液时,根据电极产物,可明显地分为二个阶段。下列叙述中错误的是 ( )
A.阴极始终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解的最后阶段是电解水 D.溶液的pH不断增大,最后pH大于7
19.一些科学家采用高质子导电性的SCY陶瓷(能传递H+),利用电解原理实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学化合氨的有关叙述正确的是 ( )
A.N2在阴极上被氧化
B.可选用铁作为阳极材料
C.负极的电极反应式:N2+6e-+6H+ ===2NH3
D.该过程的总反应式是N2+3H2 2NH3
20.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法正确的是( )
A.燃料电池工作时,正极反应为:O2+2H2O+4e- ===4OH-
B.此装置用于铁表面镀铜时,a为铁
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体的体积与电池中消耗的H2体积相等
21.21世纪是钛的世纪。在800 ℃~1 000 ℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是 ( )
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e- Ti+2O2-
D.每生成0.1 mol钛,转移电子0.2 mol
22.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe(OH)2。
以下说法正确的是 ( )
A.负极发生的反应为:Fe-2e- Fe2+
B.正极发生的反应为:2H2O+O2+2e- 4OH-
C.钢铁与电源正极连接,钢铁可被保护
D.钢铁在水下部分比在空气与水交界处更容易腐蚀
第II卷(56分)
23. (10分)近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注.该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景.已知4.4 g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95 kJ的能量。
(1)该反应的热化学方程式为:__________________________________________.
(2)在270℃、8 MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48 m3(已折合为标准状况)的CO2能合成CH3OH气体的物质的量是_____________,此过程中能放出热量______________ kJ.
(3)又已知H2O(g)===H2O(l) ΔH=-44 kJ/mol,则22 g CO2气体与H2反应生成CH3OH气体和液态水时放出热量为__________________.
(4)根据该反应特点,有利于甲醇合成的条件是________________.
A.高压高温 B.低压高温 C.高压低温 D.低压低温
24. (13分)A、B、C三种强电解质,它们在水中电离出的离子为Na+ 、Ag+ 、NO3- 、SO42- 、 Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为__________、_____________(填写化学式)。
(2)计算电极f上生成的气体为__________ mol。
(3)写出乙烧杯中的电解的离子反应方程式:____________________________________。
(4)如果电解过程中乙溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
__________________________________________________________。
(5)若经过一段时间后,测得乙中c电极质量增加54g,要使丙恢复到原来的状态,操作是_________________________________________________________________________
25. (20分)如图为相互串联的甲乙两电解池.
(1)甲池若为用电解原理精炼铜的装置,A是________极,材料是________,电极反应为________________________________,B是________极,材料是________,主要电极反应为________________________________,电解质溶液为______________。.
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe极附近呈__________色。
(3)若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为____________。
(4)若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为_______________。
26.(13分)(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的氯化钠溶液。
①B中Sn极的电极反应式为______________________________,
Sn极附近溶液的pH(填“增大”、“减小”或“不变”) _____________________。
②C中总反应化学方程式为________________________________________。
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________________。
(2)如图是甲醇燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”),该极的电极反应是:________________________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”、“减小”或“不变”)。
参考答案
1
2
3
4
5
6
7
8
9
10
11
B
D
C
D
B
B
A
D
C
C
D
12
13
14
15
16
17
18
19
20
21
22
B
B
C
B
C
D
D
D
C
C
A
23. 解析:(1)4.4 g CO2气体完全合成CH3OH和水蒸气放热4.95 kJ,则1 mol CO2完全合成CH3OH和水蒸气放热49.5 kJ,热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.5 kJ/mol.
(2)n(CH3OH)=n(CO2)=4.48×103 L22.4 L/mol×22%=44 mol,每生成1 mol CH3OH(g)放热49.5 kJ,则此过程中放热为:(44×49.5)kJ=2178 kJ.
(3)由H2O(g)===H2O(l) ΔH=-44 kJ/mol以及(1)中的热化学方程式可知,1 mol CO2完全合成CH3OH并生成液态水时放热为44 kJ+49.5 kJ=93.5 kJ.则22 g CO2即0.5 mol CO2与H2反应时,放热为93.5 kJ÷2=46.75 kJ.
(4)该反应正反应放热,低温有利于CO2合成CH3OH,又因正反应为体积减小的反应,高压有利于CO2合成CH3OH.
答案:(1)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.5 kJ/mol(2分)
(2)44 mol (2分) 2178(2分)
(3)46.75 kJ (2分) (4)C(2分)
24. (1)负 (1分),NaCl(2分)、AgNO3(2分) (2)0.025mol(2分)
(3)4AgNO3+2H2O = 4Ag+O2+4HNO3(2分)
(4)可以,因为AgNO3溶液已转变为HNO34溶液,反应变为电解水的反应(2分)
(5)向丙烧杯中加4.5g水(2分)
25. (1)阴(2分) 纯铜(2分) Cu2++2e-===Cu(2分) 阳(2分) 粗铜(2分)
Cu-2e-===Cu2+(2分) CuSO4(其它合理也可以(2分))
(2)红(2分) (3)4.48 L (2分) 1.0 mol/L (2分)
26. (1)① O2+2H2O+4e-→4OH- (2分) 增大(2分)
②2Zn+O2+2H2O==2Zn(OH)2 (2分) B>A>C (2分)
(2)①a (1分) CH3OH+8OH--6e-==CO32-+6H2O (2分)
②减小(2分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32
Mg 24 Al 27 Zn 65 Cu 64 Ag 108
第I卷(选择题共44分)
一、选择题(每题只有1个正确答案,每题2分,共44分)
1. 下列说法正确的是 ( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
2. 下列热化学方程式或离子方程式中,正确的是 ( )
A. 乙酸的标准燃烧热为870.3kJ?mol-1,则乙酸的燃烧热的热化学方程式可表示为:
CH3COOH (l)+2O2(g) ===2CO2(g)+2H2O(g) △H= -870.3kJ?mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),
放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)===2NH3(g) △H= -38.6 kJ?mol-1
C. 碳酸钠溶液中加入澄清的石灰水:Ca(OH)2 +CO32-===CaCO3 ↓+ 2OH-
D. 氧化铝溶于NaOH溶液: Al2O3 +2OH-+3H2O == 2[Al(OH)4]-
3. 已知下列热化学方程式:2H2O(g) ===2H2(g)+O2(g) ΔH=+483.6kJ/mol
2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6kJ/mol。当1g水由液态变为气态时,其热量变化是( )
①吸热 ②放热 ③2.44KJ ④88KJ
A.①④ B.②④ C.①③ D.②③
4. 25℃、101kPa 下:①2Na(s)+1/2O2(g) ===Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g) ===Na2O2(s) △H2=-511KJ/mol 下列说法正确的是( )
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101kPa 下,Na2O2(s)+2 Na(s)=== 2Na2O(s) △H= -317kJ/mol
5. 已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则C与1mol O2反应生成CO时的反应热ΔH为( )
A.-Y kJ/mol?? B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol ?
6. 已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)===Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为 ( )
A.-218 kJ/mol B.-109 kJ/mol C.+218 kJ/mol D.+109 kJ/mol
7. 根据以下3个热化学方程式: ( )
2H2S(g)+3O2(g) ===2SO2(g)+2H2O(l) ΔH=-Q1kJ·mol-1
2H2S(g)+O2(g) ===2S(s)+2H2O(l) ΔH=-Q2kJ·mol-1
2H2S(g)+O2(g) ===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>
8. 某同学按图所示的装置进行电解实验。下列说法不正确的( )
A.电解过程中,铜电极上没有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
9. 如图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是 ( )
X电极
Y电极
通电后的变化
A
石墨
石墨
Y电极质量增加,溶液的pH增大
B
铁
铜
两电极的质量不发生变化
C
铜
铁
X电极质量减小,Cu2+浓度不变
D
铁
铂
Y电极:Fe2++2e-=== Fe
10.关于下图所示各装置的叙述中,正确的是( )
A.装置①是原电池,总反应是:Cu + 2Fe3+ === Cu2+ + 2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3+ + e- === Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
11.用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解。若此时加入19.6gCu(OH)2,所得溶液恰
好与原溶液完全相同,则下列说法不正确的是( )
A. 原溶液中溶质的质量为32g
B. 电解过程中转移电子的物质的量为0.8mol
C. 电解过程中阳极产生的气体在标准状况下的体积为4.48L
D. 最终,阴极得到气体的体积大于阳极得到气体的体积
12. 如图所示的装置,C、D、E、F都是惰性电极。将电源接通后, 向1mol/L 的MgCl2溶液中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是 ( )
A. 电源A极是负极
B. 左烧杯内溶液的pH减小,右烧杯有白色浑浊出现
C. 电极D是阳极,发生的电极反应为:4OH-+4e-===2H2O+O2
D. C﹑D﹑E﹑F电极均有单质生成,其物质的量之比为2:1:1:1
13. 将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,
称为燃料电池,下列叙述正确的是 ( )
①通入CH4的电极为正极; ②正极的电极反应是O2+2H2O+4e-===4OH-; ③通入CH4的电极反应式是CH4+2O2+4e-===CO2+2H2O; ④负极的电极反应式是CH4+10OH-===CO32-+7H2O+8e-;⑤放电时溶液中的阳离子向负极移动; ⑥放电时溶液中的阴离子向负极移动。
A.①③⑤ B.②④⑥ C.④⑤⑥ D.①②③
14. 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是 ( )
A.A池为电解池,B池为原电池 B.D电极与E电极都发生氧化反应
C.F极是以粗铜板为材料 D.B池中E极质量增加25.6 g
15. 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是 ( )
A. Mg比Al活泼,Mg失去电子被氧化成Mg2+
B.铝条表面虽有氧化膜,但可不必处理
C.该电池的内外电路中,电流均是由电子定向移动形成的
D.Al是电池负极,开始工作时溶液中会立即有白色沉淀析出
16 .按如下图所示装置进行实验(其中C1、C2均是石墨电极),下列说法中错误的是 ( )
A.甲池中,Cu极上有气泡放出
B.发现a点附近显红色
C.电子走向Zn―→a―→b―→C2
D.乙池溶液的pH减小
17.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是 ( )
A.充电时阳极反应为:2Fe(OH)3+ 10 OH— ===2 FeO42—+ 8H2O+6e—
B.放电时负极反应为:3Zn +6OH— === 3Zn(OH)2+6e—
C.放电时正极附近溶液的PH增大
D.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
18.某溶液含有NaCl和H2SO4两种溶质,它们的物质的量之比为2:1,用石墨作电极电解
该混合溶液时,根据电极产物,可明显地分为二个阶段。下列叙述中错误的是 ( )
A.阴极始终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解的最后阶段是电解水 D.溶液的pH不断增大,最后pH大于7
19.一些科学家采用高质子导电性的SCY陶瓷(能传递H+),利用电解原理实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学化合氨的有关叙述正确的是 ( )
A.N2在阴极上被氧化
B.可选用铁作为阳极材料
C.负极的电极反应式:N2+6e-+6H+ ===2NH3
D.该过程的总反应式是N2+3H2 2NH3
20.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法正确的是( )
A.燃料电池工作时,正极反应为:O2+2H2O+4e- ===4OH-
B.此装置用于铁表面镀铜时,a为铁
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体的体积与电池中消耗的H2体积相等
21.21世纪是钛的世纪。在800 ℃~1 000 ℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是 ( )
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e- Ti+2O2-
D.每生成0.1 mol钛,转移电子0.2 mol
22.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe(OH)2。
以下说法正确的是 ( )
A.负极发生的反应为:Fe-2e- Fe2+
B.正极发生的反应为:2H2O+O2+2e- 4OH-
C.钢铁与电源正极连接,钢铁可被保护
D.钢铁在水下部分比在空气与水交界处更容易腐蚀
第II卷(56分)
23. (10分)近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注.该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景.已知4.4 g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95 kJ的能量。
(1)该反应的热化学方程式为:__________________________________________.
(2)在270℃、8 MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48 m3(已折合为标准状况)的CO2能合成CH3OH气体的物质的量是_____________,此过程中能放出热量______________ kJ.
(3)又已知H2O(g)===H2O(l) ΔH=-44 kJ/mol,则22 g CO2气体与H2反应生成CH3OH气体和液态水时放出热量为__________________.
(4)根据该反应特点,有利于甲醇合成的条件是________________.
A.高压高温 B.低压高温 C.高压低温 D.低压低温
24. (13分)A、B、C三种强电解质,它们在水中电离出的离子为Na+ 、Ag+ 、NO3- 、SO42- 、 Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为__________、_____________(填写化学式)。
(2)计算电极f上生成的气体为__________ mol。
(3)写出乙烧杯中的电解的离子反应方程式:____________________________________。
(4)如果电解过程中乙溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
__________________________________________________________。
(5)若经过一段时间后,测得乙中c电极质量增加54g,要使丙恢复到原来的状态,操作是_________________________________________________________________________
25. (20分)如图为相互串联的甲乙两电解池.
(1)甲池若为用电解原理精炼铜的装置,A是________极,材料是________,电极反应为________________________________,B是________极,材料是________,主要电极反应为________________________________,电解质溶液为______________。.
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe极附近呈__________色。
(3)若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为____________。
(4)若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为_______________。
26.(13分)(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的氯化钠溶液。
①B中Sn极的电极反应式为______________________________,
Sn极附近溶液的pH(填“增大”、“减小”或“不变”) _____________________。
②C中总反应化学方程式为________________________________________。
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________________。
(2)如图是甲醇燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”),该极的电极反应是:________________________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”、“减小”或“不变”)。
参考答案
1
2
3
4
5
6
7
8
9
10
11
B
D
C
D
B
B
A
D
C
C
D
12
13
14
15
16
17
18
19
20
21
22
B
B
C
B
C
D
D
D
C
C
A
23. 解析:(1)4.4 g CO2气体完全合成CH3OH和水蒸气放热4.95 kJ,则1 mol CO2完全合成CH3OH和水蒸气放热49.5 kJ,热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.5 kJ/mol.
(2)n(CH3OH)=n(CO2)=4.48×103 L22.4 L/mol×22%=44 mol,每生成1 mol CH3OH(g)放热49.5 kJ,则此过程中放热为:(44×49.5)kJ=2178 kJ.
(3)由H2O(g)===H2O(l) ΔH=-44 kJ/mol以及(1)中的热化学方程式可知,1 mol CO2完全合成CH3OH并生成液态水时放热为44 kJ+49.5 kJ=93.5 kJ.则22 g CO2即0.5 mol CO2与H2反应时,放热为93.5 kJ÷2=46.75 kJ.
(4)该反应正反应放热,低温有利于CO2合成CH3OH,又因正反应为体积减小的反应,高压有利于CO2合成CH3OH.
答案:(1)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.5 kJ/mol(2分)
(2)44 mol (2分) 2178(2分)
(3)46.75 kJ (2分) (4)C(2分)
24. (1)负 (1分),NaCl(2分)、AgNO3(2分) (2)0.025mol(2分)
(3)4AgNO3+2H2O = 4Ag+O2+4HNO3(2分)
(4)可以,因为AgNO3溶液已转变为HNO34溶液,反应变为电解水的反应(2分)
(5)向丙烧杯中加4.5g水(2分)
25. (1)阴(2分) 纯铜(2分) Cu2++2e-===Cu(2分) 阳(2分) 粗铜(2分)
Cu-2e-===Cu2+(2分) CuSO4(其它合理也可以(2分))
(2)红(2分) (3)4.48 L (2分) 1.0 mol/L (2分)
26. (1)① O2+2H2O+4e-→4OH- (2分) 增大(2分)
②2Zn+O2+2H2O==2Zn(OH)2 (2分) B>A>C (2分)
(2)①a (1分) CH3OH+8OH--6e-==CO32-+6H2O (2分)
②减小(2分)
同课章节目录
