7.2物质溶解的量课后练习-2021_2022学年九年级化学科粤版(2012)下册(含解析)
文档属性
| 名称 | 7.2物质溶解的量课后练习-2021_2022学年九年级化学科粤版(2012)下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 210.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-15 22:50:21 | ||
图片预览



文档简介
7.2物质溶解的量
一、选择题(共16题)
1.不影响固体溶解度大小的因素是
A.温度 B.溶剂质量 C.溶剂种类 D.溶质种类
2.图表法是一种常用的数据处理方法。下表记录了氢氧化钠、碳酸钠在水和酒精中的溶解度,下列说法正确的是( )
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
A.如图表示碳酸钠的溶解度曲线
B.氢氧化钠和碳酸钠在水中都是易溶物质
C.40℃时若将50g氢氧化钠分别投入到100g水和100g酒精中,均能形成饱和溶液
D.20℃时将二氧化碳分别通入氢氧化钠的水溶液和酒精溶液中,均无明显现象
3.煮沸过的冷开水里不能养鱼,是因为其中几乎不含有
A.氧分子 B.氧元素 C.氧原子 D.二氧化碳
4.在一定温度下,向盛有氯化钠饱和溶液的烧杯中加入氯化钠晶体后,则
A.晶体质量不变 B.晶体质量减少
C.氯化钠溶解度增大 D.溶质质量分数增大
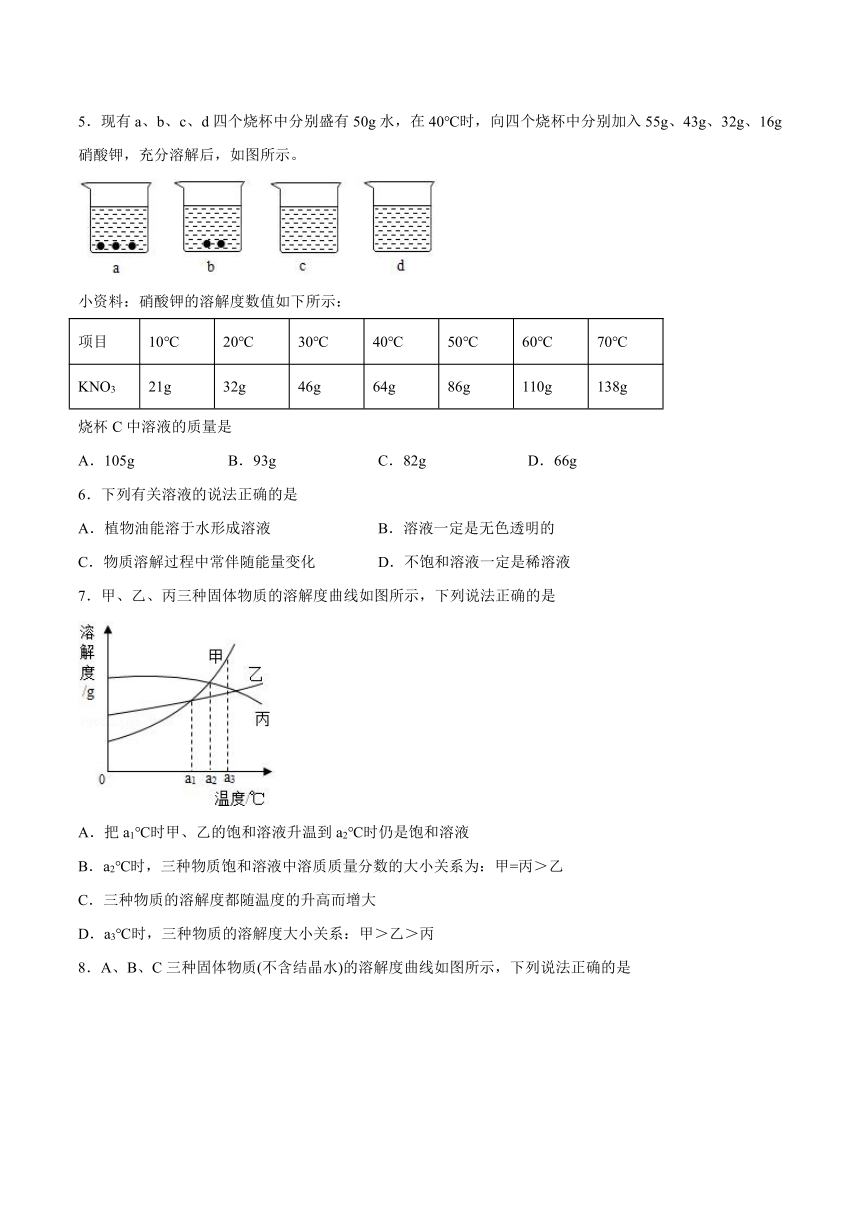
5.现有a、b、c、d四个烧杯中分别盛有50g水,在40℃时,向四个烧杯中分别加入55g、43g、32g、16g硝酸钾,充分溶解后,如图所示。
小资料:硝酸钾的溶解度数值如下所示:
项目 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 70℃
KNO3 21g 32g 46g 64g 86g 110g 138g
烧杯C中溶液的质量是
A.105g B.93g C.82g D.66g
6.下列有关溶液的说法正确的是
A.植物油能溶于水形成溶液 B.溶液一定是无色透明的
C.物质溶解过程中常伴随能量变化 D.不饱和溶液一定是稀溶液
7.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.把a1℃时甲、乙的饱和溶液升温到a2℃时仍是饱和溶液
B.a2℃时,三种物质饱和溶液中溶质质量分数的大小关系为:甲=丙>乙
C.三种物质的溶解度都随温度的升高而增大
D.a3℃时,三种物质的溶解度大小关系:甲>乙>丙
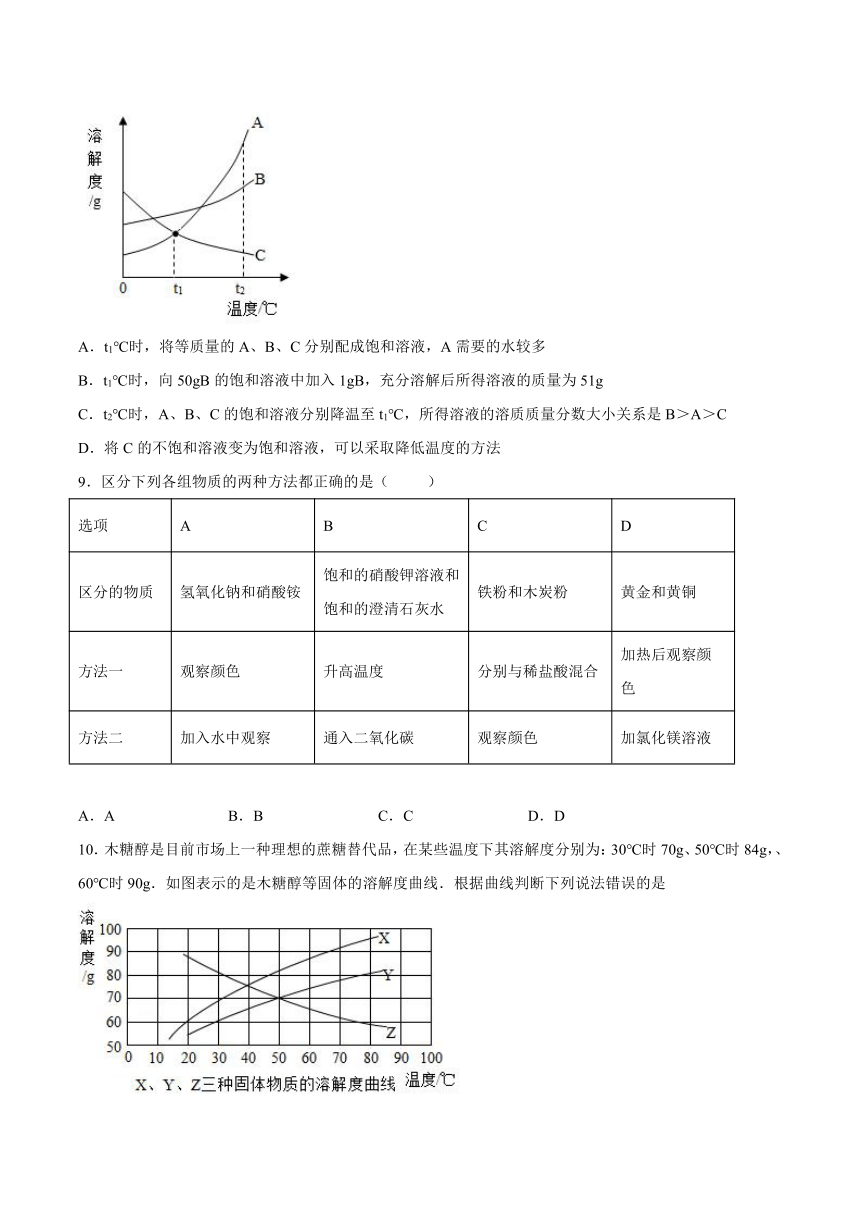
8.A、B、C三种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,将等质量的A、B、C分别配成饱和溶液,A需要的水较多
B.t1℃时,向50gB的饱和溶液中加入1gB,充分溶解后所得溶液的质量为51g
C.t2℃时,A、B、C的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数大小关系是B>A>C
D.将C的不饱和溶液变为饱和溶液,可以采取降低温度的方法
9.区分下列各组物质的两种方法都正确的是( )
选项 A B C D
区分的物质 氢氧化钠和硝酸铵 饱和的硝酸钾溶液和饱和的澄清石灰水 铁粉和木炭粉 黄金和黄铜
方法一 观察颜色 升高温度 分别与稀盐酸混合 加热后观察颜色
方法二 加入水中观察 通入二氧化碳 观察颜色 加氯化镁溶液
A.A B.B C.C D.D
10.木糖醇是目前市场上一种理想的蔗糖替代品,在某些温度下其溶解度分别为:30℃时70g、50℃时84g,、60℃时90g.如图表示的是木糖醇等固体的溶解度曲线.根据曲线判断下列说法错误的是
A.X为木糖醇的溶解度曲线
B.随着温度的升高,Z物质的溶解度逐渐减小
C.30℃时,X、Y、Z三种物质的饱和溶液中溶质质量分数最大的是Y
D.50℃时,Y、Z两物质的溶解度相等
11.X、Y两种固体物质的溶解度曲线如图所示,下列有关叙述错误的是
A.X、Y两种固体物质都是易溶性物质
B.向M点65gX溶液中加入15gX固体能得到t2℃X的饱和溶液
C.将X和Y的饱和溶液从t2℃降温到t1℃,析出的X一定比Y多
D.将t2℃时等质量X、Y两种物质的饱和溶液降温到t1℃,X、Y溶液含溶剂一样多
12.甲、乙两固体物质的溶解度曲线如图所示,下列说法不正确的是( )
A.t1℃时,甲物质的溶解度为20g
B.t1℃时,20g甲加入到50g水中最多可得60g溶液
C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液
D.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲<乙
13.右图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的饱和溶液中含甲的质量为60g
C.50℃时100g甲、乙的两种饱和溶液都降温到10℃,析出晶体甲比乙多
D.10℃时甲、乙两种溶液的溶质质量分数不一定相等
14.下列关于氧气的说法,错误的是
A.铁、硫、酒精在氧气中的燃烧都是化合反应
B.氧气能与大多数的金属、某些化合物反应,化学性质比较活泼
C.夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小
D.氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动的需要
15.如图为氯化钠和碳酸钠的溶解度曲线,下列说法正确的:
A.氯化钠的溶解度大于碳酸钠的溶解度
B.碳酸钠的溶解度随温度的升高而增大
C.20℃时向50g水中加入20g氯化钠可形成70g溶液
D.40℃时150g碳酸钠饱和溶液降温至30℃可析出晶体
16.如图是甲、乙两物质的溶解度曲线,下列说法中正确的是( )
A.甲的溶解度大于乙的溶解度
B.甲、乙的溶解度都随温度的升高而增大
C.时,可得到的乙溶液
D.时,甲、乙的溶解度相等
二、综合题(共6题)
17.结合KNO3和NaCl的溶解度表,回答下列问题。
温度/°C 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)0°C时,KNO3溶解度是_____g
(2)根据NaCl的溶解度表可知,从海水中提取氯化钠,通常采用的结晶方法是____。
(3)在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液降温到40°C,对溶液的分析正确的是____。
A 降温前后溶液都是饱和溶液
B 溶液中溶质减少
C 溶液中溶质的质量分数不变
18.水是生命之源,我们应该了解水、爱护水资源。
(1)下列水的净化方法中,净化程度最高的是___________(填字母序号)。
A.静置沉淀 B.吸附沉淀 C.蒸馏 D.过滤
(2)生活中灭除水中细菌、降低自来水的硬度常用方法是___________。
(3)在下图A实验通电时,a试管中液体呈碱性、b试管中液体呈酸性;利用此原理设计的家用电解水器(如图B所示),可得到酸碱性不同的水,其用途见下表C。
pH 水的应用
10.0 浸泡蔬菜
9.5 日常饮用
9.0 烹饪
6.0 洗头发
5.5 洗涤器皿
C 酸碱性不同的水的用途
以下关于上图的说法正确的是___________(填序号)。
①硫酸钠在水中解离出Na+和,可增强水的导电性
②电解过程中化学能转化为电能
③表C中用于“浸泡蔬菜”的水碱性最强
(4)固体物质甲和乙的溶解度曲线如图所示:
①物质甲中含有少量的乙,可采用___________提纯。
②t2°C时,50g水中加入30g物质甲,充分溶解后溶液的质量为___________g。
③若t1°C时,物质甲的饱和溶液m1g和物质乙的饱和溶液m2g,则下列关系成立的是___________(填字母序号)。
A.两种溶液中溶质的质量分数相等
B.分别升温至t2°C,所得溶液中溶质的质量分数可能相等
C.保持t1°C不变,分别加入等质量的水,所得溶液中溶质的质量分数可能相等
19.溶液与人们的生产生活密切相关。
(1)下列物质不属于溶液的是_____(填字母)。
A 冰水混合物 B 石灰水 C 碘酒 D 可乐饮料
(2)下列有关溶液的说法中,正确的是_____(填字母)。
A 溶液都是无色、透明、均一、稳定的液体
B 溶质都以分子的形式分散在溶剂中
C 饱和溶液的浓度不一定大于不饱和溶液的浓度
(3)喝了汽水后,常常会打嗝。这说明气体的溶解度与_____有关。
(4)室温时分别向三份等质量的水中加入硝酸铵、氯化钠和氢氧化钠固体,充分搅拌至不再溶解时,烧杯底部均有固体剩余。静置至室温后,观察到溶解____(填溶质的化学式)的烧杯底部固体明显减少。
温度(℃) 0 10 20 30 40 50 60
溶 解 度 /g 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3
氢氧化钠 42.0 51.0 109.0 119.0 129.0 145.0 174.0
硝酸铵 119.0 140.0 190.0 236.0 286.0 303.0 421.0
(5)配制2500 mL浓度为0.9 g/100 mL的生理盐水需要溶质质量分数为3%的氯化钠溶液_____ g。
20.水和溶液与我们的生活息息相关。
(1)将厨房中的下列物质:胡椒、花生油、面粉、白糖分别放入水中,能形成溶液的是_____。
(2)消毒液碘酒中的溶剂是_____(写名称)。
(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
①在t2°C时,甲的溶解度为_____,把30g甲溶解在50g水中得到溶液的质量为_____克。
②把N点甲的溶液转化为M点溶液的方法(写一种)_____。
③将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,溶质质量分数由大到小的顺序是_____。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,所需水的质量最多是_____。配制过程中若量取水时仰视读数,则会造成所配溶液的溶质质量分数_____。(“偏大”或“偏小”)
21.水和水溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出______个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2的溶解度变化如图中的a点变化到______(选填“b”、“c”、“d”或“e”)点。
(4)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,所得溶液中溶质质量分数的大小关系为______。
(5)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是多少。(写出计算过程)______。
22.CO2的捕集与资源化利用是目前化学研究的热点。
Ⅰ.二氧化碳的捕集
加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______(填“增大”“不变”或“减小”)。捕集CO2后的溶液可以使紫色石蕊试液变红,原因是______(用化学方程式表示)。
Ⅱ.二氧化碳的资源化利用
(1)对CO2气体加压、降温,可获得干冰,从微观角度分析,该过程主要改变的是______。
(2)科学家利用新型催化剂,将二氧化碳转化为甲醇(CH4O),反应的微观示意图为:
生成甲醇时参加反应的CO2与H2的质量比______ 。
(3)以二氧化碳为原料,制取炭黑的太阳能工艺如图所示。
①写出图中反应2的化学方程式:______。
②该工艺中Fe3O4的作用是______。
(4)一种新型“人造树叶”可在光照条件下将二氧化碳转化为乙醇(C2H6O),反应的化学方程式为 。研究显示,每升“人造树叶”每天能从空气中吸收968g二氧化碳。计算2L“人造树叶”工作一天得到的乙醇,可以配制溶质质量分数为70%的乙醇溶液多少克?(写出计算过程,结果保留一位小数)______。
参考答案
1.B
【详解】
因为温度增高多数固体溶解度增大,同种物质在不同溶剂中的溶解度往往不同,不同物质在同种溶剂里的溶解度往往也不同,而固体溶解度已规定溶剂的质量是100g,所以与溶剂的质量的多少。故选B。
2.B
【详解】
A、碳酸钠在20℃、40℃时,不溶于酒精,所以上述图象表示氢氧化钠的溶解度曲线,不是碳酸钠,故A错误;
B、20℃时,氢氧化钠在水中的溶解度是109g,碳酸钠在水中的溶解度是21.8g,所以氢氧化钠和碳酸钠在水中都是易溶物质,故B正确;
C、40℃时,氢氧化钠在水中的溶解度是129g,在酒精中的溶解度是40g,所以若将50g氢氧化钠分别投入到100g水和100g酒精中,酒精中能形成饱和溶液,水中形成不饱和溶液,故C错误;
D、40℃时,将适量CO2通入饱和的NaOH酒精溶液中,有白色沉淀生成,因为生成的碳酸钠不溶于酒精,故D错误。
故选B。
3.A
【详解】
A、因为气体的溶解度随温度升高而降低,水加热后氧气溢出,因此煮沸过的水中几乎不含氧气,氧气由氧分子构成,即冷开水中几乎不含氧分子,选项A正确;
B、无论水中是否含有氧气,一定含有氧元素,因为水是由氢元素和氧元素组成的,选项B不正确;
C、水分子是由氢原子和氧原子构成的,所以水中含有氧原子,选项C不正确;
D、鱼在水中生存,必须要有一定量的氧气,煮沸过的冷开水不能养鱼,是因为其中不含氧气,不是因为不含二氧化碳,选项D不正确。故选A。
4.A
【详解】
一定温度时,向一定质量的氯化钠饱和溶液中加入一定质量的氯化钠固体,氯化钠固体不能继续溶解,晶体的质量不变,溶质溶剂溶液的质量分数都不变,故选A。
5.C
【解析】
由于40℃时硝酸钾的溶解度64g,即100g水中溶解64g硝酸钾恰好达到饱和,可知50g水中溶解32g硝酸钾恰好饱和,所以烧杯C中恰好溶解达到饱和,溶液的质量是50g+32g=82g。故选C。
6.C
【详解】
A、植物油不溶于水,不能形成均一、稳定的混合物,即不能形成溶液,故选项说法不正确;
B、溶液不一定是无色的,如硫酸铜溶液呈蓝色,故选项说法不正确;
C、物质溶解过程中常伴随能量变化,如氢氧化钠固体溶于水放热,硝酸铵溶于水吸热,故选项说法正确;
D、溶液是否饱和与溶液的浓稀没有必然联系,不饱和溶液不一定是稀溶液,也可能是浓溶液,故选项说法不正确。
故选C。
7.B
【详解】
A、把a1℃时甲、乙的饱和溶液升温到a2℃时仍是饱和溶液是错误的,都变为不饱和溶液;故选项错误;
B、由溶解度曲线可知:a2℃时,三种物质饱和溶液中溶质质量分数的大小关系为:甲=丙>乙,是正确的,故选项正确;
C、三种物质的溶解度都随温度的升高而增大是错误的,因为丙的溶解度随温度的升高而减少,故选项错误;
D、a3℃时,三种物质的溶解度大小关系:甲>丙>乙,不是甲>乙>丙,故选项错误;
故选B
8.C
【详解】
A、t1℃时,A、C溶解度相等,分别配成饱和溶液,AC需要水的质量相等,不正确;
B、不清楚在t1℃时B的溶解度大小,所以不能确定1gB是否全部溶解,不正确;
C、在t2℃时,溶解度A>B>C,此时饱和溶液溶质质量分数A>B>C,当降温到t1℃时,A和B溶解度降低析出溶质,此时A和B仍为饱和溶液,质量分数B>A,而C的溶解升高变成不饱和溶液但溶质质量分数保持不变,所以t1℃是溶质质量分数关系:B>A>C,正确;
D、C的溶解度随温度升高而降低,所以C的不饱和溶液变成饱和溶液可以通过升高温度的方法,不正确。
故选C。
9.B
【详解】
A、氢氧化钠和硝酸铵都是白色固体,从颜色上不能区分,此选项不符合题意;
B、饱和的硝酸钾溶液和饱和的澄清石灰水,升高温度时,变浑浊的是澄清石灰水,无现象的是饱和硝酸钾溶液;通入二氧化碳,变浑浊的是澄清石灰水,无现象的是饱和硝酸钾溶液,此选项符合题意;
C、铁粉和木炭粉都是黑色固体,从颜色上不能区分,此选项不符合题意;
D、黄铜是铜、锌合金,含有铜、锌,金、铜、锌三种金属都不能与氯化镁溶液反应,用氯化镁溶液无法区分,此选项不符合题意。
故选B。
10.C
【详解】
A、利用三组数据“30℃时70g、50℃时84g、60℃时90g”中的第一或第三组数据,找到温度与溶解度的交点所在的曲线即为木糖醇的溶解度曲线,第二组数据正好落在两条曲线的交点上,无法确定曲线.曲线X为木糖醇的溶解度曲线,说法正确;
B、曲线Z随温度升高而下降,表明Z物质的溶解度随温度升高而减小,因此说法正确;
C、某温度下饱和溶液的溶质质量分数= ×100%(S为该物质在该温度下的溶解度),在30℃时,X、Y、Z三种物质的溶解度大小关系为:SZ>SX>SY,物质Y的溶解度SY最小,所以此时物质Y的饱和溶液的溶质质量分数也最小,而非是最大.说法错误;
D、50℃时,Y、Z两物质的溶解度曲线交于一点,表明此时两物质的溶解度相等.说法正确。
故选C。
11.C
【详解】
A、通过图像可知X,Y在0℃时的溶解度都大于10克。且它们的溶解度都随温度的升高而升高。20℃时它们的溶解度一定大于10克,一定是易容性物质。叙述正确,不符合题意;
B、M点65gX溶液中有溶质的质量为,含有溶剂65g-15g=50g。在加入15gX则溶质质量分数为 等于 该温度下的饱和溶液的溶质质量分数,得到的是饱和溶液。叙述正确,不符合题意;
C、未告知溶液的质量,无法判断析出晶体的多少。叙述错误,符合题意;
D、t2℃时等质量X、Y两种物质的饱和溶液含有的溶剂的量相等(溶解度相等所以饱和溶液的溶质质量分数相等。溶液质量也相等,则溶剂质量必然相等)。降温不会改变溶剂的质量,所以降温后两溶液的溶剂含量一样多。叙述正确,不符合题意。
故选C。
12.C
【详解】
A、根据溶解度曲线可知,t1℃时,甲物质的溶解度为20g,该选项说法正确,不符合题意;
B、t1℃时,甲物质的溶解度为20g,20g甲加入到50g水中最多溶解10g,即最多可得60g溶液,该选项说法正确,不符合题意;
C、乙的溶解度随着温度的升高而减小,t2℃时,乙物质的饱和溶液升温后仍然是饱和溶液,该选项说法不正确,符合题意;
D、t2℃,甲的溶解度大于乙的溶解度,两物质的饱和溶液质量分数大小关系是甲>乙,分别降温到t1℃时,甲仍然是饱和溶液,溶解度减小,质量分数也减小,而乙变成不饱和溶液,质量分数不变,因为t2℃时,乙物质的溶解度大于t1℃时甲的溶解度,所以t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是甲<乙,该选项说法正确,不符合题意。
故选:C。
13.C
【详解】
试题分析:A、比较物质的溶解度大小须确定温度,该选项未确定温度,故无法比较二者溶解度大小,故错误;B、35℃时甲的溶解度是60g,即100g水中最多溶解60的甲,160g饱和溶液中含有60g甲,故100g甲的溶液中含甲的质量一定小于60g,故错误;C、50℃时100g甲、乙的两种饱和溶液都降温到10℃,甲的溶解度减小的值比乙更大,析出的晶体必然更多,故正确;D、10℃时甲、乙两种的溶解度相等,饱和溶液的溶质质量分数相等,没说明溶液是否饱和,不能比较溶质质量分数的大小,故D错.
14.A
【详解】
A、化合反应是由两种或两种以上的物质生成一种物质的反应,故铁、硫在氧气中的燃烧都是化合反应,酒精燃烧生成二氧化碳和水两种物质,而酒精燃烧不是化合反应,错误;
B、氧气能与大多数的金属、某些化合物反应,化学性质比较活泼,正确;
C、气体的溶解度随温度的升高而降低,故夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小,正确;
D、氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动的需要,正确。故选A。
15.D
【详解】
A、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也不能确定,故A错误;
B、小于40℃时,碳酸钠的溶解度随温度的升高而增大,大于40℃时,碳酸钠的溶解度随温度的升高而减小,故B错误;
C、20℃时,氯化钠的溶解度小于40g,所以向50g水中加入20g氯化钠不能全部溶解,所以不能形成70g溶液,故C错误;
D、小于40℃时,碳酸钠的溶解度随温度的降低而减小,40℃时,150g碳酸钠饱和溶液降温至30℃,溶解度减小,所以可析出晶体,故D正确。
故选D。
16.D
【详解】
解:A、在比较物质的溶解度时,需要指明温度,故A错误;
B、通过分析溶解度曲线可知,甲物质的溶解度都随温度的升高而增大,乙物质的溶解度随温度的升高而减小,故B错误;
C、t2℃时,乙物质的溶解度是15g,所以乙物质的饱和溶液质量分数为:×100%=13.0%,不能得到15%的乙溶液,故C错误;
D、通过分析溶解度曲线可知,t2℃时,甲、乙的溶解度相等,故D正确。
故选D。
17.13.3g 蒸发结晶 AB
【详解】
(1)由表可知,0℃时,KNO3溶解度是13.3g;
(2)根据NaCl的溶解度表可知,氯化钠的溶解度随温度的变化不大,故从海水中提取氯化钠,通常采用的结晶方法是蒸发结晶;
(3)A、在60°C时,硝酸钾的溶解度是110g,将60gKNO3加入到50g水中充分溶解后,所得溶液为饱和溶液,硝酸钾的溶解度随温度的升高而增加,降温到40°C,溶液还是饱和溶液,符合题意;
B、在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液中溶质质量为55g,降温到40°C,40℃时,硝酸钾的溶解度为:63.9,溶液中溶质的质量为:31.95,故溶液中溶质质量减少,符合题意;
C、降温前后,溶液都是饱和溶液,且60℃时硝酸钾的溶解度大于40℃时硝酸钾的溶解度,故降温后,溶质的质量分数减小,不符合题意。
故选AB。
18.C 煮沸 ①③ 降温结晶 65g AC
【详解】
(1)静置沉淀、吸附沉淀、蒸馏、过滤四个操作中,单一净化程度最高的是蒸馏;故选:C;
(2)生活中灭除水中细菌、降低自来水的硬度常用方法是煮沸;故填:煮沸;
(3)①硫酸钠电离出Na+和,可增强水的导电性,故①对;
②电解:电能转化为化学能,故②错;
③浸泡蔬菜的pH最高,即碱性最强,故③对;
故选:①③
(4)①由于甲溶解度随温度变化大,故采用降温结晶的方法,故填:降温结晶;
②t2时,S甲=30g,100g水中溶解30g甲,50g水中可溶15g,溶液的质量为50+15=65g,故填:65g
③A、t1时S甲=Sv,饱和溶液中,W甲=W乙,故A正确;
B、升温S增大,质量分数一定相等,而非可能,故B错误;
C、t1不变,加水,无固体析出W不一定相等,因为M1不一定等于M2,故C正确.
故选:AC
19.A C 温度 NH4NO3 750
【详解】
(1)冰水混合物只含一种物质水,所以不是溶液,石灰水是氢氧化钙的水溶液,碘酒是碘的酒精溶液,可乐饮料是溶液,所以选A。
(2)溶液不都是无色的,如硫酸铜溶液;
溶质也不一定是分子,如硫酸铜溶液中溶质是离子;
同一温度下,饱和溶液不一定比不饱和溶液的浓度大,例如氢氧化钙和硝酸钾两种物质,所以选C。
(3)喝了汽水后,常常会打嗝。这是因为喝下去后体温将汽水加热,二氧化碳的溶解度因温度的升高而减小,说明气体的溶解度与温度有关,故填:温度;
(4)室温时,即20℃时,等质量的水中加入硝酸铵、氯化钠、氢氧化钠固体时,都有剩余,但硝酸铵溶解时吸热,溶液的温度要低于室温,氢氧化钠溶解时放热,溶液的温度要高于室温,所以恢复到室温时,硝酸铵溶液中的晶体因溶液的温度升高而多溶解一些,所以溶解硝酸铵的烧杯底部固体明显减少,硝酸铵的化学式为NH4NO3;
(5)设需要溶质质量分数为3%的氯化钠溶液质量为x,
2500mL×0.9 g/100 mL=3%x,x=750g,故填:750。
20.白糖 酒精 30g 65 添加溶质 乙大于甲大于丙 丙 偏小
【详解】
(1)溶液是一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。胡椒不溶于水、花生油不溶于水、面粉不溶于水、白糖可溶于水,故能形成溶液的是白糖;
(2)溶质:被溶解的物质,溶剂:能溶解其他物质的物质。消毒液碘酒中被溶解的是碘,溶解其他物质的是酒精,故溶剂是酒精;
(3)
①由图知,在t2°C时,甲的溶解度为30g,即100g水中可以溶解30g甲,在50g水中只能溶解15g甲,得到溶液的质量=溶剂的质量+溶液的质量=50g+15g=65g,为65克。
②在t3°C时,N点位于甲的溶解度曲线下方,属于不饱和溶液,M点位于甲的溶解度曲线上,属于饱和溶液,故把N点甲的溶液转化为M点溶液的方法为可以增加溶质;
③一定温度下饱和溶液的溶质质量分数=,溶解度越大,溶质的质量分数越大,将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,甲、乙的溶解度减小,溶质析出,但仍为饱和溶液,此时乙的溶解度大于甲,溶质的质量分数乙大于甲;丙的溶解度增大,没有晶体析出,溶质质量分数不变,故由大到小的顺序是乙大于甲大于丙。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,溶解度越小所需要的水越多,溶解度:甲大于乙大于丙,故所需水的质量最多是丙。配制过程中若量取水时仰视读数,则所量取的水体积偏大,则会造成所配溶液的溶质质量分数偏小。
21.吸附水中的色素和异味 2 取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效 c 1:6 乙>甲>丙 9.8g
【详解】
(1)活性炭具有吸附性,加入活性炭的作用是吸附水中的色素和异味。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+和一个Mg2+均带两个单位的正电荷,由图可知,一个Ca2+和一个Mg2+可交换出个4Na+,所以一个Ca2+可以交换出2个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。阳离子交换柱中Na+含量较高,属于硬水。则利用生活中常见物质检验阳离子交换柱已失效的方法是:取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开后,瓶内压强变小,所以CO2的溶解度变化如图中的a点变化到c点。
(4)①t1℃时,甲的溶解度是20g,则该饱和溶液中溶质与溶液的质量比为:20g:(20g+100g)=1:6。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,甲、乙的溶解度减小,溶质质量分数变小,丙的溶解度增大,变为不饱和溶液,溶质质量分数不变,由于t1℃时,乙的溶解度大于甲的溶解度,t1℃时,甲的溶解度大于t2℃时丙的溶解度,所以所得溶液中溶质质量分数的大小关系为:乙>甲>丙。
(5)解:设这一定量石油产品中含硫酸的质量是x。
,
x=9.8g
22.增大 CO2+H2O=H2CO3 分子间间隔 22:3 6FeO+CO22Fe3O4+C 催化作用
解:设2L人造树叶工作一天得到的乙醇的质量为x
m(溶液)=1012g÷70%=1445.7g
答:制得溶质质量分数为70%的乙醇溶液的质量1445.7g
【详解】
Ⅰ压强越大,气体溶解度越大,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度增大,捕集CO2后的溶液可以使紫色石蕊试液变红,原因是二氧化碳和水生成了碳酸,化学方程式:CO2+H2O=H2CO3,故填:增大;CO2+H2O=H2CO3。
Ⅱ(1)对CO2气体加压、降温,分子间隔变小,可获得干冰,从微观角度分析,该过程主要改变的是分子间间隔,故填:分子间间隔。
(2)由微观示意图可知,二氧化碳和氢气生成甲醇和水,化学方程式CO2+3H2CH3OH+H2O, 生成甲醇时参加反应的CO2与H2的质量比44:(2×3)=22:3,故填:22:3。
(3)①图中反应2氧化亚铁和二氧化碳生成四氧化三铁和碳,化学方程式6FeO+CO22Fe3O4+C,故填:6FeO+CO22Fe3O4+C。
②该工艺中Fe3O4改变了反应速度,质量和化学性质没变,是催化剂起到催化作用,故填:催化作用。
(4)见答案
一、选择题(共16题)
1.不影响固体溶解度大小的因素是
A.温度 B.溶剂质量 C.溶剂种类 D.溶质种类
2.图表法是一种常用的数据处理方法。下表记录了氢氧化钠、碳酸钠在水和酒精中的溶解度,下列说法正确的是( )
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
A.如图表示碳酸钠的溶解度曲线
B.氢氧化钠和碳酸钠在水中都是易溶物质
C.40℃时若将50g氢氧化钠分别投入到100g水和100g酒精中,均能形成饱和溶液
D.20℃时将二氧化碳分别通入氢氧化钠的水溶液和酒精溶液中,均无明显现象
3.煮沸过的冷开水里不能养鱼,是因为其中几乎不含有
A.氧分子 B.氧元素 C.氧原子 D.二氧化碳
4.在一定温度下,向盛有氯化钠饱和溶液的烧杯中加入氯化钠晶体后,则
A.晶体质量不变 B.晶体质量减少
C.氯化钠溶解度增大 D.溶质质量分数增大
5.现有a、b、c、d四个烧杯中分别盛有50g水,在40℃时,向四个烧杯中分别加入55g、43g、32g、16g硝酸钾,充分溶解后,如图所示。
小资料:硝酸钾的溶解度数值如下所示:
项目 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 70℃
KNO3 21g 32g 46g 64g 86g 110g 138g
烧杯C中溶液的质量是
A.105g B.93g C.82g D.66g
6.下列有关溶液的说法正确的是
A.植物油能溶于水形成溶液 B.溶液一定是无色透明的
C.物质溶解过程中常伴随能量变化 D.不饱和溶液一定是稀溶液
7.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.把a1℃时甲、乙的饱和溶液升温到a2℃时仍是饱和溶液
B.a2℃时,三种物质饱和溶液中溶质质量分数的大小关系为:甲=丙>乙
C.三种物质的溶解度都随温度的升高而增大
D.a3℃时,三种物质的溶解度大小关系:甲>乙>丙
8.A、B、C三种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,将等质量的A、B、C分别配成饱和溶液,A需要的水较多
B.t1℃时,向50gB的饱和溶液中加入1gB,充分溶解后所得溶液的质量为51g
C.t2℃时,A、B、C的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数大小关系是B>A>C
D.将C的不饱和溶液变为饱和溶液,可以采取降低温度的方法
9.区分下列各组物质的两种方法都正确的是( )
选项 A B C D
区分的物质 氢氧化钠和硝酸铵 饱和的硝酸钾溶液和饱和的澄清石灰水 铁粉和木炭粉 黄金和黄铜
方法一 观察颜色 升高温度 分别与稀盐酸混合 加热后观察颜色
方法二 加入水中观察 通入二氧化碳 观察颜色 加氯化镁溶液
A.A B.B C.C D.D
10.木糖醇是目前市场上一种理想的蔗糖替代品,在某些温度下其溶解度分别为:30℃时70g、50℃时84g,、60℃时90g.如图表示的是木糖醇等固体的溶解度曲线.根据曲线判断下列说法错误的是
A.X为木糖醇的溶解度曲线
B.随着温度的升高,Z物质的溶解度逐渐减小
C.30℃时,X、Y、Z三种物质的饱和溶液中溶质质量分数最大的是Y
D.50℃时,Y、Z两物质的溶解度相等
11.X、Y两种固体物质的溶解度曲线如图所示,下列有关叙述错误的是
A.X、Y两种固体物质都是易溶性物质
B.向M点65gX溶液中加入15gX固体能得到t2℃X的饱和溶液
C.将X和Y的饱和溶液从t2℃降温到t1℃,析出的X一定比Y多
D.将t2℃时等质量X、Y两种物质的饱和溶液降温到t1℃,X、Y溶液含溶剂一样多
12.甲、乙两固体物质的溶解度曲线如图所示,下列说法不正确的是( )
A.t1℃时,甲物质的溶解度为20g
B.t1℃时,20g甲加入到50g水中最多可得60g溶液
C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液
D.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲<乙
13.右图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的饱和溶液中含甲的质量为60g
C.50℃时100g甲、乙的两种饱和溶液都降温到10℃,析出晶体甲比乙多
D.10℃时甲、乙两种溶液的溶质质量分数不一定相等
14.下列关于氧气的说法,错误的是
A.铁、硫、酒精在氧气中的燃烧都是化合反应
B.氧气能与大多数的金属、某些化合物反应,化学性质比较活泼
C.夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小
D.氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动的需要
15.如图为氯化钠和碳酸钠的溶解度曲线,下列说法正确的:
A.氯化钠的溶解度大于碳酸钠的溶解度
B.碳酸钠的溶解度随温度的升高而增大
C.20℃时向50g水中加入20g氯化钠可形成70g溶液
D.40℃时150g碳酸钠饱和溶液降温至30℃可析出晶体
16.如图是甲、乙两物质的溶解度曲线,下列说法中正确的是( )
A.甲的溶解度大于乙的溶解度
B.甲、乙的溶解度都随温度的升高而增大
C.时,可得到的乙溶液
D.时,甲、乙的溶解度相等
二、综合题(共6题)
17.结合KNO3和NaCl的溶解度表,回答下列问题。
温度/°C 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)0°C时,KNO3溶解度是_____g
(2)根据NaCl的溶解度表可知,从海水中提取氯化钠,通常采用的结晶方法是____。
(3)在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液降温到40°C,对溶液的分析正确的是____。
A 降温前后溶液都是饱和溶液
B 溶液中溶质减少
C 溶液中溶质的质量分数不变
18.水是生命之源,我们应该了解水、爱护水资源。
(1)下列水的净化方法中,净化程度最高的是___________(填字母序号)。
A.静置沉淀 B.吸附沉淀 C.蒸馏 D.过滤
(2)生活中灭除水中细菌、降低自来水的硬度常用方法是___________。
(3)在下图A实验通电时,a试管中液体呈碱性、b试管中液体呈酸性;利用此原理设计的家用电解水器(如图B所示),可得到酸碱性不同的水,其用途见下表C。
pH 水的应用
10.0 浸泡蔬菜
9.5 日常饮用
9.0 烹饪
6.0 洗头发
5.5 洗涤器皿
C 酸碱性不同的水的用途
以下关于上图的说法正确的是___________(填序号)。
①硫酸钠在水中解离出Na+和,可增强水的导电性
②电解过程中化学能转化为电能
③表C中用于“浸泡蔬菜”的水碱性最强
(4)固体物质甲和乙的溶解度曲线如图所示:
①物质甲中含有少量的乙,可采用___________提纯。
②t2°C时,50g水中加入30g物质甲,充分溶解后溶液的质量为___________g。
③若t1°C时,物质甲的饱和溶液m1g和物质乙的饱和溶液m2g,则下列关系成立的是___________(填字母序号)。
A.两种溶液中溶质的质量分数相等
B.分别升温至t2°C,所得溶液中溶质的质量分数可能相等
C.保持t1°C不变,分别加入等质量的水,所得溶液中溶质的质量分数可能相等
19.溶液与人们的生产生活密切相关。
(1)下列物质不属于溶液的是_____(填字母)。
A 冰水混合物 B 石灰水 C 碘酒 D 可乐饮料
(2)下列有关溶液的说法中,正确的是_____(填字母)。
A 溶液都是无色、透明、均一、稳定的液体
B 溶质都以分子的形式分散在溶剂中
C 饱和溶液的浓度不一定大于不饱和溶液的浓度
(3)喝了汽水后,常常会打嗝。这说明气体的溶解度与_____有关。
(4)室温时分别向三份等质量的水中加入硝酸铵、氯化钠和氢氧化钠固体,充分搅拌至不再溶解时,烧杯底部均有固体剩余。静置至室温后,观察到溶解____(填溶质的化学式)的烧杯底部固体明显减少。
温度(℃) 0 10 20 30 40 50 60
溶 解 度 /g 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3
氢氧化钠 42.0 51.0 109.0 119.0 129.0 145.0 174.0
硝酸铵 119.0 140.0 190.0 236.0 286.0 303.0 421.0
(5)配制2500 mL浓度为0.9 g/100 mL的生理盐水需要溶质质量分数为3%的氯化钠溶液_____ g。
20.水和溶液与我们的生活息息相关。
(1)将厨房中的下列物质:胡椒、花生油、面粉、白糖分别放入水中,能形成溶液的是_____。
(2)消毒液碘酒中的溶剂是_____(写名称)。
(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
①在t2°C时,甲的溶解度为_____,把30g甲溶解在50g水中得到溶液的质量为_____克。
②把N点甲的溶液转化为M点溶液的方法(写一种)_____。
③将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,溶质质量分数由大到小的顺序是_____。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,所需水的质量最多是_____。配制过程中若量取水时仰视读数,则会造成所配溶液的溶质质量分数_____。(“偏大”或“偏小”)
21.水和水溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出______个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2的溶解度变化如图中的a点变化到______(选填“b”、“c”、“d”或“e”)点。
(4)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,所得溶液中溶质质量分数的大小关系为______。
(5)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是多少。(写出计算过程)______。
22.CO2的捕集与资源化利用是目前化学研究的热点。
Ⅰ.二氧化碳的捕集
加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______(填“增大”“不变”或“减小”)。捕集CO2后的溶液可以使紫色石蕊试液变红,原因是______(用化学方程式表示)。
Ⅱ.二氧化碳的资源化利用
(1)对CO2气体加压、降温,可获得干冰,从微观角度分析,该过程主要改变的是______。
(2)科学家利用新型催化剂,将二氧化碳转化为甲醇(CH4O),反应的微观示意图为:
生成甲醇时参加反应的CO2与H2的质量比______ 。
(3)以二氧化碳为原料,制取炭黑的太阳能工艺如图所示。
①写出图中反应2的化学方程式:______。
②该工艺中Fe3O4的作用是______。
(4)一种新型“人造树叶”可在光照条件下将二氧化碳转化为乙醇(C2H6O),反应的化学方程式为 。研究显示,每升“人造树叶”每天能从空气中吸收968g二氧化碳。计算2L“人造树叶”工作一天得到的乙醇,可以配制溶质质量分数为70%的乙醇溶液多少克?(写出计算过程,结果保留一位小数)______。
参考答案
1.B
【详解】
因为温度增高多数固体溶解度增大,同种物质在不同溶剂中的溶解度往往不同,不同物质在同种溶剂里的溶解度往往也不同,而固体溶解度已规定溶剂的质量是100g,所以与溶剂的质量的多少。故选B。
2.B
【详解】
A、碳酸钠在20℃、40℃时,不溶于酒精,所以上述图象表示氢氧化钠的溶解度曲线,不是碳酸钠,故A错误;
B、20℃时,氢氧化钠在水中的溶解度是109g,碳酸钠在水中的溶解度是21.8g,所以氢氧化钠和碳酸钠在水中都是易溶物质,故B正确;
C、40℃时,氢氧化钠在水中的溶解度是129g,在酒精中的溶解度是40g,所以若将50g氢氧化钠分别投入到100g水和100g酒精中,酒精中能形成饱和溶液,水中形成不饱和溶液,故C错误;
D、40℃时,将适量CO2通入饱和的NaOH酒精溶液中,有白色沉淀生成,因为生成的碳酸钠不溶于酒精,故D错误。
故选B。
3.A
【详解】
A、因为气体的溶解度随温度升高而降低,水加热后氧气溢出,因此煮沸过的水中几乎不含氧气,氧气由氧分子构成,即冷开水中几乎不含氧分子,选项A正确;
B、无论水中是否含有氧气,一定含有氧元素,因为水是由氢元素和氧元素组成的,选项B不正确;
C、水分子是由氢原子和氧原子构成的,所以水中含有氧原子,选项C不正确;
D、鱼在水中生存,必须要有一定量的氧气,煮沸过的冷开水不能养鱼,是因为其中不含氧气,不是因为不含二氧化碳,选项D不正确。故选A。
4.A
【详解】
一定温度时,向一定质量的氯化钠饱和溶液中加入一定质量的氯化钠固体,氯化钠固体不能继续溶解,晶体的质量不变,溶质溶剂溶液的质量分数都不变,故选A。
5.C
【解析】
由于40℃时硝酸钾的溶解度64g,即100g水中溶解64g硝酸钾恰好达到饱和,可知50g水中溶解32g硝酸钾恰好饱和,所以烧杯C中恰好溶解达到饱和,溶液的质量是50g+32g=82g。故选C。
6.C
【详解】
A、植物油不溶于水,不能形成均一、稳定的混合物,即不能形成溶液,故选项说法不正确;
B、溶液不一定是无色的,如硫酸铜溶液呈蓝色,故选项说法不正确;
C、物质溶解过程中常伴随能量变化,如氢氧化钠固体溶于水放热,硝酸铵溶于水吸热,故选项说法正确;
D、溶液是否饱和与溶液的浓稀没有必然联系,不饱和溶液不一定是稀溶液,也可能是浓溶液,故选项说法不正确。
故选C。
7.B
【详解】
A、把a1℃时甲、乙的饱和溶液升温到a2℃时仍是饱和溶液是错误的,都变为不饱和溶液;故选项错误;
B、由溶解度曲线可知:a2℃时,三种物质饱和溶液中溶质质量分数的大小关系为:甲=丙>乙,是正确的,故选项正确;
C、三种物质的溶解度都随温度的升高而增大是错误的,因为丙的溶解度随温度的升高而减少,故选项错误;
D、a3℃时,三种物质的溶解度大小关系:甲>丙>乙,不是甲>乙>丙,故选项错误;
故选B
8.C
【详解】
A、t1℃时,A、C溶解度相等,分别配成饱和溶液,AC需要水的质量相等,不正确;
B、不清楚在t1℃时B的溶解度大小,所以不能确定1gB是否全部溶解,不正确;
C、在t2℃时,溶解度A>B>C,此时饱和溶液溶质质量分数A>B>C,当降温到t1℃时,A和B溶解度降低析出溶质,此时A和B仍为饱和溶液,质量分数B>A,而C的溶解升高变成不饱和溶液但溶质质量分数保持不变,所以t1℃是溶质质量分数关系:B>A>C,正确;
D、C的溶解度随温度升高而降低,所以C的不饱和溶液变成饱和溶液可以通过升高温度的方法,不正确。
故选C。
9.B
【详解】
A、氢氧化钠和硝酸铵都是白色固体,从颜色上不能区分,此选项不符合题意;
B、饱和的硝酸钾溶液和饱和的澄清石灰水,升高温度时,变浑浊的是澄清石灰水,无现象的是饱和硝酸钾溶液;通入二氧化碳,变浑浊的是澄清石灰水,无现象的是饱和硝酸钾溶液,此选项符合题意;
C、铁粉和木炭粉都是黑色固体,从颜色上不能区分,此选项不符合题意;
D、黄铜是铜、锌合金,含有铜、锌,金、铜、锌三种金属都不能与氯化镁溶液反应,用氯化镁溶液无法区分,此选项不符合题意。
故选B。
10.C
【详解】
A、利用三组数据“30℃时70g、50℃时84g、60℃时90g”中的第一或第三组数据,找到温度与溶解度的交点所在的曲线即为木糖醇的溶解度曲线,第二组数据正好落在两条曲线的交点上,无法确定曲线.曲线X为木糖醇的溶解度曲线,说法正确;
B、曲线Z随温度升高而下降,表明Z物质的溶解度随温度升高而减小,因此说法正确;
C、某温度下饱和溶液的溶质质量分数= ×100%(S为该物质在该温度下的溶解度),在30℃时,X、Y、Z三种物质的溶解度大小关系为:SZ>SX>SY,物质Y的溶解度SY最小,所以此时物质Y的饱和溶液的溶质质量分数也最小,而非是最大.说法错误;
D、50℃时,Y、Z两物质的溶解度曲线交于一点,表明此时两物质的溶解度相等.说法正确。
故选C。
11.C
【详解】
A、通过图像可知X,Y在0℃时的溶解度都大于10克。且它们的溶解度都随温度的升高而升高。20℃时它们的溶解度一定大于10克,一定是易容性物质。叙述正确,不符合题意;
B、M点65gX溶液中有溶质的质量为,含有溶剂65g-15g=50g。在加入15gX则溶质质量分数为 等于 该温度下的饱和溶液的溶质质量分数,得到的是饱和溶液。叙述正确,不符合题意;
C、未告知溶液的质量,无法判断析出晶体的多少。叙述错误,符合题意;
D、t2℃时等质量X、Y两种物质的饱和溶液含有的溶剂的量相等(溶解度相等所以饱和溶液的溶质质量分数相等。溶液质量也相等,则溶剂质量必然相等)。降温不会改变溶剂的质量,所以降温后两溶液的溶剂含量一样多。叙述正确,不符合题意。
故选C。
12.C
【详解】
A、根据溶解度曲线可知,t1℃时,甲物质的溶解度为20g,该选项说法正确,不符合题意;
B、t1℃时,甲物质的溶解度为20g,20g甲加入到50g水中最多溶解10g,即最多可得60g溶液,该选项说法正确,不符合题意;
C、乙的溶解度随着温度的升高而减小,t2℃时,乙物质的饱和溶液升温后仍然是饱和溶液,该选项说法不正确,符合题意;
D、t2℃,甲的溶解度大于乙的溶解度,两物质的饱和溶液质量分数大小关系是甲>乙,分别降温到t1℃时,甲仍然是饱和溶液,溶解度减小,质量分数也减小,而乙变成不饱和溶液,质量分数不变,因为t2℃时,乙物质的溶解度大于t1℃时甲的溶解度,所以t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是甲<乙,该选项说法正确,不符合题意。
故选:C。
13.C
【详解】
试题分析:A、比较物质的溶解度大小须确定温度,该选项未确定温度,故无法比较二者溶解度大小,故错误;B、35℃时甲的溶解度是60g,即100g水中最多溶解60的甲,160g饱和溶液中含有60g甲,故100g甲的溶液中含甲的质量一定小于60g,故错误;C、50℃时100g甲、乙的两种饱和溶液都降温到10℃,甲的溶解度减小的值比乙更大,析出的晶体必然更多,故正确;D、10℃时甲、乙两种的溶解度相等,饱和溶液的溶质质量分数相等,没说明溶液是否饱和,不能比较溶质质量分数的大小,故D错.
14.A
【详解】
A、化合反应是由两种或两种以上的物质生成一种物质的反应,故铁、硫在氧气中的燃烧都是化合反应,酒精燃烧生成二氧化碳和水两种物质,而酒精燃烧不是化合反应,错误;
B、氧气能与大多数的金属、某些化合物反应,化学性质比较活泼,正确;
C、气体的溶解度随温度的升高而降低,故夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小,正确;
D、氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动的需要,正确。故选A。
15.D
【详解】
A、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也不能确定,故A错误;
B、小于40℃时,碳酸钠的溶解度随温度的升高而增大,大于40℃时,碳酸钠的溶解度随温度的升高而减小,故B错误;
C、20℃时,氯化钠的溶解度小于40g,所以向50g水中加入20g氯化钠不能全部溶解,所以不能形成70g溶液,故C错误;
D、小于40℃时,碳酸钠的溶解度随温度的降低而减小,40℃时,150g碳酸钠饱和溶液降温至30℃,溶解度减小,所以可析出晶体,故D正确。
故选D。
16.D
【详解】
解:A、在比较物质的溶解度时,需要指明温度,故A错误;
B、通过分析溶解度曲线可知,甲物质的溶解度都随温度的升高而增大,乙物质的溶解度随温度的升高而减小,故B错误;
C、t2℃时,乙物质的溶解度是15g,所以乙物质的饱和溶液质量分数为:×100%=13.0%,不能得到15%的乙溶液,故C错误;
D、通过分析溶解度曲线可知,t2℃时,甲、乙的溶解度相等,故D正确。
故选D。
17.13.3g 蒸发结晶 AB
【详解】
(1)由表可知,0℃时,KNO3溶解度是13.3g;
(2)根据NaCl的溶解度表可知,氯化钠的溶解度随温度的变化不大,故从海水中提取氯化钠,通常采用的结晶方法是蒸发结晶;
(3)A、在60°C时,硝酸钾的溶解度是110g,将60gKNO3加入到50g水中充分溶解后,所得溶液为饱和溶液,硝酸钾的溶解度随温度的升高而增加,降温到40°C,溶液还是饱和溶液,符合题意;
B、在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液中溶质质量为55g,降温到40°C,40℃时,硝酸钾的溶解度为:63.9,溶液中溶质的质量为:31.95,故溶液中溶质质量减少,符合题意;
C、降温前后,溶液都是饱和溶液,且60℃时硝酸钾的溶解度大于40℃时硝酸钾的溶解度,故降温后,溶质的质量分数减小,不符合题意。
故选AB。
18.C 煮沸 ①③ 降温结晶 65g AC
【详解】
(1)静置沉淀、吸附沉淀、蒸馏、过滤四个操作中,单一净化程度最高的是蒸馏;故选:C;
(2)生活中灭除水中细菌、降低自来水的硬度常用方法是煮沸;故填:煮沸;
(3)①硫酸钠电离出Na+和,可增强水的导电性,故①对;
②电解:电能转化为化学能,故②错;
③浸泡蔬菜的pH最高,即碱性最强,故③对;
故选:①③
(4)①由于甲溶解度随温度变化大,故采用降温结晶的方法,故填:降温结晶;
②t2时,S甲=30g,100g水中溶解30g甲,50g水中可溶15g,溶液的质量为50+15=65g,故填:65g
③A、t1时S甲=Sv,饱和溶液中,W甲=W乙,故A正确;
B、升温S增大,质量分数一定相等,而非可能,故B错误;
C、t1不变,加水,无固体析出W不一定相等,因为M1不一定等于M2,故C正确.
故选:AC
19.A C 温度 NH4NO3 750
【详解】
(1)冰水混合物只含一种物质水,所以不是溶液,石灰水是氢氧化钙的水溶液,碘酒是碘的酒精溶液,可乐饮料是溶液,所以选A。
(2)溶液不都是无色的,如硫酸铜溶液;
溶质也不一定是分子,如硫酸铜溶液中溶质是离子;
同一温度下,饱和溶液不一定比不饱和溶液的浓度大,例如氢氧化钙和硝酸钾两种物质,所以选C。
(3)喝了汽水后,常常会打嗝。这是因为喝下去后体温将汽水加热,二氧化碳的溶解度因温度的升高而减小,说明气体的溶解度与温度有关,故填:温度;
(4)室温时,即20℃时,等质量的水中加入硝酸铵、氯化钠、氢氧化钠固体时,都有剩余,但硝酸铵溶解时吸热,溶液的温度要低于室温,氢氧化钠溶解时放热,溶液的温度要高于室温,所以恢复到室温时,硝酸铵溶液中的晶体因溶液的温度升高而多溶解一些,所以溶解硝酸铵的烧杯底部固体明显减少,硝酸铵的化学式为NH4NO3;
(5)设需要溶质质量分数为3%的氯化钠溶液质量为x,
2500mL×0.9 g/100 mL=3%x,x=750g,故填:750。
20.白糖 酒精 30g 65 添加溶质 乙大于甲大于丙 丙 偏小
【详解】
(1)溶液是一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。胡椒不溶于水、花生油不溶于水、面粉不溶于水、白糖可溶于水,故能形成溶液的是白糖;
(2)溶质:被溶解的物质,溶剂:能溶解其他物质的物质。消毒液碘酒中被溶解的是碘,溶解其他物质的是酒精,故溶剂是酒精;
(3)
①由图知,在t2°C时,甲的溶解度为30g,即100g水中可以溶解30g甲,在50g水中只能溶解15g甲,得到溶液的质量=溶剂的质量+溶液的质量=50g+15g=65g,为65克。
②在t3°C时,N点位于甲的溶解度曲线下方,属于不饱和溶液,M点位于甲的溶解度曲线上,属于饱和溶液,故把N点甲的溶液转化为M点溶液的方法为可以增加溶质;
③一定温度下饱和溶液的溶质质量分数=,溶解度越大,溶质的质量分数越大,将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,甲、乙的溶解度减小,溶质析出,但仍为饱和溶液,此时乙的溶解度大于甲,溶质的质量分数乙大于甲;丙的溶解度增大,没有晶体析出,溶质质量分数不变,故由大到小的顺序是乙大于甲大于丙。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,溶解度越小所需要的水越多,溶解度:甲大于乙大于丙,故所需水的质量最多是丙。配制过程中若量取水时仰视读数,则所量取的水体积偏大,则会造成所配溶液的溶质质量分数偏小。
21.吸附水中的色素和异味 2 取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效 c 1:6 乙>甲>丙 9.8g
【详解】
(1)活性炭具有吸附性,加入活性炭的作用是吸附水中的色素和异味。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+和一个Mg2+均带两个单位的正电荷,由图可知,一个Ca2+和一个Mg2+可交换出个4Na+,所以一个Ca2+可以交换出2个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。阳离子交换柱中Na+含量较高,属于硬水。则利用生活中常见物质检验阳离子交换柱已失效的方法是:取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开后,瓶内压强变小,所以CO2的溶解度变化如图中的a点变化到c点。
(4)①t1℃时,甲的溶解度是20g,则该饱和溶液中溶质与溶液的质量比为:20g:(20g+100g)=1:6。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,甲、乙的溶解度减小,溶质质量分数变小,丙的溶解度增大,变为不饱和溶液,溶质质量分数不变,由于t1℃时,乙的溶解度大于甲的溶解度,t1℃时,甲的溶解度大于t2℃时丙的溶解度,所以所得溶液中溶质质量分数的大小关系为:乙>甲>丙。
(5)解:设这一定量石油产品中含硫酸的质量是x。
,
x=9.8g
22.增大 CO2+H2O=H2CO3 分子间间隔 22:3 6FeO+CO22Fe3O4+C 催化作用
解:设2L人造树叶工作一天得到的乙醇的质量为x
m(溶液)=1012g÷70%=1445.7g
答:制得溶质质量分数为70%的乙醇溶液的质量1445.7g
【详解】
Ⅰ压强越大,气体溶解度越大,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度增大,捕集CO2后的溶液可以使紫色石蕊试液变红,原因是二氧化碳和水生成了碳酸,化学方程式:CO2+H2O=H2CO3,故填:增大;CO2+H2O=H2CO3。
Ⅱ(1)对CO2气体加压、降温,分子间隔变小,可获得干冰,从微观角度分析,该过程主要改变的是分子间间隔,故填:分子间间隔。
(2)由微观示意图可知,二氧化碳和氢气生成甲醇和水,化学方程式CO2+3H2CH3OH+H2O, 生成甲醇时参加反应的CO2与H2的质量比44:(2×3)=22:3,故填:22:3。
(3)①图中反应2氧化亚铁和二氧化碳生成四氧化三铁和碳,化学方程式6FeO+CO22Fe3O4+C,故填:6FeO+CO22Fe3O4+C。
②该工艺中Fe3O4改变了反应速度,质量和化学性质没变,是催化剂起到催化作用,故填:催化作用。
(4)见答案
