第十单元 化学与健康测试题—2021—2022学年九年级化学鲁教版下册(word版 含答案)
文档属性
| 名称 | 第十单元 化学与健康测试题—2021—2022学年九年级化学鲁教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 169.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-16 23:12:33 | ||
图片预览




文档简介
第十单元《化学与健康》测试题
一、单选题
1.营养战“疫”该怎么吃?专家建议一线工作者必须保证每天摄入一定量的优质蛋白质,以下食品不富含蛋白质的是
A.苹果 B.鸡蛋
C.豆浆 D.虾仁
2.向蛋白质中加入下列物质,不能使蛋白质失去原有的生理功能的是
A.向蛋白质中加入浓硝酸 B.向蛋白质中加入重金属盐
C.向蛋白质中加入水 D.向蛋白质中加入甲醛
3.珍爱生命,关注健康。从健康角度考虑,下列观点中,不合理的是
A.不用霉变的花生榨取食用油 B.向食品包装袋充入氮气延长保质期
C.用 75%的医用酒精杀菌消毒 D.加入过量添加剂使制作的食物更加美味
4.元素是具有相同核电荷数(即质子数)的同一类原子的总称,下列说法错误的是
A.生活中加“碘”食盐,这里的“碘”指的元素
B.人体中、海水中、地壳中最多的都是氧元素
C.缺锌导致发育不良,智力低下,侏儒症
D.Fe2+右上角的“2”表示:铁离子带两个单位正电荷
5.下列说法不正确的是
A.水沸腾时掀起壶盖,因为分子间的空隙随温度升高而增大
B.水能够灭火,因为水降低了可燃物的着火点
C.反应属于置换反应
D.烹调时使用铁锅可以摄入铁元素防止贫血
6.我国科学家屠呦呦因研制出青蒿素(C15H22O5)和双氢青蒿素(C15H24O5)而荣获了诺贝尔奖,关于说法正确的是
A.双氢青蒿素分子中含有氢分子
B.C、H、O、三种元素均为人体必需的微量元素
C.青蒿素和双氢青蒿素分子构成不同
D.青蒿素和双氢青蒿素都是由碳原子、氢原子、氮原子和氧原子构成
7.下列说法或做法正确的是
A.青少年缺硒这种微量元素会引起食欲不振,生长迟缓,发育不良
B.2019 世界能源大会把核能作为含碳能源重要替代品,核电站把化学能转化为电能
C.DAC 法能够实现直接从空气中捕获二氧化碳,该法可缓解全球严重的温室效应
D.厕所清洁剂与炉具清洁剂能混用
8.化学与生活密切相关,下列有关说法错误的是
A.凡含有食品添加剂的食物对人体健康均有害,不可食用
B.PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.屠呦呦对青蒿素的提取“青蒿一握,以水二升渍,绞取汁”属于物理变化过程
9.某同学的化学笔记上有以下知识总结,你认为正确的是
A.用灯帽盖灭酒精灯,是为了降低可燃物的温度
B.CO有毒而CO2无毒,因为不同种分子化学性质不相同
C.只要有氧气参加或生成的化学反应都是氧化反应
D.“补钙、补铁、补锌、补碘”中的钙、铁、锌、碘指的都是微量元素
10.疫情期间,使我们意识到,营养均衡的重要性,下列叙述中正确的是
A.人体自身不能合成维生素,必须从食物中获取
B.糖、脂肪、蛋白质都能为人体生命运动提供能量
C.缺维生素C易得夜盲症
D.缺乏硒元素易得癌症,所以要多摄入硒元素
11.下列说法不正确的是
A.地壳中含量最多的金属元素是铝元素
B.生物细胞中含量最多的金属元素是钙元素
C.把含有可溶性钙镁化合物的水称为硬水
D.全球气候变暖、臭氧层破坏和酸雨等也与空气污染有关
12.化学是你,化学是我,化学深入我们的生活。下列说法或做法错误的是
A.火碱可用于洗涤排烟罩的油污
B.硫酸钡用于钡餐透视胃肠
C.人体缺乏维生素C会引起坏血病
D.加热蒸发使稀盐酸变为浓盐酸
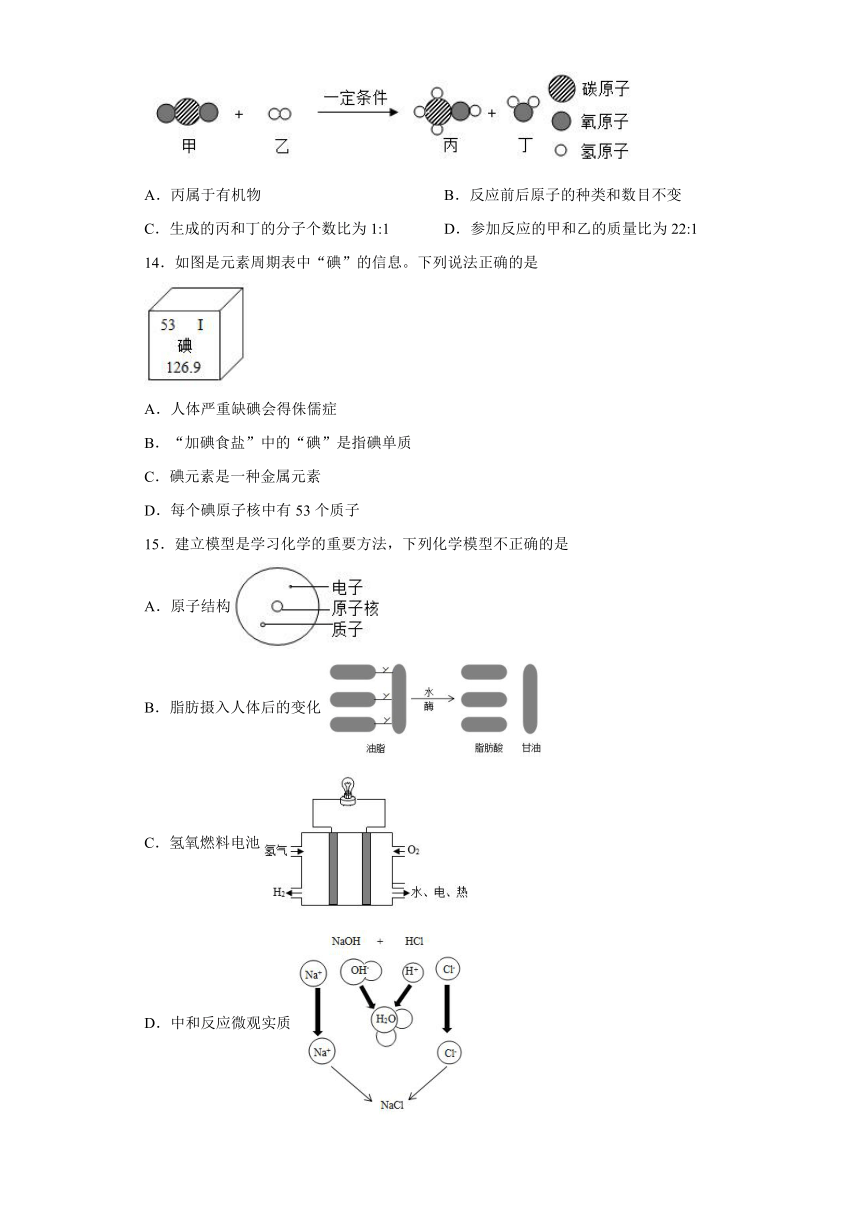
13.如图是某化学反应过程的微观示意图,下列有关说法不正确的是
A.丙属于有机物 B.反应前后原子的种类和数目不变
C.生成的丙和丁的分子个数比为1:1 D.参加反应的甲和乙的质量比为22:1
14.如图是元素周期表中“碘”的信息。下列说法正确的是
A.人体严重缺碘会得侏儒症
B.“加碘食盐”中的“碘”是指碘单质
C.碘元素是一种金属元素
D.每个碘原子核中有53个质子
15.建立模型是学习化学的重要方法,下列化学模型不正确的是
A.原子结构
B.脂肪摄入人体后的变化
C.氢氧燃料电池
D.中和反应微观实质
二、填空题
16.请回答下列问题。
(1)化学用语是学习化学的重要工具,是国际通用的化学语言。请用化学用语填空:
①5个铜原子_______;
②4个铵根离子_______;
③氢氧化铁中铁元素显+3价_______;
④某元素的原子结构示意图为,该元素与空气中含量居第二多的元素组成的化合物的化学式为_______;
(2)用所给的元素Na、C、O、H、S、Ca组成的物质填空(填化学式):
①常用于除去铁锈的酸_______;
②农业上用于改良酸性土壤的碱_______;
③用于做糕点的“泡打粉’’的主要成分纯碱_______;
④最简单的有机物_______;
(3)临近中考,妈妈给小明的膳食搭配中有:清炖鸡、回锅肉、米饭、牛奶,你认为还需给小明补充的营养素是_______;
(4)火的发现和利用对人类的发展有着重要意义。“钻木取火”使木柴燃烧起来,这说明燃烧需要的条件有:可燃物,可燃物与空气(或氧气)充分接触和_______。
17.生活处处皆化学。
(1)我国科学家袁隆平以其在杂交水稻的培育方面作出的杰出贡献被誉为“杂交水稻之父”。水稻中富含的营养素是___________。
(2)自来水生产常用___________吸附水中的色素和异味;生活中常用___________的方法降低水的硬度。
(3)餐具上的油污用加了洗涤剂的水更易洗掉,是因为洗涤剂具有___________作用。
(4)冬季是“煤气”中毒的高发季节,“煤气”主要是___________(填化学式)。
18.化学与生活密切相关,请按照要求填空。
(1)打开可乐瓶盖时,液体会喷出,这是因为______;
(2)蒸发时,当蒸发皿中有______出现时,停止加热
(3)人体缺乏维生素A会患______
(4)关闭燃气开关,运用的灭火原理是______;
(5)将Fe粉投入装有Cu(NO3)2和AgNO3溶液的烧杯中,搅拌,充分反应后过滤,向滤渣中滴加稀盐酸,发现有气泡,则滤渣是______;滤液一定是______溶液。
19.化学就在我们身边,它能改善我们的生活。请回答下列问题:
(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是___________。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平(主要成分为A1(OH)3)治疗,其原理用化学方程式表示为_____________。
(2)众志成城、全民抗疫。疫情期间,某食品公司向医院捐赠了一批“即热米饭”,该“即热米饭”用生石灰和水的反应作为热源,写出该反应的化学方程式为____________。
(3)维生素C又名抗坏血酸,在酸性环境下稳定,高温下不稳定。它主要存在于水果和黄瓜等蔬菜中,能增强人体对疾病的抵抗能力。
①根据信息可知,维生素C溶液显____________(填“酸性”“中性”或“碱性”)
②在下列物质中,能与维生素C溶液发生反应的是____________(填序号)。
a.食盐 b.苛性钠 c.硫酸钠
③为较好吸收利用维生素C,食用黄瓜时宜____________(填“凉拌”或“煮熟”)。
(4)酿酒厂生产白酒时,常加入适量稀硫酸来控制酸度,发酵完成后蒸馏即可得到白酒。盐酸也可以控制酸度,且价格比硫酸低。请说明此处不用盐酸的原因是____________。
(5)小明在家发现两根锈铁钉,带到实验室里,将其放入稀盐酸中,观察到____________,反应的化学方程式为____________;小明未将金属立即取出,过了段时间后,又看到金属表面有气泡出现,则该反应的化学方程式为____________________。
三、推断题
20.A﹣I初中化学中常见的物质,它们之间的转化关系如图,反应①是工业冶铁的主要原理。B、D组成元素相同,G是生活中最常用的溶剂,I属于糖类,部分生成物反应条件已省略,请回答:
(1)物质B的化学式是________。
(2)反应②的基本反应类型是___________。
(3)反应①中化合价降低的元素是_________。
(4)由如图可得出,化学反应能够实现的相互转化有________(填字母)。
A、酸和碱 B 无机物和有机物
C 不同种类的原子 D 化学能与其它形式的能量
21.下图是初中化学常见六种物质之间的关系图(物质是溶液的只考虑溶质)。图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。
A中含有人体中含量最多的金属元素,B、C中不含相同元素,C、D中所含元素种类相同。
(1)请分别写出A、B、C、D物质的化学式(或溶质的化学式):
A.________ B.______ C.______ D.________;
(2)写出转化①的化学方程式_____________________________________(写一个);
(3)写出Fe2O3与足量B反应的实验现象______________________________________。
四、实验题
22.酶也是一种蛋白质,可用催化剂.具有高效性、专一性和多样性的特性,其活性受温度和pH等因素影响.氯化铁是一种无机催化剂,其溶液能催化过氧化氢(化学式为H2O2)的分解.肝脏组织细胞中也有一种能催化过氧化氢溶液分解的酶.为了研究生物酶与无机催化剂的催化效率,某同学设计了一个实验,以下是该实验的几个步骤:
①向3号试管内滴入几滴氯化铁溶液;
②将点燃但无火焰的卫生香分别放在1、2、3号试管的管口,仔细观察,发现1号试管口的卫生香燃烧剧烈,2号试管口几乎无变化.
③取三支洁净的试管,编上号,分别注入10rnL3%的过氧化氢溶液.
④轻轻震荡这三支试管,使试管内的物质混合均匀,会发现1号试管的气泡多且最先发生,2号试管几乎无气泡产生.
⑤取豌豆大小的新鲜肝脏,放在培养皿中迅速剪,碎并投入到1号中,将同样大小的新鲜肝脏煮熟后,冷却、剪碎,投入到2号试管中.
(1)请根据实验原理,选择正确的顺序是____________.
(A)①②③④⑤ (B)③④①②⑤ (C)③④①⑤② (D)③⑤①④②
(2)该实验主要证明了酶具有_____________的特性.
(3)2号试管没有变化的原因是__________________.
23.维生素C又名抗坏血酸,易溶于水,易被氧化,能与碘反应.人体缺乏维生素C可引发多种疾病.某研究性学习小组对它研究如下:
(1)猜想:维生素C可能具有酸性.
(2)实验方案:提供的试剂有维生素C片、蒸馏水、紫色石蕊溶液、无色酚酞溶液、氢氧化钠溶液、pH试纸.(实验仪器自选)
根据以上用品,请你帮助他们设计出两种实验方案,并写出实验现象:
实验内容 实验内容 实验现象
方案I
方案Ⅱ
(3)结论:维生素C具有酸性.根据维生素C的性质,判断下列物质中能与维生素C反应的是( )
(A)金属镁
(B)氯化钾
(C)氢氧化钠
(D)硫酸铜
(4)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,则其放置时间的长短是否对维生素C的含量产生影响?他设计了如下的实验方案:
Ⅰ.把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中.
Ⅱ.取两支盛有2mL蓝色的碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如下:
汁液 新鲜西红柿的汁液 放置一周的西红柿的汁液
滴数 12 20
请回答下列问题:
①你认为维生素C含量较高的是________.
②你从中得到的启示是________________________.
五、计算题
24.在食盐中加入适量的碘酸钾(KIO3),可预防碘缺乏病。
(1)人类膳食中缺碘易患_________
A 甲状腺肿大 B 贫血 C 骨质疏松症 D 软骨病
(2)某兴趣小组的同学,欲检测一袋食盐是否为加碘食盐,他们查阅资料得知,加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应,生成碘(I2),淀粉遇I2变蓝色。现提供下列试剂和生活中常见的物质:
①KI溶液;②纯碱:③米汤;④白糖;⑤白酒:⑥白醋,该小组同学进行实验必须选用的试剂和物质是_______________
A ①③④ B ①③⑥ C ②④⑥ D ①④⑤
(3)该小组同学仔细阅读加碘食盐包装袋上的说明后,提出问题并与其他同学讨论,继续进行探究。
问题一:食盐是比较稳定的,而说明中强调“防热”,是否因为受热会造成碘的损失?
(实验一)探究温度对碘损失率的影响
老师指导他们将一定浓度的碘酸钾溶液分成5等份,在不同温度下加热十分钟后,用硫代硫酸
钠标准溶液测定碘酸钾溶液的浓度,计算碘损失率并记录如表:
温度 30℃水浴 50℃水浴 80℃水浴 100℃水浴 煮沸
碘损失率(%) 0 0.3 0.67 1 5.56
①分析上表可得出的结论是_____________________________________
②人们常说:“炒菜时要后放碘盐,以免碘的损失。”这里的“碘”指的是____(填“碘单质”、“碘 元素”或“碘原子”)。
问题二:炒菜时加醋对碘的损失率是否也有影响?
(实验二)探究酸碱度对碘损失率的影响
③此组对照实验,要控制在加热的时间和温度、碘酸钾溶液的浓度和______均相同,溶液的酸碱度不同的条件下进行。
④实验需要调节溶液的酸碱性,下列物质不能选用的是_______(填字母)。
A 氢氧化钠 B 纯碱粉末 C 食盐晶体 D 稀盐酸
(4)碘酸钾中碘元素的质量分数为______。我国规定,食盐中加碘的含量为每千克食盐含腆0.035克,相当于每千克食盐含碘酸钾_____克。(精确到小数点后二位)
25.某有机物在氧气中充分燃烧后,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它的组成,如图,得到两组数据.
燃烧有机物的质量 实验方法 实验前后(1)-(4)装置质量
实验前 实验后
甲组3.2克 A (1)150克 (1)154.6克
(2)150克 (2)153.4克
乙组3.2克 B (3)150克 (3)153.6克
(4)150克 (4)154.4克
请你分析、选用的正确方法是______,推测出该有机物是由______元素组成,各元素的质量比为______.(实验过程中气体均全部被吸收)
参考答案
1.A 2.C 3.D 4.D 5.B 6.C 7.C 8.A 9.B 10.B 11.C 12.D 13.D 14.D 15.A
16.(1) 5Cu
Al2O3
(2) H2SO4 Ca(OH)2 Na2CO3 CH4
(3)维生素
(4)温度达到可燃物的着火点
17.(1)糖类
(2) 活性炭 加热煮沸
(3)乳化
(4)CO
18.(1)压强减小,二氧化碳气体逸出
(2)较多晶体
(3)夜盲症
(4)隔离可燃物
(5) 银、铜、铁 硝酸亚铁3)2
19.(1) 胰液 Al(OH)3+3HCl=AlCl3+3H2O
(2)CaO+H2O=Ca(OH)2
(3) 酸性 b 凉拌
(4)盐酸挥发性较强
(5) 铁锈溶解,溶液变黄色 Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑
20.CO 置换反应 铁 B
21.Ca(OH)2 HCl CO2 CO 3CO+Fe2O32Fe+3CO2(或3C+2Fe2O3 4Fe+3CO2↑) 红棕色固体逐渐(减少至)消失,溶液(由无色)变为黄色
22.D 高效性 煮熟后,肝脏内催化过氧化氢分解的酶失去了活性
23.(2)方案Ⅰ:将维生素C片溶于蒸馏水配成溶液,向其中滴加紫色石蕊溶液 溶液变红色
方案Ⅱ:将维生素C片溶于蒸馏水配成溶液,用玻璃棒蘸取溶液滴在pH试纸上,跟标准比色卡比较 pH试纸变红色
方案Ⅲ:将维生素C片溶于蒸馏水配成溶液,把维生素C的溶液逐滴滴入含氢氧化钠的酚酞溶液中 红色消失(答案合理即可,任选两个)
(3)AC
(4)①新鲜西红柿的汁液 ②维生素C缺乏的病人要多吃维生素C含量高的、新鲜的蔬菜和水果
24.A B 温度越高碘损失率越高 碘元素 质量 C 59.35% 0.06
25.B;C、H、O;3:1:4
一、单选题
1.营养战“疫”该怎么吃?专家建议一线工作者必须保证每天摄入一定量的优质蛋白质,以下食品不富含蛋白质的是
A.苹果 B.鸡蛋
C.豆浆 D.虾仁
2.向蛋白质中加入下列物质,不能使蛋白质失去原有的生理功能的是
A.向蛋白质中加入浓硝酸 B.向蛋白质中加入重金属盐
C.向蛋白质中加入水 D.向蛋白质中加入甲醛
3.珍爱生命,关注健康。从健康角度考虑,下列观点中,不合理的是
A.不用霉变的花生榨取食用油 B.向食品包装袋充入氮气延长保质期
C.用 75%的医用酒精杀菌消毒 D.加入过量添加剂使制作的食物更加美味
4.元素是具有相同核电荷数(即质子数)的同一类原子的总称,下列说法错误的是
A.生活中加“碘”食盐,这里的“碘”指的元素
B.人体中、海水中、地壳中最多的都是氧元素
C.缺锌导致发育不良,智力低下,侏儒症
D.Fe2+右上角的“2”表示:铁离子带两个单位正电荷
5.下列说法不正确的是
A.水沸腾时掀起壶盖,因为分子间的空隙随温度升高而增大
B.水能够灭火,因为水降低了可燃物的着火点
C.反应属于置换反应
D.烹调时使用铁锅可以摄入铁元素防止贫血
6.我国科学家屠呦呦因研制出青蒿素(C15H22O5)和双氢青蒿素(C15H24O5)而荣获了诺贝尔奖,关于说法正确的是
A.双氢青蒿素分子中含有氢分子
B.C、H、O、三种元素均为人体必需的微量元素
C.青蒿素和双氢青蒿素分子构成不同
D.青蒿素和双氢青蒿素都是由碳原子、氢原子、氮原子和氧原子构成
7.下列说法或做法正确的是
A.青少年缺硒这种微量元素会引起食欲不振,生长迟缓,发育不良
B.2019 世界能源大会把核能作为含碳能源重要替代品,核电站把化学能转化为电能
C.DAC 法能够实现直接从空气中捕获二氧化碳,该法可缓解全球严重的温室效应
D.厕所清洁剂与炉具清洁剂能混用
8.化学与生活密切相关,下列有关说法错误的是
A.凡含有食品添加剂的食物对人体健康均有害,不可食用
B.PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.屠呦呦对青蒿素的提取“青蒿一握,以水二升渍,绞取汁”属于物理变化过程
9.某同学的化学笔记上有以下知识总结,你认为正确的是
A.用灯帽盖灭酒精灯,是为了降低可燃物的温度
B.CO有毒而CO2无毒,因为不同种分子化学性质不相同
C.只要有氧气参加或生成的化学反应都是氧化反应
D.“补钙、补铁、补锌、补碘”中的钙、铁、锌、碘指的都是微量元素
10.疫情期间,使我们意识到,营养均衡的重要性,下列叙述中正确的是
A.人体自身不能合成维生素,必须从食物中获取
B.糖、脂肪、蛋白质都能为人体生命运动提供能量
C.缺维生素C易得夜盲症
D.缺乏硒元素易得癌症,所以要多摄入硒元素
11.下列说法不正确的是
A.地壳中含量最多的金属元素是铝元素
B.生物细胞中含量最多的金属元素是钙元素
C.把含有可溶性钙镁化合物的水称为硬水
D.全球气候变暖、臭氧层破坏和酸雨等也与空气污染有关
12.化学是你,化学是我,化学深入我们的生活。下列说法或做法错误的是
A.火碱可用于洗涤排烟罩的油污
B.硫酸钡用于钡餐透视胃肠
C.人体缺乏维生素C会引起坏血病
D.加热蒸发使稀盐酸变为浓盐酸
13.如图是某化学反应过程的微观示意图,下列有关说法不正确的是
A.丙属于有机物 B.反应前后原子的种类和数目不变
C.生成的丙和丁的分子个数比为1:1 D.参加反应的甲和乙的质量比为22:1
14.如图是元素周期表中“碘”的信息。下列说法正确的是
A.人体严重缺碘会得侏儒症
B.“加碘食盐”中的“碘”是指碘单质
C.碘元素是一种金属元素
D.每个碘原子核中有53个质子
15.建立模型是学习化学的重要方法,下列化学模型不正确的是
A.原子结构
B.脂肪摄入人体后的变化
C.氢氧燃料电池
D.中和反应微观实质
二、填空题
16.请回答下列问题。
(1)化学用语是学习化学的重要工具,是国际通用的化学语言。请用化学用语填空:
①5个铜原子_______;
②4个铵根离子_______;
③氢氧化铁中铁元素显+3价_______;
④某元素的原子结构示意图为,该元素与空气中含量居第二多的元素组成的化合物的化学式为_______;
(2)用所给的元素Na、C、O、H、S、Ca组成的物质填空(填化学式):
①常用于除去铁锈的酸_______;
②农业上用于改良酸性土壤的碱_______;
③用于做糕点的“泡打粉’’的主要成分纯碱_______;
④最简单的有机物_______;
(3)临近中考,妈妈给小明的膳食搭配中有:清炖鸡、回锅肉、米饭、牛奶,你认为还需给小明补充的营养素是_______;
(4)火的发现和利用对人类的发展有着重要意义。“钻木取火”使木柴燃烧起来,这说明燃烧需要的条件有:可燃物,可燃物与空气(或氧气)充分接触和_______。
17.生活处处皆化学。
(1)我国科学家袁隆平以其在杂交水稻的培育方面作出的杰出贡献被誉为“杂交水稻之父”。水稻中富含的营养素是___________。
(2)自来水生产常用___________吸附水中的色素和异味;生活中常用___________的方法降低水的硬度。
(3)餐具上的油污用加了洗涤剂的水更易洗掉,是因为洗涤剂具有___________作用。
(4)冬季是“煤气”中毒的高发季节,“煤气”主要是___________(填化学式)。
18.化学与生活密切相关,请按照要求填空。
(1)打开可乐瓶盖时,液体会喷出,这是因为______;
(2)蒸发时,当蒸发皿中有______出现时,停止加热
(3)人体缺乏维生素A会患______
(4)关闭燃气开关,运用的灭火原理是______;
(5)将Fe粉投入装有Cu(NO3)2和AgNO3溶液的烧杯中,搅拌,充分反应后过滤,向滤渣中滴加稀盐酸,发现有气泡,则滤渣是______;滤液一定是______溶液。
19.化学就在我们身边,它能改善我们的生活。请回答下列问题:
(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是___________。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平(主要成分为A1(OH)3)治疗,其原理用化学方程式表示为_____________。
(2)众志成城、全民抗疫。疫情期间,某食品公司向医院捐赠了一批“即热米饭”,该“即热米饭”用生石灰和水的反应作为热源,写出该反应的化学方程式为____________。
(3)维生素C又名抗坏血酸,在酸性环境下稳定,高温下不稳定。它主要存在于水果和黄瓜等蔬菜中,能增强人体对疾病的抵抗能力。
①根据信息可知,维生素C溶液显____________(填“酸性”“中性”或“碱性”)
②在下列物质中,能与维生素C溶液发生反应的是____________(填序号)。
a.食盐 b.苛性钠 c.硫酸钠
③为较好吸收利用维生素C,食用黄瓜时宜____________(填“凉拌”或“煮熟”)。
(4)酿酒厂生产白酒时,常加入适量稀硫酸来控制酸度,发酵完成后蒸馏即可得到白酒。盐酸也可以控制酸度,且价格比硫酸低。请说明此处不用盐酸的原因是____________。
(5)小明在家发现两根锈铁钉,带到实验室里,将其放入稀盐酸中,观察到____________,反应的化学方程式为____________;小明未将金属立即取出,过了段时间后,又看到金属表面有气泡出现,则该反应的化学方程式为____________________。
三、推断题
20.A﹣I初中化学中常见的物质,它们之间的转化关系如图,反应①是工业冶铁的主要原理。B、D组成元素相同,G是生活中最常用的溶剂,I属于糖类,部分生成物反应条件已省略,请回答:
(1)物质B的化学式是________。
(2)反应②的基本反应类型是___________。
(3)反应①中化合价降低的元素是_________。
(4)由如图可得出,化学反应能够实现的相互转化有________(填字母)。
A、酸和碱 B 无机物和有机物
C 不同种类的原子 D 化学能与其它形式的能量
21.下图是初中化学常见六种物质之间的关系图(物质是溶液的只考虑溶质)。图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。
A中含有人体中含量最多的金属元素,B、C中不含相同元素,C、D中所含元素种类相同。
(1)请分别写出A、B、C、D物质的化学式(或溶质的化学式):
A.________ B.______ C.______ D.________;
(2)写出转化①的化学方程式_____________________________________(写一个);
(3)写出Fe2O3与足量B反应的实验现象______________________________________。
四、实验题
22.酶也是一种蛋白质,可用催化剂.具有高效性、专一性和多样性的特性,其活性受温度和pH等因素影响.氯化铁是一种无机催化剂,其溶液能催化过氧化氢(化学式为H2O2)的分解.肝脏组织细胞中也有一种能催化过氧化氢溶液分解的酶.为了研究生物酶与无机催化剂的催化效率,某同学设计了一个实验,以下是该实验的几个步骤:
①向3号试管内滴入几滴氯化铁溶液;
②将点燃但无火焰的卫生香分别放在1、2、3号试管的管口,仔细观察,发现1号试管口的卫生香燃烧剧烈,2号试管口几乎无变化.
③取三支洁净的试管,编上号,分别注入10rnL3%的过氧化氢溶液.
④轻轻震荡这三支试管,使试管内的物质混合均匀,会发现1号试管的气泡多且最先发生,2号试管几乎无气泡产生.
⑤取豌豆大小的新鲜肝脏,放在培养皿中迅速剪,碎并投入到1号中,将同样大小的新鲜肝脏煮熟后,冷却、剪碎,投入到2号试管中.
(1)请根据实验原理,选择正确的顺序是____________.
(A)①②③④⑤ (B)③④①②⑤ (C)③④①⑤② (D)③⑤①④②
(2)该实验主要证明了酶具有_____________的特性.
(3)2号试管没有变化的原因是__________________.
23.维生素C又名抗坏血酸,易溶于水,易被氧化,能与碘反应.人体缺乏维生素C可引发多种疾病.某研究性学习小组对它研究如下:
(1)猜想:维生素C可能具有酸性.
(2)实验方案:提供的试剂有维生素C片、蒸馏水、紫色石蕊溶液、无色酚酞溶液、氢氧化钠溶液、pH试纸.(实验仪器自选)
根据以上用品,请你帮助他们设计出两种实验方案,并写出实验现象:
实验内容 实验内容 实验现象
方案I
方案Ⅱ
(3)结论:维生素C具有酸性.根据维生素C的性质,判断下列物质中能与维生素C反应的是( )
(A)金属镁
(B)氯化钾
(C)氢氧化钠
(D)硫酸铜
(4)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,则其放置时间的长短是否对维生素C的含量产生影响?他设计了如下的实验方案:
Ⅰ.把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中.
Ⅱ.取两支盛有2mL蓝色的碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如下:
汁液 新鲜西红柿的汁液 放置一周的西红柿的汁液
滴数 12 20
请回答下列问题:
①你认为维生素C含量较高的是________.
②你从中得到的启示是________________________.
五、计算题
24.在食盐中加入适量的碘酸钾(KIO3),可预防碘缺乏病。
(1)人类膳食中缺碘易患_________
A 甲状腺肿大 B 贫血 C 骨质疏松症 D 软骨病
(2)某兴趣小组的同学,欲检测一袋食盐是否为加碘食盐,他们查阅资料得知,加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应,生成碘(I2),淀粉遇I2变蓝色。现提供下列试剂和生活中常见的物质:
①KI溶液;②纯碱:③米汤;④白糖;⑤白酒:⑥白醋,该小组同学进行实验必须选用的试剂和物质是_______________
A ①③④ B ①③⑥ C ②④⑥ D ①④⑤
(3)该小组同学仔细阅读加碘食盐包装袋上的说明后,提出问题并与其他同学讨论,继续进行探究。
问题一:食盐是比较稳定的,而说明中强调“防热”,是否因为受热会造成碘的损失?
(实验一)探究温度对碘损失率的影响
老师指导他们将一定浓度的碘酸钾溶液分成5等份,在不同温度下加热十分钟后,用硫代硫酸
钠标准溶液测定碘酸钾溶液的浓度,计算碘损失率并记录如表:
温度 30℃水浴 50℃水浴 80℃水浴 100℃水浴 煮沸
碘损失率(%) 0 0.3 0.67 1 5.56
①分析上表可得出的结论是_____________________________________
②人们常说:“炒菜时要后放碘盐,以免碘的损失。”这里的“碘”指的是____(填“碘单质”、“碘 元素”或“碘原子”)。
问题二:炒菜时加醋对碘的损失率是否也有影响?
(实验二)探究酸碱度对碘损失率的影响
③此组对照实验,要控制在加热的时间和温度、碘酸钾溶液的浓度和______均相同,溶液的酸碱度不同的条件下进行。
④实验需要调节溶液的酸碱性,下列物质不能选用的是_______(填字母)。
A 氢氧化钠 B 纯碱粉末 C 食盐晶体 D 稀盐酸
(4)碘酸钾中碘元素的质量分数为______。我国规定,食盐中加碘的含量为每千克食盐含腆0.035克,相当于每千克食盐含碘酸钾_____克。(精确到小数点后二位)
25.某有机物在氧气中充分燃烧后,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它的组成,如图,得到两组数据.
燃烧有机物的质量 实验方法 实验前后(1)-(4)装置质量
实验前 实验后
甲组3.2克 A (1)150克 (1)154.6克
(2)150克 (2)153.4克
乙组3.2克 B (3)150克 (3)153.6克
(4)150克 (4)154.4克
请你分析、选用的正确方法是______,推测出该有机物是由______元素组成,各元素的质量比为______.(实验过程中气体均全部被吸收)
参考答案
1.A 2.C 3.D 4.D 5.B 6.C 7.C 8.A 9.B 10.B 11.C 12.D 13.D 14.D 15.A
16.(1) 5Cu
Al2O3
(2) H2SO4 Ca(OH)2 Na2CO3 CH4
(3)维生素
(4)温度达到可燃物的着火点
17.(1)糖类
(2) 活性炭 加热煮沸
(3)乳化
(4)CO
18.(1)压强减小,二氧化碳气体逸出
(2)较多晶体
(3)夜盲症
(4)隔离可燃物
(5) 银、铜、铁 硝酸亚铁3)2
19.(1) 胰液 Al(OH)3+3HCl=AlCl3+3H2O
(2)CaO+H2O=Ca(OH)2
(3) 酸性 b 凉拌
(4)盐酸挥发性较强
(5) 铁锈溶解,溶液变黄色 Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑
20.CO 置换反应 铁 B
21.Ca(OH)2 HCl CO2 CO 3CO+Fe2O32Fe+3CO2(或3C+2Fe2O3 4Fe+3CO2↑) 红棕色固体逐渐(减少至)消失,溶液(由无色)变为黄色
22.D 高效性 煮熟后,肝脏内催化过氧化氢分解的酶失去了活性
23.(2)方案Ⅰ:将维生素C片溶于蒸馏水配成溶液,向其中滴加紫色石蕊溶液 溶液变红色
方案Ⅱ:将维生素C片溶于蒸馏水配成溶液,用玻璃棒蘸取溶液滴在pH试纸上,跟标准比色卡比较 pH试纸变红色
方案Ⅲ:将维生素C片溶于蒸馏水配成溶液,把维生素C的溶液逐滴滴入含氢氧化钠的酚酞溶液中 红色消失(答案合理即可,任选两个)
(3)AC
(4)①新鲜西红柿的汁液 ②维生素C缺乏的病人要多吃维生素C含量高的、新鲜的蔬菜和水果
24.A B 温度越高碘损失率越高 碘元素 质量 C 59.35% 0.06
25.B;C、H、O;3:1:4
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
