四川省雅安市2021-2022学年高二上学期期末检测化学试题(Word版含答案)
文档属性
| 名称 | 四川省雅安市2021-2022学年高二上学期期末检测化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 706.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-16 15:05:50 | ||
图片预览


文档简介
雅安市2021-2022学年上期期末检测高中二年级
化学试题
请你在做题之前仔细阅读下列说明:
1.考试时间:90分钟;满分100分.
2.答题前,考生务必将自己的姓名,准考证号填写清楚,并认真核对条形码上的准考证号,在规定的位置贴好条形码.
3.回答第Ⅰ卷(选择题)时,必须使用2B铅笔填涂;第Ⅱ卷(非选择题)必须使用0.5毫米黑色墨水签字笔书写、笔迹清楚.按照题号顺序在各题的答题区域内作答,超出答题区域的答案无效,在草稿纸上、试卷上答题无效.
4.保持卡面清洁,不要折叠、不要弄皱,禁用涂改液、涂改胶条.
第Ⅰ卷(选择题 共42分)
可能用到的相对原子质量:H-1 O-16 F-19 C1-35.5 A1-27 Ca-40 Cu-64 Zn-65
选择题(共21个小题,每小题只有一个选项符合题目要求.每小题2分,共42分.)
1.下列物质分子中有键的是( )
A. B. C. D.
2.下列基态原子的价层电子排布中,第一电离能最大的是( )
A. B. C. D.
3.下列各组物质中,都是由极性键构成极性分子的是( )
A.和 B.和 C.和 D.和
4.下列晶体熔化时,化学键没有被破坏的是( )
A.氯化铵 B.金刚石 C.甲烷晶体 D.二氧化硅
5.能区别和两种溶液的试剂是( )
A.溶液 B.溶液 C. D.浓氨水
6.下列晶体性质的比较中,正确的是( )
A.熔点: B.沸点:
C.熔点:单质硫>白磷>晶体硅 D.硬度:金刚石>硅>碳化硅
7.日常生活中,下列做法不是为了加快化学反应速率的是( )
A.清洗水垢用较浓白醋 B.将煤块粉碎后燃烧
C.发馒头加酵母粉 D.月饼盒内放置还原性铁粉
8.已知的空间结构为V形,分子中正电中心与负电中心不重合.下列关于和的说法错误的是( )
A.分子中的化学键为非极性键 B.在水中的溶解度比在中的大
C.在水中的溶解度和一样 D.在中的溶解度比在水中的大
9.下列各原子或离子的电子排布式正确的是( )
A. B.
C. D.
10.下列各组基态原子中,X和Y一定是同一主族元素的是( )
选项 X原子 Y原子
A
B M层上有1个电子 N层上有1个电子
C 能级上有2个未成对电子 能级上有2个未成对电子
D L层能级上只有一个空轨道 M层能级上只有一个空轨道
A.A B.B C.C D.D
11.下列现象与氢键无关的是( )
A.的熔沸点比的高 B.水分子高温也很稳定
C.易溶于水 D.乙醇可以和水以任意比互溶
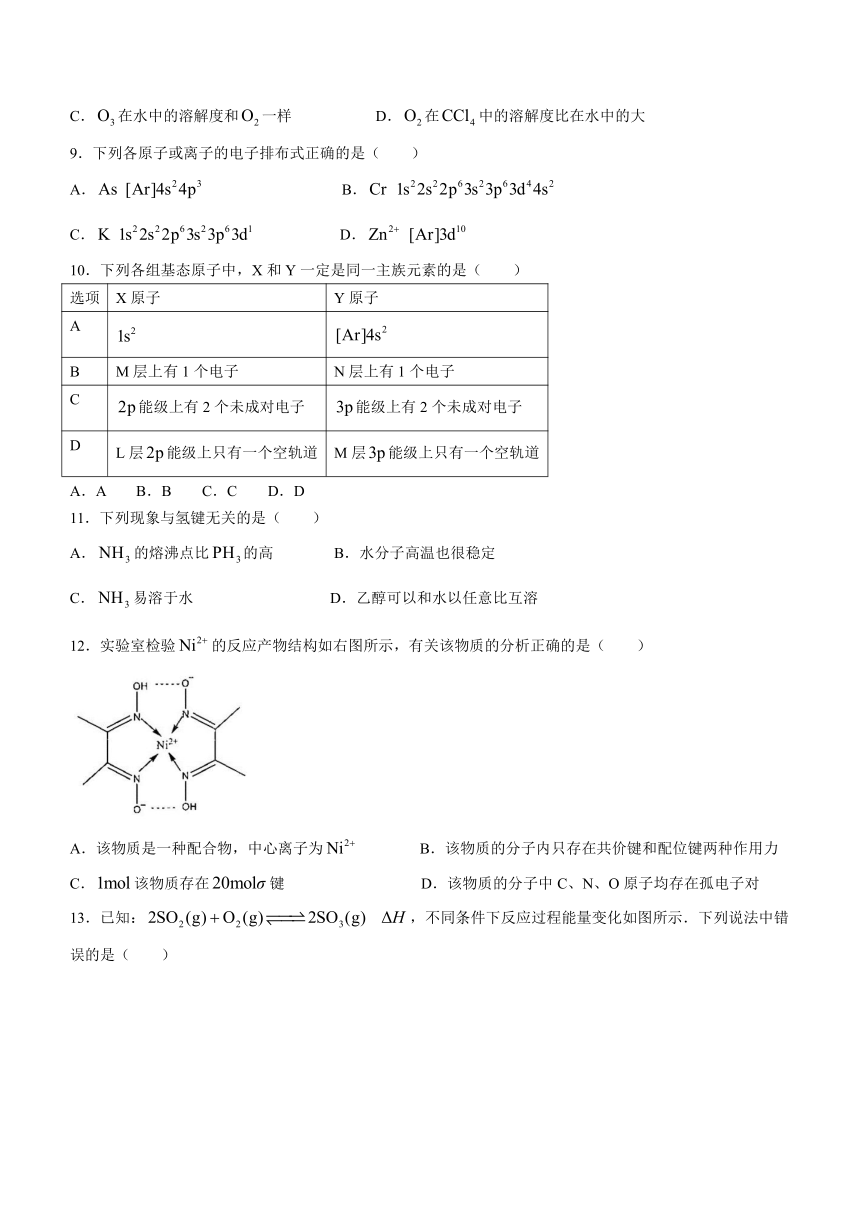
12.实验室检验的反应产物结构如右图所示,有关该物质的分析正确的是( )
A.该物质是一种配合物,中心离子为 B.该物质的分子内只存在共价键和配位键两种作用力
C.该物质存在键 D.该物质的分子中C、N、O原子均存在孤电子对
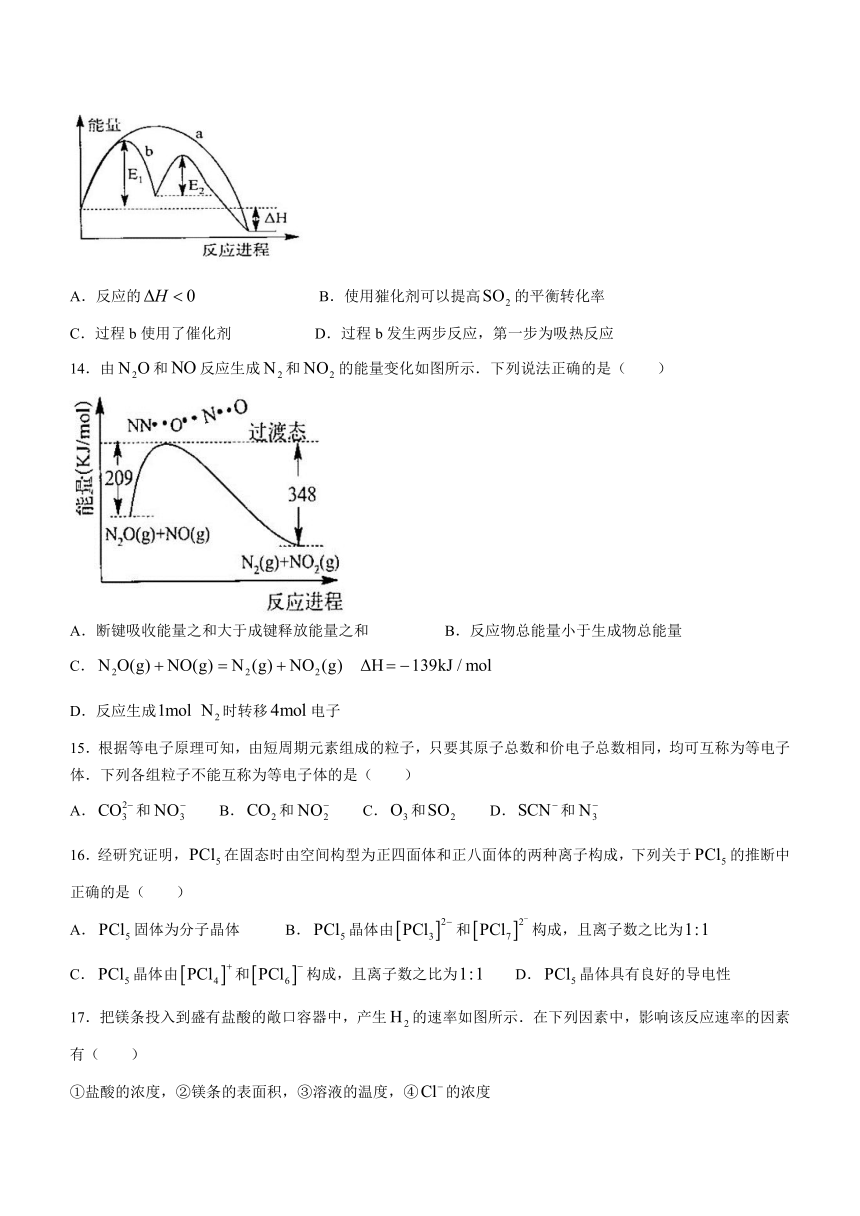
13.已知:,不同条件下反应过程能量变化如图所示.下列说法中错误的是( )
A.反应的 B.使用獕化剂可以提高的平衡转化率
C.过程b使用了催化剂 D.过程b发生两步反应,第一步为吸热反应
14.由和反应生成和的能量变化如图所示.下列说法正确的是( )
A.断键吸收能量之和大于成键释放能量之和 B.反应物总能量小于生成物总能量
C.
D.反应生成时转移电子
15.根据等电子原理可知,由短周期元素组成的粒子,只要其原子总数和价电子总数相同,均可互称为等电子体.下列各组粒子不能互称为等电子体的是( )
A.和 B.和 C.和 D.和
16.经研究证明,在固态时由空间构型为正四面体和正八面体的两种离子构成,下列关于的推断中正确的是( )
A.固体为分子晶体 B.晶体由和构成,且离子数之比为
C.晶体由和构成,且离子数之比为 D.晶体具有良好的导电性
17.把镁条投入到盛有盐酸的敞口容器中,产生的速率如图所示.在下列因素中,影响该反应速率的因素有( )
①盐酸的浓度,②镁条的表面积,③溶液的温度,④的浓度
A.①②③ B.③④ C.①④ D.②③
18.在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度,②升高温度,③增大压强,④加入催化剂
A.①② B.②③ C.③④ D.②④
19.我国科学家利用双功能催化剂(能吸附不同粒子)实现了水煤气反应在低温下的高产率和高反应速率,化学方程式为,过程示意图如下:
下列说法错误的是( )
A.过程Ⅰ、Ⅱ中未断键 B.双功能催化剂提高了活化分子百分数
C.过程Ⅲ有极性键和非极性键形成 D.上述过程提高了和的平衡转化率
20.已知反应,在一定条件下反应达到平衡.下列叙述正确的是( )
A.升高温度,K增大 B.恒温恒容充入一定量的氮气,不变
C.更换高效催化剂,转化率增大 D.减小压强,增加
21.某、混合溶液中存在平衡:,与温度T的关系如下图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
A.反应
B.若温度为,对应的平衡常数分别为,则
C.若时,反应进行到状态D时,一定
D.状态A与状态B相比,状态B时的转化率更高
第Ⅱ卷(非选择题 共58分)
22.(本题共11分).将煤转化为水煤气是将煤转化为洁净燃料的方法之一.、和完全燃烧的热化学方程式分别为:
(1)写出与水蒸气反应生成和的热化学方程式_____________.
(2)比较反应热数据可知,和完全燃烧放出的热量之和比完全燃烧放出的热量_________(填“多”或“少”).
甲同学据此认为:“煤燃烧时加少量水,可以放出更多的热量.”
乙同学根据盖斯定律做出了下列循环图:
之间的关系式是_____________.
乙同学据此认为:“将煤转化为水煤气再燃烧,放出的热量与煤直接燃烧放出的热量相同”.则甲、乙两同学观点正确的是_____________(填“甲”或“乙”),另一同学出现错误观点的原因是_____________.
23.(本题共10分)(1)分子中所有原子均满足8电子构型,分子中键和键的个数比为_________,中心原子的杂化方式为________________.
(2)的分子结构如图所示,其中原子的杂化方式为____________________.
(3)中,原子的杂化方式为_____________;列举与立体构型相同的一种离子和一种分子_______、__________(填化学式).
(4)用价层电子对互斥理论推断分子中,价层电子对数为________,的VSEPR模型名称是_______;属于_________分子(填“极性”或“非极性”)分子中的键角_________(填“>”“<”或“=”).
24.(本题共13分).优化反应条件是研究化学反应的重要方向.
(1)某同学研究浓度对化学平衡的影响.他向溶液中加入溶液,溶液颜色变化为_________,变化原因_________(结合离子方程式解释).
(2)某同学设计了如下探究实验方案:
实验 草酸溶液 高锰酸钾溶液 稀硫酸 硫酸锰溶液 温度 蒸馏水
a 0
b 0
c 0
d 0
回答下列问题:
①本方案中用于设计实验的离子方程式是__________,实验中通过观察什么现象或测定什么数据来进行判断____________.
②该实验的目的是______________.
③实验c中的_________;实验a和d测得反应速率分别为和,则______(填“>”“<”或“=”).
④实验a中,与时间t的关系如右图所示.段斜率明显大于段斜率,除反应可能放热外,还可能是由于______________________.
25.(本题共12分)合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氨气和氢气反应合成氨,实现了人工固氮,化学方程式为.
(1)合成氨在农业和国防中有很重要的意义,在实际工业生产中常采用下列措施,可以用勒夏特列原理解释的是___________(选填字母代号).
A.用铁触媒加快化学反应速率 B.采用较高压强
C.采用较高温度 D.将生成的氨及时从体系中分离出来
(2)某科研小组研究:在其他条件不变的情况下,改变氢气起始的物质的量对工业合成氨反应的影响.实验结果如图所示(图中T表示温度,n表示的起始物质的量).
①图像中和,的关系是______(填“>”“<”或“=”).
②a、b、c、d四点所处的平衡状态中,反应物的转化率最高的是__________(填字母代号).
(3)恒温下,向一个的密闭容器中充入和,反应过程中对的浓度进行检测,得到的数据如下表所示:
时间 5 10 15 20 25 30
0.08 0.14 0.18 0.2 0.2 0.2
①此条件下该反应的化学平衡常数表达式为_____________,若维持容器容积不变,温度不变,往原平衡体系中加入和各,化学平衡将向______________(填“正”或“逆”)反应方向移动;
②平衡时氨气的转化率为___________,反应放出的热量为____________.
③研究表明,合成氨的速率与相关物质的浓度关系为,k为速率常数.以下说法正确的是_____________(填字母).
A,升高温度,k值增大
B.若容器内混合气体的密度不变,则反应达到平衡状态
C.将原容器中的及时分离出来可使v增大
D.合成氨达到平衡后,增大可使正反应速率在达到新平衡的过程中始终增大
26.(本题共12分)已知U、V、W、X、Y、Z为元素周期表中原子序数依次增大的前20号元素.U与V位于同一周期,W、X与Y位于同一周期.U原子L层上有2对成对电子;W是同周期原子半径最大的元素;V是电负性最大的元素.V、W、X可形成型离子晶体M,、为电子数相同的离子晶体.
(1)U元素的基态原子价电子排布式______________.
(2)M的化学名称为____________.
(3)试解释工业冶炼X不用而是用为原料的原因(涉及到的元素用元素符号表示)________________.
(4)、的晶格能分别为、,试分析导致两者晶格能差异的主要原因是________________.
(5)Z与V可形成离子化合物,其晶胞结构如右图所示.Z与V形成的离子化合物的化学式为_________;该离子化合物晶体的密度为,则晶胞的体积是_________(只要求列出计算表达式).
2021-2022学年上期高中二年级
化学试题参考答案和评分标准
选择题(每小题只有一个选项符合题目要求,每小题2分,共42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
答案 A C B C A A D C D D B A B C B C A D D B C
非选择题(共5大题,共58分)
22.(本题共11分)
(1);(3分)
(2)多(2分);(2分); 乙(2分);甲同学忽视了生成水煤气的反应为吸热反应(2分).
23.(本题共10分)
(1)(1分);(1分) (2)(1分)
(3)(1分);(1分);(1分,其它合理回答也给分)
(4)3(1分);平面三角形(1分);极性(1分);<(1分)
24.(本题共13分)
(1)颜色由橙色变为黄色(1分);溶液中存在的可逆反应,加入氢氧化钠,消耗了,平衡正向移动(2分,方程式1分,解释平衡移动1分);
(2)①(2分);观察溶液紫红色褪去的快慢(或测定从反应开始至溶液紫红色褪去所用时间)(1分;)
②研究反应物浓度、催化剂(或的催化作用)、温度对化学反应速率的影响(2分,说出两个因素即可得分);
③3.0(2分);<(2分);
④产物中对该反应有催化作用(1分).
25.(12分)
(1)BD(2分); (2)①>(1分);②c(1分);
(3)①(1分); 逆(1分): ②(2分);36.96(2分) ③AC(2分)
26.(本题共12分)
(1)(2分) (2)六氟合铝酸钠(2分)
(3)为离子晶体(或者离子化合物),而为分子晶体(或者共价化合物)(2分)
(4)晶体中带的电荷大于晶体中、带的电荷;半径小于半径.(2分)
(5)(2分); (2分)
化学试题
请你在做题之前仔细阅读下列说明:
1.考试时间:90分钟;满分100分.
2.答题前,考生务必将自己的姓名,准考证号填写清楚,并认真核对条形码上的准考证号,在规定的位置贴好条形码.
3.回答第Ⅰ卷(选择题)时,必须使用2B铅笔填涂;第Ⅱ卷(非选择题)必须使用0.5毫米黑色墨水签字笔书写、笔迹清楚.按照题号顺序在各题的答题区域内作答,超出答题区域的答案无效,在草稿纸上、试卷上答题无效.
4.保持卡面清洁,不要折叠、不要弄皱,禁用涂改液、涂改胶条.
第Ⅰ卷(选择题 共42分)
可能用到的相对原子质量:H-1 O-16 F-19 C1-35.5 A1-27 Ca-40 Cu-64 Zn-65
选择题(共21个小题,每小题只有一个选项符合题目要求.每小题2分,共42分.)
1.下列物质分子中有键的是( )
A. B. C. D.
2.下列基态原子的价层电子排布中,第一电离能最大的是( )
A. B. C. D.
3.下列各组物质中,都是由极性键构成极性分子的是( )
A.和 B.和 C.和 D.和
4.下列晶体熔化时,化学键没有被破坏的是( )
A.氯化铵 B.金刚石 C.甲烷晶体 D.二氧化硅
5.能区别和两种溶液的试剂是( )
A.溶液 B.溶液 C. D.浓氨水
6.下列晶体性质的比较中,正确的是( )
A.熔点: B.沸点:
C.熔点:单质硫>白磷>晶体硅 D.硬度:金刚石>硅>碳化硅
7.日常生活中,下列做法不是为了加快化学反应速率的是( )
A.清洗水垢用较浓白醋 B.将煤块粉碎后燃烧
C.发馒头加酵母粉 D.月饼盒内放置还原性铁粉
8.已知的空间结构为V形,分子中正电中心与负电中心不重合.下列关于和的说法错误的是( )
A.分子中的化学键为非极性键 B.在水中的溶解度比在中的大
C.在水中的溶解度和一样 D.在中的溶解度比在水中的大
9.下列各原子或离子的电子排布式正确的是( )
A. B.
C. D.
10.下列各组基态原子中,X和Y一定是同一主族元素的是( )
选项 X原子 Y原子
A
B M层上有1个电子 N层上有1个电子
C 能级上有2个未成对电子 能级上有2个未成对电子
D L层能级上只有一个空轨道 M层能级上只有一个空轨道
A.A B.B C.C D.D
11.下列现象与氢键无关的是( )
A.的熔沸点比的高 B.水分子高温也很稳定
C.易溶于水 D.乙醇可以和水以任意比互溶
12.实验室检验的反应产物结构如右图所示,有关该物质的分析正确的是( )
A.该物质是一种配合物,中心离子为 B.该物质的分子内只存在共价键和配位键两种作用力
C.该物质存在键 D.该物质的分子中C、N、O原子均存在孤电子对
13.已知:,不同条件下反应过程能量变化如图所示.下列说法中错误的是( )
A.反应的 B.使用獕化剂可以提高的平衡转化率
C.过程b使用了催化剂 D.过程b发生两步反应,第一步为吸热反应
14.由和反应生成和的能量变化如图所示.下列说法正确的是( )
A.断键吸收能量之和大于成键释放能量之和 B.反应物总能量小于生成物总能量
C.
D.反应生成时转移电子
15.根据等电子原理可知,由短周期元素组成的粒子,只要其原子总数和价电子总数相同,均可互称为等电子体.下列各组粒子不能互称为等电子体的是( )
A.和 B.和 C.和 D.和
16.经研究证明,在固态时由空间构型为正四面体和正八面体的两种离子构成,下列关于的推断中正确的是( )
A.固体为分子晶体 B.晶体由和构成,且离子数之比为
C.晶体由和构成,且离子数之比为 D.晶体具有良好的导电性
17.把镁条投入到盛有盐酸的敞口容器中,产生的速率如图所示.在下列因素中,影响该反应速率的因素有( )
①盐酸的浓度,②镁条的表面积,③溶液的温度,④的浓度
A.①②③ B.③④ C.①④ D.②③
18.在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度,②升高温度,③增大压强,④加入催化剂
A.①② B.②③ C.③④ D.②④
19.我国科学家利用双功能催化剂(能吸附不同粒子)实现了水煤气反应在低温下的高产率和高反应速率,化学方程式为,过程示意图如下:
下列说法错误的是( )
A.过程Ⅰ、Ⅱ中未断键 B.双功能催化剂提高了活化分子百分数
C.过程Ⅲ有极性键和非极性键形成 D.上述过程提高了和的平衡转化率
20.已知反应,在一定条件下反应达到平衡.下列叙述正确的是( )
A.升高温度,K增大 B.恒温恒容充入一定量的氮气,不变
C.更换高效催化剂,转化率增大 D.减小压强,增加
21.某、混合溶液中存在平衡:,与温度T的关系如下图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
A.反应
B.若温度为,对应的平衡常数分别为,则
C.若时,反应进行到状态D时,一定
D.状态A与状态B相比,状态B时的转化率更高
第Ⅱ卷(非选择题 共58分)
22.(本题共11分).将煤转化为水煤气是将煤转化为洁净燃料的方法之一.、和完全燃烧的热化学方程式分别为:
(1)写出与水蒸气反应生成和的热化学方程式_____________.
(2)比较反应热数据可知,和完全燃烧放出的热量之和比完全燃烧放出的热量_________(填“多”或“少”).
甲同学据此认为:“煤燃烧时加少量水,可以放出更多的热量.”
乙同学根据盖斯定律做出了下列循环图:
之间的关系式是_____________.
乙同学据此认为:“将煤转化为水煤气再燃烧,放出的热量与煤直接燃烧放出的热量相同”.则甲、乙两同学观点正确的是_____________(填“甲”或“乙”),另一同学出现错误观点的原因是_____________.
23.(本题共10分)(1)分子中所有原子均满足8电子构型,分子中键和键的个数比为_________,中心原子的杂化方式为________________.
(2)的分子结构如图所示,其中原子的杂化方式为____________________.
(3)中,原子的杂化方式为_____________;列举与立体构型相同的一种离子和一种分子_______、__________(填化学式).
(4)用价层电子对互斥理论推断分子中,价层电子对数为________,的VSEPR模型名称是_______;属于_________分子(填“极性”或“非极性”)分子中的键角_________(填“>”“<”或“=”).
24.(本题共13分).优化反应条件是研究化学反应的重要方向.
(1)某同学研究浓度对化学平衡的影响.他向溶液中加入溶液,溶液颜色变化为_________,变化原因_________(结合离子方程式解释).
(2)某同学设计了如下探究实验方案:
实验 草酸溶液 高锰酸钾溶液 稀硫酸 硫酸锰溶液 温度 蒸馏水
a 0
b 0
c 0
d 0
回答下列问题:
①本方案中用于设计实验的离子方程式是__________,实验中通过观察什么现象或测定什么数据来进行判断____________.
②该实验的目的是______________.
③实验c中的_________;实验a和d测得反应速率分别为和,则______(填“>”“<”或“=”).
④实验a中,与时间t的关系如右图所示.段斜率明显大于段斜率,除反应可能放热外,还可能是由于______________________.
25.(本题共12分)合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氨气和氢气反应合成氨,实现了人工固氮,化学方程式为.
(1)合成氨在农业和国防中有很重要的意义,在实际工业生产中常采用下列措施,可以用勒夏特列原理解释的是___________(选填字母代号).
A.用铁触媒加快化学反应速率 B.采用较高压强
C.采用较高温度 D.将生成的氨及时从体系中分离出来
(2)某科研小组研究:在其他条件不变的情况下,改变氢气起始的物质的量对工业合成氨反应的影响.实验结果如图所示(图中T表示温度,n表示的起始物质的量).
①图像中和,的关系是______(填“>”“<”或“=”).
②a、b、c、d四点所处的平衡状态中,反应物的转化率最高的是__________(填字母代号).
(3)恒温下,向一个的密闭容器中充入和,反应过程中对的浓度进行检测,得到的数据如下表所示:
时间 5 10 15 20 25 30
0.08 0.14 0.18 0.2 0.2 0.2
①此条件下该反应的化学平衡常数表达式为_____________,若维持容器容积不变,温度不变,往原平衡体系中加入和各,化学平衡将向______________(填“正”或“逆”)反应方向移动;
②平衡时氨气的转化率为___________,反应放出的热量为____________.
③研究表明,合成氨的速率与相关物质的浓度关系为,k为速率常数.以下说法正确的是_____________(填字母).
A,升高温度,k值增大
B.若容器内混合气体的密度不变,则反应达到平衡状态
C.将原容器中的及时分离出来可使v增大
D.合成氨达到平衡后,增大可使正反应速率在达到新平衡的过程中始终增大
26.(本题共12分)已知U、V、W、X、Y、Z为元素周期表中原子序数依次增大的前20号元素.U与V位于同一周期,W、X与Y位于同一周期.U原子L层上有2对成对电子;W是同周期原子半径最大的元素;V是电负性最大的元素.V、W、X可形成型离子晶体M,、为电子数相同的离子晶体.
(1)U元素的基态原子价电子排布式______________.
(2)M的化学名称为____________.
(3)试解释工业冶炼X不用而是用为原料的原因(涉及到的元素用元素符号表示)________________.
(4)、的晶格能分别为、,试分析导致两者晶格能差异的主要原因是________________.
(5)Z与V可形成离子化合物,其晶胞结构如右图所示.Z与V形成的离子化合物的化学式为_________;该离子化合物晶体的密度为,则晶胞的体积是_________(只要求列出计算表达式).
2021-2022学年上期高中二年级
化学试题参考答案和评分标准
选择题(每小题只有一个选项符合题目要求,每小题2分,共42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
答案 A C B C A A D C D D B A B C B C A D D B C
非选择题(共5大题,共58分)
22.(本题共11分)
(1);(3分)
(2)多(2分);(2分); 乙(2分);甲同学忽视了生成水煤气的反应为吸热反应(2分).
23.(本题共10分)
(1)(1分);(1分) (2)(1分)
(3)(1分);(1分);(1分,其它合理回答也给分)
(4)3(1分);平面三角形(1分);极性(1分);<(1分)
24.(本题共13分)
(1)颜色由橙色变为黄色(1分);溶液中存在的可逆反应,加入氢氧化钠,消耗了,平衡正向移动(2分,方程式1分,解释平衡移动1分);
(2)①(2分);观察溶液紫红色褪去的快慢(或测定从反应开始至溶液紫红色褪去所用时间)(1分;)
②研究反应物浓度、催化剂(或的催化作用)、温度对化学反应速率的影响(2分,说出两个因素即可得分);
③3.0(2分);<(2分);
④产物中对该反应有催化作用(1分).
25.(12分)
(1)BD(2分); (2)①>(1分);②c(1分);
(3)①(1分); 逆(1分): ②(2分);36.96(2分) ③AC(2分)
26.(本题共12分)
(1)(2分) (2)六氟合铝酸钠(2分)
(3)为离子晶体(或者离子化合物),而为分子晶体(或者共价化合物)(2分)
(4)晶体中带的电荷大于晶体中、带的电荷;半径小于半径.(2分)
(5)(2分); (2分)
同课章节目录
