山东省泰安市高新区2021-2022学年九年级上学期期末化学试题(word版 含答案)
文档属性
| 名称 | 山东省泰安市高新区2021-2022学年九年级上学期期末化学试题(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 256.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-16 12:38:19 | ||
图片预览


文档简介
2021—2022学年上学期初四化学练习题
时间:60分钟 总分:50分
本试卷分第Ⅰ卷(选择題)和第Ⅱ卷(非选择题)两部分,第1卷选择题20分,第Ⅱ卷非选择题30分,满分50分。
相对原子质量:H-1 O-16 C1-35.5 S-32 Na-23 Cu-64 Zn-65
第Ⅰ卷(选择题 共20分)
一、选择题(每小题1分,共20分,每小题只有一个选项符合题意)。
1.餐桌上饮品丰富,下列饮品中属于溶液的是
A.玉米糊 B.豆浆 C.可乐 D.牛奶
2.人人都应践行“绿水青山就是金山银山”的理念,下列说法不符合该理念的是()
A.保护金属资源,提倡合理开发 B.化石燃料取之不尽,提倡大量使用
C.为了使天空更蓝,提倡植树造林 D.倡导“低碳”生活,提倡纸张双面使用
3.下列关于溶液的说法正确的是
A.溶液都是无色的 B.溶液加水稀释前后溶质的质量不变
C.只有固体和液体可以作为溶质 D.均一、稳定的液体一定是溶液
4.下列物质中,不是合金的是()
A.生铁 B.铁锈 C.黄铜 D.不锈钢
5.若要研究温度对蔗糖溶解快慢的影响,应对比(
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
6.生理盐水是医疗上常用的一种溶液。下列关于生理盐水的说法中,错误的是(
A.生理盐水的溶剂是水 B.生理盐水中存在的微粒有水分子和氯化钠分子
C.生理盐水是一种混合物 D.各部分一样咸体现了溶液成分的均一性
7.对于30%的KNO3溶液,下列说法正确的是
A.溶液中溶质和溶剂的质量比为3:10 B.每100g水中溶解30gKNO3
C.某种条件下,可转化为悬浊液 D.若再加30g硝酸钾,则变为60%KNO3溶液
8.酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以电离出H+,从而呈现酸性,主要用于饮料添加剂或药物工业原料,下列物质不能与酒石酸反应的是
A.CO2 B. CuO C. NaOH D.Mg
9.下列常见物质中,减性最强的是()
物质 橘子汁 西瓜汁 鸡蛋清 肥皂水
pH 3~4 6~7 7~8 9~10
A.橘子汁 B.西瓜汁 C.鸡蛋清 D.肥皂水
10.取少量氧化铜粉末装入试管中,向试管中加入约2mL稀硫酸,振荡。再加热试管,直到氧化铜完全反应。下列说法错误的是
A.氧化铜粉末是黑色固体,盛放在广口瓶中 B.充分反应后溶液变为黄色
C.振荡的目的是使氧化铜和稀硫酸充分反应 D.加热能加快化学反应的速率
11.推理是学习化学常用的思维方法,下列推理正确的是()
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
B.酸溶液能使紫色石蕊溶液变红,所以能使紫色石蕊变红的溶液一定是酸溶液
C.中和反应生成盐和水,但生成盐和水的反应不一定是中和反应
D.溶液一定是混合物,所以混合物一定是溶液
12.将36.5克10%稀盐酸和4克10%氢氧化钠溶液混合,反应后滴加紫色石蕊颜色变成()
A.红色 B.蓝色 C.无色 D.紫色
13.海水中含量最高的元素是()
A. H B.O C. Na D.CI
14.草木灰的主要成分是碳酸钾,其性质与碳酸钠相似,下列关于碳酸钾的说法中,正确的是()
A.碳酸钾的化学式为KCO3
B.碳酸钾水溶液中加入无色酚酞试液,溶液仍然为无色
C.向碳酸钾溶液中加入氯化钙不会发生化学反应
D.向稀盐酸中加入碳酸钾会产生气泡
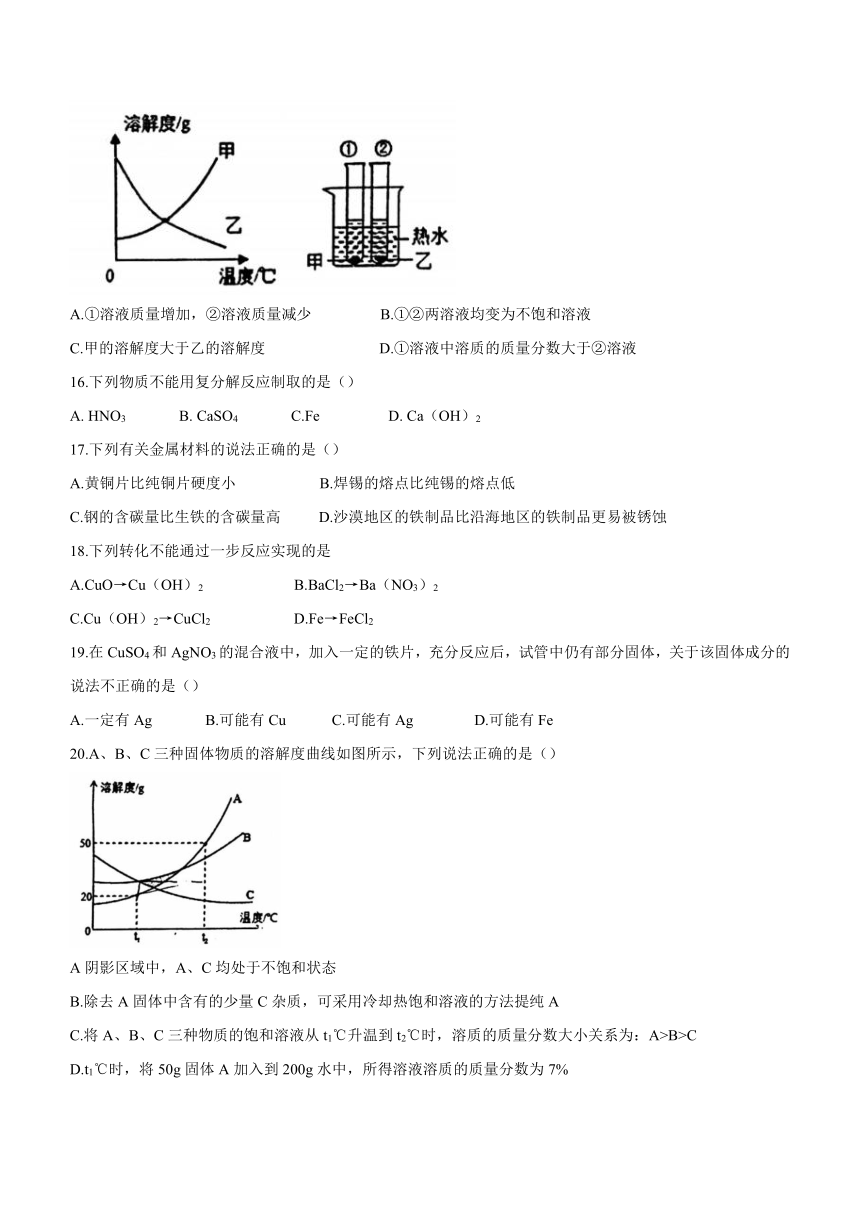
15.甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是
A.①溶液质量增加,②溶液质量减少 B.①②两溶液均变为不饱和溶液
C.甲的溶解度大于乙的溶解度 D.①溶液中溶质的质量分数大于②溶液
16.下列物质不能用复分解反应制取的是()
A. HNO3 B. CaSO4 C.Fe D. Ca(OH)2
17.下列有关金属材料的说法正确的是()
A.黄铜片比纯铜片硬度小 B.焊锡的熔点比纯锡的熔点低
C.钢的含碳量比生铁的含碳量高 D.沙漠地区的铁制品比沿海地区的铁制品更易被锈蚀
18.下列转化不能通过一步反应实现的是
A.CuO→Cu(OH)2 B.BaCl2→Ba(NO3)2
C.Cu(OH)2→CuCl2 D.Fe→FeCl2
19.在CuSO4和AgNO3的混合液中,加入一定的铁片,充分反应后,试管中仍有部分固体,关于该固体成分的说法不正确的是()
A.一定有Ag B.可能有Cu C.可能有Ag D.可能有Fe
20.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是()
A阴影区域中,A、C均处于不饱和状态
B.除去A固体中含有的少量C杂质,可采用冷却热饱和溶液的方法提纯A
C.将A、B、C三种物质的饱和溶液从t1℃升温到t2℃时,溶质的质量分数大小关系为:A>B>C
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数为7%
第Ⅱ卷(选择题 共30分)
二、填空与简答题(本题包括3小题,共12分)
21.(4分)物质的酸碱性与我们的生活密切相关。
(1)酸性是因为物质能电离出 离子,可以使紫色石蕊试液变 色。
(2)酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即pH 7.自然状态下头皮表面呈弱酸性,有利于头发的生长;所以用洗发水洗发后,最好再使用护发素,使头皮保持弱酸性;由此推测护发素的pH
7(选填“>”、“<”、“=”)。
22.(5分)根据“性质决定用途,用途体现性质”回答下列问题:
(1)NaOH可用做某些气体的干燥剂,利用了NaOH的性质是 ;氢氧化钠溶液敞口放置在空气中应密封保存的原因是 (用化学方程式解释)。
(2)碳酸氢钠在医疗上是治疗胃酸过多症的一种药剂,写出反应的化学方程式: 。
(3)铝制品具有很好的抗腐蚀性能,其原因是: 。
(4)铜可制成导线,主要是利用其有良好的延展性和 性。
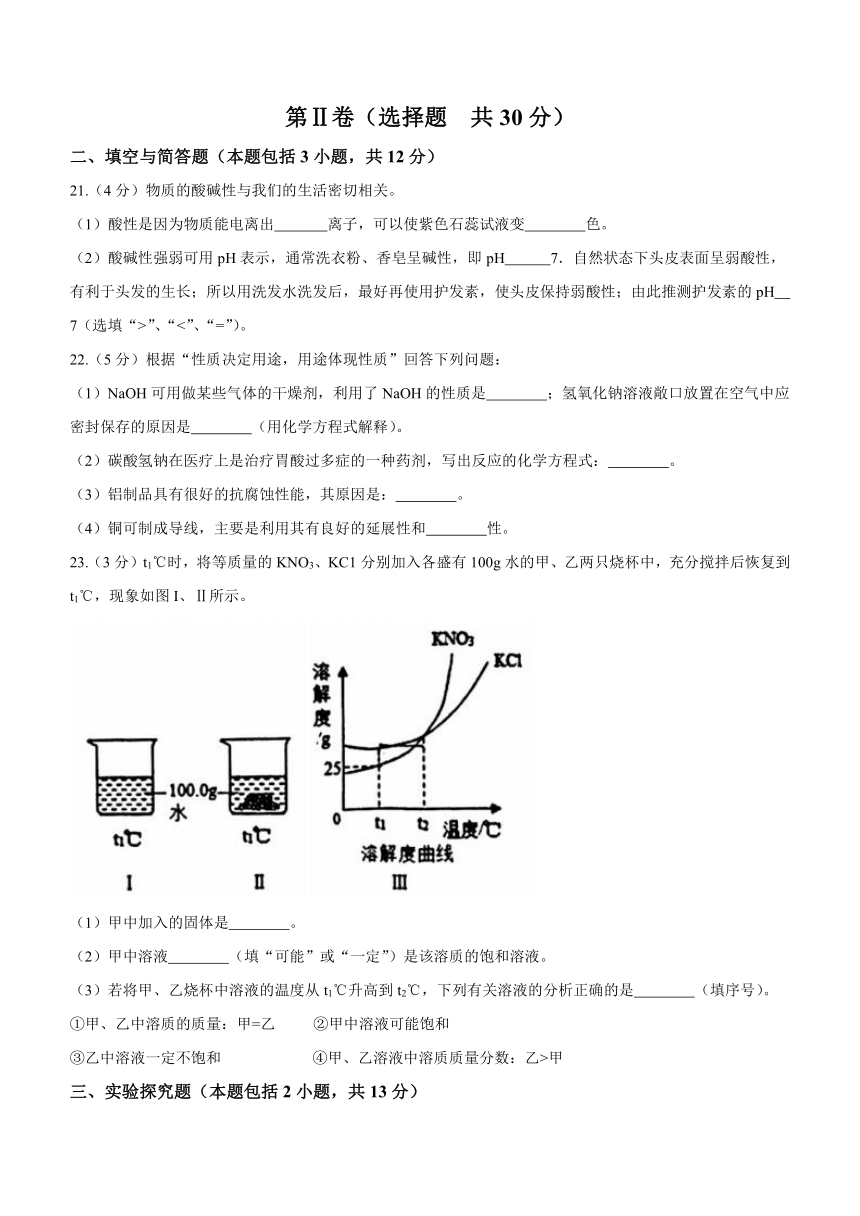
23.(3分)t1℃时,将等质量的KNO3、KC1分别加入各盛有100g水的甲、乙两只烧杯中,充分搅拌后恢复到t1℃,现象如图I、Ⅱ所示。
(1)甲中加入的固体是 。
(2)甲中溶液 (填“可能”或“一定”)是该溶质的饱和溶液。
(3)若将甲、乙烧杯中溶液的温度从t1℃升高到t2℃,下列有关溶液的分析正确的是 (填序号)。
①甲、乙中溶质的质量:甲=乙 ②甲中溶液可能饱和
③乙中溶液一定不饱和 ④甲、乙溶液中溶质质量分数:乙>甲
三、实验探究题(本题包括2小题,共13分)
24.(6分)同学们在实验室进行“粗盐中难溶性杂质的去除”实验。
【实验目的】粗盐中难溶性杂质的去除
【实验过程】
①用天平称取5.0g粗盐,加入到盛有150mL水的烧杯里,用玻璃棒搅拌;
②过滤食盐水;
③将所得滤液倒入蒸发皿,加热并用玻璃棒搅拌,当液体蒸干时,停止加热;
④冷却后用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率。
【实验分析】
(1)步骤①中量取15.0mL正确读数方法:视线与 保持水平;为节约能源实验中水的量不宜过多。步骤②得到的液体仍旧浑浊,请分析原因 写一种。
(2)步骤③中出现错误操作,请改正 ,其中玻璃棒的作用是 。
(3)步骤④最终称得固体3.5g,则所得精盐的产率为 。某学生在同等实验条件下,所得产品的产量明显比其他同学多,请帮他分析可能的原因 。
A.步骤①中食盐未完全溶解 B.步骤②中有滤渣掉入承接液体的烧杯中
C.步骤③实验过程中有物质溅出 D.步骤④最终所得精盐比较潮湿
25.(7分)某学习小组对铁锈蚀进行探究。
【提出问题】铁锈蚀与哪些因素有关?
【查阅资料】
(1)氯化钙固体可作干燥剂。
(2)一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。
【设计与实验】
实验一:定性探究铁锈蚀的因素
取四枚相同的洁净无锈铁钉分别放入试管,进行图实验,现象如表1。
表1
试管 一周后现象
A 铁钉表面有一层铁锈
B 铁钉表面无明显变化
C 铁钉表面无明显变化
D 铁钉表面有较厚铁锈
(1)对比A、B、C试管中实验现象,说明铁锈蚀主要是铁与 发生化学反应.
(2)对比A、D试管中实验现象,说明铁锈蚀还与 有关。
(3)铁锈蚀后应及时除锈的原因是 。写出用盐酸除铁锈的化学方程式 。
实验二:影响铁的锈蚀速度的因素。
(1)该小组用图甲装置进行探究铁的锈蚀的实验(量筒内的铁丝绒的量充足),起始时量筒内水面处于50mL刻度处,之后水面缓慢上升。几天后水面最终处于约 (填“40”或“10”)mL刻度处。
(2)小强同学进行如下拓展探究实验:取铁钉用砂纸打磨,称其质量,按图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。小强同学的实验是探究
因素对铁钉锈蚀快慢的影响,结论是 。
温度/°C 10 20 30 40 50
铁钉质量增加/g 0.02 0.04 0.08 0.16 0.18
四、计算题(本题包括1小题,共5分)
26.(5分)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第1次 40 m
第2次 40 14.8
第3次 40 12.2
第4次 40 11.2
第5次 40 11.2
试回答下列问题:
(1)从以上数据可知,表格中,m= 。
(2)计算所用稀硫酸中硫酸的质量分数是多少?
2021-2022学年上学期期末练习题
初四化学参考答案
第I卷(选择题 共20分)
一、选择题(每小题1分,共20分,每小题只有一个选项符合题意)。
1-5CBBBC 6-10BCADB 11-15CDBDA 16-20CBACB
第Ⅱ卷(选择题 共30分)
二、填空与简答题(本题包括3小题,共12分)。
21.(4分)
(1)氢 红 (2)> <
22.(5分)
(1)吸水性
(2)
(3)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止内部的铝进一步被氧化
(4)导电
23.(3分)
(1)氯化钾(2)可能(3)①③
三、实验探究题(本题包括2小题,共13分)。
24.(6分)
(1)量筒内液体凹液面最低处 滤纸破损或液面高于滤纸边缘等
(2)当蒸发皿中出现较多固体时,停止加热 使液体均匀受热,防止液体飞溅
(3)70% bd
25.(7分)
实验一:(1)水和氧气 (2)氯化钠
(3)铁锈疏松多孔,能吸附空气中的氧气和水,会加快铁的锈蚀
实验二:(1)40
(2)温度 温度在10~50℃的范围内,温度越高,铁钉锈蚀的速度越快
四、计算题(本题包括2小题,共5分)。
26.
(1)m= 17.4 ………………………………………………………………1分
(2)计算所用稀硫酸中硫酸的质量分数是多少?
解:40克稀硫酸反应掉的锌的质量为:14.8g﹣12.2g=2.6g………………1分
设40g稀硫酸中硫酸的质量为X
98 65
x 2.6g ………………………………………………………………1分
解得:X=3.92g …………………………………………1分
………………………………………………1分
答:稀硫酸中硫酸的质量分数为9.8% 。
时间:60分钟 总分:50分
本试卷分第Ⅰ卷(选择題)和第Ⅱ卷(非选择题)两部分,第1卷选择题20分,第Ⅱ卷非选择题30分,满分50分。
相对原子质量:H-1 O-16 C1-35.5 S-32 Na-23 Cu-64 Zn-65
第Ⅰ卷(选择题 共20分)
一、选择题(每小题1分,共20分,每小题只有一个选项符合题意)。
1.餐桌上饮品丰富,下列饮品中属于溶液的是
A.玉米糊 B.豆浆 C.可乐 D.牛奶
2.人人都应践行“绿水青山就是金山银山”的理念,下列说法不符合该理念的是()
A.保护金属资源,提倡合理开发 B.化石燃料取之不尽,提倡大量使用
C.为了使天空更蓝,提倡植树造林 D.倡导“低碳”生活,提倡纸张双面使用
3.下列关于溶液的说法正确的是
A.溶液都是无色的 B.溶液加水稀释前后溶质的质量不变
C.只有固体和液体可以作为溶质 D.均一、稳定的液体一定是溶液
4.下列物质中,不是合金的是()
A.生铁 B.铁锈 C.黄铜 D.不锈钢
5.若要研究温度对蔗糖溶解快慢的影响,应对比(
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
6.生理盐水是医疗上常用的一种溶液。下列关于生理盐水的说法中,错误的是(
A.生理盐水的溶剂是水 B.生理盐水中存在的微粒有水分子和氯化钠分子
C.生理盐水是一种混合物 D.各部分一样咸体现了溶液成分的均一性
7.对于30%的KNO3溶液,下列说法正确的是
A.溶液中溶质和溶剂的质量比为3:10 B.每100g水中溶解30gKNO3
C.某种条件下,可转化为悬浊液 D.若再加30g硝酸钾,则变为60%KNO3溶液
8.酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以电离出H+,从而呈现酸性,主要用于饮料添加剂或药物工业原料,下列物质不能与酒石酸反应的是
A.CO2 B. CuO C. NaOH D.Mg
9.下列常见物质中,减性最强的是()
物质 橘子汁 西瓜汁 鸡蛋清 肥皂水
pH 3~4 6~7 7~8 9~10
A.橘子汁 B.西瓜汁 C.鸡蛋清 D.肥皂水
10.取少量氧化铜粉末装入试管中,向试管中加入约2mL稀硫酸,振荡。再加热试管,直到氧化铜完全反应。下列说法错误的是
A.氧化铜粉末是黑色固体,盛放在广口瓶中 B.充分反应后溶液变为黄色
C.振荡的目的是使氧化铜和稀硫酸充分反应 D.加热能加快化学反应的速率
11.推理是学习化学常用的思维方法,下列推理正确的是()
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
B.酸溶液能使紫色石蕊溶液变红,所以能使紫色石蕊变红的溶液一定是酸溶液
C.中和反应生成盐和水,但生成盐和水的反应不一定是中和反应
D.溶液一定是混合物,所以混合物一定是溶液
12.将36.5克10%稀盐酸和4克10%氢氧化钠溶液混合,反应后滴加紫色石蕊颜色变成()
A.红色 B.蓝色 C.无色 D.紫色
13.海水中含量最高的元素是()
A. H B.O C. Na D.CI
14.草木灰的主要成分是碳酸钾,其性质与碳酸钠相似,下列关于碳酸钾的说法中,正确的是()
A.碳酸钾的化学式为KCO3
B.碳酸钾水溶液中加入无色酚酞试液,溶液仍然为无色
C.向碳酸钾溶液中加入氯化钙不会发生化学反应
D.向稀盐酸中加入碳酸钾会产生气泡
15.甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是
A.①溶液质量增加,②溶液质量减少 B.①②两溶液均变为不饱和溶液
C.甲的溶解度大于乙的溶解度 D.①溶液中溶质的质量分数大于②溶液
16.下列物质不能用复分解反应制取的是()
A. HNO3 B. CaSO4 C.Fe D. Ca(OH)2
17.下列有关金属材料的说法正确的是()
A.黄铜片比纯铜片硬度小 B.焊锡的熔点比纯锡的熔点低
C.钢的含碳量比生铁的含碳量高 D.沙漠地区的铁制品比沿海地区的铁制品更易被锈蚀
18.下列转化不能通过一步反应实现的是
A.CuO→Cu(OH)2 B.BaCl2→Ba(NO3)2
C.Cu(OH)2→CuCl2 D.Fe→FeCl2
19.在CuSO4和AgNO3的混合液中,加入一定的铁片,充分反应后,试管中仍有部分固体,关于该固体成分的说法不正确的是()
A.一定有Ag B.可能有Cu C.可能有Ag D.可能有Fe
20.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是()
A阴影区域中,A、C均处于不饱和状态
B.除去A固体中含有的少量C杂质,可采用冷却热饱和溶液的方法提纯A
C.将A、B、C三种物质的饱和溶液从t1℃升温到t2℃时,溶质的质量分数大小关系为:A>B>C
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数为7%
第Ⅱ卷(选择题 共30分)
二、填空与简答题(本题包括3小题,共12分)
21.(4分)物质的酸碱性与我们的生活密切相关。
(1)酸性是因为物质能电离出 离子,可以使紫色石蕊试液变 色。
(2)酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即pH 7.自然状态下头皮表面呈弱酸性,有利于头发的生长;所以用洗发水洗发后,最好再使用护发素,使头皮保持弱酸性;由此推测护发素的pH
7(选填“>”、“<”、“=”)。
22.(5分)根据“性质决定用途,用途体现性质”回答下列问题:
(1)NaOH可用做某些气体的干燥剂,利用了NaOH的性质是 ;氢氧化钠溶液敞口放置在空气中应密封保存的原因是 (用化学方程式解释)。
(2)碳酸氢钠在医疗上是治疗胃酸过多症的一种药剂,写出反应的化学方程式: 。
(3)铝制品具有很好的抗腐蚀性能,其原因是: 。
(4)铜可制成导线,主要是利用其有良好的延展性和 性。
23.(3分)t1℃时,将等质量的KNO3、KC1分别加入各盛有100g水的甲、乙两只烧杯中,充分搅拌后恢复到t1℃,现象如图I、Ⅱ所示。
(1)甲中加入的固体是 。
(2)甲中溶液 (填“可能”或“一定”)是该溶质的饱和溶液。
(3)若将甲、乙烧杯中溶液的温度从t1℃升高到t2℃,下列有关溶液的分析正确的是 (填序号)。
①甲、乙中溶质的质量:甲=乙 ②甲中溶液可能饱和
③乙中溶液一定不饱和 ④甲、乙溶液中溶质质量分数:乙>甲
三、实验探究题(本题包括2小题,共13分)
24.(6分)同学们在实验室进行“粗盐中难溶性杂质的去除”实验。
【实验目的】粗盐中难溶性杂质的去除
【实验过程】
①用天平称取5.0g粗盐,加入到盛有150mL水的烧杯里,用玻璃棒搅拌;
②过滤食盐水;
③将所得滤液倒入蒸发皿,加热并用玻璃棒搅拌,当液体蒸干时,停止加热;
④冷却后用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率。
【实验分析】
(1)步骤①中量取15.0mL正确读数方法:视线与 保持水平;为节约能源实验中水的量不宜过多。步骤②得到的液体仍旧浑浊,请分析原因 写一种。
(2)步骤③中出现错误操作,请改正 ,其中玻璃棒的作用是 。
(3)步骤④最终称得固体3.5g,则所得精盐的产率为 。某学生在同等实验条件下,所得产品的产量明显比其他同学多,请帮他分析可能的原因 。
A.步骤①中食盐未完全溶解 B.步骤②中有滤渣掉入承接液体的烧杯中
C.步骤③实验过程中有物质溅出 D.步骤④最终所得精盐比较潮湿
25.(7分)某学习小组对铁锈蚀进行探究。
【提出问题】铁锈蚀与哪些因素有关?
【查阅资料】
(1)氯化钙固体可作干燥剂。
(2)一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。
【设计与实验】
实验一:定性探究铁锈蚀的因素
取四枚相同的洁净无锈铁钉分别放入试管,进行图实验,现象如表1。
表1
试管 一周后现象
A 铁钉表面有一层铁锈
B 铁钉表面无明显变化
C 铁钉表面无明显变化
D 铁钉表面有较厚铁锈
(1)对比A、B、C试管中实验现象,说明铁锈蚀主要是铁与 发生化学反应.
(2)对比A、D试管中实验现象,说明铁锈蚀还与 有关。
(3)铁锈蚀后应及时除锈的原因是 。写出用盐酸除铁锈的化学方程式 。
实验二:影响铁的锈蚀速度的因素。
(1)该小组用图甲装置进行探究铁的锈蚀的实验(量筒内的铁丝绒的量充足),起始时量筒内水面处于50mL刻度处,之后水面缓慢上升。几天后水面最终处于约 (填“40”或“10”)mL刻度处。
(2)小强同学进行如下拓展探究实验:取铁钉用砂纸打磨,称其质量,按图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。小强同学的实验是探究
因素对铁钉锈蚀快慢的影响,结论是 。
温度/°C 10 20 30 40 50
铁钉质量增加/g 0.02 0.04 0.08 0.16 0.18
四、计算题(本题包括1小题,共5分)
26.(5分)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第1次 40 m
第2次 40 14.8
第3次 40 12.2
第4次 40 11.2
第5次 40 11.2
试回答下列问题:
(1)从以上数据可知,表格中,m= 。
(2)计算所用稀硫酸中硫酸的质量分数是多少?
2021-2022学年上学期期末练习题
初四化学参考答案
第I卷(选择题 共20分)
一、选择题(每小题1分,共20分,每小题只有一个选项符合题意)。
1-5CBBBC 6-10BCADB 11-15CDBDA 16-20CBACB
第Ⅱ卷(选择题 共30分)
二、填空与简答题(本题包括3小题,共12分)。
21.(4分)
(1)氢 红 (2)> <
22.(5分)
(1)吸水性
(2)
(3)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止内部的铝进一步被氧化
(4)导电
23.(3分)
(1)氯化钾(2)可能(3)①③
三、实验探究题(本题包括2小题,共13分)。
24.(6分)
(1)量筒内液体凹液面最低处 滤纸破损或液面高于滤纸边缘等
(2)当蒸发皿中出现较多固体时,停止加热 使液体均匀受热,防止液体飞溅
(3)70% bd
25.(7分)
实验一:(1)水和氧气 (2)氯化钠
(3)铁锈疏松多孔,能吸附空气中的氧气和水,会加快铁的锈蚀
实验二:(1)40
(2)温度 温度在10~50℃的范围内,温度越高,铁钉锈蚀的速度越快
四、计算题(本题包括2小题,共5分)。
26.
(1)m= 17.4 ………………………………………………………………1分
(2)计算所用稀硫酸中硫酸的质量分数是多少?
解:40克稀硫酸反应掉的锌的质量为:14.8g﹣12.2g=2.6g………………1分
设40g稀硫酸中硫酸的质量为X
98 65
x 2.6g ………………………………………………………………1分
解得:X=3.92g …………………………………………1分
………………………………………………1分
答:稀硫酸中硫酸的质量分数为9.8% 。
同课章节目录
