第4章认识化学变化测试题-2021-2022学年九年级化学沪教版上册(word版 含答案)
文档属性
| 名称 | 第4章认识化学变化测试题-2021-2022学年九年级化学沪教版上册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 169.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 15:30:13 | ||
图片预览



文档简介
第4章《认识化学变化》测试题
一、单选题
1.硅是重要的半导体材料, (高纯)是工业制硅流程中的一个化学反应方程式,则X为
A.SiCl B.SiCl4 C.SiHCl3 D.SiH2Cl3
2.证据推理是化学学科的核心素养,下列基于事实的推理正确的是
A.元素周期表中的纵列叫做族,因此现行元素周期表有十八个纵列即十八个族
B.氧化物是含有氧元素的化合物,因此含有氧元素的化合物都是氧化物
C.过滤可以净化水,因此过滤后的水可以直接饮用
D.碳(C)燃烧生成二氧化碳,因此甲醇(CH3OH)燃烧也会生成二氧化碳
3.生活处处有化学,安全时刻记心中。下列做法不合理的是
A.夜间发现家中石油液化气泄漏,立即开灯查明泄漏原因
B.在森林大火蔓延线路前砍一条“隔离带”,以控制火势
C.炒菜时,油锅不慎着火迅速用锅盖盖灭
D.高楼发生火灾时,用湿毛巾捂住口鼻在火场的浓烟中爬行逃生
4.煤加工后产生的气体中含有CO、CH4 和 H2.取一定质量的该混合气体,完全燃烧产生 0.5mol 二氧化碳和 1mol 水,则原混合气体中氢元素的物质的量是
A.1.5mol B.2mol C.6mol D.无法确定
5.ClO2是净化饮用水的一种十分有效的净水剂,其制备反应为,X的化学式是
A.Na B.NaClO3
C.NaClO D.NaCl
6.如表为某同学整理的部分化学知识,完全正确的一组是
A.食品保鲜的办法 B.灭火实例与原理
填充氧气—防止变质 放入铁粉—防止氧化和受潮 油锅着火时用锅盖盖灭—隔绝空气 住宅失火时用水灭火—降低着火点
C.日常物质的区别 D.化学中常见的
硬水和软水—加肥皂水并搅拌 铜丝和铁丝—看颜色 三种可燃性气体—H2、CO2、O2 三种可加热仪器—试管、烧杯,蒸发皿
A.A B.B C.C D.D
7.液化石油气的一种主要成分是C2H6,其燃烧的化学方程式为: ,根据质量守恒定律推断出m的数值为
A.2 B.4 C.6 D.7
8.将酒精灯的灯芯拨得松散些,可使火焰更旺,其原理是
A.减少空气中氧气含量 B.减少二氧化碳的生成
C.提高酒精的着火点 D.增大酒精与空气的接触面积
9.下列突发事件处理方法正确的是
A.房间着火,立即开窗通风 B.煤气泄漏,立即开灯查看
C.电器着火,立即用水浇灭 D.档案资料着火,用液态二氧化碳扑灭
10.下列实验不能达到实验目的的是
实验 方法
A 鉴别水和双氧水 二氧化锰粉末
B 鉴别氧气和氮气 燃着的木条
C 除去二氧化碳中的一氧化碳 在空气中点燃
D 硬水和蒸馏水 滴加肥皂水,搅拌,观察产生泡沫的情况
A.A B.B C.C D.D
11.下列各组转化中,不能一步实现的组合是(部分反应条件已省略)
A.H2O2H2OH2
B.CaCO3CO2H2CO3
C.KClO3O2Fe2O3
D.C CO2 CO
12.图像是化学实验分析数据的重要依据,下列图像正确的是
A.高锰酸钾制氧气,试管中固体质量的变化
B.过氧化氢与二氧化锰混合制氧气
C.电解水产生的氧气和氢气的质量
D.两份完全相同的过氧化氢溶液在有无MnO2情况下产生O2
13.四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如下图所示。则有关说法中不正确的是
A.丁一定是化合物
B.乙可能是这个反应的催化剂
C.该反应可以是过氧化氢的分解
D.该反应生成甲、丙的质量比为1∶8
14.宏观辩识和微观探析是化学核心素养之一,根据图像,下列说法不正确的是
A.参加反应的 和的微粒个数比是1:1
B.反应物镁是由镁原子直接构成的
C.反应前后元素的种类未发生改变
D.该反应生成的物质不止一种
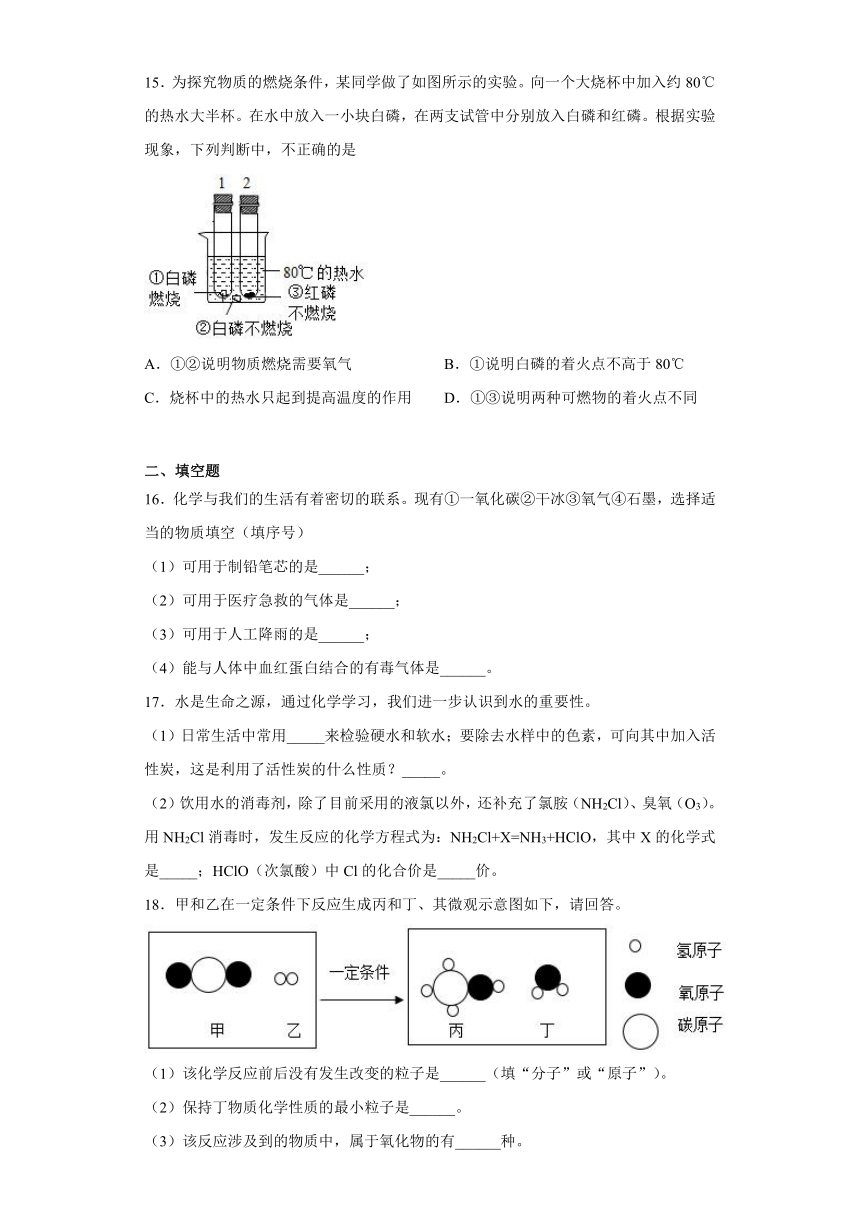
15.为探究物质的燃烧条件,某同学做了如图所示的实验。向一个大烧杯中加入约80℃的热水大半杯。在水中放入一小块白磷,在两支试管中分别放入白磷和红磷。根据实验现象,下列判断中,不正确的是
A.①②说明物质燃烧需要氧气 B.①说明白磷的着火点不高于80℃
C.烧杯中的热水只起到提高温度的作用 D.①③说明两种可燃物的着火点不同
二、填空题
16.化学与我们的生活有着密切的联系。现有①一氧化碳②干冰③氧气④石墨,选择适当的物质填空(填序号)
(1)可用于制铅笔芯的是______;
(2)可用于医疗急救的气体是______;
(3)可用于人工降雨的是______;
(4)能与人体中血红蛋白结合的有毒气体是______。
17.水是生命之源,通过化学学习,我们进一步认识到水的重要性。
(1)日常生活中常用_____来检验硬水和软水;要除去水样中的色素,可向其中加入活性炭,这是利用了活性炭的什么性质?_____。
(2)饮用水的消毒剂,除了目前采用的液氯以外,还补充了氯胺(NH2Cl)、臭氧(O3)。用NH2Cl消毒时,发生反应的化学方程式为:NH2Cl+X=NH3+HClO,其中X的化学式是_____;HClO(次氯酸)中Cl的化合价是_____价。
18.甲和乙在一定条件下反应生成丙和丁、其微观示意图如下,请回答。
(1)该化学反应前后没有发生改变的粒子是______(填“分子”或“原子”)。
(2)保持丁物质化学性质的最小粒子是______。
(3)该反应涉及到的物质中,属于氧化物的有______种。
(4)参加反应的物质甲和乙的分子个数比为______。
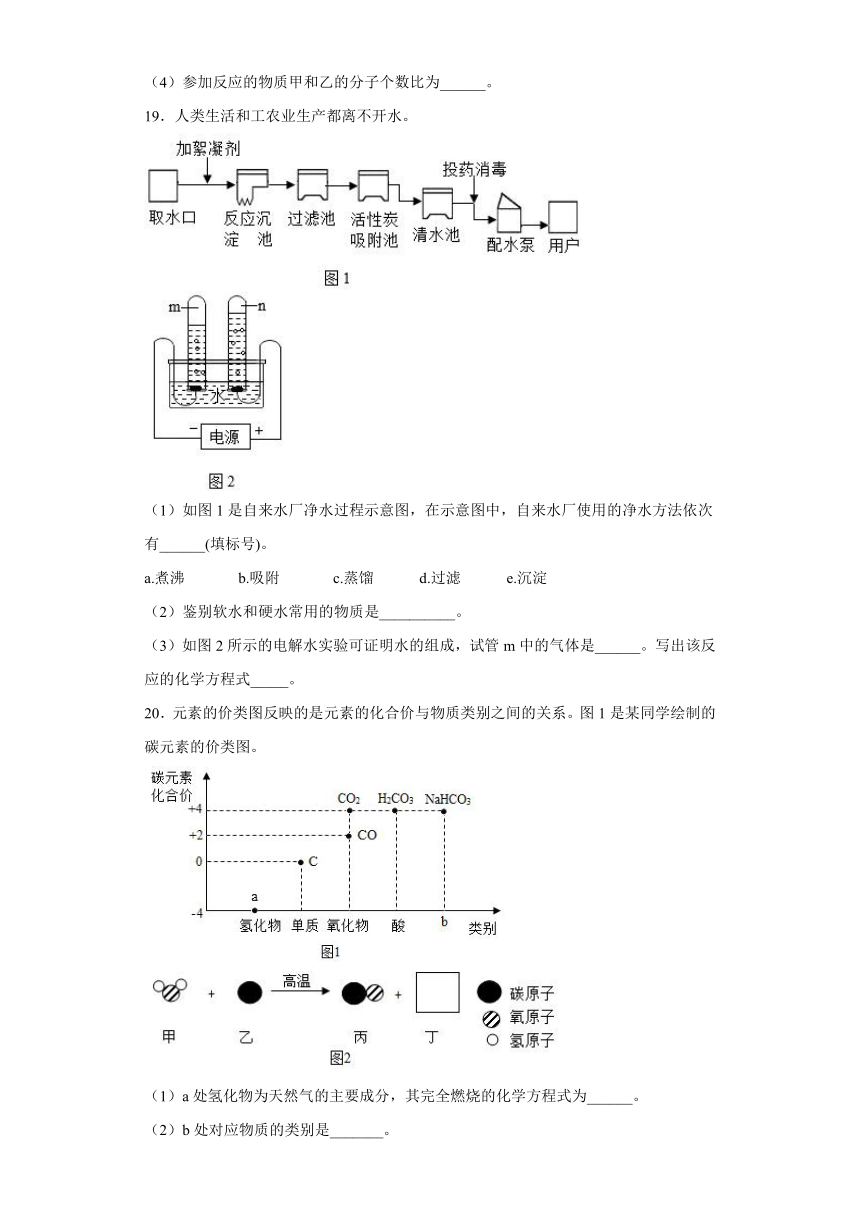
19.人类生活和工农业生产都离不开水。
(1)如图1是自来水厂净水过程示意图,在示意图中,自来水厂使用的净水方法依次有______(填标号)。
a.煮沸 b.吸附 c.蒸馏 d.过滤 e.沉淀
(2)鉴别软水和硬水常用的物质是__________。
(3)如图2所示的电解水实验可证明水的组成,试管m中的气体是______。写出该反应的化学方程式_____。
20.元素的价类图反映的是元素的化合价与物质类别之间的关系。图1是某同学绘制的碳元素的价类图。
(1)a处氢化物为天然气的主要成分,其完全燃烧的化学方程式为______。
(2)b处对应物质的类别是_______。
(3)氧化物中CO有毒而CO2无毒,CO能燃烧而CO2可以灭火,请从微观的角度解释它们化学性质不一样的原因______。
(4)煤的主要成分是单质碳。图2是用煤生产水煤气的反应微观示意图。
①该反应为置换反应,则方框丁中物质的化学式为_______,反应中化合价发生变化的元素为_______。
②反应生成的丙、丁两种物质的质量比为________。
三、推断题
21.甲、乙、丙三种物质分别是过氧化氢,水,氧气中的某一种,其中乙的相对分子质量为18,它们之间的转化关系如图所示(部分物质和反应条件已经省略)。则乙生成丙的化学方程式为______;丙生成乙的化学方程式为______;从微观角度解释甲、乙性质有差异的原因______。
22.A、B、C、D、E是初中化学中常见的不同物质,其中A为黑色固体。其转化关系如图所示。
(1)A的化学式为____________,B的化学式为____________。
(2)若C为难溶于水的固体,分别写一个由E→C、E→D的化学方程式:______、_____。
四、实验题
23.实验是进行科学探究的重要手段,请回答下列问题:
A 电解水实验 B 收集气体
C 测定空气中氧气含量 D 细铁丝在氧气中燃烧
(1)实验 A 发生反应的化学方程式是 ___________,当电源接通一段时间后,a 管与 b 管中气体的体积比约为 ___________。
(2)实验 B 收集气体的方法叫 ___________ 法。
(3)实验 C 通过 ___________,可得出氧气约占空气体积 1 / 5 的结论,若小于 1 / 5,则可能的原因有 ___________(填写其中一种即可)。
(4)实验 D 中水的作用是 ___________,其反应的化学方程式是 ___________。
24.下面是化学第二章第一节,进行“氧气的性质”的探究,请回答:
(1)写出图中仪器的名称 a_________;b___________。
(2)连接仪器组装成如下图所示实验装置。某学生用抽拉法检查该装置的气密性,发现被拉出的注射器活塞一段时间后又回到原来的位置,你认为该装置是否漏气 _________。此处用分液漏斗代替长颈漏斗的优点是________。
(3)实验室用高锰酸钾制取氧气,应选用的发生装置是________(填字母),用化学式表示该反应________。若用 E 装置收集产生的氧气,如何操作才能使收集到的氧气不含氮气________。
(4)若用过氧化氢溶液和二氧化锰制取并收集干燥的氧气,则选用的收集装置是________(填字母);用化学式表示该反应_________若用 F 装置收集产生的氧气,气体应从_________(填“c”或“d”)进入。
(5)用化学式表示装置 G 中铁丝燃烧的反应 ________在实验室做铁丝燃烧实验,失败的原因可能是_________。
(6)实验室用装置 B 制取 CO2,反应用化学表示为_________。用 F排空气法收集二氧化碳集满的方法是________。(写出步骤,现象和结论)
(7)实验室里,常用加热无水醋酸钠和碱石灰固体混合物的方法制备甲烷。选择的发生装置为________(填序号)。用装置 E 收集甲烷,利用了甲烷_______的物理性质;用装置 D 而不用装置 C 收集甲烷,原因是_________。
五、计算题
25.某校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如下:(杂质不与盐酸反应,不溶于水)
实验 1 2 3 4
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
请仔细分析上表后回答:
(1)上表中m的数值是______。
(2)计算这种石灰石中碳酸钙的质量分数______。
(3)第4次加入稀盐酸后所得溶液中钙元素的质量为_____g。
26.将一定量的CO2和CO混合气体先通过足量的澄清石灰水,得到10g白色沉淀;将剩余气体干燥,再通过足量的灼热氧化铜,充分反应后,测得固体的质量减少了3.2g.则原混合气体中氧元素的质量分数为___________。
参考答案
1.C 2.D 3.A 4.B 5.D 6.C 7.A 8.D 9.D 10.C 11.C 12.B 13.C 14.A 15.C
16.(1)④(2)③(3)②(4)①
17.(1) 肥皂水 吸附性
(2) H2O +1
18.(1)原子(2)水分子(3)2(4)1:3
19.(1)edb
(2)肥皂水
(3) 氢气2
20.(1)
(2)盐
(3)分子构成不同
(4) H2 C##碳元素、H 14:1
21.
分子构成不同
22.(1) C CO
(2)
23.(1) 1∶2
(2)排水
(3) 打开止水夹后,进入集气瓶内的水约占集气瓶内空气体积的五分之一 红磷量不足或装置漏气或未冷却至室温就打开止水夹
(4) 防止高温熔融物溅落,炸裂瓶底
24.(1) 酒精灯 水槽
(2) 否 可控制反应的速率
(3) A KMnO4K2MnO4+MnO2+O2 当导管口有连续、均匀气泡冒出时开始收集氧气
(4) C H2O2H2O+O2 c
(5) Fe+O2Fe3O4 氧气不纯或铁丝表面有铁锈
(6) CaCO3+HCl→CaCl2+H2O+CO2 将燃着的木条伸到导管c管口处,木条熄灭,证明已经集满二氧化碳
(7) A 难溶于水 甲烷的密度比空气小
25.(1)4.4
(2)解:设10 g样品中碳酸钙的质量为x
解得:x=8g
样品中碳酸钙的质量分数为×100%=80%
答:样品中碳酸钙的质量分数为80%
(3)设第四次生成氯化钙的质量为y
解得:y=11.1g
所以所得溶液中钙元素的质量为:
26.64%
一、单选题
1.硅是重要的半导体材料, (高纯)是工业制硅流程中的一个化学反应方程式,则X为
A.SiCl B.SiCl4 C.SiHCl3 D.SiH2Cl3
2.证据推理是化学学科的核心素养,下列基于事实的推理正确的是
A.元素周期表中的纵列叫做族,因此现行元素周期表有十八个纵列即十八个族
B.氧化物是含有氧元素的化合物,因此含有氧元素的化合物都是氧化物
C.过滤可以净化水,因此过滤后的水可以直接饮用
D.碳(C)燃烧生成二氧化碳,因此甲醇(CH3OH)燃烧也会生成二氧化碳
3.生活处处有化学,安全时刻记心中。下列做法不合理的是
A.夜间发现家中石油液化气泄漏,立即开灯查明泄漏原因
B.在森林大火蔓延线路前砍一条“隔离带”,以控制火势
C.炒菜时,油锅不慎着火迅速用锅盖盖灭
D.高楼发生火灾时,用湿毛巾捂住口鼻在火场的浓烟中爬行逃生
4.煤加工后产生的气体中含有CO、CH4 和 H2.取一定质量的该混合气体,完全燃烧产生 0.5mol 二氧化碳和 1mol 水,则原混合气体中氢元素的物质的量是
A.1.5mol B.2mol C.6mol D.无法确定
5.ClO2是净化饮用水的一种十分有效的净水剂,其制备反应为,X的化学式是
A.Na B.NaClO3
C.NaClO D.NaCl
6.如表为某同学整理的部分化学知识,完全正确的一组是
A.食品保鲜的办法 B.灭火实例与原理
填充氧气—防止变质 放入铁粉—防止氧化和受潮 油锅着火时用锅盖盖灭—隔绝空气 住宅失火时用水灭火—降低着火点
C.日常物质的区别 D.化学中常见的
硬水和软水—加肥皂水并搅拌 铜丝和铁丝—看颜色 三种可燃性气体—H2、CO2、O2 三种可加热仪器—试管、烧杯,蒸发皿
A.A B.B C.C D.D
7.液化石油气的一种主要成分是C2H6,其燃烧的化学方程式为: ,根据质量守恒定律推断出m的数值为
A.2 B.4 C.6 D.7
8.将酒精灯的灯芯拨得松散些,可使火焰更旺,其原理是
A.减少空气中氧气含量 B.减少二氧化碳的生成
C.提高酒精的着火点 D.增大酒精与空气的接触面积
9.下列突发事件处理方法正确的是
A.房间着火,立即开窗通风 B.煤气泄漏,立即开灯查看
C.电器着火,立即用水浇灭 D.档案资料着火,用液态二氧化碳扑灭
10.下列实验不能达到实验目的的是
实验 方法
A 鉴别水和双氧水 二氧化锰粉末
B 鉴别氧气和氮气 燃着的木条
C 除去二氧化碳中的一氧化碳 在空气中点燃
D 硬水和蒸馏水 滴加肥皂水,搅拌,观察产生泡沫的情况
A.A B.B C.C D.D
11.下列各组转化中,不能一步实现的组合是(部分反应条件已省略)
A.H2O2H2OH2
B.CaCO3CO2H2CO3
C.KClO3O2Fe2O3
D.C CO2 CO
12.图像是化学实验分析数据的重要依据,下列图像正确的是
A.高锰酸钾制氧气,试管中固体质量的变化
B.过氧化氢与二氧化锰混合制氧气
C.电解水产生的氧气和氢气的质量
D.两份完全相同的过氧化氢溶液在有无MnO2情况下产生O2
13.四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如下图所示。则有关说法中不正确的是
A.丁一定是化合物
B.乙可能是这个反应的催化剂
C.该反应可以是过氧化氢的分解
D.该反应生成甲、丙的质量比为1∶8
14.宏观辩识和微观探析是化学核心素养之一,根据图像,下列说法不正确的是
A.参加反应的 和的微粒个数比是1:1
B.反应物镁是由镁原子直接构成的
C.反应前后元素的种类未发生改变
D.该反应生成的物质不止一种
15.为探究物质的燃烧条件,某同学做了如图所示的实验。向一个大烧杯中加入约80℃的热水大半杯。在水中放入一小块白磷,在两支试管中分别放入白磷和红磷。根据实验现象,下列判断中,不正确的是
A.①②说明物质燃烧需要氧气 B.①说明白磷的着火点不高于80℃
C.烧杯中的热水只起到提高温度的作用 D.①③说明两种可燃物的着火点不同
二、填空题
16.化学与我们的生活有着密切的联系。现有①一氧化碳②干冰③氧气④石墨,选择适当的物质填空(填序号)
(1)可用于制铅笔芯的是______;
(2)可用于医疗急救的气体是______;
(3)可用于人工降雨的是______;
(4)能与人体中血红蛋白结合的有毒气体是______。
17.水是生命之源,通过化学学习,我们进一步认识到水的重要性。
(1)日常生活中常用_____来检验硬水和软水;要除去水样中的色素,可向其中加入活性炭,这是利用了活性炭的什么性质?_____。
(2)饮用水的消毒剂,除了目前采用的液氯以外,还补充了氯胺(NH2Cl)、臭氧(O3)。用NH2Cl消毒时,发生反应的化学方程式为:NH2Cl+X=NH3+HClO,其中X的化学式是_____;HClO(次氯酸)中Cl的化合价是_____价。
18.甲和乙在一定条件下反应生成丙和丁、其微观示意图如下,请回答。
(1)该化学反应前后没有发生改变的粒子是______(填“分子”或“原子”)。
(2)保持丁物质化学性质的最小粒子是______。
(3)该反应涉及到的物质中,属于氧化物的有______种。
(4)参加反应的物质甲和乙的分子个数比为______。
19.人类生活和工农业生产都离不开水。
(1)如图1是自来水厂净水过程示意图,在示意图中,自来水厂使用的净水方法依次有______(填标号)。
a.煮沸 b.吸附 c.蒸馏 d.过滤 e.沉淀
(2)鉴别软水和硬水常用的物质是__________。
(3)如图2所示的电解水实验可证明水的组成,试管m中的气体是______。写出该反应的化学方程式_____。
20.元素的价类图反映的是元素的化合价与物质类别之间的关系。图1是某同学绘制的碳元素的价类图。
(1)a处氢化物为天然气的主要成分,其完全燃烧的化学方程式为______。
(2)b处对应物质的类别是_______。
(3)氧化物中CO有毒而CO2无毒,CO能燃烧而CO2可以灭火,请从微观的角度解释它们化学性质不一样的原因______。
(4)煤的主要成分是单质碳。图2是用煤生产水煤气的反应微观示意图。
①该反应为置换反应,则方框丁中物质的化学式为_______,反应中化合价发生变化的元素为_______。
②反应生成的丙、丁两种物质的质量比为________。
三、推断题
21.甲、乙、丙三种物质分别是过氧化氢,水,氧气中的某一种,其中乙的相对分子质量为18,它们之间的转化关系如图所示(部分物质和反应条件已经省略)。则乙生成丙的化学方程式为______;丙生成乙的化学方程式为______;从微观角度解释甲、乙性质有差异的原因______。
22.A、B、C、D、E是初中化学中常见的不同物质,其中A为黑色固体。其转化关系如图所示。
(1)A的化学式为____________,B的化学式为____________。
(2)若C为难溶于水的固体,分别写一个由E→C、E→D的化学方程式:______、_____。
四、实验题
23.实验是进行科学探究的重要手段,请回答下列问题:
A 电解水实验 B 收集气体
C 测定空气中氧气含量 D 细铁丝在氧气中燃烧
(1)实验 A 发生反应的化学方程式是 ___________,当电源接通一段时间后,a 管与 b 管中气体的体积比约为 ___________。
(2)实验 B 收集气体的方法叫 ___________ 法。
(3)实验 C 通过 ___________,可得出氧气约占空气体积 1 / 5 的结论,若小于 1 / 5,则可能的原因有 ___________(填写其中一种即可)。
(4)实验 D 中水的作用是 ___________,其反应的化学方程式是 ___________。
24.下面是化学第二章第一节,进行“氧气的性质”的探究,请回答:
(1)写出图中仪器的名称 a_________;b___________。
(2)连接仪器组装成如下图所示实验装置。某学生用抽拉法检查该装置的气密性,发现被拉出的注射器活塞一段时间后又回到原来的位置,你认为该装置是否漏气 _________。此处用分液漏斗代替长颈漏斗的优点是________。
(3)实验室用高锰酸钾制取氧气,应选用的发生装置是________(填字母),用化学式表示该反应________。若用 E 装置收集产生的氧气,如何操作才能使收集到的氧气不含氮气________。
(4)若用过氧化氢溶液和二氧化锰制取并收集干燥的氧气,则选用的收集装置是________(填字母);用化学式表示该反应_________若用 F 装置收集产生的氧气,气体应从_________(填“c”或“d”)进入。
(5)用化学式表示装置 G 中铁丝燃烧的反应 ________在实验室做铁丝燃烧实验,失败的原因可能是_________。
(6)实验室用装置 B 制取 CO2,反应用化学表示为_________。用 F排空气法收集二氧化碳集满的方法是________。(写出步骤,现象和结论)
(7)实验室里,常用加热无水醋酸钠和碱石灰固体混合物的方法制备甲烷。选择的发生装置为________(填序号)。用装置 E 收集甲烷,利用了甲烷_______的物理性质;用装置 D 而不用装置 C 收集甲烷,原因是_________。
五、计算题
25.某校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如下:(杂质不与盐酸反应,不溶于水)
实验 1 2 3 4
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
请仔细分析上表后回答:
(1)上表中m的数值是______。
(2)计算这种石灰石中碳酸钙的质量分数______。
(3)第4次加入稀盐酸后所得溶液中钙元素的质量为_____g。
26.将一定量的CO2和CO混合气体先通过足量的澄清石灰水,得到10g白色沉淀;将剩余气体干燥,再通过足量的灼热氧化铜,充分反应后,测得固体的质量减少了3.2g.则原混合气体中氧元素的质量分数为___________。
参考答案
1.C 2.D 3.A 4.B 5.D 6.C 7.A 8.D 9.D 10.C 11.C 12.B 13.C 14.A 15.C
16.(1)④(2)③(3)②(4)①
17.(1) 肥皂水 吸附性
(2) H2O +1
18.(1)原子(2)水分子(3)2(4)1:3
19.(1)edb
(2)肥皂水
(3) 氢气2
20.(1)
(2)盐
(3)分子构成不同
(4) H2 C##碳元素、H 14:1
21.
分子构成不同
22.(1) C CO
(2)
23.(1) 1∶2
(2)排水
(3) 打开止水夹后,进入集气瓶内的水约占集气瓶内空气体积的五分之一 红磷量不足或装置漏气或未冷却至室温就打开止水夹
(4) 防止高温熔融物溅落,炸裂瓶底
24.(1) 酒精灯 水槽
(2) 否 可控制反应的速率
(3) A KMnO4K2MnO4+MnO2+O2 当导管口有连续、均匀气泡冒出时开始收集氧气
(4) C H2O2H2O+O2 c
(5) Fe+O2Fe3O4 氧气不纯或铁丝表面有铁锈
(6) CaCO3+HCl→CaCl2+H2O+CO2 将燃着的木条伸到导管c管口处,木条熄灭,证明已经集满二氧化碳
(7) A 难溶于水 甲烷的密度比空气小
25.(1)4.4
(2)解:设10 g样品中碳酸钙的质量为x
解得:x=8g
样品中碳酸钙的质量分数为×100%=80%
答:样品中碳酸钙的质量分数为80%
(3)设第四次生成氯化钙的质量为y
解得:y=11.1g
所以所得溶液中钙元素的质量为:
26.64%
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
