1.5 物质的溶解 同步练习(含解析)
文档属性
| 名称 | 1.5 物质的溶解 同步练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 404.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-01-18 22:10:36 | ||
图片预览



文档简介
1.5 物质的溶解
一、选择题
1.为准确配制80g 10%氧化钠溶液,要求尽量减小计量仪器称量时的误差,该实验用到了下列仪器,其中属于计量仪器的是( )
A.①⑤ B.③④⑤ C.①③④⑤ D.①②③④⑤
2.M是硝酸钾或氯化铵其中的一种,硝酸钾和氯化铵在不同温度()时的溶解度如下表所示:
温度(℃)
硝酸钾溶解度/克 31.6 44 60
氯化铵溶解度/克 67.6 40 41
某科学兴趣小组用物质M进行了如图所示实验。下列说法不正确的是( )
A.物质M是硝酸钾
B.溶液①为不饱和溶液,溶液②和③为饱和溶液
C.溶液②中溶质质量分数为37.5%
D.溶波①②③中,溶质质量分数的关系是②③①
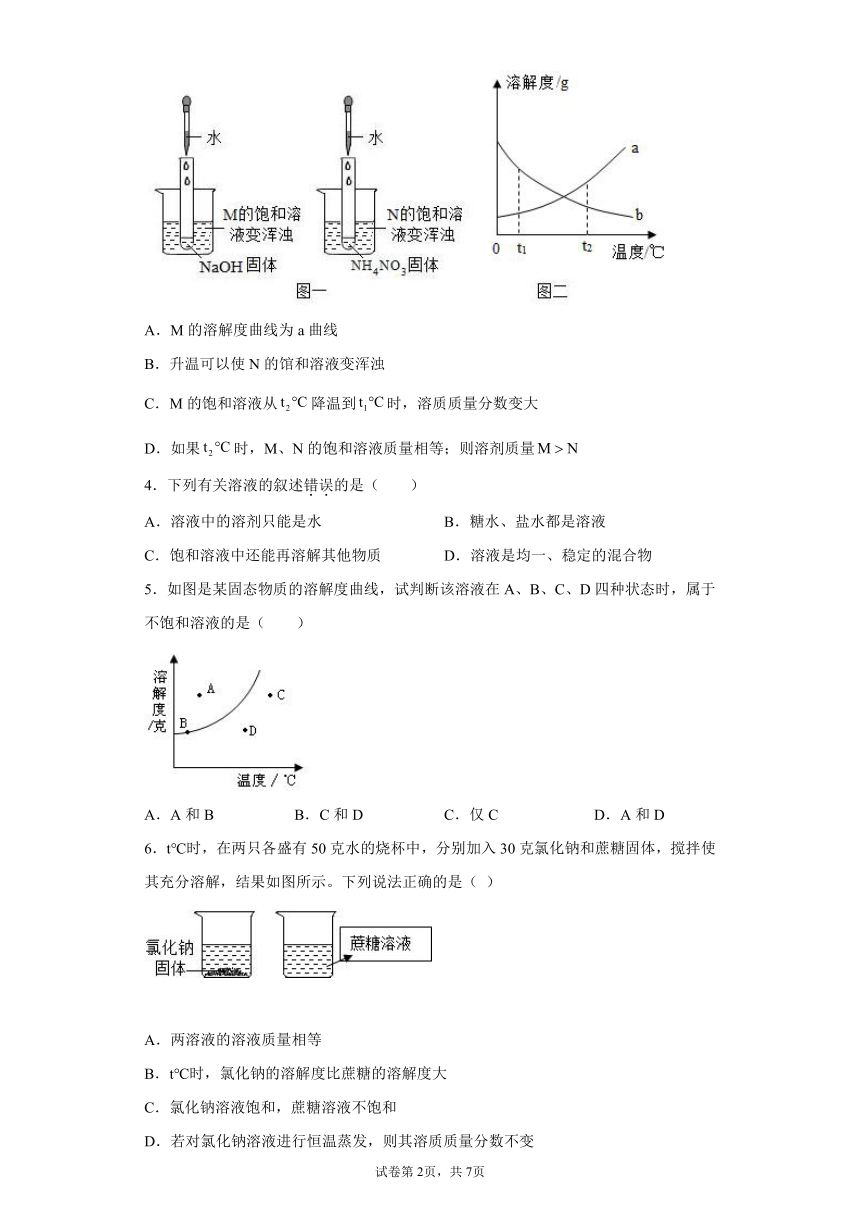
3.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是( )
A.M的溶解度曲线为a曲线
B.升温可以使N的馆和溶液变浑浊
C.M的饱和溶液从降温到时,溶质质量分数变大
D.如果时,M、N的饱和溶液质量相等;则溶剂质量
4.下列有关溶液的叙述错误的是( )
A.溶液中的溶剂只能是水 B.糖水、盐水都是溶液
C.饱和溶液中还能再溶解其他物质 D.溶液是均一、稳定的混合物
5.如图是某固态物质的溶解度曲线,试判断该溶液在A、B、C、D四种状态时,属于不饱和溶液的是( )
A.A和B B.C和D C.仅C D.A和D
6.t℃时,在两只各盛有50克水的烧杯中,分别加入30克氯化钠和蔗糖固体,搅拌使其充分溶解,结果如图所示。下列说法正确的是( )
A.两溶液的溶液质量相等
B.t℃时,氯化钠的溶解度比蔗糖的溶解度大
C.氯化钠溶液饱和,蔗糖溶液不饱和
D.若对氯化钠溶液进行恒温蒸发,则其溶质质量分数不变
7.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶质的质量减少19.1克
8.如图所示,往固体中加入少量液体。能够使气球先膨胀,一段时间后又能恢复到原状的是(固体的体积变化忽略不计)( )
A.硝酸铵固体和水
B.氯化钠固体和水
C.碘和酒精
D.氢氧化钠固体和水
9.在一定温度下向不饱和的食盐溶液中,逐渐加入食盐,下列图象表达有关量变化规律不正确的是( )
A. B.
C. D.
10.下表是氯化钾固体在不同温度时的溶解度,下列说法错误的是( )
温度/℃-0-20-40-60-80
溶解度/克-27.6-34.0-40.0-45.5-51.1
A.氯化钾固体的溶解度随温度的升高而增大
B.80 ℃时,氯化钾固体的溶解度是51.1克
C.60 ℃的氯化钾饱和溶液降温后会有晶体析出
D.20 ℃时,氯化钾饱和溶液的溶质质量分数为34.0%
11.下列关于 a、b 数值的比较中,a 一定小于 b 的是( )
A.不饱和溶液中溶质的质量分数为 a%,饱和溶液中溶质的质量分数为 b%
B.同一饱和溶液中,溶质的质量分数为 a%,溶解度为 b 克
C.某物质的饱和溶液中溶质的质量分数为 a%,向其中加入少量该物质后,溶质的质量分数为 b%
D.某物质的溶解度在低温时为 a 克,高温时为 b 克
12.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温(忽略水分蒸发),下列相关量随时间变化趋势的图象不正确的是
A. B.
C. D.
13.①、②、③、④四个烧杯分别盛有50g水,在20摄氏度时,向四个烧杯中依次加入27g、9g、36g、18g的NaCl,充分溶解后的情况如图所示,则下列叙述不正确的是( )
A.①③溶液的溶质质量分数相等
B.②中所得溶液一定是不饱和溶液
C.④所得溶液的溶质质量分数为36%
D.20摄氏度时,如果①②中的物质混合后刚好达到饱和,则④中溶液一定饱和
二、填空题
14.已知蔗糖的溶解度随温度升高而增大。配制蔗糖饱和溶液,取一定量至烧杯中,并将其放于水槽内,刚好漂浮于水面,如图所示。
(1)在配置时,你判断蔗糖溶液已经饱和的方法是__________。
(2)向水槽中加入一定量的硝酸铵固体,烧杯中蔗糖溶液会发生什么变化 并进行简要解释:________ 。
(3)经上述操作后,烧杯浸入水中的体积V将____________ (填“变大”“变小”或“不变”)
15.如图是硫酸的密度和浓度的对照表,阅读后计算:
(1)欲配制100克溶质质量分数为9.8%的稀硫酸,需要98%浓硫酸多少毫升 __________再加水多少毫升 ____
(2)100毫升90%的硫酸与144.8毫升水混合后所得溶液的密度为多少 ____
16.你见过冬天能自发热,夏天能自制冷的罐装饮料吗?下图是“玛吉克牌”一摇冰功能饮料。
根据所给资料,请仔细回答:
(1)“一摇冰”饮料在炎热的夏天解渴,其罐底的固体是_____。(填固体)
A.氢氧化钠 B.硝酸铵 C.氯化钠
(2)罐身旋钮开关下方有一个特别提示:“……务必倒置摇晃2分钟”,为什么要“倒置摇晃”呢?_____。
(3)我们在喝饮料(含有CO2气体)后,常出现打嗝现象,是因为气体的溶解度随温度的升高而____(填“增大”或“减小”)。
(4)喝完饮料后,取出罐体底部的水溶液,加热蒸发掉2克水,冷却到20℃,有2克晶体析出,此时溶液中溶质的质量分数为64.3%,则20℃时该物质的溶解度为_____克。(计算结果保留整数)
(5)我市已全面推进生活垃圾分类工作,应将罐体放入_____收集容器。
三、探究题
17.小华实验操作考试的题目是:配制一定溶质质量分数的碳酸钠溶液并测定其酸碱度。考试时,小华进行了如下图所示的操作。
(1)请填写标号仪器的名称:a_____________;b_____________。
(2)以上实验的正确操作顺序为:E________A________(用序号字母表示)。
(3)上图所示的操作中,若C中砝码的质量为10 g,游码的读数为3.5 g,则碳酸钠的实际质量为______g。配制溶液的质量分数比实际偏低,其原因可能是:(写出两点)_______________;__________________。
(4)小华在测定所配制溶液的酸碱度时,先将pH试纸用蒸馏水润湿,再进行测定,则测定的溶液pH值_____________(选填“偏大”、“偏小”或“不受影响”)。
(5)用pH试纸测定所配制溶液的pH,正确操作方法为:在白瓷板或玻璃片上放一小片pH试纸,用__________的玻璃棒将被测液滴到试纸上,把试纸显示的颜色与标准________比较,即可得出该溶液的pH。
四、简答题
18.某校实验室从化学试剂商店买回了一些硫酸试剂,该试剂瓶标签上的部分内容如图所示,阅读后请计算:
(1)这瓶浓硫酸的质量是___?
(2)这瓶浓硫酸中溶质的质量有___
(3)若将这100毫升浓硫酸与500克水均匀混合,所得稀硫酸的质量分数是多少?(写出计算过程)
_____________________
(4)欲配制1000克质量分数为19.6%的稀硫酸,需要多少毫升这种浓硫酸和多少克水?(写出计算过程)
____________________
试卷第1页,共3页
试卷第1页,共3页
参考答案
1.A
【详解】
准确配制80g10%的氯化钠溶液,药匙用于取用氯化钠,托盘天平用于称取固体氯化钠、量筒与胶头滴管用于准确量取水、烧杯用于完成溶解操作,其中属于计量仪器的是托盘天平、量筒,故①⑤属于计量仪器。故选A。
2.D
【详解】
A、t1℃时150g水中加入60gM全部溶解,蒸发50g水后,没有固体析出,低于t2℃降温会析出晶体,说明M是硝酸钾,故A正确;
B、t1℃时,硝酸钾的溶解度对于40g,t2℃时,硝酸钾的溶解度是60g,所以溶液①为不饱和溶液,溶液②和③为饱和溶液,故B正确;
C、溶液②中溶质质量分数为×100%=37.5%,故C正确;
D、溶液①②③中,②的溶质质量分数为37.5%,①的溶质质量分数为×100%≈28.6%,③的溶质质量分数要比②小,不一定比①大,故D错误。
故选D。
3.D
【详解】
A、氢氧化钠溶解放热,M饱和溶液变浑浊,说明M温度越高溶解度越小,为b,故A错误;
B、硝酸铵溶解吸热,N的饱和溶液变浑浊,说明N温度越低溶解度越小,为a,升温N溶解度变大,变为不饱和溶液,不会变浑浊,故B错误;
C、M的饱和溶液即为b的饱和溶液,从t2℃降温到t1℃时,溶解度变大,溶质质量不变,溶剂质量不变,溶质质量分数不变,故C错误;
D、如果t2℃时,M、N的饱和溶液质量相等,因为M(b)溶解度小于N(a)溶解度,则溶剂质量M>N,故D正确。
故选D。
4.A
【详解】
A、溶液中的溶剂不一定是水,例如碘酒中溶质是碘,溶剂是酒精,叙述错误,符合题意;
B、糖水、盐水都是均一、稳定的混合物,都是溶液,叙述正确,不符合题意;
C、饱和溶液只能是某种溶质的饱和溶液,而对其他的物质来说,一定是不饱和溶液,饱和溶液中还能再溶解其他物质,叙述正确,不符合题意;
D、溶液是均一、稳定的混合物,叙述正确,不符合题意。
故选A。
5.B
【详解】
由于C和D都在溶解度曲线的下方,代表的都是该物质的不饱和溶液。故选B。
6.D
【详解】
A、因相同温度,相同的溶剂,氯化钠有剩余的溶质,而蔗糖没有剩余的溶质,两烧杯中的溶液质量不相等,故A错误;
B、因相同温度,相同的溶剂,氯化钠有剩余的溶质,而蔗糖没有剩余的溶质,则t℃时,蔗糖的溶解度比氯化钠溶解度大,故B错误;
C、氯化钠溶液中有固体剩余,一定是饱和溶液,但是蔗糖溶液不能确定是否饱和,故C错误;
D、若对氯化钠溶液恒温蒸发,氯化钠溶液会析出晶体,因为温度不变,还是该温度的饱和溶液,故溶质质量分数不变,故D正确。
故选D。
7.D
【详解】
A、10℃时,在100g的水中,加入40g的硝酸钾,形成溶液的质量为120.9g,所以硝酸钾的溶解度为20.9克,故A错误;
B、②中的固体全部溶解,所得溶液不一定就是60℃时硝酸钾的饱和溶液,故B错误;
C、若通过加热将①中剩余硝酸钾全部溶解,溶质质量增大,则溶液的溶质质量分数增大,故C错误;
D、若将②所得溶液降温至10℃,则溶质的质量减少质量=40g-20.9g=19.1g,故D正确。
故选D。
8.D
【分析】
能够使气球先膨胀,一段时间后又恢复到原状说明是因为温度的变化造成的,先由于温度升高气球膨胀,冷却到室温后又恢复到原状。
【详解】
A、硝酸铵固体遇水会吸收热量,不符合题意,故错误。
B、氯化钠固体遇水不吸热也不放热,不符合题意,故错误。
C、碘和酒精混合不吸热也不放热,不符合题意,故错误。
D、氢氧化钠固体遇水放出大量热,符合题意,故正确。
故选D。
9.A
【详解】
A、室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,食盐能继续溶解,至达到饱和状态,不再继续溶解,溶液质量逐渐增加,至完全反应,不再发生改变,故选项图象错误。
B、室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,食盐能继续溶解,至达到饱和状态,不再继续溶解,溶质质量分数逐渐增大,至完全反应,不再发生改变,故选项图象正确。
C、室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,食盐能继续溶解,至达到饱和状态,不再继续溶解,溶剂的质量不变,故选项图象正确。
D、由于温度不变,食盐的溶解度不变,故选项图象正确。
故选A。
10.D
【解析】
解:A、KCl溶解度随温度的升高而增大,正确;
B、80℃时,KCl固体的溶解度是51.1g,正确;
C、KCl溶解度随温度的升高而增大,故60℃的KCl饱和溶液降温后会有晶体析出,正确;
D、20℃时,KCl饱和溶液的溶质质量分数为≈25.3%,错误;
故选D.
【点评】掌握溶质的质量分数、溶解性和溶解度的关系,掌握饱和溶液与不饱和溶液的相互转化的方法.
11.B
【详解】
A、饱和溶液与不饱和溶液的质量分数与温度有关,故错误;
B、同一饱和溶液,当溶解度为b时,溶质的质量分数为: ,故a小于b,故正确;
C、向饱和溶液中加入溶质后,溶质不能溶解,故溶质的质量分数不变,故a等于b,故错误;
D、有些物质的溶解度随温度的升高而升高,有些物质的溶解度随温度的升高而降低,故错误。故选B。
12.B
【详解】
硝酸钾的溶解度随着温度的升高而增大,随着温度的降低而减小,将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出.
A、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,故A正确;
B、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,溶质质量分数逐渐减小,故B错误;
C、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,故C正确;
D、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,应该从零开始,故D正确;故选B。
13.C
【分析】
依据饱和溶液的概念可知,①、③中有固体出现,一定是饱和溶液,④中的溶质质量比②多,而比①的少,可能是恰好溶解,则可能饱和,②一定不饱和溶液。
【详解】
A、①、③溶液都是20摄氏度时的饱和溶液,所以溶液的溶质质量分数一定相等,故正确;
B、②中所得溶液中溶解的溶质最少,一定不饱和溶液,故正确;
C、④所得溶液的溶质质量分数为:×100%≈26.5%,故错误;
D、①②中的物质混合后刚好达到饱和,说明全部溶解,所得溶液的溶质质量分数×100%≈26.5%,④所得溶液的溶质质量分数为26.5%,则④中溶液一定饱和,故正确。
故选C。
14.往蔗糖溶液继续加入蔗糖,蔗糖不溶解说明达到饱和 有蔗糖晶体析出,解释为硝酸铵溶于水吸收热量,溶液的温度降低,蔗糖溶液中蔗糖晶体析出 变小
【分析】
蔗糖的溶解度随温度升高而增大,饱和溶液是不能再溶解溶质的溶液。
【详解】
(1)在配置时,判断蔗糖溶液已经饱和的方法是往蔗糖溶液继续加入蔗糖,蔗糖不溶解说明达到饱和。
(2)硝酸铵溶于水吸收热量,向水槽中加入一定量的硝酸铵固体,烧杯中蔗糖溶液中会有蔗糖晶体析出,解释为硝酸铵溶于水吸收热量,溶液的温度降低,蔗糖溶液中蔗糖晶体析出。
(3)硝酸铵溶于水吸收热量,溶液的温度降低,蔗糖溶液中蔗糖晶体析出,硝酸铵溶液的浓度变小,故经上述操作后,烧杯浸入水中的体积V将变小。
15.5.43毫升; 90毫升 1.40克/厘米3
【详解】
(1)欲配制100克溶质质量分数为9.8%的稀硫酸,需要98%浓硫酸质量为:
100× 9.8%÷98%=10g
10g÷1.84g/cm3=5.43cm3=5.43毫升 100g-10g=90g
90g/1g/cm3=90cm3=90毫升
(2)100毫升90%的硫酸与144.8毫升水混合后所得溶液的溶质质量分数为
100毫升×1.81g/毫升=181g 144.8毫升×1g/毫升=144.8g
181g×90%=162.9g 181g+144.8g=325.8g
162.9g/325.8g×100%=50%,质量分数为:50.0%,所以密度为1.40克/厘米3。
16.B 利用对流,制冷迅速,效果好 减小 180 可回收
【详解】
(1)“一摇冰”饮料在炎热的夏天解渴,其罐底的固体溶于水吸热,温度降低。
A.氢氧化钠溶于水放热,温度升高,不符合题意;
B.硝酸铵溶于水吸热,温度降低,符合题意;
C.氯化钠溶于水吸热放热都不明显,温度不变,不符合题意。
故选B。
(2)罐身旋钮开关下方有一个特别提示:“……务必倒置摇晃2分钟”,要“倒置摇晃”的目的是:利用对流,制冷迅速,效果好。
(3)我们在喝饮料(含有CO2气体)后,常出现打嗝现象,说明排出气体,是因为气体的溶解度随温度的升高而减小。
(4)喝完饮料后,取出罐体底部的水溶液,加热蒸发掉2克水,冷却到20℃,有2克晶体析出,此时溶液饱和,饱和溶液中溶质的质量分数为64.3%,设20℃时该物质的溶解度为xg,,x=180。则20℃时该物质的溶解度为180克。
(5)我市已全面推进生活垃圾分类工作,应将罐体放入可回收收集容器。
17.(1)玻璃棒 药匙 (2)C DB
(3)6.5 仰视读液体体积 天平调平时,游码未归零
(4)偏小 (5)洁净 比色卡
【详解】
(1)a为玻璃棒,b为钥匙;
(2)配置溶液,按照,计算-称量-加水-溶解-装瓶的顺序
(3)左码右物放置的时候,实际质量为砝码的质量减去游码的质量。故为10-3.5=6.5
(4)用PH试纸时。在白瓷板或玻璃片上放一小片pH试纸,用洁净的玻璃棒将被测液滴到试纸上,与标准比色卡进行对比。
18.920 克 901.6 克 15.8% 800g
【解析】
【详解】
(1)500mL=500cm3,这瓶浓硫酸的质量是500cm3×1.84g/cm3=920g;故填:920g;
(2)这瓶浓硫酸中溶质的质量是:920g×98%=901.6g;故填:901.6g;
(3)将这100毫升浓硫酸与500克水均匀混合,所得稀硫酸的质量分数是:
×100%≈15.8%;故填:15.8%;
(4)设需要98%的浓硫酸的体积为v,则:
1000g×19.6%=v×1.84g/mL×98%
v=108.7mL;
需要水的质量为:1000g-108.7mL×1.84g/mL≈800g
答:配制1000克质量分数为19.6%的稀硫酸,需要108.7毫升这种浓硫酸和800克水。答案第1页,共2页
答案第1页,共2页
一、选择题
1.为准确配制80g 10%氧化钠溶液,要求尽量减小计量仪器称量时的误差,该实验用到了下列仪器,其中属于计量仪器的是( )
A.①⑤ B.③④⑤ C.①③④⑤ D.①②③④⑤
2.M是硝酸钾或氯化铵其中的一种,硝酸钾和氯化铵在不同温度()时的溶解度如下表所示:
温度(℃)
硝酸钾溶解度/克 31.6 44 60
氯化铵溶解度/克 67.6 40 41
某科学兴趣小组用物质M进行了如图所示实验。下列说法不正确的是( )
A.物质M是硝酸钾
B.溶液①为不饱和溶液,溶液②和③为饱和溶液
C.溶液②中溶质质量分数为37.5%
D.溶波①②③中,溶质质量分数的关系是②③①
3.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是( )
A.M的溶解度曲线为a曲线
B.升温可以使N的馆和溶液变浑浊
C.M的饱和溶液从降温到时,溶质质量分数变大
D.如果时,M、N的饱和溶液质量相等;则溶剂质量
4.下列有关溶液的叙述错误的是( )
A.溶液中的溶剂只能是水 B.糖水、盐水都是溶液
C.饱和溶液中还能再溶解其他物质 D.溶液是均一、稳定的混合物
5.如图是某固态物质的溶解度曲线,试判断该溶液在A、B、C、D四种状态时,属于不饱和溶液的是( )
A.A和B B.C和D C.仅C D.A和D
6.t℃时,在两只各盛有50克水的烧杯中,分别加入30克氯化钠和蔗糖固体,搅拌使其充分溶解,结果如图所示。下列说法正确的是( )
A.两溶液的溶液质量相等
B.t℃时,氯化钠的溶解度比蔗糖的溶解度大
C.氯化钠溶液饱和,蔗糖溶液不饱和
D.若对氯化钠溶液进行恒温蒸发,则其溶质质量分数不变
7.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶质的质量减少19.1克
8.如图所示,往固体中加入少量液体。能够使气球先膨胀,一段时间后又能恢复到原状的是(固体的体积变化忽略不计)( )
A.硝酸铵固体和水
B.氯化钠固体和水
C.碘和酒精
D.氢氧化钠固体和水
9.在一定温度下向不饱和的食盐溶液中,逐渐加入食盐,下列图象表达有关量变化规律不正确的是( )
A. B.
C. D.
10.下表是氯化钾固体在不同温度时的溶解度,下列说法错误的是( )
温度/℃-0-20-40-60-80
溶解度/克-27.6-34.0-40.0-45.5-51.1
A.氯化钾固体的溶解度随温度的升高而增大
B.80 ℃时,氯化钾固体的溶解度是51.1克
C.60 ℃的氯化钾饱和溶液降温后会有晶体析出
D.20 ℃时,氯化钾饱和溶液的溶质质量分数为34.0%
11.下列关于 a、b 数值的比较中,a 一定小于 b 的是( )
A.不饱和溶液中溶质的质量分数为 a%,饱和溶液中溶质的质量分数为 b%
B.同一饱和溶液中,溶质的质量分数为 a%,溶解度为 b 克
C.某物质的饱和溶液中溶质的质量分数为 a%,向其中加入少量该物质后,溶质的质量分数为 b%
D.某物质的溶解度在低温时为 a 克,高温时为 b 克
12.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温(忽略水分蒸发),下列相关量随时间变化趋势的图象不正确的是
A. B.
C. D.
13.①、②、③、④四个烧杯分别盛有50g水,在20摄氏度时,向四个烧杯中依次加入27g、9g、36g、18g的NaCl,充分溶解后的情况如图所示,则下列叙述不正确的是( )
A.①③溶液的溶质质量分数相等
B.②中所得溶液一定是不饱和溶液
C.④所得溶液的溶质质量分数为36%
D.20摄氏度时,如果①②中的物质混合后刚好达到饱和,则④中溶液一定饱和
二、填空题
14.已知蔗糖的溶解度随温度升高而增大。配制蔗糖饱和溶液,取一定量至烧杯中,并将其放于水槽内,刚好漂浮于水面,如图所示。
(1)在配置时,你判断蔗糖溶液已经饱和的方法是__________。
(2)向水槽中加入一定量的硝酸铵固体,烧杯中蔗糖溶液会发生什么变化 并进行简要解释:________ 。
(3)经上述操作后,烧杯浸入水中的体积V将____________ (填“变大”“变小”或“不变”)
15.如图是硫酸的密度和浓度的对照表,阅读后计算:
(1)欲配制100克溶质质量分数为9.8%的稀硫酸,需要98%浓硫酸多少毫升 __________再加水多少毫升 ____
(2)100毫升90%的硫酸与144.8毫升水混合后所得溶液的密度为多少 ____
16.你见过冬天能自发热,夏天能自制冷的罐装饮料吗?下图是“玛吉克牌”一摇冰功能饮料。
根据所给资料,请仔细回答:
(1)“一摇冰”饮料在炎热的夏天解渴,其罐底的固体是_____。(填固体)
A.氢氧化钠 B.硝酸铵 C.氯化钠
(2)罐身旋钮开关下方有一个特别提示:“……务必倒置摇晃2分钟”,为什么要“倒置摇晃”呢?_____。
(3)我们在喝饮料(含有CO2气体)后,常出现打嗝现象,是因为气体的溶解度随温度的升高而____(填“增大”或“减小”)。
(4)喝完饮料后,取出罐体底部的水溶液,加热蒸发掉2克水,冷却到20℃,有2克晶体析出,此时溶液中溶质的质量分数为64.3%,则20℃时该物质的溶解度为_____克。(计算结果保留整数)
(5)我市已全面推进生活垃圾分类工作,应将罐体放入_____收集容器。
三、探究题
17.小华实验操作考试的题目是:配制一定溶质质量分数的碳酸钠溶液并测定其酸碱度。考试时,小华进行了如下图所示的操作。
(1)请填写标号仪器的名称:a_____________;b_____________。
(2)以上实验的正确操作顺序为:E________A________(用序号字母表示)。
(3)上图所示的操作中,若C中砝码的质量为10 g,游码的读数为3.5 g,则碳酸钠的实际质量为______g。配制溶液的质量分数比实际偏低,其原因可能是:(写出两点)_______________;__________________。
(4)小华在测定所配制溶液的酸碱度时,先将pH试纸用蒸馏水润湿,再进行测定,则测定的溶液pH值_____________(选填“偏大”、“偏小”或“不受影响”)。
(5)用pH试纸测定所配制溶液的pH,正确操作方法为:在白瓷板或玻璃片上放一小片pH试纸,用__________的玻璃棒将被测液滴到试纸上,把试纸显示的颜色与标准________比较,即可得出该溶液的pH。
四、简答题
18.某校实验室从化学试剂商店买回了一些硫酸试剂,该试剂瓶标签上的部分内容如图所示,阅读后请计算:
(1)这瓶浓硫酸的质量是___?
(2)这瓶浓硫酸中溶质的质量有___
(3)若将这100毫升浓硫酸与500克水均匀混合,所得稀硫酸的质量分数是多少?(写出计算过程)
_____________________
(4)欲配制1000克质量分数为19.6%的稀硫酸,需要多少毫升这种浓硫酸和多少克水?(写出计算过程)
____________________
试卷第1页,共3页
试卷第1页,共3页
参考答案
1.A
【详解】
准确配制80g10%的氯化钠溶液,药匙用于取用氯化钠,托盘天平用于称取固体氯化钠、量筒与胶头滴管用于准确量取水、烧杯用于完成溶解操作,其中属于计量仪器的是托盘天平、量筒,故①⑤属于计量仪器。故选A。
2.D
【详解】
A、t1℃时150g水中加入60gM全部溶解,蒸发50g水后,没有固体析出,低于t2℃降温会析出晶体,说明M是硝酸钾,故A正确;
B、t1℃时,硝酸钾的溶解度对于40g,t2℃时,硝酸钾的溶解度是60g,所以溶液①为不饱和溶液,溶液②和③为饱和溶液,故B正确;
C、溶液②中溶质质量分数为×100%=37.5%,故C正确;
D、溶液①②③中,②的溶质质量分数为37.5%,①的溶质质量分数为×100%≈28.6%,③的溶质质量分数要比②小,不一定比①大,故D错误。
故选D。
3.D
【详解】
A、氢氧化钠溶解放热,M饱和溶液变浑浊,说明M温度越高溶解度越小,为b,故A错误;
B、硝酸铵溶解吸热,N的饱和溶液变浑浊,说明N温度越低溶解度越小,为a,升温N溶解度变大,变为不饱和溶液,不会变浑浊,故B错误;
C、M的饱和溶液即为b的饱和溶液,从t2℃降温到t1℃时,溶解度变大,溶质质量不变,溶剂质量不变,溶质质量分数不变,故C错误;
D、如果t2℃时,M、N的饱和溶液质量相等,因为M(b)溶解度小于N(a)溶解度,则溶剂质量M>N,故D正确。
故选D。
4.A
【详解】
A、溶液中的溶剂不一定是水,例如碘酒中溶质是碘,溶剂是酒精,叙述错误,符合题意;
B、糖水、盐水都是均一、稳定的混合物,都是溶液,叙述正确,不符合题意;
C、饱和溶液只能是某种溶质的饱和溶液,而对其他的物质来说,一定是不饱和溶液,饱和溶液中还能再溶解其他物质,叙述正确,不符合题意;
D、溶液是均一、稳定的混合物,叙述正确,不符合题意。
故选A。
5.B
【详解】
由于C和D都在溶解度曲线的下方,代表的都是该物质的不饱和溶液。故选B。
6.D
【详解】
A、因相同温度,相同的溶剂,氯化钠有剩余的溶质,而蔗糖没有剩余的溶质,两烧杯中的溶液质量不相等,故A错误;
B、因相同温度,相同的溶剂,氯化钠有剩余的溶质,而蔗糖没有剩余的溶质,则t℃时,蔗糖的溶解度比氯化钠溶解度大,故B错误;
C、氯化钠溶液中有固体剩余,一定是饱和溶液,但是蔗糖溶液不能确定是否饱和,故C错误;
D、若对氯化钠溶液恒温蒸发,氯化钠溶液会析出晶体,因为温度不变,还是该温度的饱和溶液,故溶质质量分数不变,故D正确。
故选D。
7.D
【详解】
A、10℃时,在100g的水中,加入40g的硝酸钾,形成溶液的质量为120.9g,所以硝酸钾的溶解度为20.9克,故A错误;
B、②中的固体全部溶解,所得溶液不一定就是60℃时硝酸钾的饱和溶液,故B错误;
C、若通过加热将①中剩余硝酸钾全部溶解,溶质质量增大,则溶液的溶质质量分数增大,故C错误;
D、若将②所得溶液降温至10℃,则溶质的质量减少质量=40g-20.9g=19.1g,故D正确。
故选D。
8.D
【分析】
能够使气球先膨胀,一段时间后又恢复到原状说明是因为温度的变化造成的,先由于温度升高气球膨胀,冷却到室温后又恢复到原状。
【详解】
A、硝酸铵固体遇水会吸收热量,不符合题意,故错误。
B、氯化钠固体遇水不吸热也不放热,不符合题意,故错误。
C、碘和酒精混合不吸热也不放热,不符合题意,故错误。
D、氢氧化钠固体遇水放出大量热,符合题意,故正确。
故选D。
9.A
【详解】
A、室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,食盐能继续溶解,至达到饱和状态,不再继续溶解,溶液质量逐渐增加,至完全反应,不再发生改变,故选项图象错误。
B、室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,食盐能继续溶解,至达到饱和状态,不再继续溶解,溶质质量分数逐渐增大,至完全反应,不再发生改变,故选项图象正确。
C、室温下,向一杯不饱和的食盐溶液中逐渐加入食盐,食盐能继续溶解,至达到饱和状态,不再继续溶解,溶剂的质量不变,故选项图象正确。
D、由于温度不变,食盐的溶解度不变,故选项图象正确。
故选A。
10.D
【解析】
解:A、KCl溶解度随温度的升高而增大,正确;
B、80℃时,KCl固体的溶解度是51.1g,正确;
C、KCl溶解度随温度的升高而增大,故60℃的KCl饱和溶液降温后会有晶体析出,正确;
D、20℃时,KCl饱和溶液的溶质质量分数为≈25.3%,错误;
故选D.
【点评】掌握溶质的质量分数、溶解性和溶解度的关系,掌握饱和溶液与不饱和溶液的相互转化的方法.
11.B
【详解】
A、饱和溶液与不饱和溶液的质量分数与温度有关,故错误;
B、同一饱和溶液,当溶解度为b时,溶质的质量分数为: ,故a小于b,故正确;
C、向饱和溶液中加入溶质后,溶质不能溶解,故溶质的质量分数不变,故a等于b,故错误;
D、有些物质的溶解度随温度的升高而升高,有些物质的溶解度随温度的升高而降低,故错误。故选B。
12.B
【详解】
硝酸钾的溶解度随着温度的升高而增大,随着温度的降低而减小,将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出.
A、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,故A正确;
B、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,溶质质量分数逐渐减小,故B错误;
C、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,故C正确;
D、将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,应该从零开始,故D正确;故选B。
13.C
【分析】
依据饱和溶液的概念可知,①、③中有固体出现,一定是饱和溶液,④中的溶质质量比②多,而比①的少,可能是恰好溶解,则可能饱和,②一定不饱和溶液。
【详解】
A、①、③溶液都是20摄氏度时的饱和溶液,所以溶液的溶质质量分数一定相等,故正确;
B、②中所得溶液中溶解的溶质最少,一定不饱和溶液,故正确;
C、④所得溶液的溶质质量分数为:×100%≈26.5%,故错误;
D、①②中的物质混合后刚好达到饱和,说明全部溶解,所得溶液的溶质质量分数×100%≈26.5%,④所得溶液的溶质质量分数为26.5%,则④中溶液一定饱和,故正确。
故选C。
14.往蔗糖溶液继续加入蔗糖,蔗糖不溶解说明达到饱和 有蔗糖晶体析出,解释为硝酸铵溶于水吸收热量,溶液的温度降低,蔗糖溶液中蔗糖晶体析出 变小
【分析】
蔗糖的溶解度随温度升高而增大,饱和溶液是不能再溶解溶质的溶液。
【详解】
(1)在配置时,判断蔗糖溶液已经饱和的方法是往蔗糖溶液继续加入蔗糖,蔗糖不溶解说明达到饱和。
(2)硝酸铵溶于水吸收热量,向水槽中加入一定量的硝酸铵固体,烧杯中蔗糖溶液中会有蔗糖晶体析出,解释为硝酸铵溶于水吸收热量,溶液的温度降低,蔗糖溶液中蔗糖晶体析出。
(3)硝酸铵溶于水吸收热量,溶液的温度降低,蔗糖溶液中蔗糖晶体析出,硝酸铵溶液的浓度变小,故经上述操作后,烧杯浸入水中的体积V将变小。
15.5.43毫升; 90毫升 1.40克/厘米3
【详解】
(1)欲配制100克溶质质量分数为9.8%的稀硫酸,需要98%浓硫酸质量为:
100× 9.8%÷98%=10g
10g÷1.84g/cm3=5.43cm3=5.43毫升 100g-10g=90g
90g/1g/cm3=90cm3=90毫升
(2)100毫升90%的硫酸与144.8毫升水混合后所得溶液的溶质质量分数为
100毫升×1.81g/毫升=181g 144.8毫升×1g/毫升=144.8g
181g×90%=162.9g 181g+144.8g=325.8g
162.9g/325.8g×100%=50%,质量分数为:50.0%,所以密度为1.40克/厘米3。
16.B 利用对流,制冷迅速,效果好 减小 180 可回收
【详解】
(1)“一摇冰”饮料在炎热的夏天解渴,其罐底的固体溶于水吸热,温度降低。
A.氢氧化钠溶于水放热,温度升高,不符合题意;
B.硝酸铵溶于水吸热,温度降低,符合题意;
C.氯化钠溶于水吸热放热都不明显,温度不变,不符合题意。
故选B。
(2)罐身旋钮开关下方有一个特别提示:“……务必倒置摇晃2分钟”,要“倒置摇晃”的目的是:利用对流,制冷迅速,效果好。
(3)我们在喝饮料(含有CO2气体)后,常出现打嗝现象,说明排出气体,是因为气体的溶解度随温度的升高而减小。
(4)喝完饮料后,取出罐体底部的水溶液,加热蒸发掉2克水,冷却到20℃,有2克晶体析出,此时溶液饱和,饱和溶液中溶质的质量分数为64.3%,设20℃时该物质的溶解度为xg,,x=180。则20℃时该物质的溶解度为180克。
(5)我市已全面推进生活垃圾分类工作,应将罐体放入可回收收集容器。
17.(1)玻璃棒 药匙 (2)C DB
(3)6.5 仰视读液体体积 天平调平时,游码未归零
(4)偏小 (5)洁净 比色卡
【详解】
(1)a为玻璃棒,b为钥匙;
(2)配置溶液,按照,计算-称量-加水-溶解-装瓶的顺序
(3)左码右物放置的时候,实际质量为砝码的质量减去游码的质量。故为10-3.5=6.5
(4)用PH试纸时。在白瓷板或玻璃片上放一小片pH试纸,用洁净的玻璃棒将被测液滴到试纸上,与标准比色卡进行对比。
18.920 克 901.6 克 15.8% 800g
【解析】
【详解】
(1)500mL=500cm3,这瓶浓硫酸的质量是500cm3×1.84g/cm3=920g;故填:920g;
(2)这瓶浓硫酸中溶质的质量是:920g×98%=901.6g;故填:901.6g;
(3)将这100毫升浓硫酸与500克水均匀混合,所得稀硫酸的质量分数是:
×100%≈15.8%;故填:15.8%;
(4)设需要98%的浓硫酸的体积为v,则:
1000g×19.6%=v×1.84g/mL×98%
v=108.7mL;
需要水的质量为:1000g-108.7mL×1.84g/mL≈800g
答:配制1000克质量分数为19.6%的稀硫酸,需要108.7毫升这种浓硫酸和800克水。答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
