2021-2022学年高一上学期化学鲁科版(2019)必修第一册3.2.4基于二氧化硫和硫酸的性质设计酸雨治理方案课件(18张ppt))
文档属性
| 名称 | 2021-2022学年高一上学期化学鲁科版(2019)必修第一册3.2.4基于二氧化硫和硫酸的性质设计酸雨治理方案课件(18张ppt)) |  | |
| 格式 | zip | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 08:40:08 | ||
图片预览





文档简介
(共18张PPT)
3.2.3 基于二氧化硫及硫酸的性质
设计酸雨的治理方案
一、认识酸雨
正常雨水pH约为5.6(CO2+H20 H2CO3)溶解了硫酸或硝酸的雨水,pH<5.6,称为酸雨
(分为硫酸型、硝酸型和混合型)
思考:
排放到大气中的SO2是如何转化成H2SO4的?请预测转化路径,并说明依据。
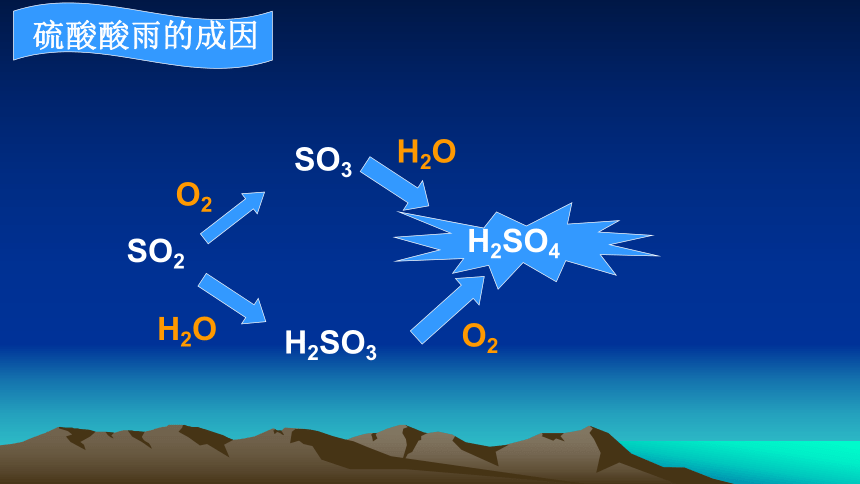
硫酸酸雨的成因
SO2
SO3
H2SO4
H2SO3
O2
O2
H2O
H2O
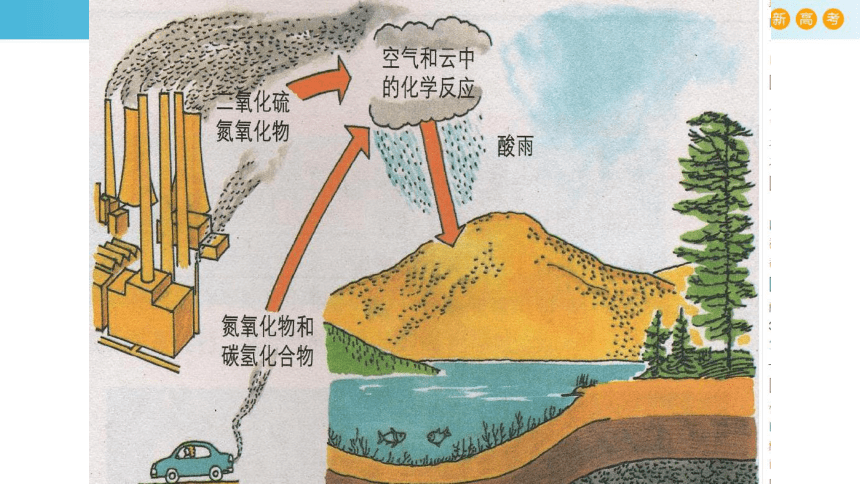
1.煤、石油中含有硫元素,故煤和石油燃烧会产生二氧化硫物质。
2.排放到空气中的二氧化硫在氧气和水蒸气的共同作用下形成酸雾,随雨水降落就成酸雨。
3.涉及的主要化学方程式
SO2+H2O H2SO3 2H2SO3+O2=2H2SO4
2SO2+O2 2SO3 SO3+H2O=H2SO4
二、酸雨危害?
酸雨侵蚀森林→大面积死亡 腐蚀建筑→建筑变得面目全非
土壤酸化 “镉米危机”
使湖泊的水变质→水生生物死亡
酸化的土壤变得板结、贫瘠
PH=3.4
“治” 理
预“防”
酸雨防治
改变能源结构,开发利用清洁能源(氢能、风能、太阳能、地热能等)
煤改电
完善法律、法规,控制电力、冶金和化工建材等行业二氧化硫排放量
1.对含硫原料煤炭中加进行脱硫处理
如向入煤炭中加入生石灰
2SO2 + 2CaO+O2=2CaSO4
2.用浓氢氧化钠吸收工业废气中的SO2
SO2+2NaOH=Na2SO3+H2O
3.向酸化的土壤中加入熟石灰
H2SO4+Ca(OH)2=CaSO4+2H2O
一、关于酸雨
正常雨水因为溶解了二氧化碳,pH约为5.6;
溶解了硫酸或硝酸的雨水,pH<5.6,称为酸雨
分为硫酸型、硝酸型和混合型
二、酸雨防治
“防”
“治”
2SO2 + 2CaO+O2=2CaSO4
H2SO4+Ca(OH)2=CaSO4+2H2O
SO2少量(NaOH足量): SO2+2NaOH=Na2SO3+H2O
SO2足量: SO2+NaOH=NaHSO3
2CaCO3+2SO2+O2=2CaSO4+2CO2
教材 P104
CaCO3+SO2=CaSO3+CO2
2CaSO3+O2=2CaSO4
2CaCO3+2SO2+O2=2CaSO4+2CO2
补充材料
方法二:氨水脱硫法
该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为
2NH3+SO2+H2O===(NH4)2SO3
2(NH4)2SO3+O2===2(NH4)2SO4
(或生成NH4HSO3,然后进一步氧化)
方法三:钠、碱脱硫法
钠、碱脱硫法是用NaOH/Na2CO3吸收烟气中的SO2,得到 Na2SO3和NaHSO3,发生反应的化学方程式为
2NaOH+SO2===Na2SO3+H2O
Na2CO3+SO2===Na2SO3+CO2
Na2SO3+SO2+H2O===2NaHSO3。
方法四:双碱脱硫法
先利用烧碱吸收SO2,再利用熟石灰浆液进行再生,再生后的NaOH碱液可循环使用,化学反应原理为
①吸收反应:2NaOH+SO2===Na2SO3+H2O
2Na2SO3+O2===2Na2SO4。
②再生反应:Na2SO3+Ca(OH)2===CaSO3↓+2NaOH
Na2SO4+Ca(OH)2===CaSO4↓+2NaOH
返回
3.2.3 基于二氧化硫及硫酸的性质
设计酸雨的治理方案
一、认识酸雨
正常雨水pH约为5.6(CO2+H20 H2CO3)溶解了硫酸或硝酸的雨水,pH<5.6,称为酸雨
(分为硫酸型、硝酸型和混合型)
思考:
排放到大气中的SO2是如何转化成H2SO4的?请预测转化路径,并说明依据。
硫酸酸雨的成因
SO2
SO3
H2SO4
H2SO3
O2
O2
H2O
H2O
1.煤、石油中含有硫元素,故煤和石油燃烧会产生二氧化硫物质。
2.排放到空气中的二氧化硫在氧气和水蒸气的共同作用下形成酸雾,随雨水降落就成酸雨。
3.涉及的主要化学方程式
SO2+H2O H2SO3 2H2SO3+O2=2H2SO4
2SO2+O2 2SO3 SO3+H2O=H2SO4
二、酸雨危害?
酸雨侵蚀森林→大面积死亡 腐蚀建筑→建筑变得面目全非
土壤酸化 “镉米危机”
使湖泊的水变质→水生生物死亡
酸化的土壤变得板结、贫瘠
PH=3.4
“治” 理
预“防”
酸雨防治
改变能源结构,开发利用清洁能源(氢能、风能、太阳能、地热能等)
煤改电
完善法律、法规,控制电力、冶金和化工建材等行业二氧化硫排放量
1.对含硫原料煤炭中加进行脱硫处理
如向入煤炭中加入生石灰
2SO2 + 2CaO+O2=2CaSO4
2.用浓氢氧化钠吸收工业废气中的SO2
SO2+2NaOH=Na2SO3+H2O
3.向酸化的土壤中加入熟石灰
H2SO4+Ca(OH)2=CaSO4+2H2O
一、关于酸雨
正常雨水因为溶解了二氧化碳,pH约为5.6;
溶解了硫酸或硝酸的雨水,pH<5.6,称为酸雨
分为硫酸型、硝酸型和混合型
二、酸雨防治
“防”
“治”
2SO2 + 2CaO+O2=2CaSO4
H2SO4+Ca(OH)2=CaSO4+2H2O
SO2少量(NaOH足量): SO2+2NaOH=Na2SO3+H2O
SO2足量: SO2+NaOH=NaHSO3
2CaCO3+2SO2+O2=2CaSO4+2CO2
教材 P104
CaCO3+SO2=CaSO3+CO2
2CaSO3+O2=2CaSO4
2CaCO3+2SO2+O2=2CaSO4+2CO2
补充材料
方法二:氨水脱硫法
该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为
2NH3+SO2+H2O===(NH4)2SO3
2(NH4)2SO3+O2===2(NH4)2SO4
(或生成NH4HSO3,然后进一步氧化)
方法三:钠、碱脱硫法
钠、碱脱硫法是用NaOH/Na2CO3吸收烟气中的SO2,得到 Na2SO3和NaHSO3,发生反应的化学方程式为
2NaOH+SO2===Na2SO3+H2O
Na2CO3+SO2===Na2SO3+CO2
Na2SO3+SO2+H2O===2NaHSO3。
方法四:双碱脱硫法
先利用烧碱吸收SO2,再利用熟石灰浆液进行再生,再生后的NaOH碱液可循环使用,化学反应原理为
①吸收反应:2NaOH+SO2===Na2SO3+H2O
2Na2SO3+O2===2Na2SO4。
②再生反应:Na2SO3+Ca(OH)2===CaSO3↓+2NaOH
Na2SO4+Ca(OH)2===CaSO4↓+2NaOH
返回
