鲁教版九年级化学上册 2.3 原子的构成(2) 课件(20张PPT)
文档属性
| 名称 | 鲁教版九年级化学上册 2.3 原子的构成(2) 课件(20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 16:19:06 | ||
图片预览







文档简介
(共20张PPT)
第三节 原子的构成
第三节 原子的构成
道尔顿理论——原子不可分的实心球体
一.原子的结构
汤姆森发现电子,原子可分
1.原子结构发展史
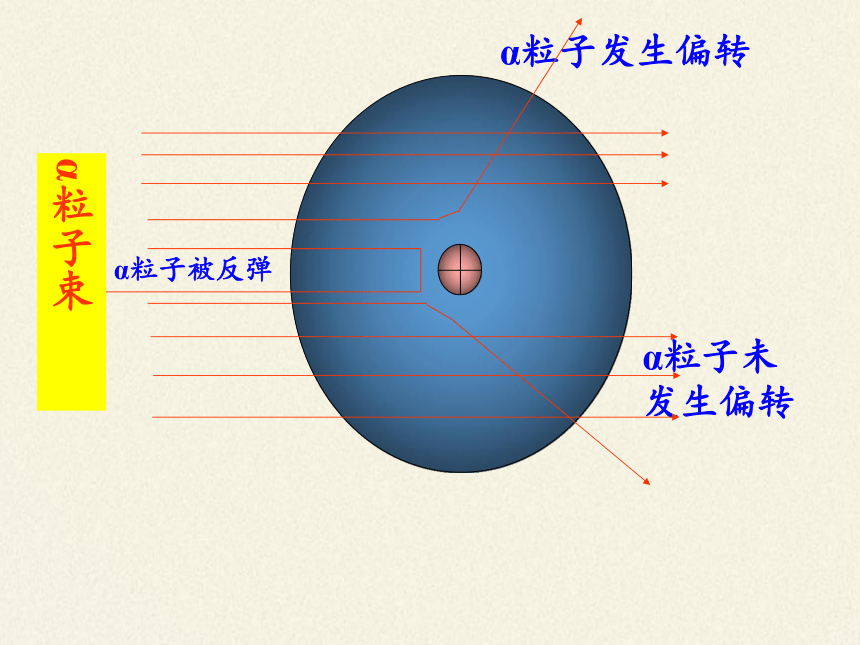
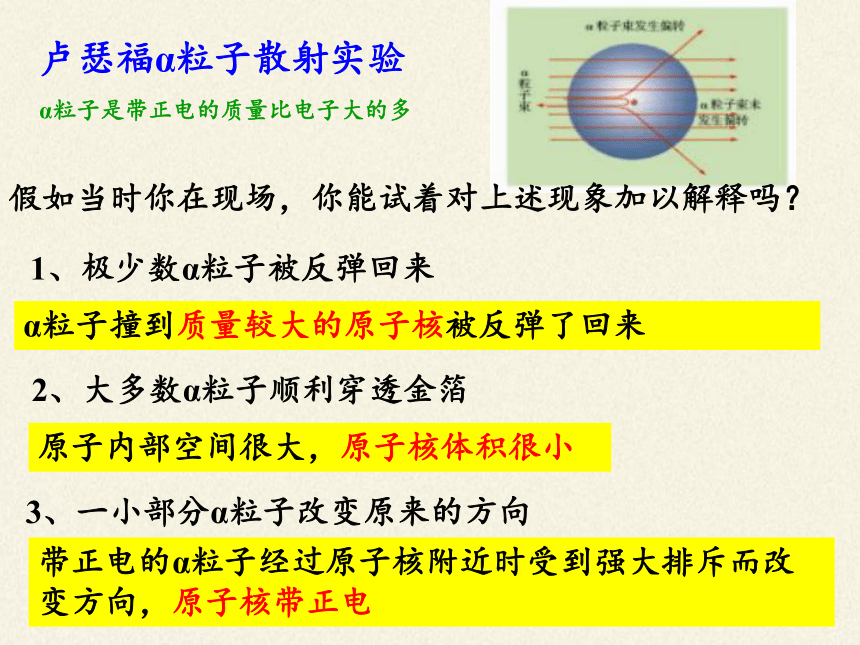
卢瑟福α粒子散射实验
“葡萄干布丁”模型
带正电比电子质量大得多的α粒子轰击金箔
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小不可分割的实心球体。
1897年汤姆生发现电子,提出了原子的模型
原子
α粒子束
带正电的粒子
原子
α粒子束
α粒子是带正电、质量比电子大的多的微粒
α粒子未发生偏转
α粒子发生偏转
α粒子束
α粒子被反弹
卢瑟福α粒子散射实验
α粒子是带正电的质量比电子大的多
2、大多数α粒子顺利穿透金箔
3、一小部分α粒子改变原来的方向
原子内部空间很大,原子核体积很小
带正电的α粒子经过原子核附近时受到强大排斥而改变方向,原子核带正电
1、极少数α粒子被反弹回来
α粒子撞到质量较大的原子核被反弹了回来
假如当时你在现场,你能试着对上述现象加以解释吗?
你知道原子核
到底有多大吗?
万人体育场如同:
原子
蚂蚁 2 mm
原子核
在1911年卢瑟福提出:原子有核模型
(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。
一、原子的结构
原子
原子核(带正电)
核外电子(带负电)
原子核带的正电荷数=核外电子带的负电荷数
即 (核电荷数) = 核外电子数
原子不显电性
原子核内有什么?
自从发现原子核和电子后,卢瑟福一直在考虑一个问题:能否打开原子核?原子核内究竟有什么?
1919年,卢瑟福和他的助手用α粒子“轰击”了氮原子核等,发现原子核里面有质子,1个质子带1个单位正电荷。1920年,卢瑟福又预言:原子核中有不带电荷的中性粒子。1932年,经过不少科学家的反复实验后确实发现,α粒子打在铍原子核上,产生了一种高速的不显电性的中性粒子,他们将其命名为中子。中子的质量与质子的质量几乎相等。卢瑟福的预言再一次被证实了。实验证明,原子核确实可以再分为质子和中子。
原子弹的爆炸是由原子核的裂变,释放出巨大的能量引起的.
资料介绍:
原子核的构成:
质子
中子
原子
原子核
核外电子
1个质子带一个单位正电荷
1个电子带一个单位负电荷
不带电
在原子中:核电荷数=核内质子数=核外电子数
粒子种类 质量(kg)
质子 =1.6726×10-27
中子 =1.6749×10-27
电子 =质子质量的1/1836
原子的质量几乎全部集中在原子核上
根据表格你得到什么启示?
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
镁 12 12 12
氯 17 18 17
铁 26 30 26
观察表格(表4-2 ) ,思考下列问题
2、所有原子都是由质子、中子、电子构成的吗?
3、质子、中子、电子在数量上有什么关系?
1、不同种原子之间有哪些区别?
4、原子本身带电吗?为什么?
不同原子的质子数、电子数不同,中子数可能相同
氢原子的中子数为0,因此,不是所有的原子都有中子。
质子数一定等于电子数,但不一定等于中子数。
质子和电子数目相等、电性相反,互相抵消 ,所以原子不带电
不是所有的物质都是由分子构成的,有些物质例如:金属(金、银等)、稀有气体(氦、氖等)、金刚石和石墨是由原子直接构成的。
原子构成的物质:
金属单质
固态非金属单质
稀有气体单质
练习
1.原子是由居于原子中心、带______的原子核和核外带______ 的电子构成,原子核是由_______和______构成。由于它们所带的电荷_______ ,电性_____,所以整个原子______(填显或不显)电性。
2、能保持物质的化学性质的最小粒子是_____;化学变化中的最小粒子是______;原子中带正电荷的粒子是_ _________;不显电性的粒子是 、质量最小的粒子是_____;决定原子质量大小的粒子是________。
3、据报道,1994年12月科学家发现了一种新元素,它的原子核内有质子111个,中子161个,则该元素核外电子数是_____
下一页
正电
负电
质子
中子
相等
相反
不显
分子
原子
质子和原子核
中子
电子
原子核
111
谢 谢
第三节 原子的构成
第三节 原子的构成
道尔顿理论——原子不可分的实心球体
一.原子的结构
汤姆森发现电子,原子可分
1.原子结构发展史
卢瑟福α粒子散射实验
“葡萄干布丁”模型
带正电比电子质量大得多的α粒子轰击金箔
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小不可分割的实心球体。
1897年汤姆生发现电子,提出了原子的模型
原子
α粒子束
带正电的粒子
原子
α粒子束
α粒子是带正电、质量比电子大的多的微粒
α粒子未发生偏转
α粒子发生偏转
α粒子束
α粒子被反弹
卢瑟福α粒子散射实验
α粒子是带正电的质量比电子大的多
2、大多数α粒子顺利穿透金箔
3、一小部分α粒子改变原来的方向
原子内部空间很大,原子核体积很小
带正电的α粒子经过原子核附近时受到强大排斥而改变方向,原子核带正电
1、极少数α粒子被反弹回来
α粒子撞到质量较大的原子核被反弹了回来
假如当时你在现场,你能试着对上述现象加以解释吗?
你知道原子核
到底有多大吗?
万人体育场如同:
原子
蚂蚁 2 mm
原子核
在1911年卢瑟福提出:原子有核模型
(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。
一、原子的结构
原子
原子核(带正电)
核外电子(带负电)
原子核带的正电荷数=核外电子带的负电荷数
即 (核电荷数) = 核外电子数
原子不显电性
原子核内有什么?
自从发现原子核和电子后,卢瑟福一直在考虑一个问题:能否打开原子核?原子核内究竟有什么?
1919年,卢瑟福和他的助手用α粒子“轰击”了氮原子核等,发现原子核里面有质子,1个质子带1个单位正电荷。1920年,卢瑟福又预言:原子核中有不带电荷的中性粒子。1932年,经过不少科学家的反复实验后确实发现,α粒子打在铍原子核上,产生了一种高速的不显电性的中性粒子,他们将其命名为中子。中子的质量与质子的质量几乎相等。卢瑟福的预言再一次被证实了。实验证明,原子核确实可以再分为质子和中子。
原子弹的爆炸是由原子核的裂变,释放出巨大的能量引起的.
资料介绍:
原子核的构成:
质子
中子
原子
原子核
核外电子
1个质子带一个单位正电荷
1个电子带一个单位负电荷
不带电
在原子中:核电荷数=核内质子数=核外电子数
粒子种类 质量(kg)
质子 =1.6726×10-27
中子 =1.6749×10-27
电子 =质子质量的1/1836
原子的质量几乎全部集中在原子核上
根据表格你得到什么启示?
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
镁 12 12 12
氯 17 18 17
铁 26 30 26
观察表格(表4-2 ) ,思考下列问题
2、所有原子都是由质子、中子、电子构成的吗?
3、质子、中子、电子在数量上有什么关系?
1、不同种原子之间有哪些区别?
4、原子本身带电吗?为什么?
不同原子的质子数、电子数不同,中子数可能相同
氢原子的中子数为0,因此,不是所有的原子都有中子。
质子数一定等于电子数,但不一定等于中子数。
质子和电子数目相等、电性相反,互相抵消 ,所以原子不带电
不是所有的物质都是由分子构成的,有些物质例如:金属(金、银等)、稀有气体(氦、氖等)、金刚石和石墨是由原子直接构成的。
原子构成的物质:
金属单质
固态非金属单质
稀有气体单质
练习
1.原子是由居于原子中心、带______的原子核和核外带______ 的电子构成,原子核是由_______和______构成。由于它们所带的电荷_______ ,电性_____,所以整个原子______(填显或不显)电性。
2、能保持物质的化学性质的最小粒子是_____;化学变化中的最小粒子是______;原子中带正电荷的粒子是_ _________;不显电性的粒子是 、质量最小的粒子是_____;决定原子质量大小的粒子是________。
3、据报道,1994年12月科学家发现了一种新元素,它的原子核内有质子111个,中子161个,则该元素核外电子数是_____
下一页
正电
负电
质子
中子
相等
相反
不显
分子
原子
质子和原子核
中子
电子
原子核
111
谢 谢
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
