第十一单元课题1常见的盐(3)复分解反应-2021-2022学年九年级化学人教版下册(20张PPT)
文档属性
| 名称 | 第十一单元课题1常见的盐(3)复分解反应-2021-2022学年九年级化学人教版下册(20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 12.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 16:23:58 | ||
图片预览






文档简介
(共20张PPT)
九年级化学第十一单元常见的盐(3)
复分解反应
上课回顾
第
一
环
节
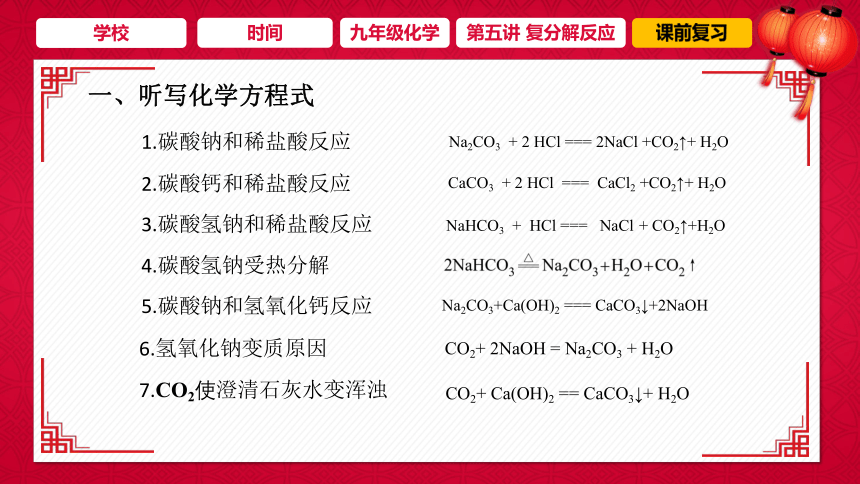
一、听写化学方程式
1.碳酸钠和稀盐酸反应
2.碳酸钙和稀盐酸反应
3.碳酸氢钠和稀盐酸反应
4.碳酸氢钠受热分解
5.碳酸钠和氢氧化钙反应
Na2CO3 + 2 HCl === 2NaCl +CO2↑+ H2O
CaCO3 + 2 HCl === CaCl2 +CO2↑+ H2O
NaHCO3 + HCl === NaCl + CO2↑+H2O
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
6.氢氧化钠变质原因
CO2+ 2NaOH = Na2CO3 + H2O
7.CO2使澄清石灰水变浑浊
CO2+ Ca(OH)2 == CaCO3↓+ H2O
时间
九年级化学
第五讲 复分解反应
课前复习
学校
二、CO32- 或HCO3–的检验问题
2.操作步骤、现象及结论
1.选用试剂:
操作步骤:取少量待测样品于试管中,加入少量稀盐酸。
现象及结论:若产生能使澄清石灰水变浑浊的气体,则说明样品中含有CO32- 或
HCO3 –。
三、氢氧化钠固体是否变质的检验问题
1.生成气体法(选稀盐酸试剂)
2.生成沉淀法(选澄清石灰水试剂)
稀盐酸和澄清石灰水。
时间
九年级化学
第五讲 复分解反应
课前复习
学校
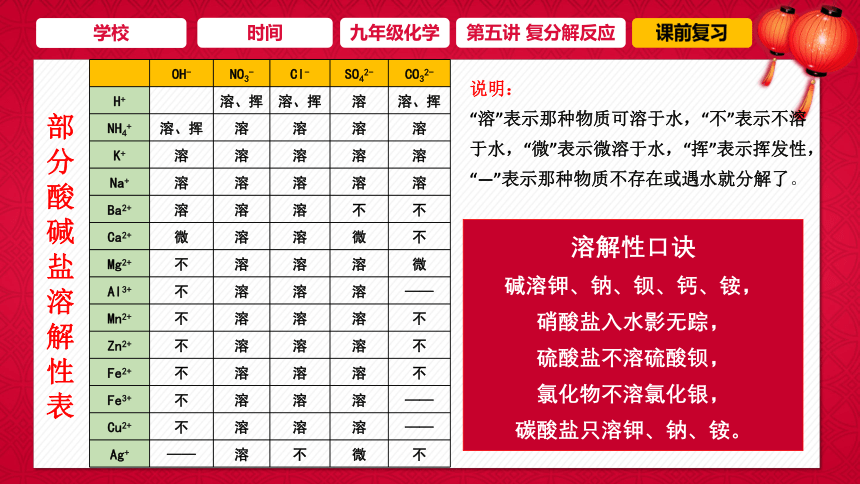
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
部分酸碱盐溶解性表
说明:
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇水就分解了。
溶解性口诀
碱溶钾、钠、钡、钙、铵,
硝酸盐入水影无踪,
硫酸盐不溶硫酸钡,
氯化物不溶氯化银,
碳酸盐只溶钾、钠、铵。
时间
九年级化学
第五讲 复分解反应
课前复习
学校
课堂讲练
第
二
环
节
1.复分解反应
2.复分解反应类型及发生条件
3.盐的化学性质
复分解反应
1.定义:由两种化合物互相交换成分生成另外两种化合物的反应。
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
+1
-2
+2
-1
-2
+2
+1
-1
3.特征:双交换,价不变。
2.表达式:AB + CD→ AD+ CB
4.条件:
5.类型:
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
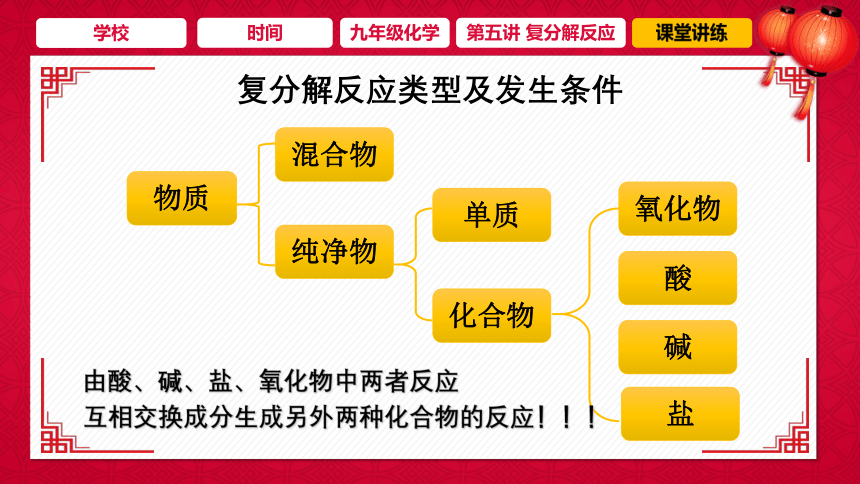
复分解反应类型及发生条件
物质
混合物
纯净物
单质
化合物
碱
酸
氧化物
盐
由酸、碱、盐、氧化物中两者反应
互相交换成分生成另外两种化合物的反应!!!
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
复分解反应类型及发生条件
类型一:金属氧化物+酸→盐+水
类型二:酸+碱→盐+水
类型三:酸+盐→酸+盐
类型四:碱+盐→碱+盐
类型五:盐+盐→盐+盐
Fe2O3+6HCl=2FeCl3+3H2O
HCl+NaOH=NaCl+H2O
Na2CO3 + 2 HCl === 2NaCl +CO2↑+ H2O
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
Na2CO3+CaCl2 === CaCO3↓+2NaCl
复分解反应的条件
2.生成物:有气体、沉淀或水中的一种。
1.反应物:有酸可不溶,无酸均要溶。
都有盐生成
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
2020寒假特训营
九年级化学
第四讲 常见的盐
课堂讲练
复分解反应
1.定义:由两种化合物互相交换成分生成另外两种化合物的反应。
3.特征:双交换,价不变。都有盐生成。
2.表达式:AB + CD→ AD+ CB
4.条件:
5.类型:
反应物:有酸可不溶,无酸均要溶。
生成物:有气体、沉淀或水中的一种。
类型一:金属氧化物+酸→盐+水
类型二:酸+碱→盐+水
类型三:酸+盐→酸+盐
类型四:碱+盐→碱+盐
类型五:盐+盐→盐+盐
1. Na2CO3 + Ca(OH)2 ===
2. Na2CO3 + KOH===
3. Na2CO3 + BaCl2 ===
4. Na2CO3 + KNO3 ===
5.Mg(OH)2+H2SO4 ===
6.Na2CO3 + H2SO4 ===
判断溶液中下列反应是否发生
CaCO3 ↓+ 2NaOH
K2CO3 + 2NaOH
×,无气体、沉淀或水
BaCO3 ↓+ 2NaCl
K2CO3 + 2NaNO3
×,无气体、沉淀或水
MgSO4 + 2H2O
Na2SO4 + 2H2O+CO2 ↑
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
复分解反应能否发生判断方法
1.看反应物类别:是否为化合物(金属氧化物、酸、碱、盐)。
有酸,另一种反应物可以不溶解。
无酸,两种反应物必须都要溶解 。
2.依特征,写反应:(双交换,价不变)。
3.看产物,来诊断:(有无气体、沉淀或水中的一种)。
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
盐的化学性质
(1)盐+金属→新盐+新金属
(2)盐+酸→新盐+新酸
(3)盐+碱→新盐+新碱
(4)盐+盐→新盐+新盐
Fe+CuSO4 ===FeSO4 +Cu
Na2CO3 + 2 HCl === 2NaCl +CO2↑+ H2O
CuSO4+Ba(OH)2 ===BaSO4 ↓+Cu(OH)2↓
Na2CO3+CaCl2 === CaCO3↓+2NaCl
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
习题讲解及总结
第
三
环
节
【考点一】复分解反应
1.下列关于复分解反应的说法正确的是( )
A.中和反应不属于复分解反应 B.反应物必须都溶于水
C.反应物一定有酸 D.生成物一定有盐
2.下列反应属于复分解反应的是( )
A.CO2+H2O===H2CO3
B.2HCl+Ca(OH)2===CaCl2+2H2O
C.2KMnO4===△==K2MnO4+MnO2+O2↑
D.2Na+2H2O===2NaOH+H2↑
D
一定是
有酸可不溶
B
化合反应
复分解反应
分解反应
置换反应
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
【考点二】复分解反应发生的条件
3.下列物质混合后,能发生复分解反应的是( )
A.氢氧化镁、氢氧化钠溶液 B.硝酸溶液、氢氧化钡溶液
C.碳酸钠溶液、氯化钾溶液 D.硫酸溶液、氯化镁溶液
4.下列各组物质中,不能发生复分解反应的是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4
C.Ca(OH)2和Na2CO3 D.KCl和CuSO4
5.下表为酸、碱和盐溶解性表(室温)的一部分,据表回答下列问题:
Cl- SO42- CO32-
K+ ① 溶 溶
Na+ 溶 溶 溶
Ba2+ 溶 ② 不
(1)表中“溶”表示该位置的物质可溶于水,“不”表示 ;
(2)表中位置①代表的物质的化学式为 ;
(3)写出生成物中含有位置②代表的物质的一个化学反应方式: 。
B
D
该位置的物质不溶于水
KCl
Ba(OH)2+H2SO4==BaSO4 ↓+2H2O
H2O
Na2SO4+H2O+CO2 ↑
CaCO3 ↓+NaOH
CuCl2 +K2SO4
Ba(NO3)2+H2O
K2CO3+NaOH
MgSO4+HCl
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
【考点三】盐的化学性质
6.使用下列试剂能将氯化钠、碳酸钠、氯化钡三种溶液鉴别出来的是( )
A.稀硫酸 B.氯化钠溶液 C.铁片 D.氢氧化钠溶液
7.实验室有4种试剂,分别为HNO3溶液、CuSO4溶液、MgCl2溶液和KOH溶液。
(1)有颜色的试剂是 。
(2)有一种试剂能与另外三种试剂发生反应,该试剂是 。
(3)书写化学方程式:
①CuSO4溶液与KOH溶液混合: 。
②HNO3溶液与NaHCO3溶液混合: 。
A
CuSO4溶液
KOH溶液
CuSO4+2KOH===Cu(OH)2 ↓+K2SO4
HNO3+NaHCO3===NaNO3+H2O+CO2 ↑
H2SO4
NaCl
Na2CO3
BaCl2
蓝色溶液
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
复分解反应
1.定义:由两种化合物互相交换成分生成另外两种化合物的反应。
3.特征:双交换,价不变。都有盐生成。
2.表达式:AB + CD→ AD+ CB
4.条件:
5.类型:
反应物:有酸可不溶,无酸均要溶。
生成物:有气体、沉淀或水中的一种。
类型一:金属氧化物+酸→盐+水
类型二:酸+碱→盐+水
类型三:酸+盐→酸+盐
类型四:碱+盐→碱+盐
类型五:盐+盐→盐+盐
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
盐的化学性质
(1)盐+金属→新盐+新金属
(2)盐+酸→新盐+新酸
(3)盐+碱→新盐+新碱
(4)盐+盐→新盐+新盐
Fe+CuSO4 ===FeSO4 +Cu
Na2CO3 + 2 HCl === 2NaCl +CO2↑+ H2O
CuSO4+Ba(OH)2 ===BaSO4 ↓+Cu(OH)2↓
Na2CO3+CaCl2 === CaCO3↓+2NaCl
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
1.记忆复分解反应五个要素。
2. 练习书写复分解反应。
九年级化学第十一单元常见的盐(3)
复分解反应
上课回顾
第
一
环
节
一、听写化学方程式
1.碳酸钠和稀盐酸反应
2.碳酸钙和稀盐酸反应
3.碳酸氢钠和稀盐酸反应
4.碳酸氢钠受热分解
5.碳酸钠和氢氧化钙反应
Na2CO3 + 2 HCl === 2NaCl +CO2↑+ H2O
CaCO3 + 2 HCl === CaCl2 +CO2↑+ H2O
NaHCO3 + HCl === NaCl + CO2↑+H2O
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
6.氢氧化钠变质原因
CO2+ 2NaOH = Na2CO3 + H2O
7.CO2使澄清石灰水变浑浊
CO2+ Ca(OH)2 == CaCO3↓+ H2O
时间
九年级化学
第五讲 复分解反应
课前复习
学校
二、CO32- 或HCO3–的检验问题
2.操作步骤、现象及结论
1.选用试剂:
操作步骤:取少量待测样品于试管中,加入少量稀盐酸。
现象及结论:若产生能使澄清石灰水变浑浊的气体,则说明样品中含有CO32- 或
HCO3 –。
三、氢氧化钠固体是否变质的检验问题
1.生成气体法(选稀盐酸试剂)
2.生成沉淀法(选澄清石灰水试剂)
稀盐酸和澄清石灰水。
时间
九年级化学
第五讲 复分解反应
课前复习
学校
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
部分酸碱盐溶解性表
说明:
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇水就分解了。
溶解性口诀
碱溶钾、钠、钡、钙、铵,
硝酸盐入水影无踪,
硫酸盐不溶硫酸钡,
氯化物不溶氯化银,
碳酸盐只溶钾、钠、铵。
时间
九年级化学
第五讲 复分解反应
课前复习
学校
课堂讲练
第
二
环
节
1.复分解反应
2.复分解反应类型及发生条件
3.盐的化学性质
复分解反应
1.定义:由两种化合物互相交换成分生成另外两种化合物的反应。
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
+1
-2
+2
-1
-2
+2
+1
-1
3.特征:双交换,价不变。
2.表达式:AB + CD→ AD+ CB
4.条件:
5.类型:
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
复分解反应类型及发生条件
物质
混合物
纯净物
单质
化合物
碱
酸
氧化物
盐
由酸、碱、盐、氧化物中两者反应
互相交换成分生成另外两种化合物的反应!!!
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
复分解反应类型及发生条件
类型一:金属氧化物+酸→盐+水
类型二:酸+碱→盐+水
类型三:酸+盐→酸+盐
类型四:碱+盐→碱+盐
类型五:盐+盐→盐+盐
Fe2O3+6HCl=2FeCl3+3H2O
HCl+NaOH=NaCl+H2O
Na2CO3 + 2 HCl === 2NaCl +CO2↑+ H2O
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
Na2CO3+CaCl2 === CaCO3↓+2NaCl
复分解反应的条件
2.生成物:有气体、沉淀或水中的一种。
1.反应物:有酸可不溶,无酸均要溶。
都有盐生成
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
2020寒假特训营
九年级化学
第四讲 常见的盐
课堂讲练
复分解反应
1.定义:由两种化合物互相交换成分生成另外两种化合物的反应。
3.特征:双交换,价不变。都有盐生成。
2.表达式:AB + CD→ AD+ CB
4.条件:
5.类型:
反应物:有酸可不溶,无酸均要溶。
生成物:有气体、沉淀或水中的一种。
类型一:金属氧化物+酸→盐+水
类型二:酸+碱→盐+水
类型三:酸+盐→酸+盐
类型四:碱+盐→碱+盐
类型五:盐+盐→盐+盐
1. Na2CO3 + Ca(OH)2 ===
2. Na2CO3 + KOH===
3. Na2CO3 + BaCl2 ===
4. Na2CO3 + KNO3 ===
5.Mg(OH)2+H2SO4 ===
6.Na2CO3 + H2SO4 ===
判断溶液中下列反应是否发生
CaCO3 ↓+ 2NaOH
K2CO3 + 2NaOH
×,无气体、沉淀或水
BaCO3 ↓+ 2NaCl
K2CO3 + 2NaNO3
×,无气体、沉淀或水
MgSO4 + 2H2O
Na2SO4 + 2H2O+CO2 ↑
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
复分解反应能否发生判断方法
1.看反应物类别:是否为化合物(金属氧化物、酸、碱、盐)。
有酸,另一种反应物可以不溶解。
无酸,两种反应物必须都要溶解 。
2.依特征,写反应:(双交换,价不变)。
3.看产物,来诊断:(有无气体、沉淀或水中的一种)。
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
盐的化学性质
(1)盐+金属→新盐+新金属
(2)盐+酸→新盐+新酸
(3)盐+碱→新盐+新碱
(4)盐+盐→新盐+新盐
Fe+CuSO4 ===FeSO4 +Cu
Na2CO3 + 2 HCl === 2NaCl +CO2↑+ H2O
CuSO4+Ba(OH)2 ===BaSO4 ↓+Cu(OH)2↓
Na2CO3+CaCl2 === CaCO3↓+2NaCl
时间
九年级化学
第五讲 复分解反应
课堂讲练
学校
习题讲解及总结
第
三
环
节
【考点一】复分解反应
1.下列关于复分解反应的说法正确的是( )
A.中和反应不属于复分解反应 B.反应物必须都溶于水
C.反应物一定有酸 D.生成物一定有盐
2.下列反应属于复分解反应的是( )
A.CO2+H2O===H2CO3
B.2HCl+Ca(OH)2===CaCl2+2H2O
C.2KMnO4===△==K2MnO4+MnO2+O2↑
D.2Na+2H2O===2NaOH+H2↑
D
一定是
有酸可不溶
B
化合反应
复分解反应
分解反应
置换反应
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
【考点二】复分解反应发生的条件
3.下列物质混合后,能发生复分解反应的是( )
A.氢氧化镁、氢氧化钠溶液 B.硝酸溶液、氢氧化钡溶液
C.碳酸钠溶液、氯化钾溶液 D.硫酸溶液、氯化镁溶液
4.下列各组物质中,不能发生复分解反应的是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4
C.Ca(OH)2和Na2CO3 D.KCl和CuSO4
5.下表为酸、碱和盐溶解性表(室温)的一部分,据表回答下列问题:
Cl- SO42- CO32-
K+ ① 溶 溶
Na+ 溶 溶 溶
Ba2+ 溶 ② 不
(1)表中“溶”表示该位置的物质可溶于水,“不”表示 ;
(2)表中位置①代表的物质的化学式为 ;
(3)写出生成物中含有位置②代表的物质的一个化学反应方式: 。
B
D
该位置的物质不溶于水
KCl
Ba(OH)2+H2SO4==BaSO4 ↓+2H2O
H2O
Na2SO4+H2O+CO2 ↑
CaCO3 ↓+NaOH
CuCl2 +K2SO4
Ba(NO3)2+H2O
K2CO3+NaOH
MgSO4+HCl
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
【考点三】盐的化学性质
6.使用下列试剂能将氯化钠、碳酸钠、氯化钡三种溶液鉴别出来的是( )
A.稀硫酸 B.氯化钠溶液 C.铁片 D.氢氧化钠溶液
7.实验室有4种试剂,分别为HNO3溶液、CuSO4溶液、MgCl2溶液和KOH溶液。
(1)有颜色的试剂是 。
(2)有一种试剂能与另外三种试剂发生反应,该试剂是 。
(3)书写化学方程式:
①CuSO4溶液与KOH溶液混合: 。
②HNO3溶液与NaHCO3溶液混合: 。
A
CuSO4溶液
KOH溶液
CuSO4+2KOH===Cu(OH)2 ↓+K2SO4
HNO3+NaHCO3===NaNO3+H2O+CO2 ↑
H2SO4
NaCl
Na2CO3
BaCl2
蓝色溶液
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
复分解反应
1.定义:由两种化合物互相交换成分生成另外两种化合物的反应。
3.特征:双交换,价不变。都有盐生成。
2.表达式:AB + CD→ AD+ CB
4.条件:
5.类型:
反应物:有酸可不溶,无酸均要溶。
生成物:有气体、沉淀或水中的一种。
类型一:金属氧化物+酸→盐+水
类型二:酸+碱→盐+水
类型三:酸+盐→酸+盐
类型四:碱+盐→碱+盐
类型五:盐+盐→盐+盐
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
盐的化学性质
(1)盐+金属→新盐+新金属
(2)盐+酸→新盐+新酸
(3)盐+碱→新盐+新碱
(4)盐+盐→新盐+新盐
Fe+CuSO4 ===FeSO4 +Cu
Na2CO3 + 2 HCl === 2NaCl +CO2↑+ H2O
CuSO4+Ba(OH)2 ===BaSO4 ↓+Cu(OH)2↓
Na2CO3+CaCl2 === CaCO3↓+2NaCl
时间
九年级化学
第五讲 复分解反应
习题讲解
学校
1.记忆复分解反应五个要素。
2. 练习书写复分解反应。
同课章节目录
