山西省怀仁市2021-2022学年高二上学期期末调研化学试题(Word版含答案)
文档属性
| 名称 | 山西省怀仁市2021-2022学年高二上学期期末调研化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 798.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 09:17:46 | ||
图片预览




文档简介
怀仁市2021-2022学年高二上学期期末调研
化学
可能用到的相对原子质量:
一、选择题:本题共24小题,每题2分,共48分。每题只有一项是符合题目要求的。
1.测定浓硫酸试剂中含量的主要操作包括:
①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取20.00mL待测液,用的NaOH溶液滴定。上述操作中,不需要用到的仪器为( )
A. B. C. D.
2.下列一些诗句、成语、谚语等包含的反应过程为反应物总能量比生成物总能量低的是( )
①野火烧不尽,春风吹又生;②春蚕到死丝方尽,蜡炬成灰泪始干;③千锤万凿出深山,烈火焚烧若等闲;④爆竹声中一岁除,春风送暖入屠苏;⑤只要功夫深,铁杵磨成针;⑥火树银花。
A.只有③ B.③④⑤ C.⑤⑥ D.①②④⑥
3.火星大气中含有大量,一种有参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
A.负极上发生还原反应 B.将电能转化为化学能
C.阳离子由正极移向负极 D.在正极上得电子
4.一定温度下,某容积为1 L的恒容密闭容器中通入和,发生反应: 。下列有关说法正确的是( )
A.该反应在高温下才能自发进行
B.充入少量He使体系压强增大,、均不变
C.若该反应的活化能为a kJ/mol,则其逆反应的活化能为
D.当和转化率相等时,该反应达到化学平衡状态
5.下列说法正确的是( )
A.25℃时,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,AgCl的溶解度增大
B.若 ,则
C.用pH计测得“84消毒液的pH为12.2
D.在的溶液中:、、、一定能大量共存
6.在一定温度下的密闭容器中发生反应:,平衡时测得A的浓度为
0.50moL。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.50 mol/L。下列有关判断不正确的是( )
A.B的转化率降低 B.平衡向正反应方向移动
C. D.C的体积分数增大
7.的沉淀溶解平衡曲线如图所示()。则下列说法正确的是( )
A.在b点对应的溶解度小于c点
B.沉淀溶解是放热的过程
C.
D.温度下,在饱和溶液中加入固体可使溶液由c点变到a点
8.在T℃下,分别在三个固定容积为10L的密闭容器中,发生反应: ,测得相关数据如下表所示。下列说法错误的是( )
容器 起始时物质的量/mol 平衡时的物质的量/mol
甲 1 0.5 0.5 0 a
乙 1 0.5 0 0 0.8
丙 2 1 0 0 b
A.平衡后,
B.
C.平衡后的容器丙中的压强是容器乙的压强的两倍
D.升温能增加活化分子百分数,加快反应速率,并提高CO的平衡转化率
9.下列热化学方程式及有关应用的叙述中,正确的是( )
A.已知 ,说明C的燃烧热为110.5 kJ/mol
B.已知 ,则
C.通常状况下,将和置于密闭容器中充分反应生成,放热18.48 kJ,其热化学方程式为
D.已知 ,可采用升温同时投入纳米CaO来提高的产率
10.已知与可相互转化: ,在恒温下,将一定量和的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析合理的是( )
A.25min时,正反应速率减小
B.反应进行到10min时,体系吸收的热量为9.68kJ
C.a、b、c、d四点中与均相等
D.10min时,的生成速率为
11.肼()在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。
已知200℃时:反应Ⅰ:
反应Ⅱ:
下列说法不正确的是( )
A.图1所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开中的化学键吸收的能量小于形成和中的化学键释放的能量
D.200℃时,肼分解生成和的热化学方程式为
12.鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是( )
A.25℃时,的GHCl水溶液中,由水电离出来的为
B.GHCl在水中的电离方程式为:
C.GHCl水溶液中:
D.水溶液加水稀释,pH升高
13.BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是( )
A.酸浸工序中分次加入稀可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成
C.水解工序中加入少量有利于BiOCl的生成
D.水解工序中加入少量可提高水解程度
14.设是阿伏加德罗常数的值,下列说法错误的是( )
A.25℃时,,则该温度下饱和溶液中含有
B.1 mol碘蒸气和1 mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为
D.溴化铵水溶液中与离子数之和大于
15.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融制备金属镁
C.“氯化”过程中发生的反应为
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
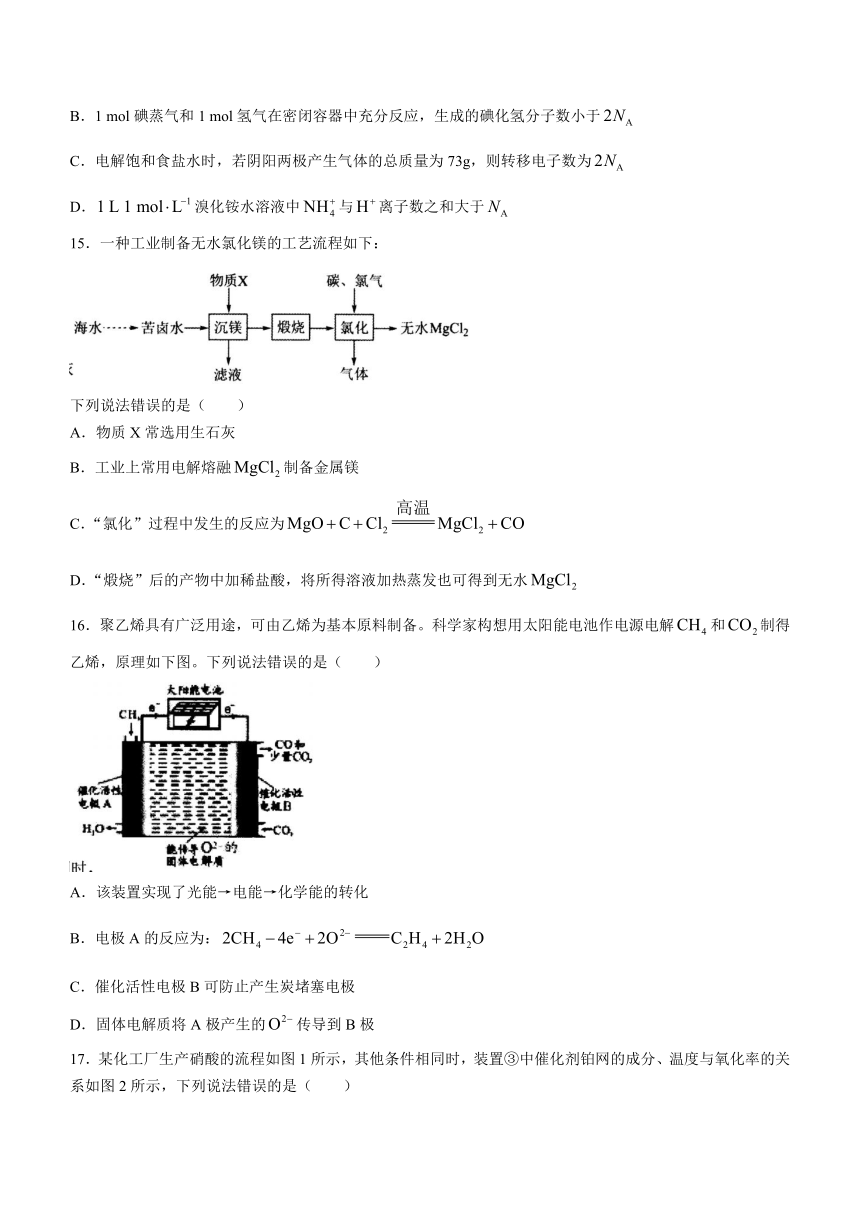
16.聚乙烯具有广泛用途,可由乙烯为基本原料制备。科学家构想用太阳能电池作电源电解和制得乙烯,原理如下图。下列说法错误的是( )
A.该装置实现了光能→电能→化学能的转化
B.电极A的反应为:
C.催化活性电极B可防止产生炭堵塞电极
D.固体电解质将A极产生的传导到B极
17.某化工厂生产硝酸的流程如图1所示,其他条件相同时,装置③中催化剂铂网的成分、温度与氧化率的关系如图2所示,下列说法错误的是( )
A.该流程中,装置①③④中发生了氧化还原反应
B.装置②中利用氨气易液化的性质分离出,既加快了正反应速率又提高了合成氨的产率
C.装置③中最佳反应条件是铂网的成分为含10%铑的铂、温度为900℃
D.装置④中排出的废气含NO、等,可以用烧碱溶液吸收
18.关于室温下pH相同、体积相同的醋酸与盐酸两种稀溶液,下列说法正确的是( )
A.两种酸溶液中,
B.两种酸溶液中,
C.两溶液的导电能力不同
D.与足量的溶液反应,醋酸产生的气体与盐酸产生的气体相等
19.下列有关电化学原理的说法正确的是( )
A.铝—空气燃料电池以KOH为电解液时,负极反应为:
B.用电解法精炼铜,阳极反应为:
C.钢铁在中性条件下被腐蚀,正极反应为:
D.电解法冶炼铝时,阳极反应为:
20.常温下,用0.1000 mol/L的盐酸分别滴定20.00 mL浓度均为0.1000 mol/L三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
A.该NaX溶液中:
B.三种一元弱酸的电离常数:
C.当时,三种溶液中:
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:
21.以铜作催化剂的一种铝硫电池的示意图如图所示,电池放电时的反应原理为:,下列说法错误的是( )
A.放电时,负极反应为
B.充电时,两电极的质量均增加
C.充电时,1 mol Cu反应时,转移2x mol电子
D.放电时,通过阳离子交换膜向电极移动
22.下列有关说法正确的是( )
A.为了减小中和滴定的误差,锥形瓶必须洗净并烘干后才能使用
B.向溶液中滴加过量的NaCl溶液得到浊液,过滤得到的滤液中不含
C.离子交换膜在工业上应用广泛,如氯碱工业中使用阴离子交换膜
D.室温下,的,的,溶液中的与中的不一定相等
23.利用调节pH的方法,可以除去硫酸铜溶液中的亚铁离子(已知:在一定条件下,某些常见阳离子沉淀时对应的pH如表所示),下列说法正确的是( )
阳离子 开始沉淀时 完全沉淀时
2.7 3.7
4.4 6.4
7.6 9.6
A.调节pH可选用
B.调节pH前,应先将氧化为,可选择或作氧化剂
C.控制除杂效果最好
D.将分离得到的硫酸铜溶液蒸干可获得固体
24.用铜片、银片设计成如图所示的原电池以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.盐桥中向左移动
C.开始时,银片上发生的反应是
D.电路中每转移,正极材料增重216g
二、非选择题:4小题,共52分。
25.(13分)和CO是常见的环境污染性气体。
(1)对于反应来说“”可作为此反应的催化剂。其总反应分两步进行:
第一步为,则第二步为________(写方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能________(填“大于”小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:
,容器Ⅰ、Ⅱ、Ⅲ中的平衡转化率如图乙所示:
①该反应的________0(填“>”或“<”)。
②若容器的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器Ⅰ中用表示的反应速率为________。B点对应的平衡常数________(保留两位有效数字)。
③图中A、C、D三点容器内气体密度、、由大到小的顺序是________。
④若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应________(填“向正反应方向进行”“向逆反应方向进行”或“不移动”)。
26.(13分)Ⅰ.某研究小组进行的沉淀溶解平衡的实验探究。
【查阅资料】25℃时,,
【制备试剂】向2支均盛有溶液的试管中分别加入2滴2 mol/L NaOH溶液,制得等量沉淀。
(1)分别向两支试管中加入不同试剂,请填写下表中的实验现象、反应离子方程式。
试管编号 加入试剂 实验现象 反应离子方程式
Ⅰ 2滴溶液 ①________ ②________
Ⅱ 溶液 白色沉淀溶解,得无色溶液
(2)同学们猜想产生试管Ⅱ中现象的主要原因有以下两种。
猜想1:结合电离出的,使的沉淀溶解平衡正向移动。
猜想2:____________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入V mL醋酸铵溶液(),另一支试管中加入和氨水混合液(),两支试管中氢氧化镁均溶解。该实验证明(2)中________(填“猜想1”或“猜想2”)正确。
Ⅱ.工业上常用惰性电极电解硫酸钠溶液联合生产硫酸和烧碱,生产裝置如图所示。测得同温同压下,气体甲、乙的体积比约为1:2。
(4)b电极反应式是________,离子交换膜d为________(填“阳”或“阴”)离子交换膜,产物丙为________溶液(填“名称”)
I某些弱酸在25°C时的电离常数如下:
弱电解质 HSCN HCN HClO
(5)下列反应可以发生的是________(填标号)。
A.
B.
C.
D.
27.(14分)(1)常作食品加工中的食品添加剂,用于焙烤食品;在分析试剂、医药、电子工业中用途广泛。
①几种均为0.1 mol/L的电解质溶液的pH随温度变化的曲线如图甲所示。其中符合溶液的pH随温度变化的曲线是________(填罗马数字),导致溶液的pH随温度变化的原因是________。
②20℃时,溶液中________。
(2)下列图像能说明醋酸钠的水解反应达到平衡的是________(填标号)。
A.溶液中与反应时间t的关系 B.的水解速率与反应时间t的关系 C.溶液的pH与反应时间t的关系 D.与反应时间t的关系
(3)常温下磷酸和氢氧化钠溶液反应获得含磷各物种的分布分数与pH的关系如图所示。由图分析:
的________;利用图中数据计算推测溶液的酸碱性________(写出推理过程和结论)。
(4)室温时,向溶液中滴加0.1 mol/L NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是________点。在b点,溶液中各离子浓度由大到小的排列顺序是________。
28.(12分)Ⅰ.亚硫酸盐是一种常见的食品添加剂。
为检验某食品中亚硫酸盐含量(通常以1 kg样品中含的质量计),某硏究小组同学设计了如下实验方案。
a.称取样品W g;
b.向样品中加入足量稀硫酸;
c.将b中产生的用足量溶液吸收;
d.将c所得硫酸溶液用氢氧化钠标准液滴定;
e.数据处理。
(1)步骤d中可选用的指示剂为________。下图显示滴定终点时,滴定管(量程为25mL)读数为________。
(2)步骤d中消耗0.010 mol/L NaOH溶液V mL,则1kg样品中含的质量是________g(用含W、V的代数式表示)。
(3)步骤d中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有________(填序号)。
①量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
②装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
③滴定开始读数时仰视读数
Ⅱ.(4)绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理如图所示:
A电极的电极反应式是____________________,
B电极的电极反应式是____________________。
(5)以KOH溶液为离子导体,组成清洁燃料电池的总反应式为________。
高二年级化学参考答案及评分标准
一、选择题:本题共24小题,每题2分,共48分。每题只有一项是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12
B A D B C A D B C B A D
13 14 15 16 17 18 19 20 21 22 23 24
C A D D B A D C C D A D
二、非选择题(4小题,共52分)
25.(13分)(1)(2分);大于(2分)
(2)①>(1分) ②(2分);0.0044(2分)
③(2分) ④向逆反应方向进行(2分)
26.(13分)(1)①白色沉淀转化为红褐色沉淀(2分)
②(2分)
(2)铵根离子水解使溶液显酸性,消耗氢氧化镁电离出的氢氧根离子,促进氧氧化镁沉淀溶解平衡正向移动(2分) (3)猜想1(1分)
(4)(2分),阳(1分),硫酸(1分) (5)AB(2分)
27.(14分)(1)①Ⅰ(1分);水解吸热,溶液呈酸性,升高温度使其水解程度增大,pH减小(2分); ②0.1(2分) (2)BC(2分); (3)(1分)
,,,则的水解程度大于电离程度,溶液显碱性(2分)。
(4)a(2分);(2分)
28.(12分)(1)酚酞(或甲基橙)(1分) 20.60 mL(1分)
(2)8V/25W或0.32V/W(2分) (3)①③(2分)
(4)(2分) (2分)
(5)(2分)
化学
可能用到的相对原子质量:
一、选择题:本题共24小题,每题2分,共48分。每题只有一项是符合题目要求的。
1.测定浓硫酸试剂中含量的主要操作包括:
①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取20.00mL待测液,用的NaOH溶液滴定。上述操作中,不需要用到的仪器为( )
A. B. C. D.
2.下列一些诗句、成语、谚语等包含的反应过程为反应物总能量比生成物总能量低的是( )
①野火烧不尽,春风吹又生;②春蚕到死丝方尽,蜡炬成灰泪始干;③千锤万凿出深山,烈火焚烧若等闲;④爆竹声中一岁除,春风送暖入屠苏;⑤只要功夫深,铁杵磨成针;⑥火树银花。
A.只有③ B.③④⑤ C.⑤⑥ D.①②④⑥
3.火星大气中含有大量,一种有参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
A.负极上发生还原反应 B.将电能转化为化学能
C.阳离子由正极移向负极 D.在正极上得电子
4.一定温度下,某容积为1 L的恒容密闭容器中通入和,发生反应: 。下列有关说法正确的是( )
A.该反应在高温下才能自发进行
B.充入少量He使体系压强增大,、均不变
C.若该反应的活化能为a kJ/mol,则其逆反应的活化能为
D.当和转化率相等时,该反应达到化学平衡状态
5.下列说法正确的是( )
A.25℃时,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,AgCl的溶解度增大
B.若 ,则
C.用pH计测得“84消毒液的pH为12.2
D.在的溶液中:、、、一定能大量共存
6.在一定温度下的密闭容器中发生反应:,平衡时测得A的浓度为
0.50moL。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.50 mol/L。下列有关判断不正确的是( )
A.B的转化率降低 B.平衡向正反应方向移动
C. D.C的体积分数增大
7.的沉淀溶解平衡曲线如图所示()。则下列说法正确的是( )
A.在b点对应的溶解度小于c点
B.沉淀溶解是放热的过程
C.
D.温度下,在饱和溶液中加入固体可使溶液由c点变到a点
8.在T℃下,分别在三个固定容积为10L的密闭容器中,发生反应: ,测得相关数据如下表所示。下列说法错误的是( )
容器 起始时物质的量/mol 平衡时的物质的量/mol
甲 1 0.5 0.5 0 a
乙 1 0.5 0 0 0.8
丙 2 1 0 0 b
A.平衡后,
B.
C.平衡后的容器丙中的压强是容器乙的压强的两倍
D.升温能增加活化分子百分数,加快反应速率,并提高CO的平衡转化率
9.下列热化学方程式及有关应用的叙述中,正确的是( )
A.已知 ,说明C的燃烧热为110.5 kJ/mol
B.已知 ,则
C.通常状况下,将和置于密闭容器中充分反应生成,放热18.48 kJ,其热化学方程式为
D.已知 ,可采用升温同时投入纳米CaO来提高的产率
10.已知与可相互转化: ,在恒温下,将一定量和的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析合理的是( )
A.25min时,正反应速率减小
B.反应进行到10min时,体系吸收的热量为9.68kJ
C.a、b、c、d四点中与均相等
D.10min时,的生成速率为
11.肼()在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。
已知200℃时:反应Ⅰ:
反应Ⅱ:
下列说法不正确的是( )
A.图1所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开中的化学键吸收的能量小于形成和中的化学键释放的能量
D.200℃时,肼分解生成和的热化学方程式为
12.鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是( )
A.25℃时,的GHCl水溶液中,由水电离出来的为
B.GHCl在水中的电离方程式为:
C.GHCl水溶液中:
D.水溶液加水稀释,pH升高
13.BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是( )
A.酸浸工序中分次加入稀可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成
C.水解工序中加入少量有利于BiOCl的生成
D.水解工序中加入少量可提高水解程度
14.设是阿伏加德罗常数的值,下列说法错误的是( )
A.25℃时,,则该温度下饱和溶液中含有
B.1 mol碘蒸气和1 mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为
D.溴化铵水溶液中与离子数之和大于
15.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融制备金属镁
C.“氯化”过程中发生的反应为
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
16.聚乙烯具有广泛用途,可由乙烯为基本原料制备。科学家构想用太阳能电池作电源电解和制得乙烯,原理如下图。下列说法错误的是( )
A.该装置实现了光能→电能→化学能的转化
B.电极A的反应为:
C.催化活性电极B可防止产生炭堵塞电极
D.固体电解质将A极产生的传导到B极
17.某化工厂生产硝酸的流程如图1所示,其他条件相同时,装置③中催化剂铂网的成分、温度与氧化率的关系如图2所示,下列说法错误的是( )
A.该流程中,装置①③④中发生了氧化还原反应
B.装置②中利用氨气易液化的性质分离出,既加快了正反应速率又提高了合成氨的产率
C.装置③中最佳反应条件是铂网的成分为含10%铑的铂、温度为900℃
D.装置④中排出的废气含NO、等,可以用烧碱溶液吸收
18.关于室温下pH相同、体积相同的醋酸与盐酸两种稀溶液,下列说法正确的是( )
A.两种酸溶液中,
B.两种酸溶液中,
C.两溶液的导电能力不同
D.与足量的溶液反应,醋酸产生的气体与盐酸产生的气体相等
19.下列有关电化学原理的说法正确的是( )
A.铝—空气燃料电池以KOH为电解液时,负极反应为:
B.用电解法精炼铜,阳极反应为:
C.钢铁在中性条件下被腐蚀,正极反应为:
D.电解法冶炼铝时,阳极反应为:
20.常温下,用0.1000 mol/L的盐酸分别滴定20.00 mL浓度均为0.1000 mol/L三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
A.该NaX溶液中:
B.三种一元弱酸的电离常数:
C.当时,三种溶液中:
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:
21.以铜作催化剂的一种铝硫电池的示意图如图所示,电池放电时的反应原理为:,下列说法错误的是( )
A.放电时,负极反应为
B.充电时,两电极的质量均增加
C.充电时,1 mol Cu反应时,转移2x mol电子
D.放电时,通过阳离子交换膜向电极移动
22.下列有关说法正确的是( )
A.为了减小中和滴定的误差,锥形瓶必须洗净并烘干后才能使用
B.向溶液中滴加过量的NaCl溶液得到浊液,过滤得到的滤液中不含
C.离子交换膜在工业上应用广泛,如氯碱工业中使用阴离子交换膜
D.室温下,的,的,溶液中的与中的不一定相等
23.利用调节pH的方法,可以除去硫酸铜溶液中的亚铁离子(已知:在一定条件下,某些常见阳离子沉淀时对应的pH如表所示),下列说法正确的是( )
阳离子 开始沉淀时 完全沉淀时
2.7 3.7
4.4 6.4
7.6 9.6
A.调节pH可选用
B.调节pH前,应先将氧化为,可选择或作氧化剂
C.控制除杂效果最好
D.将分离得到的硫酸铜溶液蒸干可获得固体
24.用铜片、银片设计成如图所示的原电池以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.盐桥中向左移动
C.开始时,银片上发生的反应是
D.电路中每转移,正极材料增重216g
二、非选择题:4小题,共52分。
25.(13分)和CO是常见的环境污染性气体。
(1)对于反应来说“”可作为此反应的催化剂。其总反应分两步进行:
第一步为,则第二步为________(写方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能________(填“大于”小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:
,容器Ⅰ、Ⅱ、Ⅲ中的平衡转化率如图乙所示:
①该反应的________0(填“>”或“<”)。
②若容器的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器Ⅰ中用表示的反应速率为________。B点对应的平衡常数________(保留两位有效数字)。
③图中A、C、D三点容器内气体密度、、由大到小的顺序是________。
④若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应________(填“向正反应方向进行”“向逆反应方向进行”或“不移动”)。
26.(13分)Ⅰ.某研究小组进行的沉淀溶解平衡的实验探究。
【查阅资料】25℃时,,
【制备试剂】向2支均盛有溶液的试管中分别加入2滴2 mol/L NaOH溶液,制得等量沉淀。
(1)分别向两支试管中加入不同试剂,请填写下表中的实验现象、反应离子方程式。
试管编号 加入试剂 实验现象 反应离子方程式
Ⅰ 2滴溶液 ①________ ②________
Ⅱ 溶液 白色沉淀溶解,得无色溶液
(2)同学们猜想产生试管Ⅱ中现象的主要原因有以下两种。
猜想1:结合电离出的,使的沉淀溶解平衡正向移动。
猜想2:____________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入V mL醋酸铵溶液(),另一支试管中加入和氨水混合液(),两支试管中氢氧化镁均溶解。该实验证明(2)中________(填“猜想1”或“猜想2”)正确。
Ⅱ.工业上常用惰性电极电解硫酸钠溶液联合生产硫酸和烧碱,生产裝置如图所示。测得同温同压下,气体甲、乙的体积比约为1:2。
(4)b电极反应式是________,离子交换膜d为________(填“阳”或“阴”)离子交换膜,产物丙为________溶液(填“名称”)
I某些弱酸在25°C时的电离常数如下:
弱电解质 HSCN HCN HClO
(5)下列反应可以发生的是________(填标号)。
A.
B.
C.
D.
27.(14分)(1)常作食品加工中的食品添加剂,用于焙烤食品;在分析试剂、医药、电子工业中用途广泛。
①几种均为0.1 mol/L的电解质溶液的pH随温度变化的曲线如图甲所示。其中符合溶液的pH随温度变化的曲线是________(填罗马数字),导致溶液的pH随温度变化的原因是________。
②20℃时,溶液中________。
(2)下列图像能说明醋酸钠的水解反应达到平衡的是________(填标号)。
A.溶液中与反应时间t的关系 B.的水解速率与反应时间t的关系 C.溶液的pH与反应时间t的关系 D.与反应时间t的关系
(3)常温下磷酸和氢氧化钠溶液反应获得含磷各物种的分布分数与pH的关系如图所示。由图分析:
的________;利用图中数据计算推测溶液的酸碱性________(写出推理过程和结论)。
(4)室温时,向溶液中滴加0.1 mol/L NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是________点。在b点,溶液中各离子浓度由大到小的排列顺序是________。
28.(12分)Ⅰ.亚硫酸盐是一种常见的食品添加剂。
为检验某食品中亚硫酸盐含量(通常以1 kg样品中含的质量计),某硏究小组同学设计了如下实验方案。
a.称取样品W g;
b.向样品中加入足量稀硫酸;
c.将b中产生的用足量溶液吸收;
d.将c所得硫酸溶液用氢氧化钠标准液滴定;
e.数据处理。
(1)步骤d中可选用的指示剂为________。下图显示滴定终点时,滴定管(量程为25mL)读数为________。
(2)步骤d中消耗0.010 mol/L NaOH溶液V mL,则1kg样品中含的质量是________g(用含W、V的代数式表示)。
(3)步骤d中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有________(填序号)。
①量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
②装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
③滴定开始读数时仰视读数
Ⅱ.(4)绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理如图所示:
A电极的电极反应式是____________________,
B电极的电极反应式是____________________。
(5)以KOH溶液为离子导体,组成清洁燃料电池的总反应式为________。
高二年级化学参考答案及评分标准
一、选择题:本题共24小题,每题2分,共48分。每题只有一项是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12
B A D B C A D B C B A D
13 14 15 16 17 18 19 20 21 22 23 24
C A D D B A D C C D A D
二、非选择题(4小题,共52分)
25.(13分)(1)(2分);大于(2分)
(2)①>(1分) ②(2分);0.0044(2分)
③(2分) ④向逆反应方向进行(2分)
26.(13分)(1)①白色沉淀转化为红褐色沉淀(2分)
②(2分)
(2)铵根离子水解使溶液显酸性,消耗氢氧化镁电离出的氢氧根离子,促进氧氧化镁沉淀溶解平衡正向移动(2分) (3)猜想1(1分)
(4)(2分),阳(1分),硫酸(1分) (5)AB(2分)
27.(14分)(1)①Ⅰ(1分);水解吸热,溶液呈酸性,升高温度使其水解程度增大,pH减小(2分); ②0.1(2分) (2)BC(2分); (3)(1分)
,,,则的水解程度大于电离程度,溶液显碱性(2分)。
(4)a(2分);(2分)
28.(12分)(1)酚酞(或甲基橙)(1分) 20.60 mL(1分)
(2)8V/25W或0.32V/W(2分) (3)①③(2分)
(4)(2分) (2分)
(5)(2分)
同课章节目录
