人教版九年级化学下册 第十一单元盐化肥 课题1生活中常见的盐练习(Word版 含解析)
文档属性
| 名称 | 人教版九年级化学下册 第十一单元盐化肥 课题1生活中常见的盐练习(Word版 含解析) | 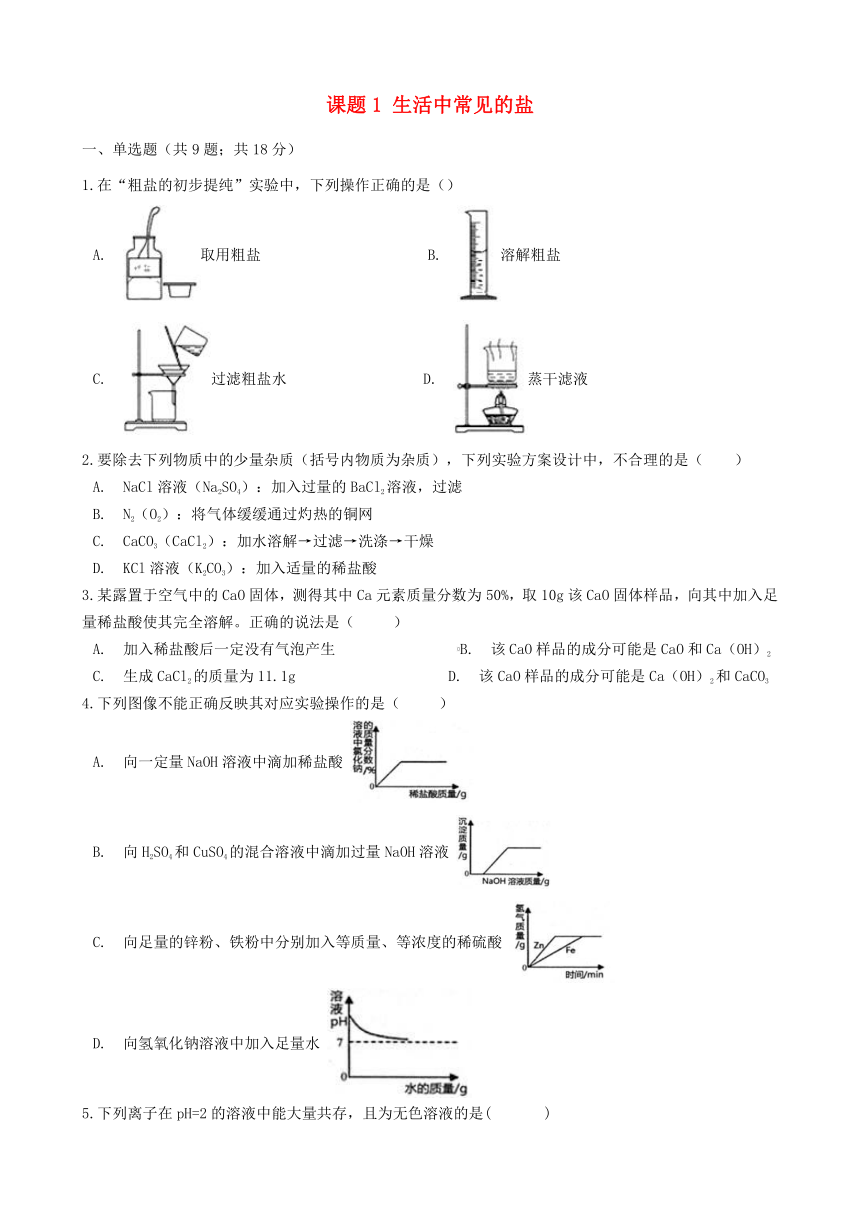 | |
| 格式 | docx | ||
| 文件大小 | 85.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 16:56:39 | ||
图片预览


文档简介
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
课题1 生活中常见的盐
一、单选题(共9题;共18分)
1.在“粗盐的初步提纯”实验中,下列操作正确的是()
A. 取用粗盐 B. 溶解粗盐
C. 过滤粗盐水 D. 蒸干滤液
2.要除去下列物质中的少量杂质(括号内物质为杂质),下列实验方案设计中,不合理的是( )
A. NaCl溶液(Na2SO4):加入过量的BaCl2溶液,过滤
B. N2(O2):将气体缓缓通过灼热的铜网
C. CaCO3(CaCl2):加水溶解→过滤→洗涤→干燥
D. KCl溶液(K2CO3):加入适量的稀盐酸
3.某露置于空气中的CaO固体,测得其中Ca元素质量分数为50%,取10g该CaO固体样品,向其中加入足量稀盐酸使其完全溶解。正确的说法是( )
A. 加入稀盐酸后一定没有气泡产生 B. 该CaO样品的成分可能是CaO和Ca(OH)2
C. 生成CaCl2的质量为11.1g D. 该CaO样品的成分可能是Ca(OH)2和CaCO3
4.下列图像不能正确反映其对应实验操作的是( )
A. 向一定量NaOH溶液中滴加稀盐酸
B. 向H2SO4和CuSO4的混合溶液中滴加过量NaOH溶液
C. 向足量的锌粉、铁粉中分别加入等质量、等浓度的稀硫酸
D. 向氢氧化钠溶液中加入足量水
5.下列离子在pH=2的溶液中能大量共存,且为无色溶液的是( )
A. NH4- Cl- K+ NO3- B. CO32- Na+ Cl- K+
C. Fe3+ Mg2+ NO3- Cl- D. Na+ Ag+ NO3- Cl-
6.有下列六种盐的固体粉末:氯化钠、氯化铁、硝酸银、硝酸钾、硝酸钠、碳酸钙,从中分别取样,两两混合为一组,加入蒸馏水,能得到无色透明溶液的最多有( )
A. 2组 B. 3组 C. 4组 D. 5组
7.下列物质发生反应时生成物都是沉淀的是( )
A. Ba(OH)2 + CuSO4 B. Ca(OH)2 + Na2CO3
C. AgNO3 + NaCl D. NaOH + FeCl3
8.关于化学反应A+B=C+D,下列说法中正确的是( )
A. 若生成物C和D分别是盐和水,则反应物一定是酸和碱
B. 若C是单质、D为化合物,则A和B中一定有一种是单质,一种是化合物
C. 若B是酸,则C和D一定有一种是盐
D. 若A,B各取10g混合,使其充分反应,则C,D质量的总和一定等于20g
9.碳酸氢钠是生活中常见的盐,下列说法错误的是( )
A. 发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
B. 碳酸氢钠和足量盐酸反应的产物与碳酸钠和足量盐酸反应的产物不同
C. 碳酸氢钠和柠檬酸、水等混合制成汽水
D. 碳酸氢钠在医疗上可用作治疗胃酸过多症的药剂
二、填空题(共5题;共16分)
10.家庭厨房中使用最多的碳酸盐是________ , 使用最多的盐酸盐是________ . 重要建筑材料之一大理石和锅炉水垢的主要成分都是________ .
11.下列物质中属于氧化物的是________,属于盐的是________。(填序号)
①冰水共存物 ②液氧 ③空气 ④纯碱 ⑤硫酸 ⑥火碱 ⑦过氧化氢 ⑧高锰酸钾
12.工厂产生的废液中含有硫酸铜、硫酸亚铁、硫酸锌、硫酸。为节能减排,回收硫酸锌及有关金属,设计如下部分流程。
①步骤 I 中操作名称是________。
②固体 A 的成分是________;步骤 II 中滤液 C 内所含溶质有________。
③写出步骤 III 中生成气体的化学方程式________、生成铁的化学方程式是________。
13.Na2CO3俗称纯碱,是一种白色粉末,可以跟CO2和H2O反应生成NaHCO3 , 该反应的化学方程式为________;Na2CO3与稀盐酸反应放出CO2 , 但实验室却不用这个反应制备CO2 , 其主要原因可能是________;已知Na2CO3的溶解度比NaHCO3大,那么在饱和的Na2CO3溶液中连续通人CO2 , 可观察到的现象是________。
14.某园林工人配制农药波尔多液时,将胆矾(CuSO4·5H2O)晶体、生石灰(CaO)分别与水按1∶50的质量比混合(胆矾溶于水得到硫酸铜溶液),然后把得到的两种液体在桶里混合并充分搅拌。
(1)配制波尔多液不使用铁桶的原因是________。
(2)两种液体在桶里反应的化学方程式为________。
(3)若要检验所配制的波尔多液中是否含有CuSO4 , 你的实验方法是________。
三、综合题(共3题;共14分)
15.回答下列与含碳物质有关的问题.
(1)金刚石、石墨、C60都是碳单质,完全燃烧时都会生成________;
(2)在红糖水中加入适量活性炭,充分混合后再过滤、浓缩、冷却便可得到白糖,这是利用了活性炭的________性;
(3)髙炉炼铁的反应原理是:3CO+Fe2O32Fe+3CO2 , 反应中的还原剂是________;
(4)Na2CO3、CaCO3都能与稀HCl反应生成CO2 , 是因为它们的构成中都含有________离子.
16.某工业园区甲、乙两化工厂排放的废水中含有K+、Cu2+、Fe3+、Cl- 、OH-、NO3-六种离子,甲厂含有其中的三种,乙厂含有另外三种,两厂废水的直接排放对当地水质带来严重影响。某课外实践小组对两厂废水进行实地检测,发现甲厂废水星碱性。
(1)甲厂废水中定含有的离子是________,可能含有的离子是________;
(2)经课外实践小组多次实验,发现两厂废水按适当比例混合,可将废水中的某些离子转化为沉淀,这些离子分别是________(填离子符号),过滤后的废水中主要含有________两种物质(填化学式),处理后的废水符合排放标准。
17.酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20℃时的溶解性。
阴离子 阳离子 OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
Na+ 溶 溶 溶 溶 溶
Ca2+ 微 溶 溶 微 不
Ba2+ 溶 溶 溶 不 不
Cu2+ 不 溶 溶 溶 不
请依据上表,按要求回答下列问题:
(1)BaSO4的溶解性为________。
(2)写出一种挥发性酸的化学式________。
(3)氯化钙溶液与硝酸钠溶液填________(“能”或“不能”)发生反应,理由是________。
(4)碱和盐反应时,反应物必须都是可溶的。请写出一个碱和盐反应的化学方程式:________。
(5)NaOH和Ba(OH)2是两种可溶性碱,其溶液均为无色。简要写出鉴别这两种物质的实验步骤及现象________。
参考答案:
一、单选题
1.【答案】 C
2.【答案】 A
3.【答案】 D
4.【答案】 A
5.【答案】 A
6.【答案】 D
7.【答案】 A
8.【答案】 C
9.【答案】B
二、填空题
10.【答案】 碳酸钠;氯化钠;碳酸钙
11.【答案】 ①⑦④;⑧
12.【答案】 过滤;锌、铜、铁;ZnSO4、FeSO4、H2SO4;Zn+H2SO4=ZnSO4+H2↑;Zn+FeSO4=ZnSO4+Fe
13.【答案】 Na2CO3+CO2+H2O=2NaHCO3;Na2CO3与稀盐酸反应速度太快,产生的CO2不易收集;溶液变浑浊(或有晶体析出)
14.【答案】 (1)铁能与硫酸铜溶液发生反应,会腐蚀铁桶和降低农药质量
(2)CuSO4+Ca(OH)2====Cu(OH)2↓+CaSO4
(3)用一支试管取少量波尔多液,插入一根铁丝,若铁丝上覆盖一层红色物质,说明波尔多液中含CuSO4 , 否则不含CuSO4
三、综合题
15.【答案】 (1)二氧化碳
(2)吸附
(3)CO
(4)碳酸根
16.【答案】 (1)OH-和K+;氯离子,硝酸根离子
(2)OH-,Fe3+,Cu2+;KCl和KNO3
17.【答案】 (1)不溶
(2)HNO3(或HCl、H2CO3)
(3)不能;没有沉淀生成,不符合复分解反应发生的条件
(4)Ba(OH)2+Na2SO4═BaSO4↓+2NaOH
(5)分别取少量两种无色溶液于试管中,分别通入二氧化碳,变浑浊的是Ba(OH)2 , 无现象的是NaOH[或分别取少量两种无色溶液于试管中,分别滴加H2SO4或Na2SO4溶液,有白色沉淀生成的是Ba(OH)2 , 无现象的是NaOH]
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
课题1 生活中常见的盐
一、单选题(共9题;共18分)
1.在“粗盐的初步提纯”实验中,下列操作正确的是()
A. 取用粗盐 B. 溶解粗盐
C. 过滤粗盐水 D. 蒸干滤液
2.要除去下列物质中的少量杂质(括号内物质为杂质),下列实验方案设计中,不合理的是( )
A. NaCl溶液(Na2SO4):加入过量的BaCl2溶液,过滤
B. N2(O2):将气体缓缓通过灼热的铜网
C. CaCO3(CaCl2):加水溶解→过滤→洗涤→干燥
D. KCl溶液(K2CO3):加入适量的稀盐酸
3.某露置于空气中的CaO固体,测得其中Ca元素质量分数为50%,取10g该CaO固体样品,向其中加入足量稀盐酸使其完全溶解。正确的说法是( )
A. 加入稀盐酸后一定没有气泡产生 B. 该CaO样品的成分可能是CaO和Ca(OH)2
C. 生成CaCl2的质量为11.1g D. 该CaO样品的成分可能是Ca(OH)2和CaCO3
4.下列图像不能正确反映其对应实验操作的是( )
A. 向一定量NaOH溶液中滴加稀盐酸
B. 向H2SO4和CuSO4的混合溶液中滴加过量NaOH溶液
C. 向足量的锌粉、铁粉中分别加入等质量、等浓度的稀硫酸
D. 向氢氧化钠溶液中加入足量水
5.下列离子在pH=2的溶液中能大量共存,且为无色溶液的是( )
A. NH4- Cl- K+ NO3- B. CO32- Na+ Cl- K+
C. Fe3+ Mg2+ NO3- Cl- D. Na+ Ag+ NO3- Cl-
6.有下列六种盐的固体粉末:氯化钠、氯化铁、硝酸银、硝酸钾、硝酸钠、碳酸钙,从中分别取样,两两混合为一组,加入蒸馏水,能得到无色透明溶液的最多有( )
A. 2组 B. 3组 C. 4组 D. 5组
7.下列物质发生反应时生成物都是沉淀的是( )
A. Ba(OH)2 + CuSO4 B. Ca(OH)2 + Na2CO3
C. AgNO3 + NaCl D. NaOH + FeCl3
8.关于化学反应A+B=C+D,下列说法中正确的是( )
A. 若生成物C和D分别是盐和水,则反应物一定是酸和碱
B. 若C是单质、D为化合物,则A和B中一定有一种是单质,一种是化合物
C. 若B是酸,则C和D一定有一种是盐
D. 若A,B各取10g混合,使其充分反应,则C,D质量的总和一定等于20g
9.碳酸氢钠是生活中常见的盐,下列说法错误的是( )
A. 发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
B. 碳酸氢钠和足量盐酸反应的产物与碳酸钠和足量盐酸反应的产物不同
C. 碳酸氢钠和柠檬酸、水等混合制成汽水
D. 碳酸氢钠在医疗上可用作治疗胃酸过多症的药剂
二、填空题(共5题;共16分)
10.家庭厨房中使用最多的碳酸盐是________ , 使用最多的盐酸盐是________ . 重要建筑材料之一大理石和锅炉水垢的主要成分都是________ .
11.下列物质中属于氧化物的是________,属于盐的是________。(填序号)
①冰水共存物 ②液氧 ③空气 ④纯碱 ⑤硫酸 ⑥火碱 ⑦过氧化氢 ⑧高锰酸钾
12.工厂产生的废液中含有硫酸铜、硫酸亚铁、硫酸锌、硫酸。为节能减排,回收硫酸锌及有关金属,设计如下部分流程。
①步骤 I 中操作名称是________。
②固体 A 的成分是________;步骤 II 中滤液 C 内所含溶质有________。
③写出步骤 III 中生成气体的化学方程式________、生成铁的化学方程式是________。
13.Na2CO3俗称纯碱,是一种白色粉末,可以跟CO2和H2O反应生成NaHCO3 , 该反应的化学方程式为________;Na2CO3与稀盐酸反应放出CO2 , 但实验室却不用这个反应制备CO2 , 其主要原因可能是________;已知Na2CO3的溶解度比NaHCO3大,那么在饱和的Na2CO3溶液中连续通人CO2 , 可观察到的现象是________。
14.某园林工人配制农药波尔多液时,将胆矾(CuSO4·5H2O)晶体、生石灰(CaO)分别与水按1∶50的质量比混合(胆矾溶于水得到硫酸铜溶液),然后把得到的两种液体在桶里混合并充分搅拌。
(1)配制波尔多液不使用铁桶的原因是________。
(2)两种液体在桶里反应的化学方程式为________。
(3)若要检验所配制的波尔多液中是否含有CuSO4 , 你的实验方法是________。
三、综合题(共3题;共14分)
15.回答下列与含碳物质有关的问题.
(1)金刚石、石墨、C60都是碳单质,完全燃烧时都会生成________;
(2)在红糖水中加入适量活性炭,充分混合后再过滤、浓缩、冷却便可得到白糖,这是利用了活性炭的________性;
(3)髙炉炼铁的反应原理是:3CO+Fe2O32Fe+3CO2 , 反应中的还原剂是________;
(4)Na2CO3、CaCO3都能与稀HCl反应生成CO2 , 是因为它们的构成中都含有________离子.
16.某工业园区甲、乙两化工厂排放的废水中含有K+、Cu2+、Fe3+、Cl- 、OH-、NO3-六种离子,甲厂含有其中的三种,乙厂含有另外三种,两厂废水的直接排放对当地水质带来严重影响。某课外实践小组对两厂废水进行实地检测,发现甲厂废水星碱性。
(1)甲厂废水中定含有的离子是________,可能含有的离子是________;
(2)经课外实践小组多次实验,发现两厂废水按适当比例混合,可将废水中的某些离子转化为沉淀,这些离子分别是________(填离子符号),过滤后的废水中主要含有________两种物质(填化学式),处理后的废水符合排放标准。
17.酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20℃时的溶解性。
阴离子 阳离子 OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
Na+ 溶 溶 溶 溶 溶
Ca2+ 微 溶 溶 微 不
Ba2+ 溶 溶 溶 不 不
Cu2+ 不 溶 溶 溶 不
请依据上表,按要求回答下列问题:
(1)BaSO4的溶解性为________。
(2)写出一种挥发性酸的化学式________。
(3)氯化钙溶液与硝酸钠溶液填________(“能”或“不能”)发生反应,理由是________。
(4)碱和盐反应时,反应物必须都是可溶的。请写出一个碱和盐反应的化学方程式:________。
(5)NaOH和Ba(OH)2是两种可溶性碱,其溶液均为无色。简要写出鉴别这两种物质的实验步骤及现象________。
参考答案:
一、单选题
1.【答案】 C
2.【答案】 A
3.【答案】 D
4.【答案】 A
5.【答案】 A
6.【答案】 D
7.【答案】 A
8.【答案】 C
9.【答案】B
二、填空题
10.【答案】 碳酸钠;氯化钠;碳酸钙
11.【答案】 ①⑦④;⑧
12.【答案】 过滤;锌、铜、铁;ZnSO4、FeSO4、H2SO4;Zn+H2SO4=ZnSO4+H2↑;Zn+FeSO4=ZnSO4+Fe
13.【答案】 Na2CO3+CO2+H2O=2NaHCO3;Na2CO3与稀盐酸反应速度太快,产生的CO2不易收集;溶液变浑浊(或有晶体析出)
14.【答案】 (1)铁能与硫酸铜溶液发生反应,会腐蚀铁桶和降低农药质量
(2)CuSO4+Ca(OH)2====Cu(OH)2↓+CaSO4
(3)用一支试管取少量波尔多液,插入一根铁丝,若铁丝上覆盖一层红色物质,说明波尔多液中含CuSO4 , 否则不含CuSO4
三、综合题
15.【答案】 (1)二氧化碳
(2)吸附
(3)CO
(4)碳酸根
16.【答案】 (1)OH-和K+;氯离子,硝酸根离子
(2)OH-,Fe3+,Cu2+;KCl和KNO3
17.【答案】 (1)不溶
(2)HNO3(或HCl、H2CO3)
(3)不能;没有沉淀生成,不符合复分解反应发生的条件
(4)Ba(OH)2+Na2SO4═BaSO4↓+2NaOH
(5)分别取少量两种无色溶液于试管中,分别通入二氧化碳,变浑浊的是Ba(OH)2 , 无现象的是NaOH[或分别取少量两种无色溶液于试管中,分别滴加H2SO4或Na2SO4溶液,有白色沉淀生成的是Ba(OH)2 , 无现象的是NaOH]
同课章节目录
