第5章金属的冶炼与利用测试题-2021-2022学年九年级化学沪教版(全国)上册(word版 含答案)
文档属性
| 名称 | 第5章金属的冶炼与利用测试题-2021-2022学年九年级化学沪教版(全国)上册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 149.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 17:22:08 | ||
图片预览



文档简介
第5章《金属的冶炼与利用》测试题
一、单选题
1.下列是有关我们常用的1元、5角、1角硬币的部分说法,其中错误的是
A.从保值的角度来看,硬币应用纯金属制造
B.硬币的设计应美观、大方
C.硬币的取材一定要于其价值相匹配
D.硬币应具有良好的抗腐蚀性
2.我们的生活离不开金属材料,下列金属材料的使用,主要是利用其导热性的是
A.铂金戒指 B.铜导线 C.铁制门把手 D.不锈钢炒锅
3.下列物质间的转化,在给定条件下能实现的是
A. B.
C. D.
4.下列实验操作能达到实验目的是
选项 实验目的 实验操作
A 鉴别木炭粉和铁粉 用磁铁吸引
B 鉴别氮气和二氧化碳 将燃着的木条分别伸入盛气体的集气瓶中
C 除去CO中的O2 将气体缓慢通过灼热的铜网
D 除去CaO粉末中的CaCO3 加热混合物
A.A B.B C.C D.D
5.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.化学反应通常伴随着能量的变化,则人类利用的能量都是由化学反应提供的
B.分子、原子都是不带电的粒子,所以不带电的粒子一定是分子或原子
C.金属能导电,但是能导电的不一定是金属
D.燃烧需要同时满足三个条件才能发生,所以灭火也一定要同时控制这三个条件
6.下列有关对自行车的做法不合理的是
A.车架表面喷涂油漆 B.钢圈表面镀防护金属
C.露天放置,日晒雨淋 D.链条表面涂机油
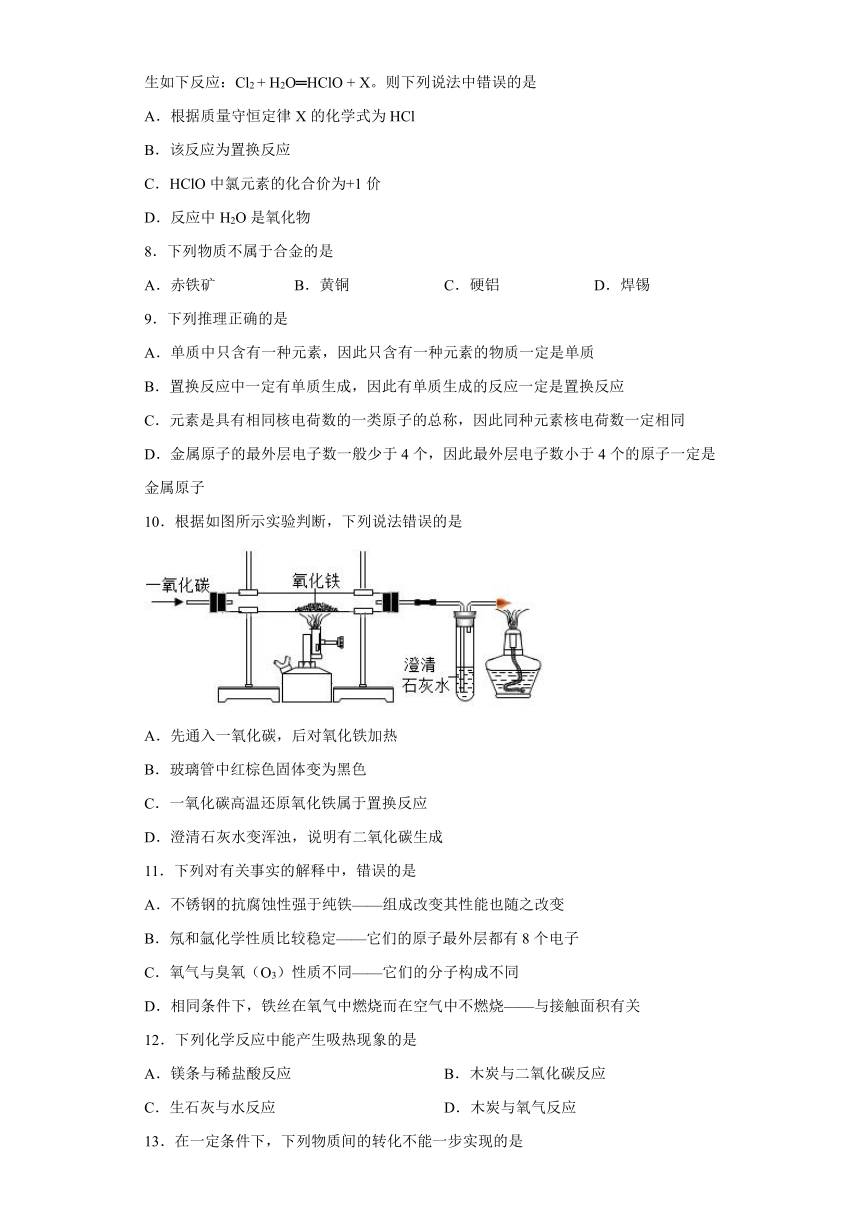
7.为预防新型冠状病毒,人们常用消毒水进行消毒,氯气是一种重要的消毒剂,会发生如下反应:Cl2 + H2O═HClO + X。则下列说法中错误的是
A.根据质量守恒定律X的化学式为HCl
B.该反应为置换反应
C.HClO中氯元素的化合价为+1价
D.反应中H2O是氧化物
8.下列物质不属于合金的是
A.赤铁矿 B.黄铜 C.硬铝 D.焊锡
9.下列推理正确的是
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.置换反应中一定有单质生成,因此有单质生成的反应一定是置换反应
C.元素是具有相同核电荷数的一类原子的总称,因此同种元素核电荷数一定相同
D.金属原子的最外层电子数一般少于4个,因此最外层电子数小于4个的原子一定是金属原子
10.根据如图所示实验判断,下列说法错误的是
A.先通入一氧化碳,后对氧化铁加热
B.玻璃管中红棕色固体变为黑色
C.一氧化碳高温还原氧化铁属于置换反应
D.澄清石灰水变浑浊,说明有二氧化碳生成
11.下列对有关事实的解释中,错误的是
A.不锈钢的抗腐蚀性强于纯铁——组成改变其性能也随之改变
B.氖和氩化学性质比较稳定——它们的原子最外层都有8个电子
C.氧气与臭氧(O3)性质不同——它们的分子构成不同
D.相同条件下,铁丝在氧气中燃烧而在空气中不燃烧——与接触面积有关
12.下列化学反应中能产生吸热现象的是
A.镁条与稀盐酸反应 B.木炭与二氧化碳反应
C.生石灰与水反应 D.木炭与氧气反应
13.在一定条件下,下列物质间的转化不能一步实现的是
A.Fe→Fe3O4 B.Zn→ZnCl2 C.H2CO3→CO D.CaO→Ca(OH)2
14.下列有关金属和金属材料的说法正确的是
A.铜制导线主要利用了铜的导热性
B.生铁的含碳量比钢的含碳量低
C.黄铜片(铜锌合金)的硬度大于纯铜片的硬度
D.铁钉浸没在植物油中比在潮湿空气中更易生锈
15.准确称取某种铁的氧化物2.88g,用足量的CO进行还原,将生成的CO2全部用足量的澄清石灰水吸收,得到沉淀4g,则这种铁的氧化物为
A.Fe3O4 B.Fe2O3 C.FeO D.以上都不是
二、填空题
16.回答下列问题
(1)最简单的有机物的化学式___________。
(2)大豆生长过程中出现叶片边缘发黄的症状,应补充的化肥种类___________。
(3)汽车用铅蓄电池中含有的酸的化学式___________。
(4)消毒液碘酒中的溶剂的化学式___________。
(5)“神舟十号”飞船的发射让航天员再次访问“天宫一号”资源舱舱段使用了铝锂合金材料代替传统材料,铝锂合金属于___________材料(“金属”或“合成”或“复合”)。
17.日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)地壳中含量最高的金属元素是______。
(2)根据下图的金属应用实例推断,金属具有的物理性质有______。
(3)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
合金 合金的主要性能 主要成分及纯金属的性能
焊锡 熔点183℃ 锡:熔点232℃;铅:熔点327℃。
硬铝 强度和硬度好 铝、铜、镁等。硬度小,质软。
不锈钢 抗腐蚀性好 不锈钢的成分有铁、铬、镍等,纯铁抗锈蚀性能不如不锈钢。
由上表可以推断,与组成合金的纯金属相比,合金的优点一般有(填序号)______。
①硬度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性能更好
18.化学知识与我们的生产生活息息相关,请从下列物质中选择相应序号填空。
①汞 ②稀有气体 ③酒精 ④氮气 ⑤水 ⑥明矾
(1)可用于食品防腐的是________________________;
(2)可用于净化水是________________________;
(3)温度计中的液体是________________________;
(4)人体中含量最多的物质是________________________;
(5)通电时会发出有色光的是________________________;
(6)实验室常用的燃料是________________________。
19.2020年7月23日,长征五号运载火箭在中国文昌航天发射场点火起飞,成功将天问一号火星探测器送入预定轨道,中国迈出了行星探测的第一步﹣﹣奔向火星。
(1)长征五号运载火箭用到了钛合金材料,其显著特点是___________(填一点即可)。
(2)“祝融号”上使用了我国自主研发的砷化镓(GaAs)太阳能电池,该电池将___________转化为电能。(CH3)3Ga和AsH3在700℃的条件下反应,可制得砷化镓并生成一种最简单的有机物,请写出该反应的化学方程式___________。
20.金属材料广泛应用于生产、生活中。
(1)家庭用的电线通常用铜来制作,这是利用了金属铜的___________性(填“导电”或“导热”)。室外的高压线用铝线,铝在空气中与氧气反应,生成致密的氧化铝而防锈,该反应的化学方程式为___________。
(2)铁是用量最大的金属。生产铁主要是利用高炉炼铁,其主要反应原理是一氧化碳与氧化铁的反应,该反应的化学方程式为___________。生产出来的铁制品容易生锈,请写出生活中铁制品防锈的一条具体措施:___________。
(3)某锌粉含有铜、镁中的一种杂质,取该样品 13 g 与足量稀盐酸充分反应,生成氢气0.42g,该锌粉中含有的杂质是___________。另取一定量该样品放入硫酸铜溶液中,充分反应后过滤,得到滤渣和滤液。将滤渣洗浄,滴入稀硫酸,有气泡产生,则滤液中一定含有的溶质是__________________(填化学式)。
三、推断题
21.A、B、C、D都是初中化学中常见的物质,A、C为组成元素相同的两种氧化物,D为紫红色金属单质。它们之间的相互转化关系如图(图中反应条件已略去)。请回答:
(1)写出C转化为A的化学方程式___________。
(2)写出A与B反应的化学方程式___________
(3)碳可以和B在高温条件下发生反应,其化学反应类型属于___________反应。
22.A~G是初中化学常见的物质。已知A、D、F均为单质,其中D是日常生产生活中使用最多的金属,B是一种氧化物,C是一种常见的酸,E(相对分子质量为135)的水溶液呈蓝色,它们相互转化关系如图所示(部分生成物和反应条件已略去)。
试回答下列问题:
(1)B的化学式:________。
(2)A在生产生活中的一种用途________。
(3)写出反应①③的化学方程式
①__________;
③___________。
四、实验题
23.炼铁的原理是利用一氧化碳与氧化铁反应。某同学利用该原理设计了一个 实验,实验装置如图所示。对实验进行分析并回答问题。
(1)实验中玻璃管内固体粉末的颜色变化是______,观察到试管中的现象是______。发生反应的化学方程式分别为______,______。
(2)实验时“A.通一氧化碳”与“B.开始加热”的顺序是(填字母)______。
(3)该实验装置的缺陷是______。
24.回答下列实验问题。
(1)现提供下列装置。
①a仪器的名称是______。
②用氯酸钾和二氧化锰制取氧气时的化学方程式是______;应选用的发生装置为______(选填装置序号)。
③小明尝试用碳酸钠粉末和稀硫酸来制取二氧化碳,写出反应的化学方程式______;为收集到干燥的二氧化碳,可将气体先通过盛有______的F装置,再用______装置收集。
(2)如图为实验室模拟工业炼铁的装置。
④实验中正确的操作顺序是______(将下列四个选项的符号正确排序后填空)。
A.点燃酒精喷灯 B.通入一氧化碳
C.停止通入一氧化碳 D.熄灭酒精喷灯
⑤写出硬质玻璃管中反应的化学方程式______。
⑥该装置还存在的缺点是______。
五、计算题
25.现有一块黄铜(锌铜合金),学校实验探究小组的同学想测定黄铜中铜的含量。先用电子秤称得黄铜的质量是25.00g,再用稀盐酸分多次与此黄铜充分反应。实验数据如下表:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量(g) 10.00 10.00 10.00 10.00 10.00
充分反应后剩余固体的质量(g) 24.35 23.70 23.05 23.00 23.00
根据上表中数据分析,完成下列问题:
(1)黄铜中铜的质量是_______克。
(2)所用稀盐酸中溶质的质量分数是_____?
26.2019年12月17日,我国第一艘国产航母“山东号”正式交付中国人民解放军某海军部队。航母的建设需要用到大量钢铁等金属材料,工业上常用赤铁矿石为原料冶炼生铁。赤铁矿石中的氧化铁能与稀硫酸反应,生成氯化铁(可溶性)和水,杂质不溶于水和酸。取20g赤铁矿石于烧杯中,将200g稀硫酸分5次加入,每次加40g,充分反应后过滤、洗涤、干燥、称量,得到实验数据如下:
第一次 第二次 第三次 第四次 第五次
剩余固体质量(g) 15 10 5 4 4
(1)根据以上数据可知,该赤铁矿石样品中氧化铁的质量分数为 。
(2)炼铁厂用该赤铁矿石样品1000t冶炼铁,理论上可炼出纯铁多少吨?(写出计算过程)
参考答案
1.A 2.D 3.B 4.A 5.C 6.C 7.B 8.A 9.C 10.C 11.D 12.B 13.C 14.C 15.C
16.(1)CH4(2)氮肥(3)H2SO4(4)C2H5OH(5)金属
17.(1)铝
(2)导电性、延展性和导热性
(3)②④
18.(1)④(2)⑥(3)①(4)⑤(5)②(6)③
19.(1)耐高温(合理即可)
(2) 太阳能
20.(1) 导电 4Al+3O2=2Al2O3
(2) Fe2O3+3CO2Fe+3CO2 刷油漆等
(3) 镁 MgSO4
21.(1)
(2)
(3)置换
22.(1)CuO
(2)燃料
(3) 略
23.(1) 红色粉末逐渐变成黑色 澄清石灰水变浑浊 Fe2O3+3CO2Fe+3CO2 CO2+Ca(OH)2=CaCO3↓+H2O
(2)AB
(3)缺少尾气处理装置
24.(1) 试管 A 浓硫酸(浓H2SO4) D
(2) BADC 缺乏尾气处理装置(或尾气中的CO未经处理,合理即可)
25.(1)23.00
(2)解:根据实验可知,每10g稀盐酸与0.65g的锌恰好完全反应
设所用稀盐酸中溶质的质量分数为x
x=7.3%;
答:所用稀盐酸中溶质的质量分数是 7.3%。
26.(1)80%;
(2)设可炼出纯铁的质量为x,
解得:x=560t。
答:可炼出纯铁560t。
一、单选题
1.下列是有关我们常用的1元、5角、1角硬币的部分说法,其中错误的是
A.从保值的角度来看,硬币应用纯金属制造
B.硬币的设计应美观、大方
C.硬币的取材一定要于其价值相匹配
D.硬币应具有良好的抗腐蚀性
2.我们的生活离不开金属材料,下列金属材料的使用,主要是利用其导热性的是
A.铂金戒指 B.铜导线 C.铁制门把手 D.不锈钢炒锅
3.下列物质间的转化,在给定条件下能实现的是
A. B.
C. D.
4.下列实验操作能达到实验目的是
选项 实验目的 实验操作
A 鉴别木炭粉和铁粉 用磁铁吸引
B 鉴别氮气和二氧化碳 将燃着的木条分别伸入盛气体的集气瓶中
C 除去CO中的O2 将气体缓慢通过灼热的铜网
D 除去CaO粉末中的CaCO3 加热混合物
A.A B.B C.C D.D
5.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.化学反应通常伴随着能量的变化,则人类利用的能量都是由化学反应提供的
B.分子、原子都是不带电的粒子,所以不带电的粒子一定是分子或原子
C.金属能导电,但是能导电的不一定是金属
D.燃烧需要同时满足三个条件才能发生,所以灭火也一定要同时控制这三个条件
6.下列有关对自行车的做法不合理的是
A.车架表面喷涂油漆 B.钢圈表面镀防护金属
C.露天放置,日晒雨淋 D.链条表面涂机油
7.为预防新型冠状病毒,人们常用消毒水进行消毒,氯气是一种重要的消毒剂,会发生如下反应:Cl2 + H2O═HClO + X。则下列说法中错误的是
A.根据质量守恒定律X的化学式为HCl
B.该反应为置换反应
C.HClO中氯元素的化合价为+1价
D.反应中H2O是氧化物
8.下列物质不属于合金的是
A.赤铁矿 B.黄铜 C.硬铝 D.焊锡
9.下列推理正确的是
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.置换反应中一定有单质生成,因此有单质生成的反应一定是置换反应
C.元素是具有相同核电荷数的一类原子的总称,因此同种元素核电荷数一定相同
D.金属原子的最外层电子数一般少于4个,因此最外层电子数小于4个的原子一定是金属原子
10.根据如图所示实验判断,下列说法错误的是
A.先通入一氧化碳,后对氧化铁加热
B.玻璃管中红棕色固体变为黑色
C.一氧化碳高温还原氧化铁属于置换反应
D.澄清石灰水变浑浊,说明有二氧化碳生成
11.下列对有关事实的解释中,错误的是
A.不锈钢的抗腐蚀性强于纯铁——组成改变其性能也随之改变
B.氖和氩化学性质比较稳定——它们的原子最外层都有8个电子
C.氧气与臭氧(O3)性质不同——它们的分子构成不同
D.相同条件下,铁丝在氧气中燃烧而在空气中不燃烧——与接触面积有关
12.下列化学反应中能产生吸热现象的是
A.镁条与稀盐酸反应 B.木炭与二氧化碳反应
C.生石灰与水反应 D.木炭与氧气反应
13.在一定条件下,下列物质间的转化不能一步实现的是
A.Fe→Fe3O4 B.Zn→ZnCl2 C.H2CO3→CO D.CaO→Ca(OH)2
14.下列有关金属和金属材料的说法正确的是
A.铜制导线主要利用了铜的导热性
B.生铁的含碳量比钢的含碳量低
C.黄铜片(铜锌合金)的硬度大于纯铜片的硬度
D.铁钉浸没在植物油中比在潮湿空气中更易生锈
15.准确称取某种铁的氧化物2.88g,用足量的CO进行还原,将生成的CO2全部用足量的澄清石灰水吸收,得到沉淀4g,则这种铁的氧化物为
A.Fe3O4 B.Fe2O3 C.FeO D.以上都不是
二、填空题
16.回答下列问题
(1)最简单的有机物的化学式___________。
(2)大豆生长过程中出现叶片边缘发黄的症状,应补充的化肥种类___________。
(3)汽车用铅蓄电池中含有的酸的化学式___________。
(4)消毒液碘酒中的溶剂的化学式___________。
(5)“神舟十号”飞船的发射让航天员再次访问“天宫一号”资源舱舱段使用了铝锂合金材料代替传统材料,铝锂合金属于___________材料(“金属”或“合成”或“复合”)。
17.日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)地壳中含量最高的金属元素是______。
(2)根据下图的金属应用实例推断,金属具有的物理性质有______。
(3)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
合金 合金的主要性能 主要成分及纯金属的性能
焊锡 熔点183℃ 锡:熔点232℃;铅:熔点327℃。
硬铝 强度和硬度好 铝、铜、镁等。硬度小,质软。
不锈钢 抗腐蚀性好 不锈钢的成分有铁、铬、镍等,纯铁抗锈蚀性能不如不锈钢。
由上表可以推断,与组成合金的纯金属相比,合金的优点一般有(填序号)______。
①硬度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性能更好
18.化学知识与我们的生产生活息息相关,请从下列物质中选择相应序号填空。
①汞 ②稀有气体 ③酒精 ④氮气 ⑤水 ⑥明矾
(1)可用于食品防腐的是________________________;
(2)可用于净化水是________________________;
(3)温度计中的液体是________________________;
(4)人体中含量最多的物质是________________________;
(5)通电时会发出有色光的是________________________;
(6)实验室常用的燃料是________________________。
19.2020年7月23日,长征五号运载火箭在中国文昌航天发射场点火起飞,成功将天问一号火星探测器送入预定轨道,中国迈出了行星探测的第一步﹣﹣奔向火星。
(1)长征五号运载火箭用到了钛合金材料,其显著特点是___________(填一点即可)。
(2)“祝融号”上使用了我国自主研发的砷化镓(GaAs)太阳能电池,该电池将___________转化为电能。(CH3)3Ga和AsH3在700℃的条件下反应,可制得砷化镓并生成一种最简单的有机物,请写出该反应的化学方程式___________。
20.金属材料广泛应用于生产、生活中。
(1)家庭用的电线通常用铜来制作,这是利用了金属铜的___________性(填“导电”或“导热”)。室外的高压线用铝线,铝在空气中与氧气反应,生成致密的氧化铝而防锈,该反应的化学方程式为___________。
(2)铁是用量最大的金属。生产铁主要是利用高炉炼铁,其主要反应原理是一氧化碳与氧化铁的反应,该反应的化学方程式为___________。生产出来的铁制品容易生锈,请写出生活中铁制品防锈的一条具体措施:___________。
(3)某锌粉含有铜、镁中的一种杂质,取该样品 13 g 与足量稀盐酸充分反应,生成氢气0.42g,该锌粉中含有的杂质是___________。另取一定量该样品放入硫酸铜溶液中,充分反应后过滤,得到滤渣和滤液。将滤渣洗浄,滴入稀硫酸,有气泡产生,则滤液中一定含有的溶质是__________________(填化学式)。
三、推断题
21.A、B、C、D都是初中化学中常见的物质,A、C为组成元素相同的两种氧化物,D为紫红色金属单质。它们之间的相互转化关系如图(图中反应条件已略去)。请回答:
(1)写出C转化为A的化学方程式___________。
(2)写出A与B反应的化学方程式___________
(3)碳可以和B在高温条件下发生反应,其化学反应类型属于___________反应。
22.A~G是初中化学常见的物质。已知A、D、F均为单质,其中D是日常生产生活中使用最多的金属,B是一种氧化物,C是一种常见的酸,E(相对分子质量为135)的水溶液呈蓝色,它们相互转化关系如图所示(部分生成物和反应条件已略去)。
试回答下列问题:
(1)B的化学式:________。
(2)A在生产生活中的一种用途________。
(3)写出反应①③的化学方程式
①__________;
③___________。
四、实验题
23.炼铁的原理是利用一氧化碳与氧化铁反应。某同学利用该原理设计了一个 实验,实验装置如图所示。对实验进行分析并回答问题。
(1)实验中玻璃管内固体粉末的颜色变化是______,观察到试管中的现象是______。发生反应的化学方程式分别为______,______。
(2)实验时“A.通一氧化碳”与“B.开始加热”的顺序是(填字母)______。
(3)该实验装置的缺陷是______。
24.回答下列实验问题。
(1)现提供下列装置。
①a仪器的名称是______。
②用氯酸钾和二氧化锰制取氧气时的化学方程式是______;应选用的发生装置为______(选填装置序号)。
③小明尝试用碳酸钠粉末和稀硫酸来制取二氧化碳,写出反应的化学方程式______;为收集到干燥的二氧化碳,可将气体先通过盛有______的F装置,再用______装置收集。
(2)如图为实验室模拟工业炼铁的装置。
④实验中正确的操作顺序是______(将下列四个选项的符号正确排序后填空)。
A.点燃酒精喷灯 B.通入一氧化碳
C.停止通入一氧化碳 D.熄灭酒精喷灯
⑤写出硬质玻璃管中反应的化学方程式______。
⑥该装置还存在的缺点是______。
五、计算题
25.现有一块黄铜(锌铜合金),学校实验探究小组的同学想测定黄铜中铜的含量。先用电子秤称得黄铜的质量是25.00g,再用稀盐酸分多次与此黄铜充分反应。实验数据如下表:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量(g) 10.00 10.00 10.00 10.00 10.00
充分反应后剩余固体的质量(g) 24.35 23.70 23.05 23.00 23.00
根据上表中数据分析,完成下列问题:
(1)黄铜中铜的质量是_______克。
(2)所用稀盐酸中溶质的质量分数是_____?
26.2019年12月17日,我国第一艘国产航母“山东号”正式交付中国人民解放军某海军部队。航母的建设需要用到大量钢铁等金属材料,工业上常用赤铁矿石为原料冶炼生铁。赤铁矿石中的氧化铁能与稀硫酸反应,生成氯化铁(可溶性)和水,杂质不溶于水和酸。取20g赤铁矿石于烧杯中,将200g稀硫酸分5次加入,每次加40g,充分反应后过滤、洗涤、干燥、称量,得到实验数据如下:
第一次 第二次 第三次 第四次 第五次
剩余固体质量(g) 15 10 5 4 4
(1)根据以上数据可知,该赤铁矿石样品中氧化铁的质量分数为 。
(2)炼铁厂用该赤铁矿石样品1000t冶炼铁,理论上可炼出纯铁多少吨?(写出计算过程)
参考答案
1.A 2.D 3.B 4.A 5.C 6.C 7.B 8.A 9.C 10.C 11.D 12.B 13.C 14.C 15.C
16.(1)CH4(2)氮肥(3)H2SO4(4)C2H5OH(5)金属
17.(1)铝
(2)导电性、延展性和导热性
(3)②④
18.(1)④(2)⑥(3)①(4)⑤(5)②(6)③
19.(1)耐高温(合理即可)
(2) 太阳能
20.(1) 导电 4Al+3O2=2Al2O3
(2) Fe2O3+3CO2Fe+3CO2 刷油漆等
(3) 镁 MgSO4
21.(1)
(2)
(3)置换
22.(1)CuO
(2)燃料
(3) 略
23.(1) 红色粉末逐渐变成黑色 澄清石灰水变浑浊 Fe2O3+3CO2Fe+3CO2 CO2+Ca(OH)2=CaCO3↓+H2O
(2)AB
(3)缺少尾气处理装置
24.(1) 试管 A 浓硫酸(浓H2SO4) D
(2) BADC 缺乏尾气处理装置(或尾气中的CO未经处理,合理即可)
25.(1)23.00
(2)解:根据实验可知,每10g稀盐酸与0.65g的锌恰好完全反应
设所用稀盐酸中溶质的质量分数为x
x=7.3%;
答:所用稀盐酸中溶质的质量分数是 7.3%。
26.(1)80%;
(2)设可炼出纯铁的质量为x,
解得:x=560t。
答:可炼出纯铁560t。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
