广西百色市2021-2022学年高二上学期期末教学质量调研化学试题(Word版含答案)
文档属性
| 名称 | 广西百色市2021-2022学年高二上学期期末教学质量调研化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 753.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-18 21:14:10 | ||
图片预览


文档简介
百色市2021-2022学年高二上学期期末教学质量调研
化学
(试卷总分:100分 考试时间90分钟)
注意事项∶
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡指定位置上。
2.本试卷分为第I卷(选择题)和第I卷(非选择题)两部分。回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,必须用0.5血黑色签字笔答题,将答案写在答题卡上,在本试卷上作答无效。
3.考试结束后,只交答题卡,试卷自行保存。
可能用到的相对原子质量∶H-1 C-12 O-16 Cu-64
第I卷(选择题共48 分)
一、选择题:本题共16题,每题3分,共48分;每题只有1个选项符合题意。
1.化学与人类生产、生活、社会可持续发展密切相关。下列说法不正确的是
A.用纯碱溶液清洗油污时,加热可以增强其去污力
B.为保护地下钢管不受腐蚀,可使它与锌板相连
C.煤、石油、天然气都是可再生能源
D.“一带一路”是“丝绸之路经济带”的简称,丝绸的主要成分是蛋白质,属于高分子化合物
2.化学用语是学习化学的工具,下列说法正确的是
A.乙烯的结构简式: CH2=CH2 B. CO2的空间结构模型:
C.氯化氢的电子式: D. S2-的结构示意图为:
3.原电池为电化学建构认识模型奠定了重要的基础,下图装置中的盐桥装有琼脂凝胶、内含氯化钾。下列对于
该原电池说法错误的是
A.该装置能将化学能转化为电能
C.负极反应为Zn—2e—=Zn2+,发生还原反应
D.电池工作时,盐桥中的K+移向AgNO3溶液
ZnSO.溶液AgNOg溶液
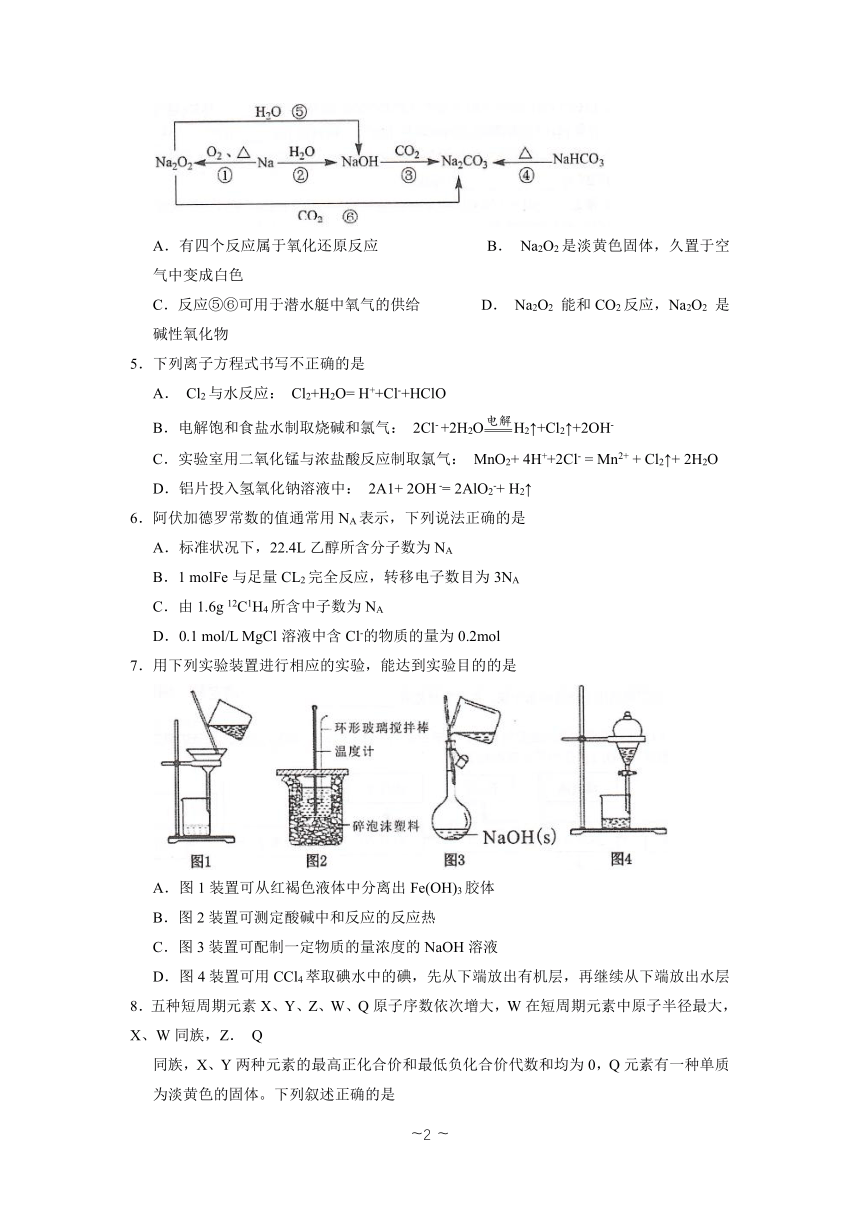
4.以不同类别物质间的转化为线索,认识钠及其化合物。下列分析不正确的是
A.有四个反应属于氧化还原反应 B. Na2O2是淡黄色固体,久置于空气中变成白色
C.反应⑤⑥可用于潜水艇中氧气的供给 D. Na2O2 能和CO2反应,Na2O2 是碱性氧化物
5.下列离子方程式书写不正确的是
A. Cl2与水反应: Cl2+H2O= H++Cl-+HClO
B.电解饱和食盐水制取烧碱和氯气: 2Cl- +2H2OH2↑+Cl2↑+2OH-
C.实验室用二氧化锰与浓盐酸反应制取氯气: MnO2+ 4H++2Cl- = Mn2+ + Cl2↑+ 2H2O
D.铝片投入氢氧化钠溶液中: 2A1+ 2OH -= 2AlO2-+ H2↑
6.阿伏加德罗常数的值通常用NA表示,下列说法正确的是
A.标准状况下,22.4L乙醇所含分子数为NA
B.1 molFe与足量CL2完全反应,转移电子数目为3NA
C.由1.6g 12C1H4所含中子数为NA
D.0.1 mol/L MgCl溶液中含Cl-的物质的量为0.2mol
7.用下列实验装置进行相应的实验,能达到实验目的的是
A.图1装置可从红褐色液体中分离出Fe(OH)3胶体
B.图2装置可测定酸碱中和反应的反应热
C.图3装置可配制一定物质的量浓度的NaOH溶液
D.图4装置可用CCl4萃取碘水中的碘,先从下端放出有机层,再继续从下端放出水层
8.五种短周期元素X、Y、Z、W、Q原子序数依次增大,W在短周期元素中原子半径最大,X、W同族,Z. Q
同族,X、Y两种元素的最高正化合价和最低负化合价代数和均为0,Q元素有一种单质为淡黄色的固体。下列叙述正确的是
A.Z、W两种元素简单离子的半径大小: Z< W
B.Q、Y元素的最高价氧化物的水化物的酸性: QC.X、Z、W形成的化合物既含有离子键也含有共价键
D.X与Z形成的化合物中各原子均满足最外层8电子稳定结构
9.常见的四种有机物的比例模型如图,下列叙述 正确的是( )
A.甲能使酸性高锰酸钾溶液褪色 B.乙可与溴水发生取代反应使溴水褪色
C.丙在铁作催化剂下与溴水发生取代反应 D.丁在浓硫酸作用下可与乙酸发生酯化反应
10.理论研究表明,在101kPa和298K下,HCN(g)HNC(g) 异构化反应过程的能量变化如图所示。下列说法正确的是
A. HNC比HCN更稳定
B.该异构化反应的ΔH = +59.3 kJ/mol
C.该异构化反应一定需要加热才能发生
D.使用催化剂,可降低活化能,改变反应热
11.下列物质的水溶液因水解显酸性的是
A. NH4Cl B. K2CO3 C. CH3COOH D. K2SO4
12.在密闭容器中进行反应H2(g)+I2(g)2Hl(g) ΔH<0,该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、 T4时刻只改变一个条件,下列说法正确的是
A.决定化学反应速率快慢的主要因素是外部因素
B.在t1~t2时,H2的转化率最大
C.在t2时,采取的措施是升高温度
D.在t4时,采取的措施可以是增大压强
13.已知25°C、101 kPa时,
①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;
②2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol;
③2H2(g)+O2(g)= 2H2O(g) ΔH= 483.6 kJ/mol;
下列判断不正确的是
A.6g碳完全燃烧时放出热量196.75 kJ
B.反应②可以自发进行
C.H2的燃烧热ΔH= -241.8 kJ/mol
D.制备水煤气的热化学反应方程式为: C(S)+H2O(g)=CO(g)+H2(g) ΔH= + 131.3 kJ/mol
14.根据右图回答,下列说法不正确的是
A. X极为电源的正极
B.此装置用于铁器表面镀铜时,a电极为铜,一段时间后Cu2+的
浓度变小
C.若a、b均为石墨电极,a的电极反应式为:2H2O- 4e-=O2↑+4H+
D.若用该装置进行粗铜的精炼,当有0.2NA电子转移时,可得到
6.4g精铜
15.常温时,用0.10mol/L NaOH溶液滴定25.00mL 0.10molL某一元酸HX的溶液,滴定过程中pH变化曲线如图所示,下列判断不正确的是
A.HX为一元弱酸
B. V(NaOH 溶液)=12.50mL时,c(X-)>c(Na+ )>c(H+)>c(OH-)
C.溶液pH=7时,HX和NaOH恰好完全反应
D.V(NaOH溶液)=25.00mL时,c(Na+)= c(X-)+c(HX)
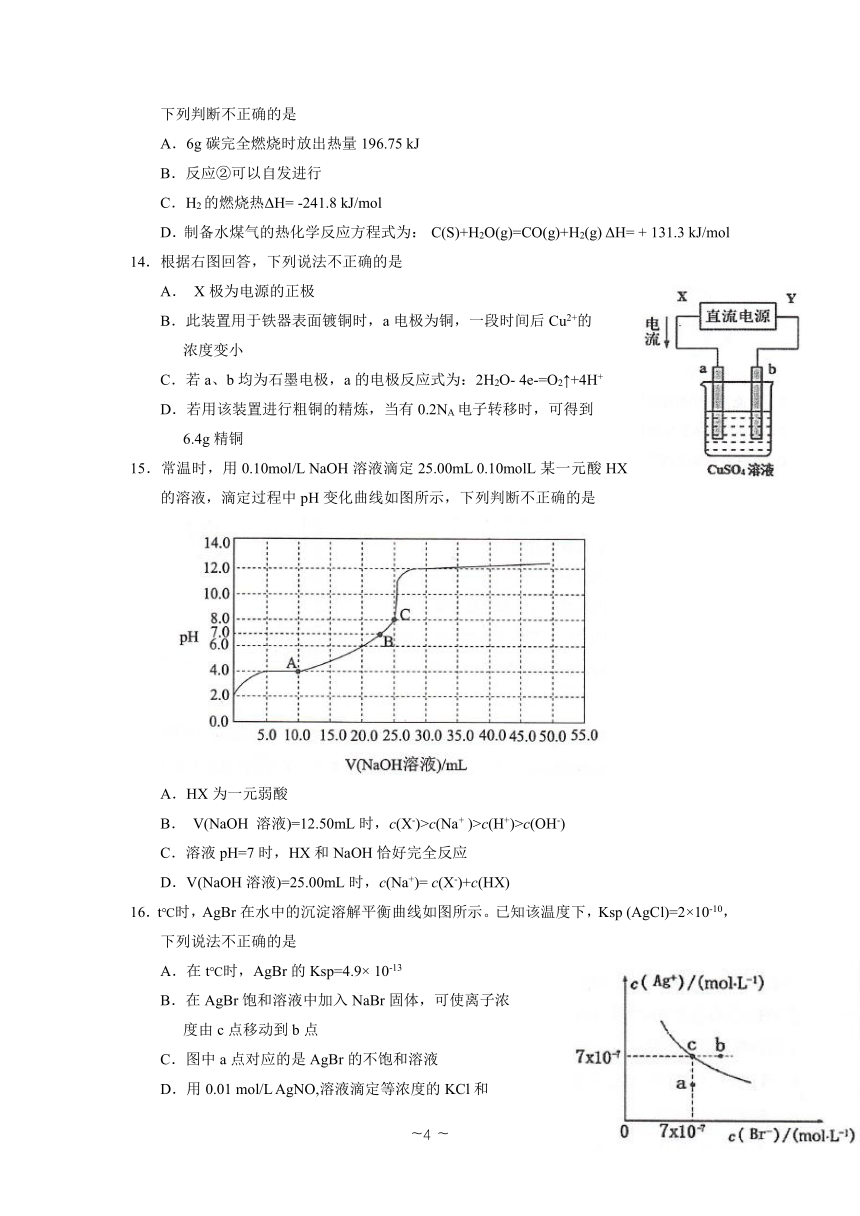
16.t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。已知该温度下,Ksp (AgCl)=2×10-10,下列说法不正确的是
A.在t℃时,AgBr的Ksp=4.9× 10-13
B.在AgBr饱和溶液中加入NaBr固体,可使离子浓
度由c点移动到b点
C.图中a点对应的是AgBr的不饱和溶液
D.用0.01 mol/L AgNO,溶液滴定等浓度的KCl和
KBr的混合液,先产生AgBr沉淀
第I卷(共52分)
二、非选择题:本题包括四小题,共'52分。
17.(13分)据普通高中化学课程标准要求,强酸与强碱的中和滴定是学生必做的实验。
现某学生为测定NaOH溶液的浓度,用盐酸标准溶液进行滴定,实验如下:
(1)配制100 mL 0.1000 mol/L盐酸标准溶液时,所需仪器除量筒、烧杯、玻
璃棒、胶头滴管外,还需要的玻璃仪器是 。
(2)用 (填“甲”或“乙”)滴定管量取20.00 mL待测NaOH溶液
放入锥形瓶中,滴加2~3滴酚酞溶液作指示剂,再用盐酸标准溶液进行滴定,
本实验达到滴定终点的标志是 。
(3)右图表示50mL滴定管在滴定前后液面的位置,消耗的盐酸溶液的体中
积为 _mL,进而计算出NaOH溶液的浓度为 。
(4)下列操作对测定结果有何影响 (填“偏高”“偏低”或“无影响”)
①酸式滴定管水洗后未用盐酸标准溶液润洗 。
②滴定到达终点时,俯视读出滴定管读数 。
③锥形瓶用水洗涤后未干燥,直接装待测液 。
18.(13 分)矿渣的成分主要为CuO,还有少量的Fe2O3、FeO、 SiO2, 工业上用该矿渣获取胆矾CuSO4·5H2O的工艺流程如下图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH (室温 )
Cu(OH)2 Fe(OH)3 Fe(OH)2
开始沉淀的pH 5.4 2.7 5.8
沉淀完全的pH 6.7 3.7 8.8
(1)滤渣A的成分是 ,为了加快反应1的速率,可以采取的措施是 (写 1条)。
(2)反应1矿渣的主要成分CuO与稀硫酸反应的离子方程式为 ,往滤液1中加入H2O2的目的是 。
(3)①物质Y的作用是调节溶液的pH值,加入的最佳物质为 。
A. NaOH B. HCl C. CuO D. NH3·H2O
②根据表格信息,调节pH值的范围是 。
(4)已知溶液中离子浓度≤10-5mol/L'时,认为该离子完全沉淀。室温下,Ksp[Fe(OH)3]=
19. (14 分)
I.氮及其化合物在工农业生产、生活中有着重要作用。氮气在一定的温度、压强和催化剂的作用下可合成氨: N2(g)+3H2(g)2NH3 (g)。
(1)在恒温固定容积的反应室中,能说明上述反应达到平衡状态的是 。
A. N2、 H2、NH3的物质的量浓度之比为1 :3:2 B. 混合气体总物质的量不再变化
C.混合气体的密度不再变化 D.3v ×(NH3)=2v迪(H2)
(2)一定条件下,合成氨反应中N2的平衡转化率与温度、压强的
关系如图所示。从图中可知,p1 p2(填“<”、“>”或
“=”,下同),正反应的ΔH _0。
(3)下列措施一定能使c(QNH3)/c(N2)减小的是 。
A.升高温度 B.恒温恒容充入惰性气体
C.恒温恒压充入N2 D.加入更高效的催化剂
(4)200℃、P1条件下,将1molN2和3molH2通入2L的反应室,tmin末NH3(g)的浓度为0.4 mol/L,t min内H2的反应速率为 _mol·L-1·min-1 (用含有t的代数式表示);该条件下化学平衡常数K=________ (列式即可,不用计算出结果)。
II.有人设想以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氨的新型燃料电池,装置如图所示。
(5)电池正极发生的电极反应式是
20.(12 分)已知25℃时,部分弱酸的电离平衡常数如下表:
弱酸 HCOOH HClO H2CO3 CH3COOH
电离平衡常数 Ka=1.77×10-4 Ka=4.0×10-8 Ka1=4.3×10-7 Ka2=4.7×10-11 Ka=1.75×10 -5
(1) NaClO溶液显 性,用离子方程式表示原因 。
(2) CH3COOH溶液中加少量的CH3COONa固体,平衡 移动(填“正向”、“逆向”或“不”);若取pH=3的醋酸溶液用水稀释100倍,稀释后pH___ 5(填“>”、 “<"或“=”)。
(3)室温下,相同浓度的四种溶液①HCOONa ②NaClO ③Na2CO3 ④NaHCO3的pH由大到小的顺序为
(填编号)。
(4)常温下,pH=3 的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 .
(5)常温下,在pH=6的HClO溶液中由水电离出来的c(H+)= 。
百色市2021-2022学年高二上学期期末教学质量调研
化学
选择题:本题共16题,每题3分,共48分。每题只有1个选项符合题意。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 C A C D D B B C D B A D C B C B
17.(共13分,第(4)问每空1分,其余每空2分)
(1)100 mL容量瓶(2分)
乙 (2分) 当滴入最后一滴盐酸时,溶液由红色变为无色,且半分钟内不褪色(2分)
24.60(2分) 0.1230 mol·L-1(2分)
①偏高(1分) ②偏低(1分) ③无影响(1分)
18.(共13分,除第1空外,其余每空2分)
(1)SiO2(1分) 适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等 (2分)
CuO+ 2H+ = Cu2++H2O (2分)
将Fe2+氧化为Fe3+(2分)
(3)①C (2分) ②3.7≤ pH < 5.4(2分)
(4)10-35.9 (2分)
19.(共14分)
(1)BD(2分)
(2)(2)<(2分)
(3)AC(2分)
(4)0.6/t(2分)
0.12/(0.45×1.353) (2分)
(5)N2+6e-+8H+=2NH4+ (2分)
20.(共12分)
(1)碱(1分) ClO-+H2O HClO+OH-(2分)
(2)逆向(1分) <(2分)
(3)③>②>④>①(2分)
(4)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(2分)
(5)10-8(2分)
~1 ~
化学
(试卷总分:100分 考试时间90分钟)
注意事项∶
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡指定位置上。
2.本试卷分为第I卷(选择题)和第I卷(非选择题)两部分。回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,必须用0.5血黑色签字笔答题,将答案写在答题卡上,在本试卷上作答无效。
3.考试结束后,只交答题卡,试卷自行保存。
可能用到的相对原子质量∶H-1 C-12 O-16 Cu-64
第I卷(选择题共48 分)
一、选择题:本题共16题,每题3分,共48分;每题只有1个选项符合题意。
1.化学与人类生产、生活、社会可持续发展密切相关。下列说法不正确的是
A.用纯碱溶液清洗油污时,加热可以增强其去污力
B.为保护地下钢管不受腐蚀,可使它与锌板相连
C.煤、石油、天然气都是可再生能源
D.“一带一路”是“丝绸之路经济带”的简称,丝绸的主要成分是蛋白质,属于高分子化合物
2.化学用语是学习化学的工具,下列说法正确的是
A.乙烯的结构简式: CH2=CH2 B. CO2的空间结构模型:
C.氯化氢的电子式: D. S2-的结构示意图为:
3.原电池为电化学建构认识模型奠定了重要的基础,下图装置中的盐桥装有琼脂凝胶、内含氯化钾。下列对于
该原电池说法错误的是
A.该装置能将化学能转化为电能
C.负极反应为Zn—2e—=Zn2+,发生还原反应
D.电池工作时,盐桥中的K+移向AgNO3溶液
ZnSO.溶液AgNOg溶液
4.以不同类别物质间的转化为线索,认识钠及其化合物。下列分析不正确的是
A.有四个反应属于氧化还原反应 B. Na2O2是淡黄色固体,久置于空气中变成白色
C.反应⑤⑥可用于潜水艇中氧气的供给 D. Na2O2 能和CO2反应,Na2O2 是碱性氧化物
5.下列离子方程式书写不正确的是
A. Cl2与水反应: Cl2+H2O= H++Cl-+HClO
B.电解饱和食盐水制取烧碱和氯气: 2Cl- +2H2OH2↑+Cl2↑+2OH-
C.实验室用二氧化锰与浓盐酸反应制取氯气: MnO2+ 4H++2Cl- = Mn2+ + Cl2↑+ 2H2O
D.铝片投入氢氧化钠溶液中: 2A1+ 2OH -= 2AlO2-+ H2↑
6.阿伏加德罗常数的值通常用NA表示,下列说法正确的是
A.标准状况下,22.4L乙醇所含分子数为NA
B.1 molFe与足量CL2完全反应,转移电子数目为3NA
C.由1.6g 12C1H4所含中子数为NA
D.0.1 mol/L MgCl溶液中含Cl-的物质的量为0.2mol
7.用下列实验装置进行相应的实验,能达到实验目的的是
A.图1装置可从红褐色液体中分离出Fe(OH)3胶体
B.图2装置可测定酸碱中和反应的反应热
C.图3装置可配制一定物质的量浓度的NaOH溶液
D.图4装置可用CCl4萃取碘水中的碘,先从下端放出有机层,再继续从下端放出水层
8.五种短周期元素X、Y、Z、W、Q原子序数依次增大,W在短周期元素中原子半径最大,X、W同族,Z. Q
同族,X、Y两种元素的最高正化合价和最低负化合价代数和均为0,Q元素有一种单质为淡黄色的固体。下列叙述正确的是
A.Z、W两种元素简单离子的半径大小: Z< W
B.Q、Y元素的最高价氧化物的水化物的酸性: Q
D.X与Z形成的化合物中各原子均满足最外层8电子稳定结构
9.常见的四种有机物的比例模型如图,下列叙述 正确的是( )
A.甲能使酸性高锰酸钾溶液褪色 B.乙可与溴水发生取代反应使溴水褪色
C.丙在铁作催化剂下与溴水发生取代反应 D.丁在浓硫酸作用下可与乙酸发生酯化反应
10.理论研究表明,在101kPa和298K下,HCN(g)HNC(g) 异构化反应过程的能量变化如图所示。下列说法正确的是
A. HNC比HCN更稳定
B.该异构化反应的ΔH = +59.3 kJ/mol
C.该异构化反应一定需要加热才能发生
D.使用催化剂,可降低活化能,改变反应热
11.下列物质的水溶液因水解显酸性的是
A. NH4Cl B. K2CO3 C. CH3COOH D. K2SO4
12.在密闭容器中进行反应H2(g)+I2(g)2Hl(g) ΔH<0,该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、 T4时刻只改变一个条件,下列说法正确的是
A.决定化学反应速率快慢的主要因素是外部因素
B.在t1~t2时,H2的转化率最大
C.在t2时,采取的措施是升高温度
D.在t4时,采取的措施可以是增大压强
13.已知25°C、101 kPa时,
①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;
②2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol;
③2H2(g)+O2(g)= 2H2O(g) ΔH= 483.6 kJ/mol;
下列判断不正确的是
A.6g碳完全燃烧时放出热量196.75 kJ
B.反应②可以自发进行
C.H2的燃烧热ΔH= -241.8 kJ/mol
D.制备水煤气的热化学反应方程式为: C(S)+H2O(g)=CO(g)+H2(g) ΔH= + 131.3 kJ/mol
14.根据右图回答,下列说法不正确的是
A. X极为电源的正极
B.此装置用于铁器表面镀铜时,a电极为铜,一段时间后Cu2+的
浓度变小
C.若a、b均为石墨电极,a的电极反应式为:2H2O- 4e-=O2↑+4H+
D.若用该装置进行粗铜的精炼,当有0.2NA电子转移时,可得到
6.4g精铜
15.常温时,用0.10mol/L NaOH溶液滴定25.00mL 0.10molL某一元酸HX的溶液,滴定过程中pH变化曲线如图所示,下列判断不正确的是
A.HX为一元弱酸
B. V(NaOH 溶液)=12.50mL时,c(X-)>c(Na+ )>c(H+)>c(OH-)
C.溶液pH=7时,HX和NaOH恰好完全反应
D.V(NaOH溶液)=25.00mL时,c(Na+)= c(X-)+c(HX)
16.t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。已知该温度下,Ksp (AgCl)=2×10-10,下列说法不正确的是
A.在t℃时,AgBr的Ksp=4.9× 10-13
B.在AgBr饱和溶液中加入NaBr固体,可使离子浓
度由c点移动到b点
C.图中a点对应的是AgBr的不饱和溶液
D.用0.01 mol/L AgNO,溶液滴定等浓度的KCl和
KBr的混合液,先产生AgBr沉淀
第I卷(共52分)
二、非选择题:本题包括四小题,共'52分。
17.(13分)据普通高中化学课程标准要求,强酸与强碱的中和滴定是学生必做的实验。
现某学生为测定NaOH溶液的浓度,用盐酸标准溶液进行滴定,实验如下:
(1)配制100 mL 0.1000 mol/L盐酸标准溶液时,所需仪器除量筒、烧杯、玻
璃棒、胶头滴管外,还需要的玻璃仪器是 。
(2)用 (填“甲”或“乙”)滴定管量取20.00 mL待测NaOH溶液
放入锥形瓶中,滴加2~3滴酚酞溶液作指示剂,再用盐酸标准溶液进行滴定,
本实验达到滴定终点的标志是 。
(3)右图表示50mL滴定管在滴定前后液面的位置,消耗的盐酸溶液的体中
积为 _mL,进而计算出NaOH溶液的浓度为 。
(4)下列操作对测定结果有何影响 (填“偏高”“偏低”或“无影响”)
①酸式滴定管水洗后未用盐酸标准溶液润洗 。
②滴定到达终点时,俯视读出滴定管读数 。
③锥形瓶用水洗涤后未干燥,直接装待测液 。
18.(13 分)矿渣的成分主要为CuO,还有少量的Fe2O3、FeO、 SiO2, 工业上用该矿渣获取胆矾CuSO4·5H2O的工艺流程如下图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH (室温 )
Cu(OH)2 Fe(OH)3 Fe(OH)2
开始沉淀的pH 5.4 2.7 5.8
沉淀完全的pH 6.7 3.7 8.8
(1)滤渣A的成分是 ,为了加快反应1的速率,可以采取的措施是 (写 1条)。
(2)反应1矿渣的主要成分CuO与稀硫酸反应的离子方程式为 ,往滤液1中加入H2O2的目的是 。
(3)①物质Y的作用是调节溶液的pH值,加入的最佳物质为 。
A. NaOH B. HCl C. CuO D. NH3·H2O
②根据表格信息,调节pH值的范围是 。
(4)已知溶液中离子浓度≤10-5mol/L'时,认为该离子完全沉淀。室温下,Ksp[Fe(OH)3]=
19. (14 分)
I.氮及其化合物在工农业生产、生活中有着重要作用。氮气在一定的温度、压强和催化剂的作用下可合成氨: N2(g)+3H2(g)2NH3 (g)。
(1)在恒温固定容积的反应室中,能说明上述反应达到平衡状态的是 。
A. N2、 H2、NH3的物质的量浓度之比为1 :3:2 B. 混合气体总物质的量不再变化
C.混合气体的密度不再变化 D.3v ×(NH3)=2v迪(H2)
(2)一定条件下,合成氨反应中N2的平衡转化率与温度、压强的
关系如图所示。从图中可知,p1 p2(填“<”、“>”或
“=”,下同),正反应的ΔH _0。
(3)下列措施一定能使c(QNH3)/c(N2)减小的是 。
A.升高温度 B.恒温恒容充入惰性气体
C.恒温恒压充入N2 D.加入更高效的催化剂
(4)200℃、P1条件下,将1molN2和3molH2通入2L的反应室,tmin末NH3(g)的浓度为0.4 mol/L,t min内H2的反应速率为 _mol·L-1·min-1 (用含有t的代数式表示);该条件下化学平衡常数K=________ (列式即可,不用计算出结果)。
II.有人设想以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氨的新型燃料电池,装置如图所示。
(5)电池正极发生的电极反应式是
20.(12 分)已知25℃时,部分弱酸的电离平衡常数如下表:
弱酸 HCOOH HClO H2CO3 CH3COOH
电离平衡常数 Ka=1.77×10-4 Ka=4.0×10-8 Ka1=4.3×10-7 Ka2=4.7×10-11 Ka=1.75×10 -5
(1) NaClO溶液显 性,用离子方程式表示原因 。
(2) CH3COOH溶液中加少量的CH3COONa固体,平衡 移动(填“正向”、“逆向”或“不”);若取pH=3的醋酸溶液用水稀释100倍,稀释后pH___ 5(填“>”、 “<"或“=”)。
(3)室温下,相同浓度的四种溶液①HCOONa ②NaClO ③Na2CO3 ④NaHCO3的pH由大到小的顺序为
(填编号)。
(4)常温下,pH=3 的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 .
(5)常温下,在pH=6的HClO溶液中由水电离出来的c(H+)= 。
百色市2021-2022学年高二上学期期末教学质量调研
化学
选择题:本题共16题,每题3分,共48分。每题只有1个选项符合题意。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 C A C D D B B C D B A D C B C B
17.(共13分,第(4)问每空1分,其余每空2分)
(1)100 mL容量瓶(2分)
乙 (2分) 当滴入最后一滴盐酸时,溶液由红色变为无色,且半分钟内不褪色(2分)
24.60(2分) 0.1230 mol·L-1(2分)
①偏高(1分) ②偏低(1分) ③无影响(1分)
18.(共13分,除第1空外,其余每空2分)
(1)SiO2(1分) 适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等 (2分)
CuO+ 2H+ = Cu2++H2O (2分)
将Fe2+氧化为Fe3+(2分)
(3)①C (2分) ②3.7≤ pH < 5.4(2分)
(4)10-35.9 (2分)
19.(共14分)
(1)BD(2分)
(2)(2)<(2分)
(3)AC(2分)
(4)0.6/t(2分)
0.12/(0.45×1.353) (2分)
(5)N2+6e-+8H+=2NH4+ (2分)
20.(共12分)
(1)碱(1分) ClO-+H2O HClO+OH-(2分)
(2)逆向(1分) <(2分)
(3)③>②>④>①(2分)
(4)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(2分)
(5)10-8(2分)
~1 ~
同课章节目录
