10.2 酸和碱的中和反应(第二课时)课后练习—2021—2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 10.2 酸和碱的中和反应(第二课时)课后练习—2021—2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 120.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-19 15:17:05 | ||
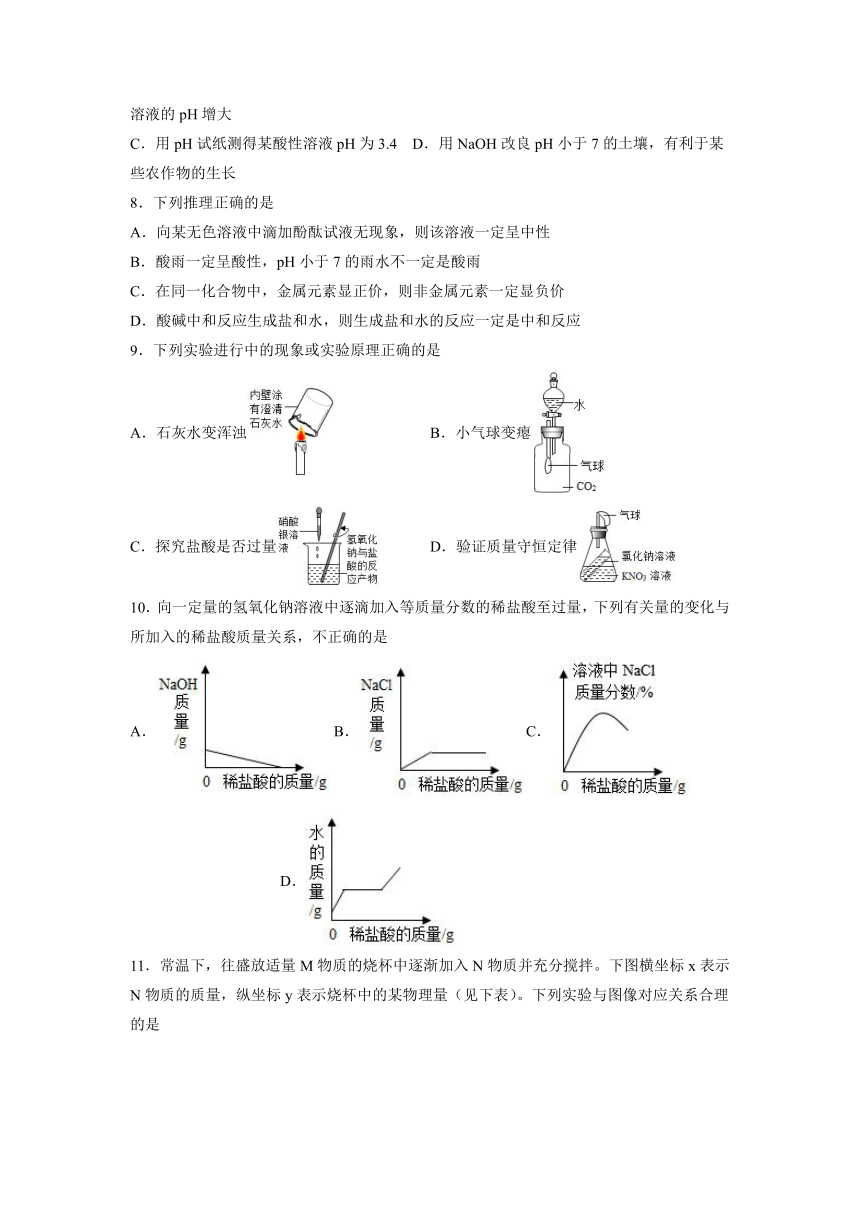
图片预览



文档简介
2021——2022学年度人教版九年级化学下册 第十单元 酸和碱
课题2 酸和碱的中和反应(第二课时)课后练习
一、选择题
1.下列叙述不正确的是
A.自行车链条涂油可防锈
B.印染厂的废水可以加入熟石灰进行处理
C.健康人体胃液的pH范围在0.9﹣1.5
D.硝酸铵不能与易燃物质混在一起,在高温或受猛烈撞击时易爆炸
2.pH能定量描述溶液酸碱性的强弱。下列有关说法正确的是
A.pH的数值通常在1和14之间
B.通常用蓝色石蕊试纸测定溶液的pH
C.用pH试纸测得某酸溶液的pH是5.6
D.pH大小与一定量溶液中所含氢离子和氢氧根离子的数量多少无关
3.下列说法中,正确的是
A.浓盐酸和浓硫酸露置在空气中,溶质的质量分数都会减小
B.用蒸馏水润湿的pH试纸来测定10%的盐酸溶液的pH,结果偏小
C.生成盐和水的反应一定是中和反应。
D.炼铁是把单质铁变成氧化铁的过程
4.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
5.学习要善于分析比较,去伪存真。下列说法中正确的一项是
A.不能使酚酞变色的溶液的pH一定等于7
B.已知NaHSO4在溶液中离解出Na+、H+和SO42-,其pH<7,但不是酸
C.上网查资料得知水也能离解出极少量H+和OH-,所以水既可看作酸也可看作碱
D.甲用石蕊试液测知某果汁液变红色;乙改用pH试纸测知pH=8.2
6.常温下,下列说法错误的是
A.pH=2的溶液显酸性 B.pH=7的溶液显中性
C.溶液的pH由5变成2,其酸性减弱 D.pH>10的土壤不适于种植农作物,因为碱性太强
7.下列有关pH的说法正确的是( )
A.pH的大小与一定量溶液中所含H+或OH﹣的数量有关 B.向氢氧化钠溶液中加水后,溶液的pH增大
C.用pH试纸测得某酸性溶液pH为3.4 D.用NaOH改良pH小于7的土壤,有利于某些农作物的生长
8.下列推理正确的是
A.向某无色溶液中滴加酚酞试液无现象,则该溶液一定呈中性
B.酸雨一定呈酸性,pH小于7的雨水不一定是酸雨
C.在同一化合物中,金属元素显正价,则非金属元素一定显负价
D.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
9.下列实验进行中的现象或实验原理正确的是
A.石灰水变浑浊 B.小气球变瘪
C.探究盐酸是否过量 D.验证质量守恒定律
10.向一定量的氢氧化钠溶液中逐滴加入等质量分数的稀盐酸至过量,下列有关量的变化与所加入的稀盐酸质量关系,不正确的是
A.B.C. D.
11.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表)。下列实验与图像对应关系合理的是
M N Y
A 水 氧化钙 溶液的温度
B 水 氢氧化钠 溶液的pH
C 饱和石灰水溶液 氧化钙 溶液中溶质的质量
D 硫酸铜溶液 铁粉 溶液的质量
A.A B.B C.C D.D
12.下列选项中的描述与图象不相符的是
A. 由密闭容器中四种物质的质量变化推测该反应是化合反应
B. 向一定量的稀盐酸中滴加氢氧化钠溶液,溶液pH的变化
C. 电解水,水分解生成的气体体积随时间的变化
D. 等质量、等浓度的稀盐酸,与足量的镁粉与锌粉反应
13.室温下,用数字pH仪连接电脑实时测得稀盐酸和氢氧化钠溶液反应过程中的pH变化曲线如图,下列相关叙述错误的是
A.图中X溶液为氢氧化钠溶液 B.a点溶液能使紫色石蕊溶液变红
C.c点溶液中的溶质是NaC1和NaOH D.b点表示HC1与NaOH等质量反应
14.如图是室温下稀盐酸与氢氧化钾溶液反应过程中pH变化的曲线图。下列说法错误的是
A.图中X是稀盐酸 B.c点时,溶液中的K+个数大于Cl-个数
C.b点表示两溶液恰好完全反应 D.滴加方式是将稀盐酸滴入氢氧化钾溶液中
二、填空题
15.pH试纸的使用步骤:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒将待测液体滴到pH试纸上,将pH试纸显示的颜色与_________比较,读出该溶液的pH。使用pH试纸是测定pH的最简单方法,只能粗略地测定溶液的酸碱度,测得的pH是________,而不是________。使用pH试纸时不能将pH试纸________,也不能将pH试纸_________。
16.下图是向氢氧化钠溶液中滴加稀盐酸的微观过程,请根据下列图示回答问题:
(1)在B中将相关粒子图形补充完整_____。
(2)写出中和反应的微观实质是_____。
(3)画出比一个水分子少两个质子的离子结构示意图_____。
(4)符合A→B过程中溶液pH变化的图像是_____(填字母“C”或“D”)。
17.已知反应前后分子变化的微观示意图如下所示,请回答下列问题:
(1)图中的反应类型____________(填“属于”或“不属于”)中和反应。
(2)此反应过程中,原子数量保持_____________,分子数目_____________。
(3)写出该反应的方程式:_____________。
18.周末小红和班级部分同学在老师的带领下,在野外野炊,请你运用所学化学知识帮助小红解决在野炊过程中遇到的问题:
(1)在离桃花林很远的地方,就闻到了花的香味,从微观上分析原因是_____。
(2)小红在桃花林游玩时,为了近距离观赏桃花,没有注意正在采蜜的蜜蜂,结果被蜜蜂蜇了一下(蜜蜂毒液呈弱碱性),下列物质可用于涂抹以减轻疼痛的是 (填字母代号)。
A.食盐水 B.食醋 C.肥皂水
19.根据信息回答下列问题:
(1)图中三种酸溶于水时生成的阳离子全部是______。
(2)由图可推测出,它们具有相似的化学性质。请写出氢溴酸()与氢氧化钙溶液反应的化学方程式:______。
(3)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是______。
20.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。熟石灰与盐酸反应的化学方程式为___________;当加入熟石灰mg时,溶液中的溶质为___________。若改用ng氢氧化钠与相同量盐酸反应,所得溶液中加入紫色石蕊溶液溶液变为___________色。
三、简答题
21.在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7
Ⅱ pH=7
Ⅲ pH <7
ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
22.向一定量 NaOH 溶液中,滴加稀盐酸,所加盐酸的量与溶液 pH 的变化如图所示:
(1)当加入稀盐酸的体积为_____mL 时,稀盐酸与 NaOH 溶液恰好完全反应;
(2)向上述加了 12mL 稀盐酸后的 NaOH 溶液中滴加紫色石蕊试液,溶液显_____色;
(3)当加入 8 mL 稀盐酸时,溶液中的溶质有_____。
23.甲工厂排出的废水中含有少量氢氧化钠,与乙工厂排出的废水混合后,测得溶液的pH=7,且只含有氯化钠一种溶质。回答下列问题:
(1)乙工厂的废水中含有的物质为_____(写化学式)。
(2)写出反应的化学方程式_____。
24.某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。下图为依据实验数据绘制的v盐酸)-pH图。请填空:
(1)滴加盐酸之前,烧杯中溶液的颜色为_______,滴加盐酸的体积为V2时,烧杯中溶液颜色为_________。
(2)滴加盐酸的体积为V1时,溶液中除了水分子外,其他的成分为____________.
(3)该反应的化学方程式为________________________________.
四、综合应用题
25.硝酸(HNO3)是一种重要的工业强酸,广泛应用于生产化肥、染料、炸药、医药、冶金、化工等领域。下图为工业法制备硝酸的流程图:
(1)二氧化氮中,氮元素的化合价为______。
(2)汽车发动机产生的氮氧化物和煤燃烧产生的二氧化硫排放到空气中,会形成酸雨,请简述酸雨形成的原因:______。
(3)在上述流程图的步骤③中,有两个生成硝酸的方案:
【方案一】将二氧化氮通入水中,发生的反应为:
【方案二】将二氧化氮和氧气同时通入水中,其反应原理为:
上述方案中,更符合绿色化学理念的是方案______(填“一”或“二”),理由是______。
(4)浓硝酸具有强挥发性和强腐蚀性,溶于水时伴随放出大量的热,稀释操作与浓硫酸的稀释操作相似。市售硝酸的溶质质量分数一般为65%-70%,小颖同学欲测定某市售硝酸溶液的溶质质量分数,她先在烧杯中加入适量水,再将1.0g硝酸溶液样品滴入其中,然后逐滴加入溶质质量分数为5.0%的氢氧化钠溶液,烧杯内溶液pH随滴加氢氧化钠溶液的质量变化如图所示。
试计算:小颖所测硝酸溶液样品的溶质质量分数?______(根据化学方程式计算,计算结果精确至0.1%)
【参考答案】
1.B 2.A 3.A 4.C 5.B 6.C 7.A 8.B 9.A 10.D 11.D 12.D 13.D 14.B
15. 标准比色卡 整数 精确值 润湿 直接插入溶液中
16.(1)
(2)H+和OH-结合生成了水分子(或H++ OH-=H2O)
(3)
(4)D
17.(1)不属于(2) 不变 不变(3)
18.(1)分子在不断运动 (2)B
19.(1)H+
(2)
(3)浓盐酸
20. Ca(OH)2+2HCl=CaCl2+2H2O 氯化氢和氯化钙 红
21. 红 Ⅰ 白色固体 0.1mol
22. 10 红 氯化钠和氢氧化钠
23. HCl NaOH+HCl=NaCl+H2O
24. 红色 无色 氢氧根离子、氯离子、钠离子 NaOH+HCl=NaCl+H2O
25. +4 汽车发动机产生的氮氧化物和煤燃烧产生的二氧化硫排放到空气中,与空气中的水、氧气发生反应,生成酸,随降水降落到地面,形成酸雨(注:酸雨pH<5.6,常见硝酸型酸雨和硫酸型酸雨) 二 方案一中,气体产物NO会污染空气,并且降低了氮元素的利用率;或方案二中,产物里没有污染物,且所有反应物的原子均进入期望产物中,提高了原料的利用率、转化率(即原子“零排放”)(其他合理答案酌情给分) 解:恰好完全反应时,消耗NaOH质量=8.6g×5%=0.43g
设硝酸样品中HNO3质量为x,则
则
答:硝酸样品溶质质量分数约为 67.7%。
课题2 酸和碱的中和反应(第二课时)课后练习
一、选择题
1.下列叙述不正确的是
A.自行车链条涂油可防锈
B.印染厂的废水可以加入熟石灰进行处理
C.健康人体胃液的pH范围在0.9﹣1.5
D.硝酸铵不能与易燃物质混在一起,在高温或受猛烈撞击时易爆炸
2.pH能定量描述溶液酸碱性的强弱。下列有关说法正确的是
A.pH的数值通常在1和14之间
B.通常用蓝色石蕊试纸测定溶液的pH
C.用pH试纸测得某酸溶液的pH是5.6
D.pH大小与一定量溶液中所含氢离子和氢氧根离子的数量多少无关
3.下列说法中,正确的是
A.浓盐酸和浓硫酸露置在空气中,溶质的质量分数都会减小
B.用蒸馏水润湿的pH试纸来测定10%的盐酸溶液的pH,结果偏小
C.生成盐和水的反应一定是中和反应。
D.炼铁是把单质铁变成氧化铁的过程
4.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
5.学习要善于分析比较,去伪存真。下列说法中正确的一项是
A.不能使酚酞变色的溶液的pH一定等于7
B.已知NaHSO4在溶液中离解出Na+、H+和SO42-,其pH<7,但不是酸
C.上网查资料得知水也能离解出极少量H+和OH-,所以水既可看作酸也可看作碱
D.甲用石蕊试液测知某果汁液变红色;乙改用pH试纸测知pH=8.2
6.常温下,下列说法错误的是
A.pH=2的溶液显酸性 B.pH=7的溶液显中性
C.溶液的pH由5变成2,其酸性减弱 D.pH>10的土壤不适于种植农作物,因为碱性太强
7.下列有关pH的说法正确的是( )
A.pH的大小与一定量溶液中所含H+或OH﹣的数量有关 B.向氢氧化钠溶液中加水后,溶液的pH增大
C.用pH试纸测得某酸性溶液pH为3.4 D.用NaOH改良pH小于7的土壤,有利于某些农作物的生长
8.下列推理正确的是
A.向某无色溶液中滴加酚酞试液无现象,则该溶液一定呈中性
B.酸雨一定呈酸性,pH小于7的雨水不一定是酸雨
C.在同一化合物中,金属元素显正价,则非金属元素一定显负价
D.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
9.下列实验进行中的现象或实验原理正确的是
A.石灰水变浑浊 B.小气球变瘪
C.探究盐酸是否过量 D.验证质量守恒定律
10.向一定量的氢氧化钠溶液中逐滴加入等质量分数的稀盐酸至过量,下列有关量的变化与所加入的稀盐酸质量关系,不正确的是
A.B.C. D.
11.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表)。下列实验与图像对应关系合理的是
M N Y
A 水 氧化钙 溶液的温度
B 水 氢氧化钠 溶液的pH
C 饱和石灰水溶液 氧化钙 溶液中溶质的质量
D 硫酸铜溶液 铁粉 溶液的质量
A.A B.B C.C D.D
12.下列选项中的描述与图象不相符的是
A. 由密闭容器中四种物质的质量变化推测该反应是化合反应
B. 向一定量的稀盐酸中滴加氢氧化钠溶液,溶液pH的变化
C. 电解水,水分解生成的气体体积随时间的变化
D. 等质量、等浓度的稀盐酸,与足量的镁粉与锌粉反应
13.室温下,用数字pH仪连接电脑实时测得稀盐酸和氢氧化钠溶液反应过程中的pH变化曲线如图,下列相关叙述错误的是
A.图中X溶液为氢氧化钠溶液 B.a点溶液能使紫色石蕊溶液变红
C.c点溶液中的溶质是NaC1和NaOH D.b点表示HC1与NaOH等质量反应
14.如图是室温下稀盐酸与氢氧化钾溶液反应过程中pH变化的曲线图。下列说法错误的是
A.图中X是稀盐酸 B.c点时,溶液中的K+个数大于Cl-个数
C.b点表示两溶液恰好完全反应 D.滴加方式是将稀盐酸滴入氢氧化钾溶液中
二、填空题
15.pH试纸的使用步骤:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒将待测液体滴到pH试纸上,将pH试纸显示的颜色与_________比较,读出该溶液的pH。使用pH试纸是测定pH的最简单方法,只能粗略地测定溶液的酸碱度,测得的pH是________,而不是________。使用pH试纸时不能将pH试纸________,也不能将pH试纸_________。
16.下图是向氢氧化钠溶液中滴加稀盐酸的微观过程,请根据下列图示回答问题:
(1)在B中将相关粒子图形补充完整_____。
(2)写出中和反应的微观实质是_____。
(3)画出比一个水分子少两个质子的离子结构示意图_____。
(4)符合A→B过程中溶液pH变化的图像是_____(填字母“C”或“D”)。
17.已知反应前后分子变化的微观示意图如下所示,请回答下列问题:
(1)图中的反应类型____________(填“属于”或“不属于”)中和反应。
(2)此反应过程中,原子数量保持_____________,分子数目_____________。
(3)写出该反应的方程式:_____________。
18.周末小红和班级部分同学在老师的带领下,在野外野炊,请你运用所学化学知识帮助小红解决在野炊过程中遇到的问题:
(1)在离桃花林很远的地方,就闻到了花的香味,从微观上分析原因是_____。
(2)小红在桃花林游玩时,为了近距离观赏桃花,没有注意正在采蜜的蜜蜂,结果被蜜蜂蜇了一下(蜜蜂毒液呈弱碱性),下列物质可用于涂抹以减轻疼痛的是 (填字母代号)。
A.食盐水 B.食醋 C.肥皂水
19.根据信息回答下列问题:
(1)图中三种酸溶于水时生成的阳离子全部是______。
(2)由图可推测出,它们具有相似的化学性质。请写出氢溴酸()与氢氧化钙溶液反应的化学方程式:______。
(3)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是______。
20.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。熟石灰与盐酸反应的化学方程式为___________;当加入熟石灰mg时,溶液中的溶质为___________。若改用ng氢氧化钠与相同量盐酸反应,所得溶液中加入紫色石蕊溶液溶液变为___________色。
三、简答题
21.在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7
Ⅱ pH=7
Ⅲ pH <7
ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
22.向一定量 NaOH 溶液中,滴加稀盐酸,所加盐酸的量与溶液 pH 的变化如图所示:
(1)当加入稀盐酸的体积为_____mL 时,稀盐酸与 NaOH 溶液恰好完全反应;
(2)向上述加了 12mL 稀盐酸后的 NaOH 溶液中滴加紫色石蕊试液,溶液显_____色;
(3)当加入 8 mL 稀盐酸时,溶液中的溶质有_____。
23.甲工厂排出的废水中含有少量氢氧化钠,与乙工厂排出的废水混合后,测得溶液的pH=7,且只含有氯化钠一种溶质。回答下列问题:
(1)乙工厂的废水中含有的物质为_____(写化学式)。
(2)写出反应的化学方程式_____。
24.某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。下图为依据实验数据绘制的v盐酸)-pH图。请填空:
(1)滴加盐酸之前,烧杯中溶液的颜色为_______,滴加盐酸的体积为V2时,烧杯中溶液颜色为_________。
(2)滴加盐酸的体积为V1时,溶液中除了水分子外,其他的成分为____________.
(3)该反应的化学方程式为________________________________.
四、综合应用题
25.硝酸(HNO3)是一种重要的工业强酸,广泛应用于生产化肥、染料、炸药、医药、冶金、化工等领域。下图为工业法制备硝酸的流程图:
(1)二氧化氮中,氮元素的化合价为______。
(2)汽车发动机产生的氮氧化物和煤燃烧产生的二氧化硫排放到空气中,会形成酸雨,请简述酸雨形成的原因:______。
(3)在上述流程图的步骤③中,有两个生成硝酸的方案:
【方案一】将二氧化氮通入水中,发生的反应为:
【方案二】将二氧化氮和氧气同时通入水中,其反应原理为:
上述方案中,更符合绿色化学理念的是方案______(填“一”或“二”),理由是______。
(4)浓硝酸具有强挥发性和强腐蚀性,溶于水时伴随放出大量的热,稀释操作与浓硫酸的稀释操作相似。市售硝酸的溶质质量分数一般为65%-70%,小颖同学欲测定某市售硝酸溶液的溶质质量分数,她先在烧杯中加入适量水,再将1.0g硝酸溶液样品滴入其中,然后逐滴加入溶质质量分数为5.0%的氢氧化钠溶液,烧杯内溶液pH随滴加氢氧化钠溶液的质量变化如图所示。
试计算:小颖所测硝酸溶液样品的溶质质量分数?______(根据化学方程式计算,计算结果精确至0.1%)
【参考答案】
1.B 2.A 3.A 4.C 5.B 6.C 7.A 8.B 9.A 10.D 11.D 12.D 13.D 14.B
15. 标准比色卡 整数 精确值 润湿 直接插入溶液中
16.(1)
(2)H+和OH-结合生成了水分子(或H++ OH-=H2O)
(3)
(4)D
17.(1)不属于(2) 不变 不变(3)
18.(1)分子在不断运动 (2)B
19.(1)H+
(2)
(3)浓盐酸
20. Ca(OH)2+2HCl=CaCl2+2H2O 氯化氢和氯化钙 红
21. 红 Ⅰ 白色固体 0.1mol
22. 10 红 氯化钠和氢氧化钠
23. HCl NaOH+HCl=NaCl+H2O
24. 红色 无色 氢氧根离子、氯离子、钠离子 NaOH+HCl=NaCl+H2O
25. +4 汽车发动机产生的氮氧化物和煤燃烧产生的二氧化硫排放到空气中,与空气中的水、氧气发生反应,生成酸,随降水降落到地面,形成酸雨(注:酸雨pH<5.6,常见硝酸型酸雨和硫酸型酸雨) 二 方案一中,气体产物NO会污染空气,并且降低了氮元素的利用率;或方案二中,产物里没有污染物,且所有反应物的原子均进入期望产物中,提高了原料的利用率、转化率(即原子“零排放”)(其他合理答案酌情给分) 解:恰好完全反应时,消耗NaOH质量=8.6g×5%=0.43g
设硝酸样品中HNO3质量为x,则
则
答:硝酸样品溶质质量分数约为 67.7%。
同课章节目录
