5.1质量守恒定律同步练习-2021-2022学年九年级化学人教版上册(word版 含解析)
文档属性
| 名称 | 5.1质量守恒定律同步练习-2021-2022学年九年级化学人教版上册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 297.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-19 16:06:51 | ||
图片预览




文档简介
5.1质量守恒定律
一、选择题(共16题)
1.2020年春节期间,新型冠状病毒蔓延,研究表明喷洒过氧乙酸消毒液可有效灭活病毒,下图为过氧乙酸的结构式,下列有关过氧乙酸的叙述中不正确的是
A.C、H、O三种元素的质量比为2:4:3
B.过氧乙酸的相对分子质量为76
C.过氧乙酸的化学式为C2H4O3
D.完全燃烧生成H2O和CO2
2.化学反应前后,下列各项中:①原子总数;②分子总数;③物质总质量;④ 物质的种类;⑤元素的种类,一定发生改变的是
A.②④ B.①③⑤ C.①②③④⑤ D.④
3.下列说法正确的是
A.鱼类可以在水中畅游说明水中含有氧元素
B.地壳中、人体中以及海水中含量最多的元素都是氧元素
C.含有氧元素的化合物就是氧化物
D.某物质中除了氧元素以外只含一种元素,则它一定是氧化物
4.在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中正确的是
A.该反应属于分解反应 B.2g甲与5g丁可恰好反应
C.丙能加快该反应的速率 D.反应生成的乙的质量为32g
5.超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料经研磨烧结可合成一种高温超导物质Y2Ba4Cu6Ox,假设在研磨烧结过程中各元素的化合价无变化,则x的值为( )
A.12 B.13 C.15 D.26
6.下列变化中能用质量守恒定律解释的是
A.打开瓶盖,瓶内的酒精质量逐渐减小
B.加热高锰酸钾固体,一段时间后固体质量减小
C.4g氢气和16g氧气混合点燃,完全燃烧生成20g水
D.10g硫酸铜溶解在90g水中,得到硫酸铜溶液的质量是100g
7.据测定,某气体在氧气中燃烧的产物只有二氧化碳和水两种,下列叙述正确的是
A、该气体一定是甲烷
B、该气体中一定含有碳、氢、氧三种元素
C、该气体中一定含有碳、氢二种元素,可能含有氧元素
D、该气体一定是碳氢化合物
8.我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破。下图为该转化的微观示意图,下列有关转化的说法错误的是
A.反应前后原子的种类发生了变化 B.生成物之一为C2H4
C.反应物与生成物均由分子构成 D.催化剂改变了反应速率
9.消毒是新冠病毒疫情防控中重要的环节。下图为某消毒剂反应的微观小意图,有关说法错误的是
A.A的化学式为H2O2 B.该反应前后原子的种类发生了改变
C.该反应属于分解反应 D.反应中生成B、C物质的分子个数比为2:1
10.某可燃物在空气中燃烧时,只产生二氧化碳和水,关于该可燃物的组成的推论正确的是
A.只含有C、O元素 B.只含有C、H元素
C.一定含有C、H、O元素 D.一定含有C、H元素,可能含有O元素
11.有机物X在足量的氧气中燃烧,生成二氧化碳和水的质量比为44:27,则X的化学式可能( )。
A. B. C. D.
12.2015年10月,中国女科学家屠呦呦因发现了青蒿素(C11H22O7)而获得诺贝尔生理学或医学奖。下列有关青蒿素的说法错误的是
A.青蒿素是有机化合物
B.青蒿素由碳、氢、氧三种元素组成
C.青蒿素中碳、氢、氧元素的质量比为14:22:5
D.青蒿素中氢元素的质量分数最小
13.推理是化学学习的一种重要方法。下列推理关系合理的是
A.原子团作为一个整体参加反应,所以原子团在任何反应中都不可拆分
B.水电解产生氢气和氧气,所以水由氢元素和氧元素组成
C.某物质燃烧生成二氧化碳和水,该物质中一定含有碳、氢、氧三种元素
D.纸张燃烧后余烬的质量比原纸张的质量小,所以该反应不符合质量守恒定律
14.在一个密闭容器内有甲、乙、丙、丁四种物质,经过反应一段时间后,测得反应前后各物质的质量如表所示,以下说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/克 49 6 12 5
反应后质量/克 19 6 X 25
A.丁是该反应的反应物 B.X 的值为 22
C.该反应为化合反应 D.乙一定是该反应的催化剂
15.下列关于化学反应的说法中,正确的是
A.系数与的和一定等于和的和
B.若与反应,生成和的质量总和一定等于
C.反应物与的质量比一定等于生成物和的质量比
D.若为,为,充分反应后生成的和的质量总和一定不是
16.三角烯(化学式为C22H14)应用于量子计算、量子信息处理和自旋电子学等领域。下列说法中正确的是( )
A.三角烯属于有机高分子化合物
B.三角烯中含有氢分子
C.三角烯中碳、氢元素的质量比为11:7
D.三角烯中碳元素的质量分数大于90%
二、综合题(共6题)
17.如图是电解水的实验:
(1)从宏观上观察:m端是电源的______极,a、b试管中产生的气体的体积比约为______,可用______检验b试管中产生的气体。电解水的文字表达式是______。电解水的过程伴随的能量变化是______能转化为化学能。
(2)从微观上分析:电解水的反应中变化的粒子是______,不变的粒子是______(用化学符号填写,上同)。由此得出化学变化的实质是______。
(3)有关水通电分解时没有发生变化的是______(填字母序号,下同)。
A.水的化学性质 B.水分子的组成和结构
C.构成水分子的原子种类 D.水分子的能量
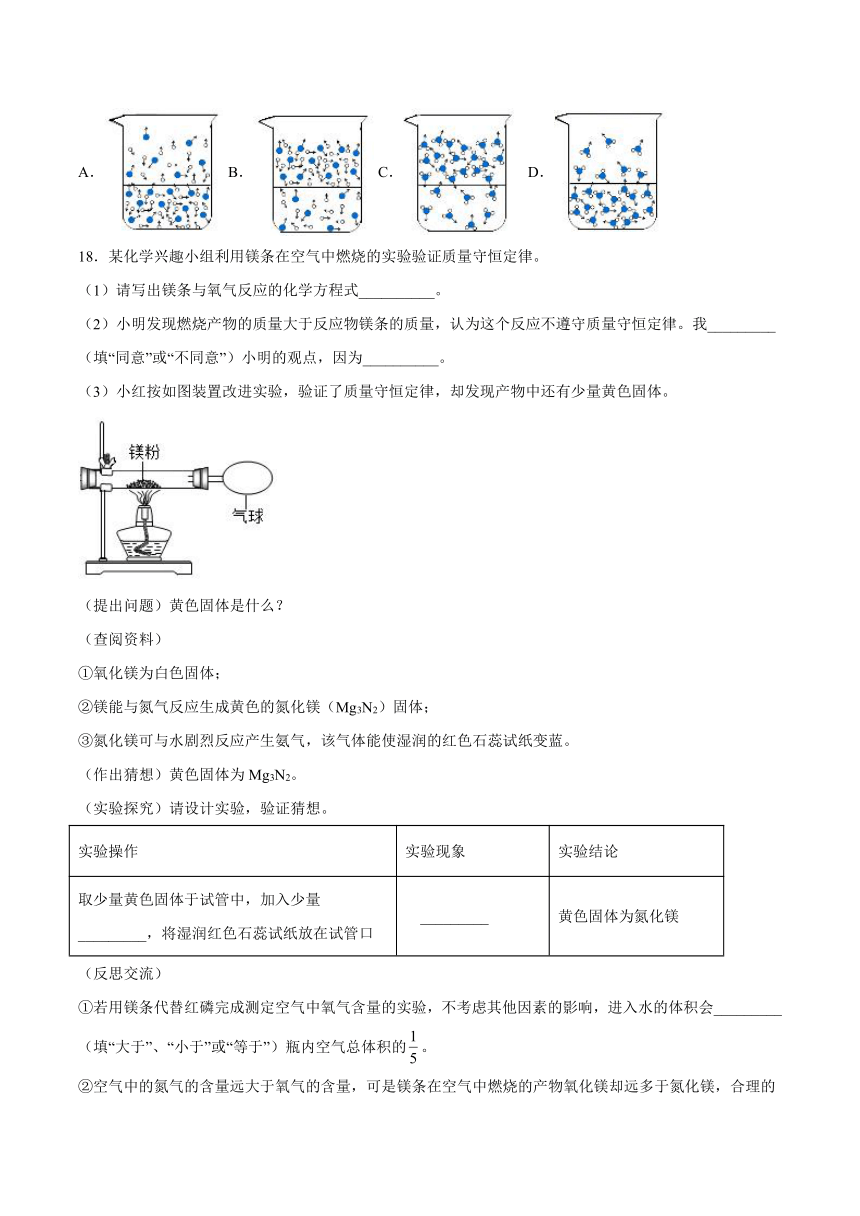
(4)下图能表示水在空气中放置时发生变化的微观示意图是______。(图中表示氧原子,表示氢原子)
A. B. C. D.
18.某化学兴趣小组利用镁条在空气中燃烧的实验验证质量守恒定律。
(1)请写出镁条与氧气反应的化学方程式__________。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我_________(填“同意”或“不同意”)小明的观点,因为__________。
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)
①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(作出猜想)黄色固体为Mg3N2。
(实验探究)请设计实验,验证猜想。
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入少量_________,将湿润红色石蕊试纸放在试管口 _________ 黄色固体为氮化镁
(反思交流)
①若用镁条代替红磷完成测定空气中氧气含量的实验,不考虑其他因素的影响,进入水的体积会_________(填“大于”、“小于”或“等于”)瓶内空气总体积的。
②空气中的氮气的含量远大于氧气的含量,可是镁条在空气中燃烧的产物氧化镁却远多于氮化镁,合理的解释是__________。
19.化学课外小组同学用如下图所示实验探究质量守恒定律:
(1)甲同学用图 A 所示实验:实验过程中产生的现象是__________。
(2)乙同学用 B 装置研究质量守恒定律时,实验步骤如下:如图将烧杯放在天平上用砝码平衡,然后倾斜烧杯使盐酸与碳酸钠粉末接触,一段时间后再把烧杯放在天平上,发现天平的指针偏 右。造成天平的指针向右偏转的原因是__________。
(3)丙同学认为 C 实验说明了质量守恒。请你从原子的角度说明为什么 __________。
(4)丁同学用图 D 中的镁带在空气中燃烧的实验来探究质量守恒定律时,发现一定质量的镁完 全燃烧后留下的固体质量比反应前镁带的质量轻,联系实验现象,可能的原因是__________。如果 在燃着的镁条上方罩上罩,使生成物全部收集起来称量,出现的结果是__________ (填“偏大”、偏 小“或”不变“)。
(5)综上所述,A、B、C、D 所示四个实验中能用质量守恒定律解释的是实验__________。(填“A”、 “B” 、“C”或“D”,下同);上述现象能用来验证质量守恒定律的是实验__________。可见, 在探究质量守恒定律时,若利用有气体参加或有气体生成的化学反应来设计实验,在装置设计 方面应做到__________。
20.(1)用和“”和“”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如图1所示。
①根据质量守恒定律,化学反应前后没有变化的是:_____ (可能有一个或多个答案)
a元素的种类 b物质的种类c原子的数目d 分子的数目e 原子的种类
②参加反应的“”和“”分子的个数比是_____。
(2)根据图2中提供的信息,请回答下列问题:
①由A 图可知,硅的相对原子质量为_____。
②B、C、D、E 中属于同种元素的是_____
③B、C 元素化学性质相似的原因是_____相同。
④C、E 两种元素组成化合物的化学式为_____。
21.电石,学名碳化钙(CaC2),以焦炭和碳酸钙为原料生产碳化钙并制备重要工业原料乙炔(CxHy)气体的原理如下图。
(实验探究)
(1)气体C有毒,写出固体A和焦炭反应得到碳化钙的化学方程式为 。
(2)小组同学对固体D提出三种猜想:
猜想一:氧化钙;
猜想二:氢氧化钙;
猜想三:碳酸钙。
同学们经过分析将猜想一排除了,理由是 。
(3)检验固体D:取样,滴加足量的稀盐酸,观察到 ,猜想二正确。
(组成测定)
(一)实验设计:
将一定量的乙炔(CxHy)在足量的氧气中完全燃烧,生成的气体全部缓缓通过下图
装置(选填“Ⅰ”或“Ⅱ”)。
(二)实验测定:(小资料:乙炔的相对分子质量为26)
实验数据记录于下表中,试通过计算,确定乙炔的化学式。
反应前质量/g
反应后质量/g
装置①
125.3
127.1
装置②
78.2
87.0
结论:乙炔的化学式 。
(归纳小结)写出碳化钙与水反应的化学方程式: 。
22.空气是一种重要资源.
(1)如图1所示装置可测定空气中氧气的含量,用注射器抽取30mL空气,硬质玻璃管的体积为50mL,在硬质玻璃管中放入过量的铜粉,在右侧导管口套上瘪的气球,点燃酒精灯,反复推拉注射器,待反应结束后,冷却值室温.
①实验时,铜粉过量的目的是_____
②冷却后,理论上注射器内剩余气体的体积约为_____mL
(2)利用空气制取氮肥(尿素)的流程如图2所示
①Ⅰ中参加反应的单质甲为_____,请你写出Ⅲ中反应的化学方程式(煤的主要成分是碳)________
②已知常压下,氮气沸点-196℃,氧气沸点-183℃,若将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是________
(3)汽车尾气催化转化器的投入使用,大大缓解了空气污染,请在图Ⅰ和图Ⅱ方框中,把转化器中某种转化反应(4CO+2NO24CO2+N2)的微观粒子补充完整._______
参考答案
1.A
【详解】
A、过氧乙酸(C2H4O3)中C、H、O三种元素的质量比为():():()=6:1:12,故A不正确;
B、过氧乙酸的相对分子质量为=76,故B正确;
C、根据分析,C正确;
D、过氧乙酸含有C、H、O三种元素,属于有机物,则完全燃烧生成CO2和H2O,故D正确。故选A。
2.D
【解析】
试题分析:根据质量守恒定律可以知道原子总数;物质总质量;;元素的种类一定不会改变,分子总数不一定改变;物质的种类一定变,故选D.
3.B
【详解】
A、自然界中,鱼类能够在水中生存,是因为水中含有氧气,氧气是由氧分子构成的,故选项说法错误;
B、地壳中含量最多的元素是氧元素,人体中含量最多的物质是水,故人体中含量最多的元素是氧元素,海水中含量最多的物质也是水,海水中含量最多的元素是氧元素,故选项说法正确;
C、氧化物是指由两种元素组成,其中一种元素是氧元素的化合物,如KClO3含有氧元素,但不是氧化物,故选项说法错误;
D、某物质中除了氧元素以外只含一种元素,不一定是氧化物,如过氧化氢溶液中只有氧元素和氢元素,属于混合物,故选项说法错误。
故选:B。
4.B
【详解】
A、反应后乙质量增大,是生成物,甲、丁质量减小,都是反应物,即甲、丁反应生成乙,是化合反应,说法错误;
B、该反应中,甲、丁的质量变化之比为:(16-8):(24-4)=2:5,所以2g甲与5g丁可恰好反应,说法正确;
C、丙可能加快该反应的速率,可能没有参加反应,说法错误;
D、反应生成的乙的质量为28g,说法错误。
故选:B。
5.B
【详解】
假设在研磨烧结过程中各元素的化合价无变化,Y2O3中Y元素为+3价,氧元素为-2价、BaCO3中钡元素为+2价,碳元素为+4价,氧元素为-2价、CuO中铜元素为+2价,氧元素为-2价,则由化合物中各元素化合价代数和为零可知:(+3)×2+(+2)×4+(+2)×6+(-2)×x=0;则x=13;
故选:B。
6.B
【详解】
A.打开瓶盖,瓶内的酒精质量逐渐减小,只是因为酒精状态改变了,属于物理变化,所以不能用质量守恒定律解释。
B.加热高锰酸钾固体,一段时间后固体质量减小,因为发生了化学变化生成了氧气,所以能用质量守恒定律解释。
C.根据质量守恒定律可知,4g氢气和32g氧气混合点燃,完全燃烧生成36g水,不能用质量守恒定律解释;
D. 10g硫酸铜溶解在90g水中,得到硫酸铜溶液的质量是100g,只是简单的混合,属于物理变化,所以不能用质量守恒定律解释。
故选:B
7.C
【解析】
试题分析:在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变.某气体在氧气中燃烧的产物只有二氧化碳和水两种,生成物中含有碳元素、氢元素和氧元素,碳元素、氢元素来自于该气体,该气体中是否含有氧元素无法确定.故答案选C.
8.A
【详解】
A、观察微观示意图反应前后都是碳原子和氢原子,原子的种类没有发生变化,错误;B、由观察微观示意图可知,生成物为C2H4和H2,正确;C、由物质的微观构成可知,反应物与生成物均由分子构成,正确;D、催化剂的作用是改变反应的速率,正确。故选A。
9.B
【详解】
A、分析物质A的微粒示意图可知,该物质的1个分子是由2个氢原子和2个氧原子构成的,故该物质的化学式为H2O2,此选项表述正确;
B、化学反应前后原子的种类不变,此选项表述不正确;
C、分析该反应的示意图可知,该反应是由一种物质分解后生成了两种物质,故该反应属于分解反应,此选项表述正确;
D、分析该反应的微观示意图可知,该反应的化学方程式为:,又知物质B是水,C是氧气,故反应中生成B、C物质的分子个数比为2:1,此选项表述正确。
故选B。
10.D
【详解】
可燃物在空气中燃烧生成水和二氧化碳,水中的氢元素和二氧化碳中的碳元素来自于该物质,水中的氧元素和二氧化碳中的氧元素可能来自于该物质和氧气,也可能完全来自于氧气,因此该物质中一定含有C、H元素,可能含有O元素。故选D。
11.D
【详解】
根据题意“生成的与水的质量比为44:27”,则生成物中碳元素和氢元素的质量比,碳原子和氢原子的数目之比为1:3。
A、中碳原子与氢原子的数目比为1:4,不符合题意;
B、碳原子和氢原子的数目之比是1:4,不符合题意;
C、中碳原子与氢原子的数目之比是1:2,不符合题意;
D、中碳元素与氢元素的数目比为1:3,符合题意。
故选D。
12.A
【解析】
试题分析:A、有机物:含碳元素的化合物,青蒿素是有机化合物,正确,B、物质由元素组成,青蒿素由碳、氢、氧三种元素组成,正确,C、青蒿素中碳、氢、氧元素的质量比=12×11:1×22:16×7=121:11:56,错误,D、根据元素质量分数计算的表达式,青蒿素中氢元素的质量分数最小,正确,故选A
13.B
【详解】
A、原子团作为一个整体参加反应,原子团在反应中一般不可拆分,如KClO3受热分解生成氯化钾和氧气,氯酸根就拆开了,说法错误;
B、水电解产生氢气和氧气,氢气由氢元素组成,氧气由氧元素组成,所以水由氢元素和氧元素组成,说法正确;
C、根据质量守恒定律,反应前后元素种类不变,某物质燃烧生成二氧化碳和水,反应物是该物质与氧气,生成物是二氧化碳和水,所以该物质中一定含有碳、氢元素,可能含氧元素.说法错误;
D、纸张燃烧后余烬的质量比原纸张的质量小,是因为生成的二氧化碳和水逸散到空气中,该反应符合质量守恒定律.说法错误;
故选B.
14.B
【详解】
A. 由表中的数据分析可知,丁物质从反应前的5克变到反应后的25克,质量增加,所以丁是该反应的生成物,而不是反应物,故A不符合题意;
B. 由表中的数据分析可知,根据质量守恒定律,反应前物质的总质量等于反应后物质的总质量,即49g+6g+12g+5g=19g+6g+X+25g,解得X=22g,故B符合题意;
C. 根据表中数据分析可知,甲物质从反应前到反应后质量减少,所以甲做反应物,由B中的分析可知,X=22,丙物质由反应前12g增加到22g,所以丙物质作生成物,由A分析可知丁物质也作生成物,即反应的关系式为:,由一种物质生成了两种物质,属于分解反应,故C不符合题意;
D. 根据表中数据可知,乙物质反应前后的质量不变,所以乙可能是该反应的催化剂,也有可能是不参加反应的杂质,故D不符合题意。
故选B。
15.D
【详解】
A、在化学变化前后虽然原子的个数不变,但分子个数可能改变,故与的和不一定等于与的和,错;
B、若与恰好完全反应,则生成的与的质量和就等于,若不是恰好完全反应,则生成的与的质量之和就会小于,故错;
C、同理,反应物与的质量比不一定等于生成物和的质量比,故错误;
D、若、各,充分反应后生成与的质量之和也应,但一定不等于,因为两者充分反应,至少有一种物质完全反应,生成物的质量总和大于,故正确。
16.D
【详解】
A、由三角烯的化学式可知,三角烯由碳、氢两种元素组成,属于有机物,但三角烯的相对分子质量为278,不属于有机高分子化合物,选项错误;
B、三角烯由三角烯分子构成,三角烯分子中含有氢原子,不含氢分子,选项错误;
C、三角烯中碳、氢元素的质量比为(12×22):(1×14)=132:7,选项错误;
D、三角烯中碳元素的质量分数为×100%≈95%大于90%,选项正确,故选D。
17.
(1) 负 2:1 带火星的木条 电
(2) H2O H、O 化学变化中分子分解,分成原子,原子重新组合成新的分子
(3)C
(4)D
【分析】
(1)
从宏观上观察:m端是电源的负极,水电解生成氢气和氧气,a试管中产生的的气体是氢气,b试管中产生的的气体是氧气,气体的体积比约为2:1,可用带火星的木条检验b试管中产生的气体。电解水的文字表达式是:,电解水的过程伴随的能量变化是电能转化为化学能;
(2)
电解水的微观实质是水分子分解成氢原子和氧原子,氢原子和氧原子重新组合成氢分子和氧分子,反应中变化的粒子是水分子,其化学式为:H2O,不变的粒子是氢原子、氧原子,其化学式分别为:H、O,化学变化的实质是化学变化中分子分解,分成原子,原子重新组合成新的分子
(3)
A、水在直流电作用水分子被分解,所以水的化学性质发生了改变,故不符合题意;
B、水在直流电作用水分子被分解,所以水分子的组成和结构发生了改变,故不符合题意;
C、水在直流电作用水分子被分解,但是氢原子和氧原子不变,所以构成水分子的原子种类不变,故符合题意;
D、水在直流电作用水分子被分解,所以水分子的能量发生了改变,故不符合题意,故选:C;
(4)
水由水分子构成,一个水分子由2个氢原子和1个氧原子构成,水在空气中放置,水分子向外扩散的过程中水分子间的间隔增大,水分子不变,ACB图示水分子的微观示意图错误,D图示正确。
18.
(1)
(2) 不同意 所有的化学变化都遵循质量守恒定律,镁燃烧是镁与空气中氧气发生化合反应生成氧化镁
(3) 蒸馏水 红色的石蕊试纸变蓝 大于 氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应
【解析】
(1)
在点燃的条件下,镁与氧气反应生成氧化镁,反应的化学方程式为:;
(2)
我不同意小明的观点,因为所有的化学变化都遵循质量守恒定律,镁燃烧是镁与空气中氧气发生化合反应生成氧化镁,所以产物的质量大于反应物镁条的质量;
(3)
实验探究:根据题干信息,可将生成的固体物质放入水中,检验是否产生氨气来进行判断;具体实验操作:取少量黄色固体于试管中,加入少量蒸馏水,将湿润的红色石蕊试纸放在试管口,观察现象;若看到红色的石蕊试纸变蓝,证明猜想正确,黄色固体为氮化镁;
反思交流:①若用镁条代替红磷完成测定空气中氧气含量的实验,镁和空气中的氮气也会发生反应生成氮化镁,消耗了空气中的氮气,集气瓶中进入水的体积自然会大于瓶内空气总体积的 1/5;
②氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应,所以镁条在空气中燃烧的产物氧化镁却远多于氮化镁。
19.白磷燃烧产生大量白烟,气球先变大后又逐渐缩小,天平仍然平衡 碳酸钠与稀盐酸反应产生的二氧化碳逸散到空气中去了,所以左盘质量减少 化学反应前后原子的种类、数目、质量没有改变 坩埚钳中残留一部分氧化镁(或实验过程中以白烟的形式扩散一部分氧化镁等) 偏大 ABCD AC 装置密闭,体积不变
【详解】
(1)实验过程中白磷燃烧产生大量白烟,由于白磷燃烧放热,所以气球先变大,随着温度的降低,气球又逐渐缩小,由于实验过程中质量不变,所以天平仍然保持平衡。
(2)由于碳酸钠与稀盐酸反应产生的二氧化碳逸散到空气中去了,所以左盘质量减少,导致天平的指针向右偏转。
(3)化学反应前后原子的种类、数目、质量没有改变。
(4)坩埚钳中残留一部分氧化镁(或实验过程中以白烟的形式扩散一部分氧化镁等)。由于镁带燃烧消耗氧气,如果在燃着的镁条上方罩上罩,使生成物全部收集起来称量,出现的结果是偏大,增多的质量是参加反应的氧气的质量。
(5)质量守恒定律是化学变化普遍遵守的规律,A、B、C、D 所示四个实验中都能用质量守恒定律解释,上述现象能用来验证质量守恒定律的是实验AC。在探究质量守恒定律时,若利用有气体参加或有气体生成的化学反应来设计实验,在装置设计方面应做到装置密闭,体积不变。
20.ace 3:1 28.09 CD 最外层电子数相同 Na2S
【详解】
(1) ①根据质量守恒定律,化学反应前后没有变化的是:元素的种类;原子的数目;原子的种类;由反应的微观示意图可知,参加反应的“”和“”分子的个数比是3:1;(2) ①由A 图可知,硅的相对原子质量为28.09;②质子数相同元素的种类也相同,故B、C、D、E 中属于同种元素的是CD;③B、C 元素化学性质相似的原因是最外层电子数相同;④C为16号元素硫,硫原子最外层电子数为6,容易得到2个电子带2个单位的负电荷,E为11号元素钠元素,钠原子最外层电子数为1,容易失去,带一个单位的正电荷,它们的化合价在数值上与所带电荷数相等,所以两种元素组成化合物的化学式为:Na2S。
21.(1)CaO + 3CCaC2 + CO↑(2)氧化钙与水反应生成氢氧化钙 (3)固体溶解,无气泡产生
(一)II(二)C2H2 【归纳小结】CaC2 + 2H2O = Ca(OH)2 + C2H2↑
【解析】
试题分析:碳酸钙受热分解生成氧化钙和二氧化碳气体,所以A是氧化钙,C是一种有毒气体,固体A和焦炭反应得到碳化钙的化学方程式为CaO + 3CCaC2 + CO↑,经过分析将猜想一排除了,理由是 氧化钙与水反应生成氢氧化钙。检验固体D:取样,滴加足量的稀盐酸,观察到固体溶解,无气泡产生,猜想二正确,将一定量的乙炔(CxHy)在足量的氧气中完全燃烧,生成的气体全部缓缓通过下图II装置,如果选择1,则可能从氢氧化钠的溶液中带出水分,使得浓硫酸的装置增重,影响实验的数据,从表格的数据看:水的质量为1.8克,而二氧化碳的质量为8.8克,生成一分子水的同时生成两分子的二氧化碳,所以碳原子和氢原子的个数之比是1:1,12X+Y=26,X=Y,所以X=2,所以化学式为C2H2,碳化钙与水反应的化学方程式:CaC2 + 2H2O = Ca(OH)2 + C2H2↑。
22.耗尽装置的氧气 14 H2 木条熄灭
【详解】
(1)①实验时,为了完全除去空气中的氧气,铜粉必须是过量的,否则得出的结果不准确。
②足量的铜粉充分加热消耗氧气的体积为:(30mL+50mL)×1/5 =16mL;冷却后,理论上注射器内剩余气体的体积约为30mL-16mL=14mL;故冷却后,理论上注射器内剩余气体的体积约为14mL。
(2)①氮气和氢气在一定条件下生成氨气,Ⅰ中参加反应的单质甲为氢气;Ⅲ中反应是碳与氧气在点燃的条件下反应生成二氧化碳;化学方程式为:。
②分离液态空气制氧气,是利用液氧和液氮的沸点不同,液氮的沸点低,首先蒸发出来,所以若将燃着的木条置于盛满液态空气的烧杯口,木条会熄灭。
(3)由化学方程式可知,每4个一氧化碳分子与2个二氧化氮分子在催化剂的作用下反应生成4个二氧化碳分子与1个氮分子;故微观粒子图为: 。
一、选择题(共16题)
1.2020年春节期间,新型冠状病毒蔓延,研究表明喷洒过氧乙酸消毒液可有效灭活病毒,下图为过氧乙酸的结构式,下列有关过氧乙酸的叙述中不正确的是
A.C、H、O三种元素的质量比为2:4:3
B.过氧乙酸的相对分子质量为76
C.过氧乙酸的化学式为C2H4O3
D.完全燃烧生成H2O和CO2
2.化学反应前后,下列各项中:①原子总数;②分子总数;③物质总质量;④ 物质的种类;⑤元素的种类,一定发生改变的是
A.②④ B.①③⑤ C.①②③④⑤ D.④
3.下列说法正确的是
A.鱼类可以在水中畅游说明水中含有氧元素
B.地壳中、人体中以及海水中含量最多的元素都是氧元素
C.含有氧元素的化合物就是氧化物
D.某物质中除了氧元素以外只含一种元素,则它一定是氧化物
4.在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中正确的是
A.该反应属于分解反应 B.2g甲与5g丁可恰好反应
C.丙能加快该反应的速率 D.反应生成的乙的质量为32g
5.超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料经研磨烧结可合成一种高温超导物质Y2Ba4Cu6Ox,假设在研磨烧结过程中各元素的化合价无变化,则x的值为( )
A.12 B.13 C.15 D.26
6.下列变化中能用质量守恒定律解释的是
A.打开瓶盖,瓶内的酒精质量逐渐减小
B.加热高锰酸钾固体,一段时间后固体质量减小
C.4g氢气和16g氧气混合点燃,完全燃烧生成20g水
D.10g硫酸铜溶解在90g水中,得到硫酸铜溶液的质量是100g
7.据测定,某气体在氧气中燃烧的产物只有二氧化碳和水两种,下列叙述正确的是
A、该气体一定是甲烷
B、该气体中一定含有碳、氢、氧三种元素
C、该气体中一定含有碳、氢二种元素,可能含有氧元素
D、该气体一定是碳氢化合物
8.我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破。下图为该转化的微观示意图,下列有关转化的说法错误的是
A.反应前后原子的种类发生了变化 B.生成物之一为C2H4
C.反应物与生成物均由分子构成 D.催化剂改变了反应速率
9.消毒是新冠病毒疫情防控中重要的环节。下图为某消毒剂反应的微观小意图,有关说法错误的是
A.A的化学式为H2O2 B.该反应前后原子的种类发生了改变
C.该反应属于分解反应 D.反应中生成B、C物质的分子个数比为2:1
10.某可燃物在空气中燃烧时,只产生二氧化碳和水,关于该可燃物的组成的推论正确的是
A.只含有C、O元素 B.只含有C、H元素
C.一定含有C、H、O元素 D.一定含有C、H元素,可能含有O元素
11.有机物X在足量的氧气中燃烧,生成二氧化碳和水的质量比为44:27,则X的化学式可能( )。
A. B. C. D.
12.2015年10月,中国女科学家屠呦呦因发现了青蒿素(C11H22O7)而获得诺贝尔生理学或医学奖。下列有关青蒿素的说法错误的是
A.青蒿素是有机化合物
B.青蒿素由碳、氢、氧三种元素组成
C.青蒿素中碳、氢、氧元素的质量比为14:22:5
D.青蒿素中氢元素的质量分数最小
13.推理是化学学习的一种重要方法。下列推理关系合理的是
A.原子团作为一个整体参加反应,所以原子团在任何反应中都不可拆分
B.水电解产生氢气和氧气,所以水由氢元素和氧元素组成
C.某物质燃烧生成二氧化碳和水,该物质中一定含有碳、氢、氧三种元素
D.纸张燃烧后余烬的质量比原纸张的质量小,所以该反应不符合质量守恒定律
14.在一个密闭容器内有甲、乙、丙、丁四种物质,经过反应一段时间后,测得反应前后各物质的质量如表所示,以下说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/克 49 6 12 5
反应后质量/克 19 6 X 25
A.丁是该反应的反应物 B.X 的值为 22
C.该反应为化合反应 D.乙一定是该反应的催化剂
15.下列关于化学反应的说法中,正确的是
A.系数与的和一定等于和的和
B.若与反应,生成和的质量总和一定等于
C.反应物与的质量比一定等于生成物和的质量比
D.若为,为,充分反应后生成的和的质量总和一定不是
16.三角烯(化学式为C22H14)应用于量子计算、量子信息处理和自旋电子学等领域。下列说法中正确的是( )
A.三角烯属于有机高分子化合物
B.三角烯中含有氢分子
C.三角烯中碳、氢元素的质量比为11:7
D.三角烯中碳元素的质量分数大于90%
二、综合题(共6题)
17.如图是电解水的实验:
(1)从宏观上观察:m端是电源的______极,a、b试管中产生的气体的体积比约为______,可用______检验b试管中产生的气体。电解水的文字表达式是______。电解水的过程伴随的能量变化是______能转化为化学能。
(2)从微观上分析:电解水的反应中变化的粒子是______,不变的粒子是______(用化学符号填写,上同)。由此得出化学变化的实质是______。
(3)有关水通电分解时没有发生变化的是______(填字母序号,下同)。
A.水的化学性质 B.水分子的组成和结构
C.构成水分子的原子种类 D.水分子的能量
(4)下图能表示水在空气中放置时发生变化的微观示意图是______。(图中表示氧原子,表示氢原子)
A. B. C. D.
18.某化学兴趣小组利用镁条在空气中燃烧的实验验证质量守恒定律。
(1)请写出镁条与氧气反应的化学方程式__________。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我_________(填“同意”或“不同意”)小明的观点,因为__________。
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)
①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(作出猜想)黄色固体为Mg3N2。
(实验探究)请设计实验,验证猜想。
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入少量_________,将湿润红色石蕊试纸放在试管口 _________ 黄色固体为氮化镁
(反思交流)
①若用镁条代替红磷完成测定空气中氧气含量的实验,不考虑其他因素的影响,进入水的体积会_________(填“大于”、“小于”或“等于”)瓶内空气总体积的。
②空气中的氮气的含量远大于氧气的含量,可是镁条在空气中燃烧的产物氧化镁却远多于氮化镁,合理的解释是__________。
19.化学课外小组同学用如下图所示实验探究质量守恒定律:
(1)甲同学用图 A 所示实验:实验过程中产生的现象是__________。
(2)乙同学用 B 装置研究质量守恒定律时,实验步骤如下:如图将烧杯放在天平上用砝码平衡,然后倾斜烧杯使盐酸与碳酸钠粉末接触,一段时间后再把烧杯放在天平上,发现天平的指针偏 右。造成天平的指针向右偏转的原因是__________。
(3)丙同学认为 C 实验说明了质量守恒。请你从原子的角度说明为什么 __________。
(4)丁同学用图 D 中的镁带在空气中燃烧的实验来探究质量守恒定律时,发现一定质量的镁完 全燃烧后留下的固体质量比反应前镁带的质量轻,联系实验现象,可能的原因是__________。如果 在燃着的镁条上方罩上罩,使生成物全部收集起来称量,出现的结果是__________ (填“偏大”、偏 小“或”不变“)。
(5)综上所述,A、B、C、D 所示四个实验中能用质量守恒定律解释的是实验__________。(填“A”、 “B” 、“C”或“D”,下同);上述现象能用来验证质量守恒定律的是实验__________。可见, 在探究质量守恒定律时,若利用有气体参加或有气体生成的化学反应来设计实验,在装置设计 方面应做到__________。
20.(1)用和“”和“”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如图1所示。
①根据质量守恒定律,化学反应前后没有变化的是:_____ (可能有一个或多个答案)
a元素的种类 b物质的种类c原子的数目d 分子的数目e 原子的种类
②参加反应的“”和“”分子的个数比是_____。
(2)根据图2中提供的信息,请回答下列问题:
①由A 图可知,硅的相对原子质量为_____。
②B、C、D、E 中属于同种元素的是_____
③B、C 元素化学性质相似的原因是_____相同。
④C、E 两种元素组成化合物的化学式为_____。
21.电石,学名碳化钙(CaC2),以焦炭和碳酸钙为原料生产碳化钙并制备重要工业原料乙炔(CxHy)气体的原理如下图。
(实验探究)
(1)气体C有毒,写出固体A和焦炭反应得到碳化钙的化学方程式为 。
(2)小组同学对固体D提出三种猜想:
猜想一:氧化钙;
猜想二:氢氧化钙;
猜想三:碳酸钙。
同学们经过分析将猜想一排除了,理由是 。
(3)检验固体D:取样,滴加足量的稀盐酸,观察到 ,猜想二正确。
(组成测定)
(一)实验设计:
将一定量的乙炔(CxHy)在足量的氧气中完全燃烧,生成的气体全部缓缓通过下图
装置(选填“Ⅰ”或“Ⅱ”)。
(二)实验测定:(小资料:乙炔的相对分子质量为26)
实验数据记录于下表中,试通过计算,确定乙炔的化学式。
反应前质量/g
反应后质量/g
装置①
125.3
127.1
装置②
78.2
87.0
结论:乙炔的化学式 。
(归纳小结)写出碳化钙与水反应的化学方程式: 。
22.空气是一种重要资源.
(1)如图1所示装置可测定空气中氧气的含量,用注射器抽取30mL空气,硬质玻璃管的体积为50mL,在硬质玻璃管中放入过量的铜粉,在右侧导管口套上瘪的气球,点燃酒精灯,反复推拉注射器,待反应结束后,冷却值室温.
①实验时,铜粉过量的目的是_____
②冷却后,理论上注射器内剩余气体的体积约为_____mL
(2)利用空气制取氮肥(尿素)的流程如图2所示
①Ⅰ中参加反应的单质甲为_____,请你写出Ⅲ中反应的化学方程式(煤的主要成分是碳)________
②已知常压下,氮气沸点-196℃,氧气沸点-183℃,若将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是________
(3)汽车尾气催化转化器的投入使用,大大缓解了空气污染,请在图Ⅰ和图Ⅱ方框中,把转化器中某种转化反应(4CO+2NO24CO2+N2)的微观粒子补充完整._______
参考答案
1.A
【详解】
A、过氧乙酸(C2H4O3)中C、H、O三种元素的质量比为():():()=6:1:12,故A不正确;
B、过氧乙酸的相对分子质量为=76,故B正确;
C、根据分析,C正确;
D、过氧乙酸含有C、H、O三种元素,属于有机物,则完全燃烧生成CO2和H2O,故D正确。故选A。
2.D
【解析】
试题分析:根据质量守恒定律可以知道原子总数;物质总质量;;元素的种类一定不会改变,分子总数不一定改变;物质的种类一定变,故选D.
3.B
【详解】
A、自然界中,鱼类能够在水中生存,是因为水中含有氧气,氧气是由氧分子构成的,故选项说法错误;
B、地壳中含量最多的元素是氧元素,人体中含量最多的物质是水,故人体中含量最多的元素是氧元素,海水中含量最多的物质也是水,海水中含量最多的元素是氧元素,故选项说法正确;
C、氧化物是指由两种元素组成,其中一种元素是氧元素的化合物,如KClO3含有氧元素,但不是氧化物,故选项说法错误;
D、某物质中除了氧元素以外只含一种元素,不一定是氧化物,如过氧化氢溶液中只有氧元素和氢元素,属于混合物,故选项说法错误。
故选:B。
4.B
【详解】
A、反应后乙质量增大,是生成物,甲、丁质量减小,都是反应物,即甲、丁反应生成乙,是化合反应,说法错误;
B、该反应中,甲、丁的质量变化之比为:(16-8):(24-4)=2:5,所以2g甲与5g丁可恰好反应,说法正确;
C、丙可能加快该反应的速率,可能没有参加反应,说法错误;
D、反应生成的乙的质量为28g,说法错误。
故选:B。
5.B
【详解】
假设在研磨烧结过程中各元素的化合价无变化,Y2O3中Y元素为+3价,氧元素为-2价、BaCO3中钡元素为+2价,碳元素为+4价,氧元素为-2价、CuO中铜元素为+2价,氧元素为-2价,则由化合物中各元素化合价代数和为零可知:(+3)×2+(+2)×4+(+2)×6+(-2)×x=0;则x=13;
故选:B。
6.B
【详解】
A.打开瓶盖,瓶内的酒精质量逐渐减小,只是因为酒精状态改变了,属于物理变化,所以不能用质量守恒定律解释。
B.加热高锰酸钾固体,一段时间后固体质量减小,因为发生了化学变化生成了氧气,所以能用质量守恒定律解释。
C.根据质量守恒定律可知,4g氢气和32g氧气混合点燃,完全燃烧生成36g水,不能用质量守恒定律解释;
D. 10g硫酸铜溶解在90g水中,得到硫酸铜溶液的质量是100g,只是简单的混合,属于物理变化,所以不能用质量守恒定律解释。
故选:B
7.C
【解析】
试题分析:在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变.某气体在氧气中燃烧的产物只有二氧化碳和水两种,生成物中含有碳元素、氢元素和氧元素,碳元素、氢元素来自于该气体,该气体中是否含有氧元素无法确定.故答案选C.
8.A
【详解】
A、观察微观示意图反应前后都是碳原子和氢原子,原子的种类没有发生变化,错误;B、由观察微观示意图可知,生成物为C2H4和H2,正确;C、由物质的微观构成可知,反应物与生成物均由分子构成,正确;D、催化剂的作用是改变反应的速率,正确。故选A。
9.B
【详解】
A、分析物质A的微粒示意图可知,该物质的1个分子是由2个氢原子和2个氧原子构成的,故该物质的化学式为H2O2,此选项表述正确;
B、化学反应前后原子的种类不变,此选项表述不正确;
C、分析该反应的示意图可知,该反应是由一种物质分解后生成了两种物质,故该反应属于分解反应,此选项表述正确;
D、分析该反应的微观示意图可知,该反应的化学方程式为:,又知物质B是水,C是氧气,故反应中生成B、C物质的分子个数比为2:1,此选项表述正确。
故选B。
10.D
【详解】
可燃物在空气中燃烧生成水和二氧化碳,水中的氢元素和二氧化碳中的碳元素来自于该物质,水中的氧元素和二氧化碳中的氧元素可能来自于该物质和氧气,也可能完全来自于氧气,因此该物质中一定含有C、H元素,可能含有O元素。故选D。
11.D
【详解】
根据题意“生成的与水的质量比为44:27”,则生成物中碳元素和氢元素的质量比,碳原子和氢原子的数目之比为1:3。
A、中碳原子与氢原子的数目比为1:4,不符合题意;
B、碳原子和氢原子的数目之比是1:4,不符合题意;
C、中碳原子与氢原子的数目之比是1:2,不符合题意;
D、中碳元素与氢元素的数目比为1:3,符合题意。
故选D。
12.A
【解析】
试题分析:A、有机物:含碳元素的化合物,青蒿素是有机化合物,正确,B、物质由元素组成,青蒿素由碳、氢、氧三种元素组成,正确,C、青蒿素中碳、氢、氧元素的质量比=12×11:1×22:16×7=121:11:56,错误,D、根据元素质量分数计算的表达式,青蒿素中氢元素的质量分数最小,正确,故选A
13.B
【详解】
A、原子团作为一个整体参加反应,原子团在反应中一般不可拆分,如KClO3受热分解生成氯化钾和氧气,氯酸根就拆开了,说法错误;
B、水电解产生氢气和氧气,氢气由氢元素组成,氧气由氧元素组成,所以水由氢元素和氧元素组成,说法正确;
C、根据质量守恒定律,反应前后元素种类不变,某物质燃烧生成二氧化碳和水,反应物是该物质与氧气,生成物是二氧化碳和水,所以该物质中一定含有碳、氢元素,可能含氧元素.说法错误;
D、纸张燃烧后余烬的质量比原纸张的质量小,是因为生成的二氧化碳和水逸散到空气中,该反应符合质量守恒定律.说法错误;
故选B.
14.B
【详解】
A. 由表中的数据分析可知,丁物质从反应前的5克变到反应后的25克,质量增加,所以丁是该反应的生成物,而不是反应物,故A不符合题意;
B. 由表中的数据分析可知,根据质量守恒定律,反应前物质的总质量等于反应后物质的总质量,即49g+6g+12g+5g=19g+6g+X+25g,解得X=22g,故B符合题意;
C. 根据表中数据分析可知,甲物质从反应前到反应后质量减少,所以甲做反应物,由B中的分析可知,X=22,丙物质由反应前12g增加到22g,所以丙物质作生成物,由A分析可知丁物质也作生成物,即反应的关系式为:,由一种物质生成了两种物质,属于分解反应,故C不符合题意;
D. 根据表中数据可知,乙物质反应前后的质量不变,所以乙可能是该反应的催化剂,也有可能是不参加反应的杂质,故D不符合题意。
故选B。
15.D
【详解】
A、在化学变化前后虽然原子的个数不变,但分子个数可能改变,故与的和不一定等于与的和,错;
B、若与恰好完全反应,则生成的与的质量和就等于,若不是恰好完全反应,则生成的与的质量之和就会小于,故错;
C、同理,反应物与的质量比不一定等于生成物和的质量比,故错误;
D、若、各,充分反应后生成与的质量之和也应,但一定不等于,因为两者充分反应,至少有一种物质完全反应,生成物的质量总和大于,故正确。
16.D
【详解】
A、由三角烯的化学式可知,三角烯由碳、氢两种元素组成,属于有机物,但三角烯的相对分子质量为278,不属于有机高分子化合物,选项错误;
B、三角烯由三角烯分子构成,三角烯分子中含有氢原子,不含氢分子,选项错误;
C、三角烯中碳、氢元素的质量比为(12×22):(1×14)=132:7,选项错误;
D、三角烯中碳元素的质量分数为×100%≈95%大于90%,选项正确,故选D。
17.
(1) 负 2:1 带火星的木条 电
(2) H2O H、O 化学变化中分子分解,分成原子,原子重新组合成新的分子
(3)C
(4)D
【分析】
(1)
从宏观上观察:m端是电源的负极,水电解生成氢气和氧气,a试管中产生的的气体是氢气,b试管中产生的的气体是氧气,气体的体积比约为2:1,可用带火星的木条检验b试管中产生的气体。电解水的文字表达式是:,电解水的过程伴随的能量变化是电能转化为化学能;
(2)
电解水的微观实质是水分子分解成氢原子和氧原子,氢原子和氧原子重新组合成氢分子和氧分子,反应中变化的粒子是水分子,其化学式为:H2O,不变的粒子是氢原子、氧原子,其化学式分别为:H、O,化学变化的实质是化学变化中分子分解,分成原子,原子重新组合成新的分子
(3)
A、水在直流电作用水分子被分解,所以水的化学性质发生了改变,故不符合题意;
B、水在直流电作用水分子被分解,所以水分子的组成和结构发生了改变,故不符合题意;
C、水在直流电作用水分子被分解,但是氢原子和氧原子不变,所以构成水分子的原子种类不变,故符合题意;
D、水在直流电作用水分子被分解,所以水分子的能量发生了改变,故不符合题意,故选:C;
(4)
水由水分子构成,一个水分子由2个氢原子和1个氧原子构成,水在空气中放置,水分子向外扩散的过程中水分子间的间隔增大,水分子不变,ACB图示水分子的微观示意图错误,D图示正确。
18.
(1)
(2) 不同意 所有的化学变化都遵循质量守恒定律,镁燃烧是镁与空气中氧气发生化合反应生成氧化镁
(3) 蒸馏水 红色的石蕊试纸变蓝 大于 氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应
【解析】
(1)
在点燃的条件下,镁与氧气反应生成氧化镁,反应的化学方程式为:;
(2)
我不同意小明的观点,因为所有的化学变化都遵循质量守恒定律,镁燃烧是镁与空气中氧气发生化合反应生成氧化镁,所以产物的质量大于反应物镁条的质量;
(3)
实验探究:根据题干信息,可将生成的固体物质放入水中,检验是否产生氨气来进行判断;具体实验操作:取少量黄色固体于试管中,加入少量蒸馏水,将湿润的红色石蕊试纸放在试管口,观察现象;若看到红色的石蕊试纸变蓝,证明猜想正确,黄色固体为氮化镁;
反思交流:①若用镁条代替红磷完成测定空气中氧气含量的实验,镁和空气中的氮气也会发生反应生成氮化镁,消耗了空气中的氮气,集气瓶中进入水的体积自然会大于瓶内空气总体积的 1/5;
②氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应,所以镁条在空气中燃烧的产物氧化镁却远多于氮化镁。
19.白磷燃烧产生大量白烟,气球先变大后又逐渐缩小,天平仍然平衡 碳酸钠与稀盐酸反应产生的二氧化碳逸散到空气中去了,所以左盘质量减少 化学反应前后原子的种类、数目、质量没有改变 坩埚钳中残留一部分氧化镁(或实验过程中以白烟的形式扩散一部分氧化镁等) 偏大 ABCD AC 装置密闭,体积不变
【详解】
(1)实验过程中白磷燃烧产生大量白烟,由于白磷燃烧放热,所以气球先变大,随着温度的降低,气球又逐渐缩小,由于实验过程中质量不变,所以天平仍然保持平衡。
(2)由于碳酸钠与稀盐酸反应产生的二氧化碳逸散到空气中去了,所以左盘质量减少,导致天平的指针向右偏转。
(3)化学反应前后原子的种类、数目、质量没有改变。
(4)坩埚钳中残留一部分氧化镁(或实验过程中以白烟的形式扩散一部分氧化镁等)。由于镁带燃烧消耗氧气,如果在燃着的镁条上方罩上罩,使生成物全部收集起来称量,出现的结果是偏大,增多的质量是参加反应的氧气的质量。
(5)质量守恒定律是化学变化普遍遵守的规律,A、B、C、D 所示四个实验中都能用质量守恒定律解释,上述现象能用来验证质量守恒定律的是实验AC。在探究质量守恒定律时,若利用有气体参加或有气体生成的化学反应来设计实验,在装置设计方面应做到装置密闭,体积不变。
20.ace 3:1 28.09 CD 最外层电子数相同 Na2S
【详解】
(1) ①根据质量守恒定律,化学反应前后没有变化的是:元素的种类;原子的数目;原子的种类;由反应的微观示意图可知,参加反应的“”和“”分子的个数比是3:1;(2) ①由A 图可知,硅的相对原子质量为28.09;②质子数相同元素的种类也相同,故B、C、D、E 中属于同种元素的是CD;③B、C 元素化学性质相似的原因是最外层电子数相同;④C为16号元素硫,硫原子最外层电子数为6,容易得到2个电子带2个单位的负电荷,E为11号元素钠元素,钠原子最外层电子数为1,容易失去,带一个单位的正电荷,它们的化合价在数值上与所带电荷数相等,所以两种元素组成化合物的化学式为:Na2S。
21.(1)CaO + 3CCaC2 + CO↑(2)氧化钙与水反应生成氢氧化钙 (3)固体溶解,无气泡产生
(一)II(二)C2H2 【归纳小结】CaC2 + 2H2O = Ca(OH)2 + C2H2↑
【解析】
试题分析:碳酸钙受热分解生成氧化钙和二氧化碳气体,所以A是氧化钙,C是一种有毒气体,固体A和焦炭反应得到碳化钙的化学方程式为CaO + 3CCaC2 + CO↑,经过分析将猜想一排除了,理由是 氧化钙与水反应生成氢氧化钙。检验固体D:取样,滴加足量的稀盐酸,观察到固体溶解,无气泡产生,猜想二正确,将一定量的乙炔(CxHy)在足量的氧气中完全燃烧,生成的气体全部缓缓通过下图II装置,如果选择1,则可能从氢氧化钠的溶液中带出水分,使得浓硫酸的装置增重,影响实验的数据,从表格的数据看:水的质量为1.8克,而二氧化碳的质量为8.8克,生成一分子水的同时生成两分子的二氧化碳,所以碳原子和氢原子的个数之比是1:1,12X+Y=26,X=Y,所以X=2,所以化学式为C2H2,碳化钙与水反应的化学方程式:CaC2 + 2H2O = Ca(OH)2 + C2H2↑。
22.耗尽装置的氧气 14 H2 木条熄灭
【详解】
(1)①实验时,为了完全除去空气中的氧气,铜粉必须是过量的,否则得出的结果不准确。
②足量的铜粉充分加热消耗氧气的体积为:(30mL+50mL)×1/5 =16mL;冷却后,理论上注射器内剩余气体的体积约为30mL-16mL=14mL;故冷却后,理论上注射器内剩余气体的体积约为14mL。
(2)①氮气和氢气在一定条件下生成氨气,Ⅰ中参加反应的单质甲为氢气;Ⅲ中反应是碳与氧气在点燃的条件下反应生成二氧化碳;化学方程式为:。
②分离液态空气制氧气,是利用液氧和液氮的沸点不同,液氮的沸点低,首先蒸发出来,所以若将燃着的木条置于盛满液态空气的烧杯口,木条会熄灭。
(3)由化学方程式可知,每4个一氧化碳分子与2个二氧化氮分子在催化剂的作用下反应生成4个二氧化碳分子与1个氮分子;故微观粒子图为: 。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
