3.1溶液的形成同步练习—2021_2022学年九年级化学鲁教版上册(word版 含解析)
文档属性
| 名称 | 3.1溶液的形成同步练习—2021_2022学年九年级化学鲁教版上册(word版 含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 95.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-22 10:52:48 | ||
图片预览



文档简介
3.1溶液的形成
一、选择题(共16题)
1.下列物质中,能与水反应且放热的是
A.碳酸钙 B.生石灰 C.氢氧化钠 D.硝酸铵
2.下列物质中不能与水形成溶液的是
A.白糖 B.食盐 C.氢氧化钠 D.植物油
3.下列物质属于溶液的是
A.芒果汁 B.牛奶 C.玉米粥 D.矿泉水
4.生活中的下列物质放入水中,能形成溶液的是
A.豆油 B.面粉 C.蔗糖 D.泥沙
5.餐桌上的饮品种类丰富,下列饮品中属于溶液的是
A.酸奶 B.雪碧 C.豆浆 D.玉米糊
6.下列物质放入水中,不能形成溶液的是
A.花生油 B.白糖 C.白酒 D.白醋
7.下列关于溶液的说法中,不正确的是
A.溶液中各部分性质相同,是一种高级混合物
B.氢氧化钠溶液能导电,是因为溶液中含有自由移动的离子
C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D.20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液中含有氯化钠36g
8.下列饮品中,属于溶液的是
A.蒸馏水 B.玉米汁 C.糖水 D.豆浆
9.厨房中的下列物质与水混合,不能形成溶液的是
A.白糖 B.豆油 C.食盐 D.白酒
10.为提高石油产量,需将附着在岩石表面的石油均匀分散在水中,所以此时开采需加
A.催化剂 B.酸化剂 C.氧化剂 D.乳化剂
11.下列物质与水混合,不能形成溶液的是
A.食盐 B.蔗糖 C.花生油 D.白醋
12.下列属于溶液的是( )
A.豆浆 B.泥水 C.食盐水 D.牛奶
13.下列物质属于溶液的是
A.医用酒精
B.蒸馏水
C.牛奶
D.泥浆
14.下表中知识的归纳总结都正确的一项是( )
A、清洗试管内附着物 B、鉴别、除杂 C、保护金属资源 D、燃烧、灭火
①用食醋浸泡除去水垢 ②用稀硫酸浸泡除去试管中附着的铜 ①用溶解、过滤、洗涤、干燥的方法除去粗盐中的泥沙②用灼烧,闻气味的方法区分棉线和羊毛线 ①铁生锈的原因是铁与氧气和水接触 ②切了咸菜的菜刀容易生锈 ①煤气泄漏要先打开排气扇 ②酒精灯失火应用湿布盖灭
A.A B.B C.C D.D
15.如图是甲、乙两种固体(均不含结晶水)的溶解度曲线,下列叙述正确的是( )
A.0﹣t2℃时,甲物质的溶解度大于乙物质的溶解度
B.t2℃时,等质量的甲、乙溶液中所含的溶质质量相等
C.欲提纯含有少量甲的乙物质,应采取冷却热饱和溶液的方法
D.t1℃时,用60g甲的饱和溶液加水可以配制成200g5%的甲溶液
16.下列实验设计正确的是
A.加入活性炭使硬水变为软水 B.用湿润的pH试纸测白醋的pH
C.用托盘天平称量5.62g氯化钠 D.用水区分硝酸铵和氢氧化钠固体
二、综合题(共5题)
17.结合KNO3和NaCl的溶解度表,回答下列问题。
温度/°C 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)0°C时,KNO3溶解度是_____g
(2)根据NaCl的溶解度表可知,从海水中提取氯化钠,通常采用的结晶方法是____。
(3)在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液降温到40°C,对溶液的分析正确的是____。
A 降温前后溶液都是饱和溶液
B 溶液中溶质减少
C 溶液中溶质的质量分数不变
18.如图是a、b、c三种固体物质的溶解度曲线:请回答下列问题:
(1)t1℃时a物质的饱和溶液中溶液质量与溶剂质量的比(最简比)_____。
(2)三种物质的结晶方法与海水晒盐相同的是_____(填“a”“b”或“c”)
(3)t3℃时,把20ga、b、c三种物质分别加入盛有50g水的烧杯中不断搅拌,充分溶解后恢复至t3℃,所得溶液的溶质质量分数大小关系为__(填字母,下同)再将溶液降低到t1℃时所得溶液质量大小关系为__。
(4)t1℃时a、b、c三种物质的饱和溶液同时升温到t2℃此时溶液中溶质的质量分数大小关系是_____。
19.水是生命的源泉,是人类最宝贵的资源
(1)自来水净化天然水的主要步骤如图所示:试剂X可以用_____,净化后的水是_____(选填“纯净物”或“混合物”)
(2)水是一种最常用的溶剂,将下列生活中的物质分别放入水中,能形成溶液的是_____
A面粉 B冰块 C冰糖 D花生油
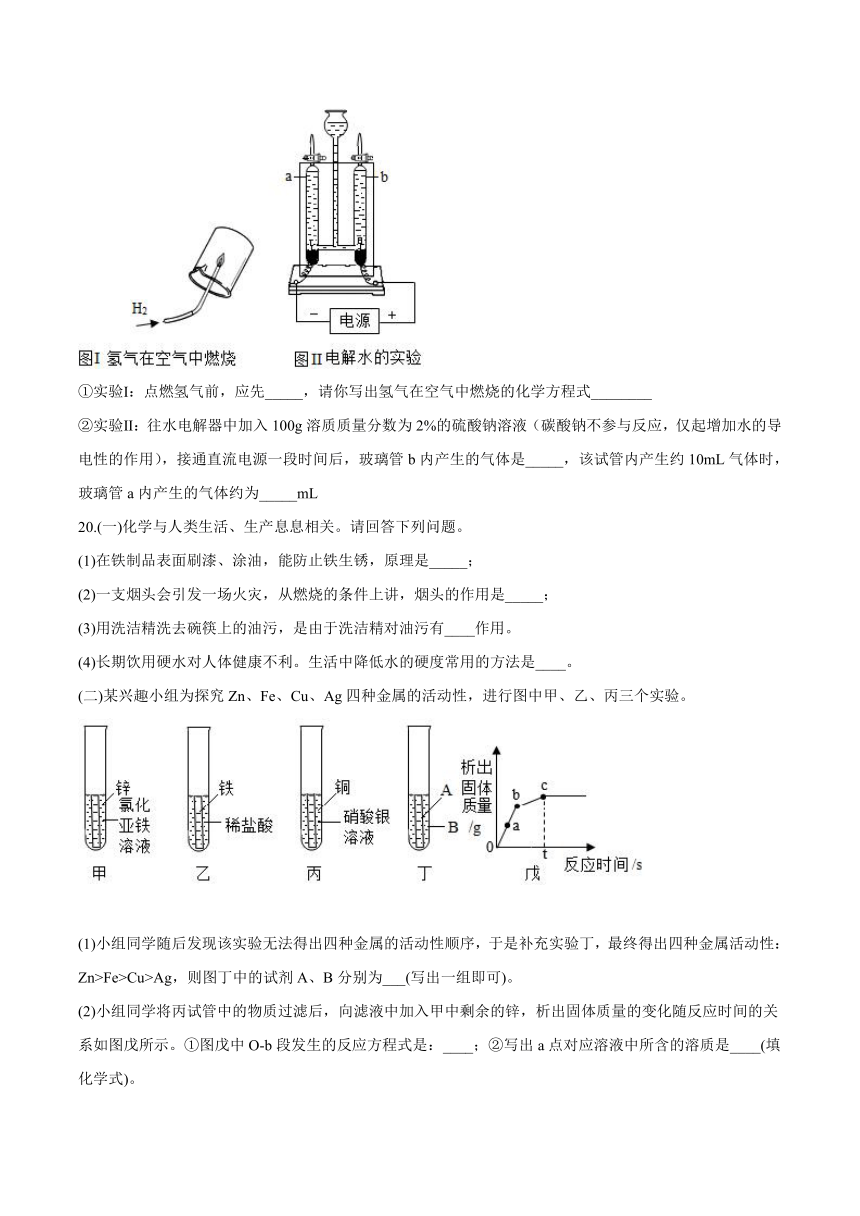
(3)某化学兴趣小组的同学利用以下两个实验验证水的组成
①实验Ⅰ:点燃氢气前,应先_____,请你写出氢气在空气中燃烧的化学方程式________
②实验Ⅱ:往水电解器中加入100g溶质质量分数为2%的硫酸钠溶液(碳酸钠不参与反应,仅起增加水的导电性的作用),接通直流电源一段时间后,玻璃管b内产生的气体是_____,该试管内产生约10mL气体时,玻璃管a内产生的气体约为_____mL
20.(一)化学与人类生活、生产息息相关。请回答下列问题。
(1)在铁制品表面刷漆、涂油,能防止铁生锈,原理是_____;
(2)一支烟头会引发一场火灾,从燃烧的条件上讲,烟头的作用是_____;
(3)用洗洁精洗去碗筷上的油污,是由于洗洁精对油污有____作用。
(4)长期饮用硬水对人体健康不利。生活中降低水的硬度常用的方法是____。
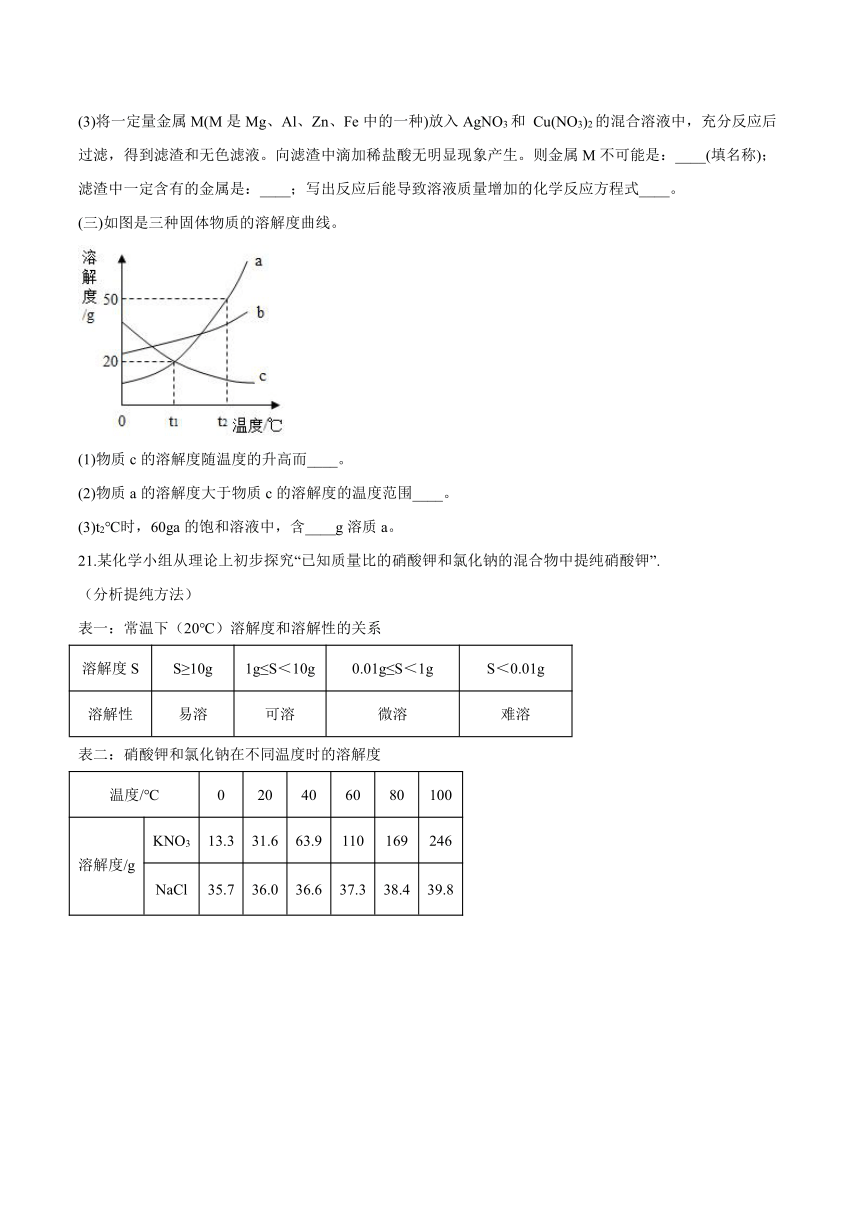
(二)某兴趣小组为探究Zn、Fe、Cu、Ag四种金属的活动性,进行图中甲、乙、丙三个实验。
(1)小组同学随后发现该实验无法得出四种金属的活动性顺序,于是补充实验丁,最终得出四种金属活动性:Zn>Fe>Cu>Ag,则图丁中的试剂A、B分别为___(写出一组即可)。
(2)小组同学将丙试管中的物质过滤后,向滤液中加入甲中剩余的锌,析出固体质量的变化随反应时间的关系如图戊所示。①图戊中O-b段发生的反应方程式是:____;②写出a点对应溶液中所含的溶质是____(填化学式)。
(3)将一定量金属M(M是Mg、Al、Zn、Fe中的一种)放入AgNO3和 Cu(NO3)2的混合溶液中,充分反应后过滤,得到滤渣和无色滤液。向滤渣中滴加稀盐酸无明显现象产生。则金属M不可能是:____(填名称);滤渣中一定含有的金属是:____;写出反应后能导致溶液质量增加的化学反应方程式____。
(三)如图是三种固体物质的溶解度曲线。
(1)物质c的溶解度随温度的升高而____。
(2)物质a的溶解度大于物质c的溶解度的温度范围____。
(3)t2℃时,60ga的饱和溶液中,含____g溶质a。
21.某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”.
(分析提纯方法)
表一:常温下(20℃)溶解度和溶解性的关系
溶解度S S≥10g 1g≤S<10g 0.01g≤S<1g S<0.01g
溶解性 易溶 可溶 微溶 难溶
表二:硝酸钾和氯化钠在不同温度时的溶解度
温度/℃ 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)①常温下,KNO3和NaCl的溶解性均为______。
②根据表中数据,绘制KNO3的溶解度曲线_____.
③根据KNO3的溶解度曲线,获得KNO3在70℃时的溶解度约为 ______g.
(2)(设计提纯步骤)
①选取样品(95gKNO3和5gNaCl的混合物)
②配制80℃时KNO3的饱和溶液(加水约56.2mL,水的密度约为1g mL﹣1)
③降温至20℃
④得到晶体
(设计提纯方案)
为了证明④中得到的晶体为纯净的KNO3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水铬固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加________,观察实验现象.
方案二 计算析出KNO3晶体的质量约为________g(精确到0.1g)与(4)中得到晶体的质量进行比较;
方案三________与95%进行比较;
方案四________.
参考答案
1.B
【详解】
A.碳酸钙难溶于水且不和水反应,不符合题意;
B.生石灰能与水反应生成氢氧化钙,反应放出大量的热,符合题意;
C.氢氧化钠溶于水放出大量的热,不能发生化学反应,不符合题意;
D.硝酸铵溶于水会吸收热量,溶液的温度会降低,不符合题意。
故选B。
2.D
【详解】
试题分析:溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物.
解:A、白糖易溶于水,能和水形成均一、稳定的混合物,即能够形成溶液;
B、食盐易溶于水,能和水形成均一、稳定的混合物,即能够形成溶液;
C、氢氧化钠易溶于水,能和酒精形成均一、稳定的混合物,即能够形成溶液;
D、植物油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液.
故选D.
3.D
【详解】
A、芒果汁不均一不稳定,不属于溶液,故A错;
B、牛奶属于乳浊液,不均一不稳定,故B错;
C、玉米粥不均一不稳定,属于悬浊液,故C错;
D、矿泉水是均一稳定的混合物,属于溶液,故D正确。
故选D。
4.C
【详解】
A、豆油不溶于水,形成的是乳浊液,故A不符合题意;
B、面粉不溶于水,形成的是悬浊液,故B不符合题意;
C、蔗糖溶于水,可以形成溶液,故C符合题意;
D、泥沙不溶于水,形成悬浊液,故D不符合题意;
故选C。
5.B
【详解】
A. 酸奶不均一不稳定,属于乳浊液,故选项错误;
B. 雪碧是均一稳定的混合物,属于溶液,故选项正确;
C. 豆浆不均一不稳定,属于悬浊液,故选项错误;
D. 玉米糊不均一不稳定,属于悬浊液,故选项错误。
故选:B。
6.A
【详解】
A、花生油不溶于水,与水混合形成的是乳浊液,不均一、不稳定,故A正确;
B、白糖易溶于水,形成了均一、稳定的混合物,属于溶液,故B错;
C、白酒易溶于水,形成了均一、稳定的混合物,属于溶液,故C错;
D、白醋易溶于水,形成了均一、稳定的混合物,属于溶液,故D错;
故选A。
7.D
【详解】
A、溶液中各部分性质相同,是一种高级混合物,正确;B、氢氧化钠溶液能导电,是因为溶液中含有自由移动的钠离子和氢氧根离子,正确;C、接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态,正确;D、20℃,氯化钠的溶解度为36g,此时对应的应该是100g水,溶液的质量为136g,所以20℃时100g氯化钠饱和溶液中含有氯化钠的质量小于36g,错误。故选D。
8.C
【详解】
A、蒸馏水中只含有水一种物质,属于纯净物,不属于溶液,选项错误;
B、玉米汁中含有难溶性物质,是难溶性物质与水组成的混合物,属于悬浊液,选项错误;
C、糖水是可溶性固体蔗糖与水组成的混合物,属于溶液,选项正确;
D、豆浆玉米汁中含有难溶性物质,是难溶性物质与水组成的混合物,属于悬浊液,选项错误,故选C。
9.B
【详解】
A、白糖易溶于水,能和水形成均一、稳定的混合物,即能和水形成溶液,故A错误;
B、豆油不溶于水,不能和水形成溶液,形成乳浊液,故B正确;
C、食盐易溶于水,能和水形成溶液,故C错误;
D、白酒与水以任意比互溶,能和水形成均一、稳定的混合物,能和水形成溶液,故D错误。
故选B。
10.D
【详解】
乳化剂具有乳化性,能将油污乳化为细小油滴,均匀分散在水中,故需要加乳化剂,不能加催化剂、酸化剂、氧化剂。
故选D。
11.C
【详解】
A、食盐能与水形成均一、稳定的溶液,不符合题意;
B、蔗糖能与水形成均一、稳定的溶液,不符合题意;
C、花生油不能与水不互溶,无法形成均一、稳定的溶液,符合题意;
D、白醋能与水形成均一、稳定的溶液,不符合题意。
故选C。
12.C
【详解】
A、豆浆中的营养物质有的溶于水,有的不溶于水,豆浆不是均一、稳定的混合物,不属于溶液,不符合题意;
B、泥土不溶于水,只能以固体小颗粒的形式悬浮于液体里,形成悬浊液,不符合题意;
C、食盐水是均一、稳定的溶液,符合题意;
D、牛奶中的营养物质有的溶于水,有的不溶于水,牛奶不是均一、稳定的混合物,不属于溶液,不符合题意。
故选C。
13.A
【详解】
A. 医用酒精中水和酒精均匀混合在一起,且非常稳定,属于溶液。
B、蒸馏水是纯净物,不属于混合物,故不是溶液。
C、牛奶是不溶性的小液滴等分散到液体中形成的,不均一、不稳定,不属于溶液。
D、泥浆不溶于水,泥浆水不均一、不稳定,不属于溶液。
故选:A。
14.C
【详解】
A、①水垢的主要成分为是碳酸钙和氢氧化镁等碱性物质,可用食醋浸泡除去;②由于铜位于氢的后面,铜不能和稀硫酸反应,用稀硫酸浸泡不除去试管中附着的铜,故选项错误;
B、氯化钠溶解,泥沙不溶,过滤除去泥沙,蒸发才可得到氯化钠固体;灼烧,有烧焦羽毛气味的气体产生的是羊毛线,没有此气味的气体产生的是棉线,现象不同,可以鉴别,故选项错误;
C、①铁生锈的原因是铁与氧气和水接触,②切了咸菜的菜刀,由于有食盐加快了生锈速率,故选项正确;
D、①煤气泄漏不可先打开排气扇,易产生火花,引发爆炸;②酒精灯失火应用湿布盖灭,故选项错误。故选C。
15.D
【解析】A、通过分析溶解度曲线可知,0﹣t2℃时,甲的曲线在乙的曲线下方,甲物质的溶解度小于乙物质的溶解度,错误;
B、t2℃时,甲、乙两种物质的溶解度相等,等质量的甲、乙饱和溶液中所含的溶质质量相等,错误;
C、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,要提纯乙物质应采用蒸发结晶的方法,错误;
D、根据溶解度曲线可知,t1℃时,甲的溶解度是20g,其饱和溶液的溶质质量分数=×100%=33.3%,所以t1℃时,用60 g甲的饱和溶液加水可以配制成200g 5%的甲溶液,正确。
故选D。
16.D
【详解】
A、加入活性炭不能使硬水变为软水,活性炭具有吸附性,可以吸附色素或异味,不能吸附钙镁离子,故A错误;B、用湿润的pH试纸测白醋的pH,会影响结果,应用干燥的pH试纸测白醋的pH,故B错误;C、不能用托盘天平称量5.62g氯化钠,天平精确度是0.1g,故C错误;D、用水区分硝酸铵和氢氧化钠固体,硝酸铵溶于水吸热,氢氧化钠固体溶于水放热,故D正确。
17.13.3g 蒸发结晶 AB
【详解】
(1)由表可知,0℃时,KNO3溶解度是13.3g;
(2)根据NaCl的溶解度表可知,氯化钠的溶解度随温度的变化不大,故从海水中提取氯化钠,通常采用的结晶方法是蒸发结晶;
(3)A、在60°C时,硝酸钾的溶解度是110g,将60gKNO3加入到50g水中充分溶解后,所得溶液为饱和溶液,硝酸钾的溶解度随温度的升高而增加,降温到40°C,溶液还是饱和溶液,符合题意;
B、在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液中溶质质量为55g,降温到40°C,40℃时,硝酸钾的溶解度为:63.9,溶液中溶质的质量为:31.95,故溶液中溶质质量减少,符合题意;
C、降温前后,溶液都是饱和溶液,且60℃时硝酸钾的溶解度大于40℃时硝酸钾的溶解度,故降温后,溶质的质量分数减小,不符合题意。
故选AB。
18.6:5 b a>b>c b>a=c b>a>c
【详解】
(1)t1℃时a物质的溶解度为20g,a物质的饱和溶液中溶液质量与溶剂质量的比为:(100g+20g):100g=6:5
(2)a、b两种固体物质的溶解度,都是随温度升高而增大,而c的溶解度随温度的升高而减少;三种物质的结晶方法中与海水晒盐相同的是b,因为b的溶解度受温度的影响变化不大;
(3)t3℃时,把20克 a、b、c三种物质分别加入到盛有50克水的烧杯中不断搅拌,所得溶液的溶质质量分数大小关系:a>b>c,因为在该温度下a的溶解度最大是50g,物质a完全被溶解,b的溶解度是38g,物质b未溶解了,物质c剩余最多;若将温度降低到t1℃时,溶液质量的大小关系为b>a=c,因为a降温后析出固体比b多,c又溶解一部分固体,该温度下,b的溶解度最大,a与c的溶解度相等,溶质的质量分数相等;
(4)t1℃时a、b、c三种物质的饱和溶液中溶质质量分数大小为b>a=c,三种物质的饱和溶液同时升温到t2℃,a、b物质的溶解度增大,c物质的溶解度减小,此时溶液中溶质的质量分数大小关系是b>a>c。
19.活性炭 混合物 C 验纯 氧气 20
【详解】
(1)活性炭具有吸附性,能除去水中的色素和异味,自来水净化天然水的主要步骤如图所示:试剂X可以用活性炭,净化后的水中含有可溶性物质,是混合物;
(2)冰糖能溶于水,形成溶液,而面粉、花生油都不能溶于水形成均一稳定的混合物,即不能形成溶液;冰块和水是同一种物质,不是溶液,故填:C;
(3)①可燃性气体在点燃前都要进行验纯,以防爆炸;氢气燃烧生成水,其化学方程式为:。
②接通直流电源一段时间后,玻璃管a与负极相连,是氢气,玻璃管b与正极相连,是氧气,氢气和氧气的体积比为2:1,该管内产生约10mL气体时,玻璃管a内产生约20mL气体。
20.隔绝空气(或氧气)和水 使可燃物温度达到着火点 乳化 煮沸 Fe、CuSO4溶液(合理即可) Zn+2AgNO3=2Ag + Zn(NO3)2 AgNO3、Cu(NO3)2、Zn(NO3)2 铁 银和铜 Zn+ Cu(NO3)2=Cu+ Zn(NO3)2 减小 >t1℃ 20
【详解】
(一)(1)在铁制品表面刷漆、涂油,能防止铁生锈,原理是隔绝空气(或氧气)和水,故填:隔绝空气(或氧气)和水;
(2)烟头的温度很高,使可燃物温度达到着火点,从而引燃其它的可燃物,故填:使可燃物温度达到着火点;
(3)洗洁精对油污有乳化作用,故填:乳化;
(4)加热煮沸时,水中的钙离子、镁离子能够以碳酸钙沉淀、氢氧化镁沉淀的形式从水中析出从而降低水的硬度,因此能降低水硬度的方法是煮沸,故填:煮沸;
(二)(1)甲、乙、丙实验已经得出:锌>铁,铁>H,铜>银,丁实验只要得出铁和铜的活动性,故可用金属和盐溶液,即铁和硫酸铜溶液或金属与酸反应等,故填:Fe、CuSO4溶液(合理即可);
(2)由图戊可知,析出固体质量先增加的多,后增加的小,说明丙溶液中的溶质为硝酸银和硝酸铜,由于锌>铜>银,故锌加入后先置换银,固体质量增加,然后置换铜,固体质量增加比银要小,待硝酸铜反应完后,固体质量不再增加,O-b段发生反应的化学方程式是Zn+2AgNO3=2Ag + Zn(NO3)2;a点对应锌与部分硝酸银反应,溶液中所含的溶质是剩余的硝酸银、硝酸铜和生成的硝酸锌,故填:Zn+2AgNO3=2Ag + Zn(NO3)2;AgNO3、Cu(NO3)2、Zn(NO3)2;
(3)充分反应后过滤得到无色滤液,说明硝酸铜已经完全反应,金属M不可能是铁,这是因为铁能与硝酸银、硝酸铜反应生成硝酸亚铁,而硝酸亚铁溶液是浅绿色溶液;充分反应后过滤,得到无色滤液,说明硝酸铜已经完全反应,而硝酸银先于硝酸铜反应,因此硝酸银也已经完全反应,滤渣中一定含有的金属是反应生成的银和铜;Mg、Al、Zn的相对原子质量都比Ag小,与硝酸银反应后导致溶液质量都减少;Zn的相对原子质量比Cu大,与硝酸铜反应后能导致溶液质量增加,锌与硝酸铜溶液反应生成硝酸锌和铜,反应的化学方程式为Zn+ Cu(NO3)2=Cu+ Zn(NO3)2,故填:铁;银和铜;Zn+ Cu(NO3)2=Cu+ Zn(NO3)2;
(三)(1)由溶解度曲线可知,物质c的溶解度随温度的升高而减小,故填:减小;
(2)由溶解度曲线可知,当温度大于t1℃时,物质a的溶解度大于物质c的溶解度,故填:>t1℃;
(3)t2℃时,a的溶解度为50g,60ga的饱和溶液中溶质的质量为60g××100%=20g,故填:20。
21.易溶 138 硝酸银 77.2 82% 利用20.2g与5g进行比较
【详解】
(1)①由表二可知,20℃时,NaCl和KNO3的溶解度分别为31.6g和36.0g,均大于10g,所以常温下,KNO3和NaCl的溶解性均为易溶;
②根据表格中硝酸钾在不同温度下的溶解度,用横坐标表示温度,纵坐标表示物质的溶解度,可画出其溶解度曲线;
③所绘制的曲线,找出KNO3曲线中横坐标为70时所对应的纵坐标的数值,为138,所以在70℃时KNO3的溶解度约为138g;
(2)①假设④中的晶体是纯净的KNO3,则所配制的溶液中不含NaCl,因此可滴加硝酸银溶液来检验溶液中是否含NaCl,若有白色沉淀产生,则证明有NaCl,晶体④不是纯净的KNO3,反之晶体则是纯净的KNO3;
②20℃时,硝酸钾的溶解度为31.6g,设在该温度下的56.2g水中最多溶解硝酸钾的质量为x,则,得x=17.8g,则析出硝酸钾晶体的质量为:95g-17.8g=77.2g;
③析出晶体中硝酸钾所占的比例,因此82%与95%进行比较。
④20℃时,氯化钠的溶解度为36.0g,设在该温度下的56.2g水中最多溶解氯化钠的质量为y,则,得y=20.2g,则在20℃时,56.2g水中可以溶解氯化钠20.2g,大于5g,则实验中加入的5g氯化钠可以全部溶解。
一、选择题(共16题)
1.下列物质中,能与水反应且放热的是
A.碳酸钙 B.生石灰 C.氢氧化钠 D.硝酸铵
2.下列物质中不能与水形成溶液的是
A.白糖 B.食盐 C.氢氧化钠 D.植物油
3.下列物质属于溶液的是
A.芒果汁 B.牛奶 C.玉米粥 D.矿泉水
4.生活中的下列物质放入水中,能形成溶液的是
A.豆油 B.面粉 C.蔗糖 D.泥沙
5.餐桌上的饮品种类丰富,下列饮品中属于溶液的是
A.酸奶 B.雪碧 C.豆浆 D.玉米糊
6.下列物质放入水中,不能形成溶液的是
A.花生油 B.白糖 C.白酒 D.白醋
7.下列关于溶液的说法中,不正确的是
A.溶液中各部分性质相同,是一种高级混合物
B.氢氧化钠溶液能导电,是因为溶液中含有自由移动的离子
C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D.20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液中含有氯化钠36g
8.下列饮品中,属于溶液的是
A.蒸馏水 B.玉米汁 C.糖水 D.豆浆
9.厨房中的下列物质与水混合,不能形成溶液的是
A.白糖 B.豆油 C.食盐 D.白酒
10.为提高石油产量,需将附着在岩石表面的石油均匀分散在水中,所以此时开采需加
A.催化剂 B.酸化剂 C.氧化剂 D.乳化剂
11.下列物质与水混合,不能形成溶液的是
A.食盐 B.蔗糖 C.花生油 D.白醋
12.下列属于溶液的是( )
A.豆浆 B.泥水 C.食盐水 D.牛奶
13.下列物质属于溶液的是
A.医用酒精
B.蒸馏水
C.牛奶
D.泥浆
14.下表中知识的归纳总结都正确的一项是( )
A、清洗试管内附着物 B、鉴别、除杂 C、保护金属资源 D、燃烧、灭火
①用食醋浸泡除去水垢 ②用稀硫酸浸泡除去试管中附着的铜 ①用溶解、过滤、洗涤、干燥的方法除去粗盐中的泥沙②用灼烧,闻气味的方法区分棉线和羊毛线 ①铁生锈的原因是铁与氧气和水接触 ②切了咸菜的菜刀容易生锈 ①煤气泄漏要先打开排气扇 ②酒精灯失火应用湿布盖灭
A.A B.B C.C D.D
15.如图是甲、乙两种固体(均不含结晶水)的溶解度曲线,下列叙述正确的是( )
A.0﹣t2℃时,甲物质的溶解度大于乙物质的溶解度
B.t2℃时,等质量的甲、乙溶液中所含的溶质质量相等
C.欲提纯含有少量甲的乙物质,应采取冷却热饱和溶液的方法
D.t1℃时,用60g甲的饱和溶液加水可以配制成200g5%的甲溶液
16.下列实验设计正确的是
A.加入活性炭使硬水变为软水 B.用湿润的pH试纸测白醋的pH
C.用托盘天平称量5.62g氯化钠 D.用水区分硝酸铵和氢氧化钠固体
二、综合题(共5题)
17.结合KNO3和NaCl的溶解度表,回答下列问题。
温度/°C 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)0°C时,KNO3溶解度是_____g
(2)根据NaCl的溶解度表可知,从海水中提取氯化钠,通常采用的结晶方法是____。
(3)在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液降温到40°C,对溶液的分析正确的是____。
A 降温前后溶液都是饱和溶液
B 溶液中溶质减少
C 溶液中溶质的质量分数不变
18.如图是a、b、c三种固体物质的溶解度曲线:请回答下列问题:
(1)t1℃时a物质的饱和溶液中溶液质量与溶剂质量的比(最简比)_____。
(2)三种物质的结晶方法与海水晒盐相同的是_____(填“a”“b”或“c”)
(3)t3℃时,把20ga、b、c三种物质分别加入盛有50g水的烧杯中不断搅拌,充分溶解后恢复至t3℃,所得溶液的溶质质量分数大小关系为__(填字母,下同)再将溶液降低到t1℃时所得溶液质量大小关系为__。
(4)t1℃时a、b、c三种物质的饱和溶液同时升温到t2℃此时溶液中溶质的质量分数大小关系是_____。
19.水是生命的源泉,是人类最宝贵的资源
(1)自来水净化天然水的主要步骤如图所示:试剂X可以用_____,净化后的水是_____(选填“纯净物”或“混合物”)
(2)水是一种最常用的溶剂,将下列生活中的物质分别放入水中,能形成溶液的是_____
A面粉 B冰块 C冰糖 D花生油
(3)某化学兴趣小组的同学利用以下两个实验验证水的组成
①实验Ⅰ:点燃氢气前,应先_____,请你写出氢气在空气中燃烧的化学方程式________
②实验Ⅱ:往水电解器中加入100g溶质质量分数为2%的硫酸钠溶液(碳酸钠不参与反应,仅起增加水的导电性的作用),接通直流电源一段时间后,玻璃管b内产生的气体是_____,该试管内产生约10mL气体时,玻璃管a内产生的气体约为_____mL
20.(一)化学与人类生活、生产息息相关。请回答下列问题。
(1)在铁制品表面刷漆、涂油,能防止铁生锈,原理是_____;
(2)一支烟头会引发一场火灾,从燃烧的条件上讲,烟头的作用是_____;
(3)用洗洁精洗去碗筷上的油污,是由于洗洁精对油污有____作用。
(4)长期饮用硬水对人体健康不利。生活中降低水的硬度常用的方法是____。
(二)某兴趣小组为探究Zn、Fe、Cu、Ag四种金属的活动性,进行图中甲、乙、丙三个实验。
(1)小组同学随后发现该实验无法得出四种金属的活动性顺序,于是补充实验丁,最终得出四种金属活动性:Zn>Fe>Cu>Ag,则图丁中的试剂A、B分别为___(写出一组即可)。
(2)小组同学将丙试管中的物质过滤后,向滤液中加入甲中剩余的锌,析出固体质量的变化随反应时间的关系如图戊所示。①图戊中O-b段发生的反应方程式是:____;②写出a点对应溶液中所含的溶质是____(填化学式)。
(3)将一定量金属M(M是Mg、Al、Zn、Fe中的一种)放入AgNO3和 Cu(NO3)2的混合溶液中,充分反应后过滤,得到滤渣和无色滤液。向滤渣中滴加稀盐酸无明显现象产生。则金属M不可能是:____(填名称);滤渣中一定含有的金属是:____;写出反应后能导致溶液质量增加的化学反应方程式____。
(三)如图是三种固体物质的溶解度曲线。
(1)物质c的溶解度随温度的升高而____。
(2)物质a的溶解度大于物质c的溶解度的温度范围____。
(3)t2℃时,60ga的饱和溶液中,含____g溶质a。
21.某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”.
(分析提纯方法)
表一:常温下(20℃)溶解度和溶解性的关系
溶解度S S≥10g 1g≤S<10g 0.01g≤S<1g S<0.01g
溶解性 易溶 可溶 微溶 难溶
表二:硝酸钾和氯化钠在不同温度时的溶解度
温度/℃ 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)①常温下,KNO3和NaCl的溶解性均为______。
②根据表中数据,绘制KNO3的溶解度曲线_____.
③根据KNO3的溶解度曲线,获得KNO3在70℃时的溶解度约为 ______g.
(2)(设计提纯步骤)
①选取样品(95gKNO3和5gNaCl的混合物)
②配制80℃时KNO3的饱和溶液(加水约56.2mL,水的密度约为1g mL﹣1)
③降温至20℃
④得到晶体
(设计提纯方案)
为了证明④中得到的晶体为纯净的KNO3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水铬固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加________,观察实验现象.
方案二 计算析出KNO3晶体的质量约为________g(精确到0.1g)与(4)中得到晶体的质量进行比较;
方案三________与95%进行比较;
方案四________.
参考答案
1.B
【详解】
A.碳酸钙难溶于水且不和水反应,不符合题意;
B.生石灰能与水反应生成氢氧化钙,反应放出大量的热,符合题意;
C.氢氧化钠溶于水放出大量的热,不能发生化学反应,不符合题意;
D.硝酸铵溶于水会吸收热量,溶液的温度会降低,不符合题意。
故选B。
2.D
【详解】
试题分析:溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物.
解:A、白糖易溶于水,能和水形成均一、稳定的混合物,即能够形成溶液;
B、食盐易溶于水,能和水形成均一、稳定的混合物,即能够形成溶液;
C、氢氧化钠易溶于水,能和酒精形成均一、稳定的混合物,即能够形成溶液;
D、植物油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液.
故选D.
3.D
【详解】
A、芒果汁不均一不稳定,不属于溶液,故A错;
B、牛奶属于乳浊液,不均一不稳定,故B错;
C、玉米粥不均一不稳定,属于悬浊液,故C错;
D、矿泉水是均一稳定的混合物,属于溶液,故D正确。
故选D。
4.C
【详解】
A、豆油不溶于水,形成的是乳浊液,故A不符合题意;
B、面粉不溶于水,形成的是悬浊液,故B不符合题意;
C、蔗糖溶于水,可以形成溶液,故C符合题意;
D、泥沙不溶于水,形成悬浊液,故D不符合题意;
故选C。
5.B
【详解】
A. 酸奶不均一不稳定,属于乳浊液,故选项错误;
B. 雪碧是均一稳定的混合物,属于溶液,故选项正确;
C. 豆浆不均一不稳定,属于悬浊液,故选项错误;
D. 玉米糊不均一不稳定,属于悬浊液,故选项错误。
故选:B。
6.A
【详解】
A、花生油不溶于水,与水混合形成的是乳浊液,不均一、不稳定,故A正确;
B、白糖易溶于水,形成了均一、稳定的混合物,属于溶液,故B错;
C、白酒易溶于水,形成了均一、稳定的混合物,属于溶液,故C错;
D、白醋易溶于水,形成了均一、稳定的混合物,属于溶液,故D错;
故选A。
7.D
【详解】
A、溶液中各部分性质相同,是一种高级混合物,正确;B、氢氧化钠溶液能导电,是因为溶液中含有自由移动的钠离子和氢氧根离子,正确;C、接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态,正确;D、20℃,氯化钠的溶解度为36g,此时对应的应该是100g水,溶液的质量为136g,所以20℃时100g氯化钠饱和溶液中含有氯化钠的质量小于36g,错误。故选D。
8.C
【详解】
A、蒸馏水中只含有水一种物质,属于纯净物,不属于溶液,选项错误;
B、玉米汁中含有难溶性物质,是难溶性物质与水组成的混合物,属于悬浊液,选项错误;
C、糖水是可溶性固体蔗糖与水组成的混合物,属于溶液,选项正确;
D、豆浆玉米汁中含有难溶性物质,是难溶性物质与水组成的混合物,属于悬浊液,选项错误,故选C。
9.B
【详解】
A、白糖易溶于水,能和水形成均一、稳定的混合物,即能和水形成溶液,故A错误;
B、豆油不溶于水,不能和水形成溶液,形成乳浊液,故B正确;
C、食盐易溶于水,能和水形成溶液,故C错误;
D、白酒与水以任意比互溶,能和水形成均一、稳定的混合物,能和水形成溶液,故D错误。
故选B。
10.D
【详解】
乳化剂具有乳化性,能将油污乳化为细小油滴,均匀分散在水中,故需要加乳化剂,不能加催化剂、酸化剂、氧化剂。
故选D。
11.C
【详解】
A、食盐能与水形成均一、稳定的溶液,不符合题意;
B、蔗糖能与水形成均一、稳定的溶液,不符合题意;
C、花生油不能与水不互溶,无法形成均一、稳定的溶液,符合题意;
D、白醋能与水形成均一、稳定的溶液,不符合题意。
故选C。
12.C
【详解】
A、豆浆中的营养物质有的溶于水,有的不溶于水,豆浆不是均一、稳定的混合物,不属于溶液,不符合题意;
B、泥土不溶于水,只能以固体小颗粒的形式悬浮于液体里,形成悬浊液,不符合题意;
C、食盐水是均一、稳定的溶液,符合题意;
D、牛奶中的营养物质有的溶于水,有的不溶于水,牛奶不是均一、稳定的混合物,不属于溶液,不符合题意。
故选C。
13.A
【详解】
A. 医用酒精中水和酒精均匀混合在一起,且非常稳定,属于溶液。
B、蒸馏水是纯净物,不属于混合物,故不是溶液。
C、牛奶是不溶性的小液滴等分散到液体中形成的,不均一、不稳定,不属于溶液。
D、泥浆不溶于水,泥浆水不均一、不稳定,不属于溶液。
故选:A。
14.C
【详解】
A、①水垢的主要成分为是碳酸钙和氢氧化镁等碱性物质,可用食醋浸泡除去;②由于铜位于氢的后面,铜不能和稀硫酸反应,用稀硫酸浸泡不除去试管中附着的铜,故选项错误;
B、氯化钠溶解,泥沙不溶,过滤除去泥沙,蒸发才可得到氯化钠固体;灼烧,有烧焦羽毛气味的气体产生的是羊毛线,没有此气味的气体产生的是棉线,现象不同,可以鉴别,故选项错误;
C、①铁生锈的原因是铁与氧气和水接触,②切了咸菜的菜刀,由于有食盐加快了生锈速率,故选项正确;
D、①煤气泄漏不可先打开排气扇,易产生火花,引发爆炸;②酒精灯失火应用湿布盖灭,故选项错误。故选C。
15.D
【解析】A、通过分析溶解度曲线可知,0﹣t2℃时,甲的曲线在乙的曲线下方,甲物质的溶解度小于乙物质的溶解度,错误;
B、t2℃时,甲、乙两种物质的溶解度相等,等质量的甲、乙饱和溶液中所含的溶质质量相等,错误;
C、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,要提纯乙物质应采用蒸发结晶的方法,错误;
D、根据溶解度曲线可知,t1℃时,甲的溶解度是20g,其饱和溶液的溶质质量分数=×100%=33.3%,所以t1℃时,用60 g甲的饱和溶液加水可以配制成200g 5%的甲溶液,正确。
故选D。
16.D
【详解】
A、加入活性炭不能使硬水变为软水,活性炭具有吸附性,可以吸附色素或异味,不能吸附钙镁离子,故A错误;B、用湿润的pH试纸测白醋的pH,会影响结果,应用干燥的pH试纸测白醋的pH,故B错误;C、不能用托盘天平称量5.62g氯化钠,天平精确度是0.1g,故C错误;D、用水区分硝酸铵和氢氧化钠固体,硝酸铵溶于水吸热,氢氧化钠固体溶于水放热,故D正确。
17.13.3g 蒸发结晶 AB
【详解】
(1)由表可知,0℃时,KNO3溶解度是13.3g;
(2)根据NaCl的溶解度表可知,氯化钠的溶解度随温度的变化不大,故从海水中提取氯化钠,通常采用的结晶方法是蒸发结晶;
(3)A、在60°C时,硝酸钾的溶解度是110g,将60gKNO3加入到50g水中充分溶解后,所得溶液为饱和溶液,硝酸钾的溶解度随温度的升高而增加,降温到40°C,溶液还是饱和溶液,符合题意;
B、在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液中溶质质量为55g,降温到40°C,40℃时,硝酸钾的溶解度为:63.9,溶液中溶质的质量为:31.95,故溶液中溶质质量减少,符合题意;
C、降温前后,溶液都是饱和溶液,且60℃时硝酸钾的溶解度大于40℃时硝酸钾的溶解度,故降温后,溶质的质量分数减小,不符合题意。
故选AB。
18.6:5 b a>b>c b>a=c b>a>c
【详解】
(1)t1℃时a物质的溶解度为20g,a物质的饱和溶液中溶液质量与溶剂质量的比为:(100g+20g):100g=6:5
(2)a、b两种固体物质的溶解度,都是随温度升高而增大,而c的溶解度随温度的升高而减少;三种物质的结晶方法中与海水晒盐相同的是b,因为b的溶解度受温度的影响变化不大;
(3)t3℃时,把20克 a、b、c三种物质分别加入到盛有50克水的烧杯中不断搅拌,所得溶液的溶质质量分数大小关系:a>b>c,因为在该温度下a的溶解度最大是50g,物质a完全被溶解,b的溶解度是38g,物质b未溶解了,物质c剩余最多;若将温度降低到t1℃时,溶液质量的大小关系为b>a=c,因为a降温后析出固体比b多,c又溶解一部分固体,该温度下,b的溶解度最大,a与c的溶解度相等,溶质的质量分数相等;
(4)t1℃时a、b、c三种物质的饱和溶液中溶质质量分数大小为b>a=c,三种物质的饱和溶液同时升温到t2℃,a、b物质的溶解度增大,c物质的溶解度减小,此时溶液中溶质的质量分数大小关系是b>a>c。
19.活性炭 混合物 C 验纯 氧气 20
【详解】
(1)活性炭具有吸附性,能除去水中的色素和异味,自来水净化天然水的主要步骤如图所示:试剂X可以用活性炭,净化后的水中含有可溶性物质,是混合物;
(2)冰糖能溶于水,形成溶液,而面粉、花生油都不能溶于水形成均一稳定的混合物,即不能形成溶液;冰块和水是同一种物质,不是溶液,故填:C;
(3)①可燃性气体在点燃前都要进行验纯,以防爆炸;氢气燃烧生成水,其化学方程式为:。
②接通直流电源一段时间后,玻璃管a与负极相连,是氢气,玻璃管b与正极相连,是氧气,氢气和氧气的体积比为2:1,该管内产生约10mL气体时,玻璃管a内产生约20mL气体。
20.隔绝空气(或氧气)和水 使可燃物温度达到着火点 乳化 煮沸 Fe、CuSO4溶液(合理即可) Zn+2AgNO3=2Ag + Zn(NO3)2 AgNO3、Cu(NO3)2、Zn(NO3)2 铁 银和铜 Zn+ Cu(NO3)2=Cu+ Zn(NO3)2 减小 >t1℃ 20
【详解】
(一)(1)在铁制品表面刷漆、涂油,能防止铁生锈,原理是隔绝空气(或氧气)和水,故填:隔绝空气(或氧气)和水;
(2)烟头的温度很高,使可燃物温度达到着火点,从而引燃其它的可燃物,故填:使可燃物温度达到着火点;
(3)洗洁精对油污有乳化作用,故填:乳化;
(4)加热煮沸时,水中的钙离子、镁离子能够以碳酸钙沉淀、氢氧化镁沉淀的形式从水中析出从而降低水的硬度,因此能降低水硬度的方法是煮沸,故填:煮沸;
(二)(1)甲、乙、丙实验已经得出:锌>铁,铁>H,铜>银,丁实验只要得出铁和铜的活动性,故可用金属和盐溶液,即铁和硫酸铜溶液或金属与酸反应等,故填:Fe、CuSO4溶液(合理即可);
(2)由图戊可知,析出固体质量先增加的多,后增加的小,说明丙溶液中的溶质为硝酸银和硝酸铜,由于锌>铜>银,故锌加入后先置换银,固体质量增加,然后置换铜,固体质量增加比银要小,待硝酸铜反应完后,固体质量不再增加,O-b段发生反应的化学方程式是Zn+2AgNO3=2Ag + Zn(NO3)2;a点对应锌与部分硝酸银反应,溶液中所含的溶质是剩余的硝酸银、硝酸铜和生成的硝酸锌,故填:Zn+2AgNO3=2Ag + Zn(NO3)2;AgNO3、Cu(NO3)2、Zn(NO3)2;
(3)充分反应后过滤得到无色滤液,说明硝酸铜已经完全反应,金属M不可能是铁,这是因为铁能与硝酸银、硝酸铜反应生成硝酸亚铁,而硝酸亚铁溶液是浅绿色溶液;充分反应后过滤,得到无色滤液,说明硝酸铜已经完全反应,而硝酸银先于硝酸铜反应,因此硝酸银也已经完全反应,滤渣中一定含有的金属是反应生成的银和铜;Mg、Al、Zn的相对原子质量都比Ag小,与硝酸银反应后导致溶液质量都减少;Zn的相对原子质量比Cu大,与硝酸铜反应后能导致溶液质量增加,锌与硝酸铜溶液反应生成硝酸锌和铜,反应的化学方程式为Zn+ Cu(NO3)2=Cu+ Zn(NO3)2,故填:铁;银和铜;Zn+ Cu(NO3)2=Cu+ Zn(NO3)2;
(三)(1)由溶解度曲线可知,物质c的溶解度随温度的升高而减小,故填:减小;
(2)由溶解度曲线可知,当温度大于t1℃时,物质a的溶解度大于物质c的溶解度,故填:>t1℃;
(3)t2℃时,a的溶解度为50g,60ga的饱和溶液中溶质的质量为60g××100%=20g,故填:20。
21.易溶 138 硝酸银 77.2 82% 利用20.2g与5g进行比较
【详解】
(1)①由表二可知,20℃时,NaCl和KNO3的溶解度分别为31.6g和36.0g,均大于10g,所以常温下,KNO3和NaCl的溶解性均为易溶;
②根据表格中硝酸钾在不同温度下的溶解度,用横坐标表示温度,纵坐标表示物质的溶解度,可画出其溶解度曲线;
③所绘制的曲线,找出KNO3曲线中横坐标为70时所对应的纵坐标的数值,为138,所以在70℃时KNO3的溶解度约为138g;
(2)①假设④中的晶体是纯净的KNO3,则所配制的溶液中不含NaCl,因此可滴加硝酸银溶液来检验溶液中是否含NaCl,若有白色沉淀产生,则证明有NaCl,晶体④不是纯净的KNO3,反之晶体则是纯净的KNO3;
②20℃时,硝酸钾的溶解度为31.6g,设在该温度下的56.2g水中最多溶解硝酸钾的质量为x,则,得x=17.8g,则析出硝酸钾晶体的质量为:95g-17.8g=77.2g;
③析出晶体中硝酸钾所占的比例,因此82%与95%进行比较。
④20℃时,氯化钠的溶解度为36.0g,设在该温度下的56.2g水中最多溶解氯化钠的质量为y,则,得y=20.2g,则在20℃时,56.2g水中可以溶解氯化钠20.2g,大于5g,则实验中加入的5g氯化钠可以全部溶解。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
