河北省唐山一中2012-2013学年高二上学期期中考试化学(理)试题(有答案)
文档属性
| 名称 | 河北省唐山一中2012-2013学年高二上学期期中考试化学(理)试题(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 198.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-19 14:03:44 | ||
图片预览



文档简介
唐山一中2012-2013学年高二上学期期中考试化学(理)试题
说明: 1.考试时间90分钟,满分100分。2.将卷Ⅰ答案用2B铅笔涂在答题卡上,卷Ⅱ用蓝黑钢笔或圆珠笔答在答题纸上。3.Ⅱ卷卷头和答题卡均填涂本次考试的考号。
可能用到的相对原子质量: K-39 O-16 I-127 Mg-24 Cl-35.5
卷Ⅰ(选择题 共56分)
一、选择题(本题包括13小题。每题2分,共26分,每小题只有一个选项符合题意)
1.下列溶液肯定显酸性的是
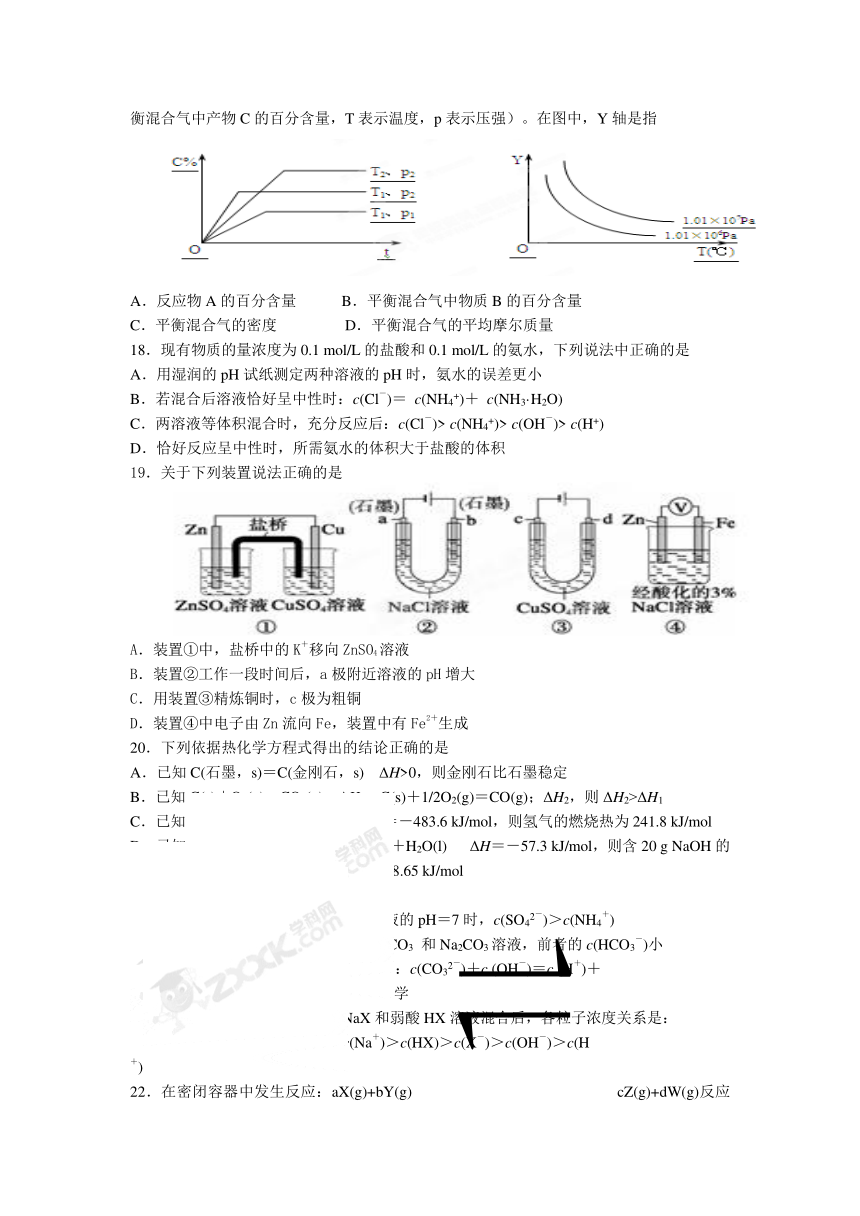
A.含H+的溶液 B.能使酚酞显无色的溶液
C.pH>7的溶液 D.c(OH-)<c(H+)
2.反应FeO(s)+C(s)=Fe(s)+CO(g) △H>0,ΔS>0,下列说法正确的是
A.低温下自发进行,高温下非自发进行 B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D.任何温度下均为自发进行
3.在由水电离出的c(H+)= 1×10-13 mol·L-1的溶液中一定能大量共存的离子组是
A. Fe2+ Na+ NO3- Cl- ???? B. Ba2+ Na+ NO3- Cl- C.SO42- S2O32- NH4+ Na+??? D.Mg2+ Na+ Br- AlO2-
4.下列反应中,不属于盐类水解反应的是
A.NH4+ + H2O NH3?H2O + H+
B.HCO3- + H2O CO32- + H3O+
C.Al3+ + 3H2O Al(OH)3 + 3H+
D.S2-+ H2O HS- + OH-
5.在合成氨工业中,为增加NH3的日产量,实施下列目的的变化过程中与平衡移动无关的是
A.不断将氨分离出来
B.使用催化剂
C.采用500℃左右的高温而不是700℃的高温
D.采用2×107~5×107Pa的压强
6.已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol?L ̄1的一元酸HA与b mol?L ̄1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b B.混合溶液的pH=7 C.混合溶液中,c(H+)=mol?L ̄1 D.混合溶液中,c(H+)+c(B+)=c(OH ̄)+c(A ̄)
7.下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.加热稀醋酸溶液其pH 稍有减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 D.浓的硫化钠溶液有臭味
8.下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
9.按下列实验方法能够达到要求的是
A.用托盘天平称量25.20 g NaCl. B. 用10 mL量筒量取7.50 mL稀盐酸
C.用25 mL滴定管量取14.80 mL溶液 D.用pH试纸测得某碱溶液的pH=12.7
10.对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
11.下列事实中,不能用勒夏特列原理解释的是
A.常温下,将1mLpH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
B.实验室中常用排饱和食盐水的方式收集氯气
C.打开汽水瓶,有气泡从溶液中冒出
D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
12.常温下,某种溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,该溶液中的溶质不可能是:
A. NaHSO4 B. NaOH C. HCl D.Al2(SO4)3
13.在容积不变的密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g)=1/2N2(g)+CO2 (g) ΔH=-373.2 kJ/mol。
右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是
A.加催化剂 B.向密闭容器中加入氩气
C.降低温度 D.增大反应物中NO的浓度
二、选择题(本题包括10小题。每题3分,共30分,每小题有一到两个选项符合题意,
只选一个得1分,选错0分)
14.用惰性电极分别电解下列物质的溶液后,加入括号中的固体或气体,能使其恢复到原溶液的是
A.CuCl2(CuO) B.CuSO4(Cu(OH)2) C.Na2SO4(H2O) D.AgNO3(Ag2O)
15.在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
A.c(Na+) = c(CH3COO-) + c(CH3COOH)
B.c(H+) =c(CH3COO-) + c(OH-)
C.c(Na+) >c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
16.氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。以下有数种说法:
①正极反应为:O2+2H2O+4e-=4OH-
②负极反应为:2H2-4e-=4H+
③电池工作时正极区碱性增强,负极区碱性减弱
④电池工作时溶液中的阴离子移向正极
正确的组合是
A.①④ B.②③④ C.①③ D.①②③
17.在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
18.现有物质的量浓度为0.1 mol/L的盐酸和0.1 mol/L的氨水,下列说法中正确的是
A.用湿润的pH试纸测定两种溶液的pH时,氨水的误差更小
B.若混合后溶液恰好呈中性时:c(Cl-)= c(NH4+)+ c(NH3·H2O)
C.两溶液等体积混合时,充分反应后:c(Cl-)> c(NH4+)> c(OH-)> c(H+)
D.恰好反应呈中性时,所需氨水的体积大于盐酸的体积
19.关于下列装置说法正确的是
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
20.下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
21.下列叙述正确的是
A.硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.常温下,等物质的量浓度的 (NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小
C.NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3)学
D.等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:
c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
22.在密闭容器中发生反应:aX(g)+bY(g)cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动
B.a + b > c + d
C.Z的体积分数减小
D.X的转化率增大
23.若室温时,将pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度为:
A.10a+b-12 % B.10a+b-14 % C.1012-a-b % D.1014-a-b %
卷Ⅱ(非选择题 共44分)
24.(9分)如图所示,溶液体积均为200 mL,若电解5 min
时铜电极质量增加2.16 g,试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化: B池_______,C池________。
(填增大、减小或不变)
通电5 min时,A池pH值为_______。
⑶ 通电5 min时,B中共收集224 mL气体(标
况),则通电前硫酸铜溶液的物质的量浓度为______________。
(4)写出A池中发生反应的化学方程式_____________________________________。
25. (8分)某化学小组为测定加碘盐中KIO3的质量分数,进行了如下实验。
已知:
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:用c mol·L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2O3溶液12.00 mL。
(1) 步骤一中配制250 mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有___________和__________。
(2)步骤三中应选择________为指示剂,到达滴定终点时的现象为_________________________。
(3) 实验测得此加碘盐中KIO3的质量分数=___________(KIO3的相对分子质量为214)。
(4)步骤三中,滴定前滴定管没有用Na2S2O3溶液润洗,会使测定结果______;滴定后仰视读数,会使测定结果_______。(填偏高或偏低)
26. (5分)Ⅰ、在一定温度下,氧化铁可以与一氧化碳发生反应:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
温度/℃
1 000
1 150
1 300
平衡常数
64.0
50.7
42.9
请回答下列问题:
该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”)。
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V?L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号
起始时各物质物质的量/mol
达到平衡的时间/min
达平衡时体系能量的变化/kJ
CO
H2O
CO2
H2
①
1
4
0
0
t1
放出热量:32.8 kJ
②
2
8
0
0
t2
放出热量:Q
(1)容器①中反应达平衡时,CO的转化率为 。
(2)计算容器②中反应的平衡常数K= 。
(3)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:
27. (12分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子
Na+、Ba2+、NH4+
阴离子
CH3COO-、Cl-、OH-、SO42-
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同; ②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。 (1)A是______ ,B是_______ ,C是_______ ,D是________ 。
(2)用离子方程式表示A的水溶液显碱性的原因________________________________。 (3)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。 (4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为___________________。 (5)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
28. (10分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为:
,写出以N2和H2为原料合成NH3的热化学方程式________________________。
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图 所示:
①t1时刻改变的条件为__________________。
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像。
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充人如图所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡。
①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为,则 ______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的,则平衡时容器C中H2的体积分数为_______。
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O,则负极的电极反应式为__________________。
唐山一中2012—2013学年度第一学期期中考试
高二年级化学答案及评分标准
⑵降低(1分),不变(1分),13(2分)
⑶0.25mol/L(2分)(4) (2分)
25. (7分) (1)250mL容量瓶、胶头滴管(1分)
(2)淀粉 (1分) 溶液蓝色褪色,半分钟内不恢复蓝色 (1分)
(3)(4.28c)/a×100%(2分,不化简或其他合理答案也可给分)
(4) 偏高; 偏高(2分)
28. (10分) (1)N2(g)+3H2(g)2NH3(g) △H= -90.8 kJ·mol-1 (2分)
(2)①升高温度 (1分)
说明: 1.考试时间90分钟,满分100分。2.将卷Ⅰ答案用2B铅笔涂在答题卡上,卷Ⅱ用蓝黑钢笔或圆珠笔答在答题纸上。3.Ⅱ卷卷头和答题卡均填涂本次考试的考号。
可能用到的相对原子质量: K-39 O-16 I-127 Mg-24 Cl-35.5
卷Ⅰ(选择题 共56分)
一、选择题(本题包括13小题。每题2分,共26分,每小题只有一个选项符合题意)
1.下列溶液肯定显酸性的是
A.含H+的溶液 B.能使酚酞显无色的溶液
C.pH>7的溶液 D.c(OH-)<c(H+)
2.反应FeO(s)+C(s)=Fe(s)+CO(g) △H>0,ΔS>0,下列说法正确的是
A.低温下自发进行,高温下非自发进行 B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D.任何温度下均为自发进行
3.在由水电离出的c(H+)= 1×10-13 mol·L-1的溶液中一定能大量共存的离子组是
A. Fe2+ Na+ NO3- Cl- ???? B. Ba2+ Na+ NO3- Cl- C.SO42- S2O32- NH4+ Na+??? D.Mg2+ Na+ Br- AlO2-
4.下列反应中,不属于盐类水解反应的是
A.NH4+ + H2O NH3?H2O + H+
B.HCO3- + H2O CO32- + H3O+
C.Al3+ + 3H2O Al(OH)3 + 3H+
D.S2-+ H2O HS- + OH-
5.在合成氨工业中,为增加NH3的日产量,实施下列目的的变化过程中与平衡移动无关的是
A.不断将氨分离出来
B.使用催化剂
C.采用500℃左右的高温而不是700℃的高温
D.采用2×107~5×107Pa的压强
6.已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol?L ̄1的一元酸HA与b mol?L ̄1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b B.混合溶液的pH=7 C.混合溶液中,c(H+)=mol?L ̄1 D.混合溶液中,c(H+)+c(B+)=c(OH ̄)+c(A ̄)
7.下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.加热稀醋酸溶液其pH 稍有减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 D.浓的硫化钠溶液有臭味
8.下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
9.按下列实验方法能够达到要求的是
A.用托盘天平称量25.20 g NaCl. B. 用10 mL量筒量取7.50 mL稀盐酸
C.用25 mL滴定管量取14.80 mL溶液 D.用pH试纸测得某碱溶液的pH=12.7
10.对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
11.下列事实中,不能用勒夏特列原理解释的是
A.常温下,将1mLpH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
B.实验室中常用排饱和食盐水的方式收集氯气
C.打开汽水瓶,有气泡从溶液中冒出
D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
12.常温下,某种溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,该溶液中的溶质不可能是:
A. NaHSO4 B. NaOH C. HCl D.Al2(SO4)3
13.在容积不变的密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g)=1/2N2(g)+CO2 (g) ΔH=-373.2 kJ/mol。
右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是
A.加催化剂 B.向密闭容器中加入氩气
C.降低温度 D.增大反应物中NO的浓度
二、选择题(本题包括10小题。每题3分,共30分,每小题有一到两个选项符合题意,
只选一个得1分,选错0分)
14.用惰性电极分别电解下列物质的溶液后,加入括号中的固体或气体,能使其恢复到原溶液的是
A.CuCl2(CuO) B.CuSO4(Cu(OH)2) C.Na2SO4(H2O) D.AgNO3(Ag2O)
15.在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
A.c(Na+) = c(CH3COO-) + c(CH3COOH)
B.c(H+) =c(CH3COO-) + c(OH-)
C.c(Na+) >c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
16.氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。以下有数种说法:
①正极反应为:O2+2H2O+4e-=4OH-
②负极反应为:2H2-4e-=4H+
③电池工作时正极区碱性增强,负极区碱性减弱
④电池工作时溶液中的阴离子移向正极
正确的组合是
A.①④ B.②③④ C.①③ D.①②③
17.在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
18.现有物质的量浓度为0.1 mol/L的盐酸和0.1 mol/L的氨水,下列说法中正确的是
A.用湿润的pH试纸测定两种溶液的pH时,氨水的误差更小
B.若混合后溶液恰好呈中性时:c(Cl-)= c(NH4+)+ c(NH3·H2O)
C.两溶液等体积混合时,充分反应后:c(Cl-)> c(NH4+)> c(OH-)> c(H+)
D.恰好反应呈中性时,所需氨水的体积大于盐酸的体积
19.关于下列装置说法正确的是
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
20.下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
21.下列叙述正确的是
A.硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.常温下,等物质的量浓度的 (NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小
C.NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3)学
D.等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:
c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
22.在密闭容器中发生反应:aX(g)+bY(g)cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动
B.a + b > c + d
C.Z的体积分数减小
D.X的转化率增大
23.若室温时,将pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度为:
A.10a+b-12 % B.10a+b-14 % C.1012-a-b % D.1014-a-b %
卷Ⅱ(非选择题 共44分)
24.(9分)如图所示,溶液体积均为200 mL,若电解5 min
时铜电极质量增加2.16 g,试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化: B池_______,C池________。
(填增大、减小或不变)
通电5 min时,A池pH值为_______。
⑶ 通电5 min时,B中共收集224 mL气体(标
况),则通电前硫酸铜溶液的物质的量浓度为______________。
(4)写出A池中发生反应的化学方程式_____________________________________。
25. (8分)某化学小组为测定加碘盐中KIO3的质量分数,进行了如下实验。
已知:
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:用c mol·L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2O3溶液12.00 mL。
(1) 步骤一中配制250 mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有___________和__________。
(2)步骤三中应选择________为指示剂,到达滴定终点时的现象为_________________________。
(3) 实验测得此加碘盐中KIO3的质量分数=___________(KIO3的相对分子质量为214)。
(4)步骤三中,滴定前滴定管没有用Na2S2O3溶液润洗,会使测定结果______;滴定后仰视读数,会使测定结果_______。(填偏高或偏低)
26. (5分)Ⅰ、在一定温度下,氧化铁可以与一氧化碳发生反应:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
温度/℃
1 000
1 150
1 300
平衡常数
64.0
50.7
42.9
请回答下列问题:
该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”)。
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V?L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号
起始时各物质物质的量/mol
达到平衡的时间/min
达平衡时体系能量的变化/kJ
CO
H2O
CO2
H2
①
1
4
0
0
t1
放出热量:32.8 kJ
②
2
8
0
0
t2
放出热量:Q
(1)容器①中反应达平衡时,CO的转化率为 。
(2)计算容器②中反应的平衡常数K= 。
(3)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:
27. (12分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子
Na+、Ba2+、NH4+
阴离子
CH3COO-、Cl-、OH-、SO42-
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同; ②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。 (1)A是______ ,B是_______ ,C是_______ ,D是________ 。
(2)用离子方程式表示A的水溶液显碱性的原因________________________________。 (3)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。 (4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为___________________。 (5)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
28. (10分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为:
,写出以N2和H2为原料合成NH3的热化学方程式________________________。
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图 所示:
①t1时刻改变的条件为__________________。
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像。
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充人如图所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡。
①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为,则 ______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的,则平衡时容器C中H2的体积分数为_______。
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O,则负极的电极反应式为__________________。
唐山一中2012—2013学年度第一学期期中考试
高二年级化学答案及评分标准
⑵降低(1分),不变(1分),13(2分)
⑶0.25mol/L(2分)(4) (2分)
25. (7分) (1)250mL容量瓶、胶头滴管(1分)
(2)淀粉 (1分) 溶液蓝色褪色,半分钟内不恢复蓝色 (1分)
(3)(4.28c)/a×100%(2分,不化简或其他合理答案也可给分)
(4) 偏高; 偏高(2分)
28. (10分) (1)N2(g)+3H2(g)2NH3(g) △H= -90.8 kJ·mol-1 (2分)
(2)①升高温度 (1分)
同课章节目录
