河北省唐山一中2012-2013学年高二上学期期中考试化学(文)试题(有答案)
文档属性
| 名称 | 河北省唐山一中2012-2013学年高二上学期期中考试化学(文)试题(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 209.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-19 14:06:33 | ||
图片预览


文档简介
唐山一中2012-2013学年高二上学期期中考试化学(文)试题
卷Ⅰ(选择题 共72分)
说明:
1.考试时间60分钟,满分100分。2.将卷Ⅰ答案用2B铅笔涂在答题卡上,卷Ⅱ用蓝黑钢笔或圆珠笔答在答题纸上.。3.Ⅱ卷卷头和答题卡均填涂本次考试的考号,不要误填学号,答题卡占后5位。
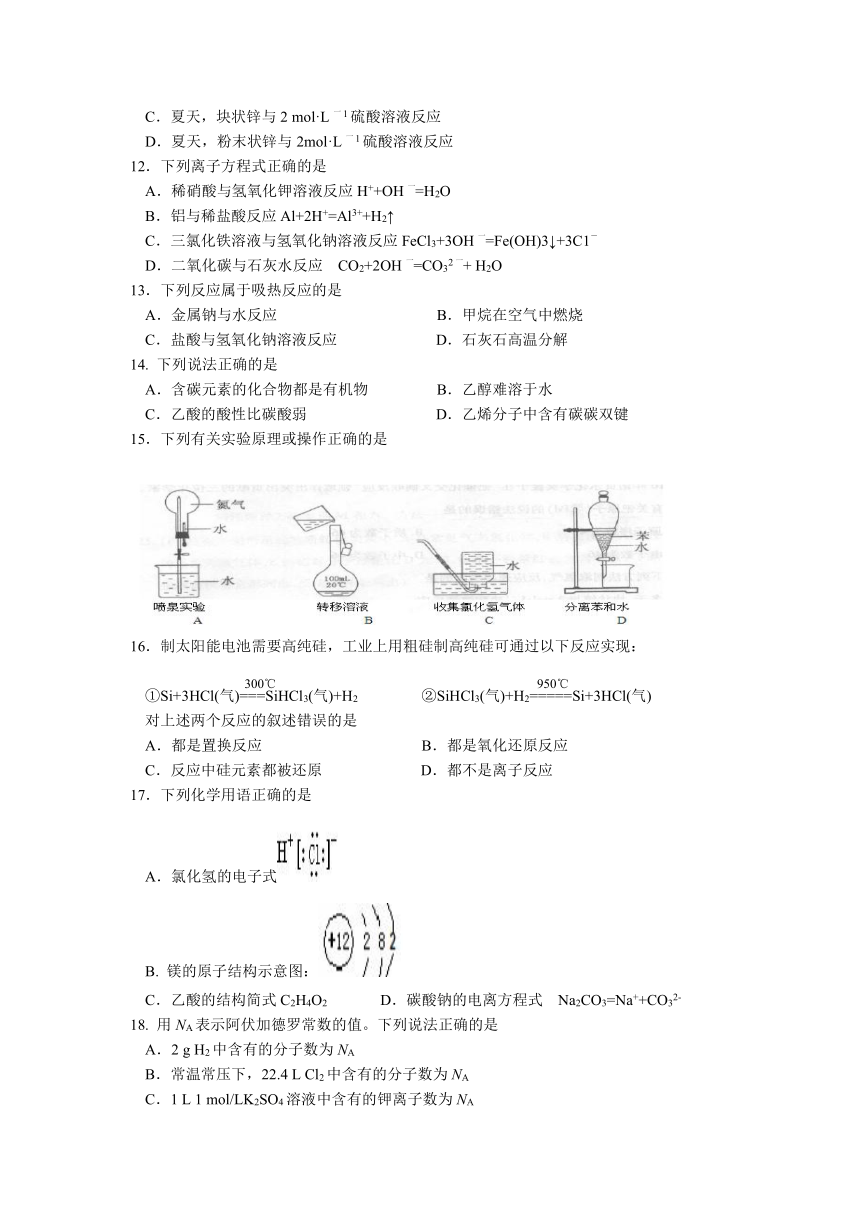
本卷可能用到的相对原子质量 H:1 C:12 N:14 Na:23 O:16 S:32 Fe:56 Cu:64
一、单项选择题(在每题的4个选项中。只有1个选项是符合要求的(本部分23题,1-9题每题2分,10-23题每题 3分。共60分)。
1.现代社会,人们越来越关注饮食中的营养成分。肉、鱼和红枣等食物含有丰富的铁,这里的铁应理解为
A.单质 B.分子 C.元素 D.同位素
2.当光束通过鸡蛋清水溶液时,从侧面观察到一条光亮的“通路”,说明鸡蛋清水溶液是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
3.体操运动员比赛时为了防滑。常在手掌上涂抹碳酸镁粉末。碳酸镁属于
A.酸 B.碱 C.盐 D.氧化物
4.下列关于二氧化硫的说法错误的是
A.无色无味 B.有毒 C.密度比空气大 D.氧化物
5.石墨烯是仅由一层碳原子构成的新型材料,具有超强的导电性。下列元素与碳元素处于同一主族的是
A.He B.O C.Si D.P
6.下列各组物质互为同分异构体的是
A.O2和O3 B.CH3CH2CH2CH3和CH(CH3)3 C.12C和13C D.CH3和CH3CH3
7.某溶液中存在大量的H+、Cl一、SO42一,该溶液中还可能大量存在的是
A.HCO3一 B.Ba2+ C.Al3+ D.Ag+
8.下列物质含有离子键的是
A.C12 B.NaCl C.CO2 D.H2O
9.下列试剂需要用棕色试剂瓶保存的是
A.浓硫酸 B.浓硝酸 C.浓盐酸 D.碳酸钠溶液
10.2010年诺贝尔化学奖授予在“钯催化交叉偶联反应”领域作出突出贡献的三位化学家。下列有关钯原子(46106Pd)的说法错误的是
A.原子序数为46 B.质子数为46 C.电子数为46 D.中子数为46
11.用下列方法制取氢气,反应速率最大的是
A.冬天,块状锌与2 mol·L一1硫酸溶液反应
B.冬天,粉末状锌与2 mol·L一1硫酸溶液反应
C.夏天,块状锌与2 mol·L一1硫酸溶液反应
D.夏天,粉末状锌与2mol·L一1硫酸溶液反应
12.下列离子方程式正确的是
A.稀硝酸与氢氧化钾溶液反应H++OH一=H2O
B.铝与稀盐酸反应Al+2H+=Al3++H2↑
C.三氯化铁溶液与氢氧化钠溶液反应FeCl3+3OH一=Fe(OH)3↓+3C1-
D.二氧化碳与石灰水反应 CO2+2OH一=CO32一+ H2O
13.下列反应属于吸热反应的是
A.金属钠与水反应 B.甲烷在空气中燃烧
C.盐酸与氢氧化钠溶液反应 D.石灰石高温分解
14. 下列说法正确的是
A.含碳元素的化合物都是有机物 B.乙醇难溶于水
C.乙酸的酸性比碳酸弱 D.乙烯分子中含有碳碳双键
15.下列有关实验原理或操作正确的是
16.制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
①Si+3HCl(气)===SiHCl3(气)+H2 ②SiHCl3(气)+H2=====Si+3HCl(气)
对上述两个反应的叙述错误的是
A.都是置换反应 B.都是氧化还原反应
C.反应中硅元素都被还原 D.都不是离子反应
17.下列化学用语正确的是
A.氯化氢的电子式
B. 镁的原子结构示意图:
C.乙酸的结构简式C2H4O2 D.碳酸钠的电离方程式 Na2CO3=Na++CO32-
18. 用NA表示阿伏加德罗常数的值。下列说法正确的是
A.2 g H2中含有的分子数为NA
B.常温常压下,22.4 L Cl2中含有的分子数为NA
C.1 L 1 mol/LK2SO4溶液中含有的钾离子数为NA
D.1 mol钠原子中含有的电子数为NA
19.下列反应属于加成反应的是
A.2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
B.
C.
D.
20.在下列自然资源的开发利用中,不涉及化学变化的是
A.用蒸馏法淡化海水 B.用铁矿石冶炼铁
C.用石油裂解生产乙烯 D.用煤生产水煤气
21.某原电池结构如图所示,下列有关该原电池的说法正确的是
A.能将电能转换成化学能
B.电子从碳棒经外电路流向铁棒
C. 碳棒发生氧化反应
D.总反应为Fe+H2SO4= FeSO4+H2↑
22.X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
23.在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225mol/L B.0.25mol/L C.0.45mol/L D.0.9mol/L
二、双项选择题(本题包括 4 小题,每小题 3 分,共 12 分。每小题有两个选项符合题意 ,只选一个且正确的得 2 分,两个全选对的得 3 分,不选、多选、错选均不得分) ,
24.合理使用食品添加剂既不会影响人体健康 ,又能有效改善食物品质和色 、香 、味 ,但有 些物质严禁用作食品添加剂 。下列做法正确的是
A.二氧化硫用作银耳的漂白剂 B.胡萝卜素用作饮料的着色剂
C.次氯酸钠用作饼干的膨松剂 D. 苯甲酸钠用作火腿肠的防腐剂
25. 合理使用药物有利于身心健康 。下列有关说法正确的是
A 氯化钠用于治疗胃酸过多 B 阿司匹林常用于解热镇痛
C 青霉素是一种常用的抗生素 D 非处方药都无毒副作用 、可长期大量服用
26.下列防止金属腐蚀的做法可行的是
A. 在铁制的炒锅 、蒸锅等炊具上镀铜 、防止生锈
B. 埋在地下的钢铁管道每隔一段距离就连结一定数量的铜块
C. 供应热水的水龙头使用陶瓷制品代替钢铁制品
D. 洗衣机的滚筒采用不锈钢材料 、既耐磨又耐腐蚀
27.下列有关环境问题的叙述正确的是
A. 沉淀法是对污水处理的一种化学方法 B. 常见非金属氧化物都属于大气污染物
C. 澄清且显中性的水一定是没有被污染的水
D. 新装饰居室中最常见的污染物是甲醛 、苯等
卷Ⅱ(非选择题 共28分)
三 、填空题(本题包括 2 小题 ,共 16分)
28. (10分)下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化合物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。反应①和②均在溶液中进行。
请按要求回答下列问题。
(1)写出下列物质的化学式:D 、F 。
(2)反应①的离子方程式为 。
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为 。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色,该反应的离子方程式
为 。这说明单质C的氧化性 于单质碘(填“强”或“弱”)。
(5)向J溶液中滴入NaOH溶液时,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由灰白色变成红褐色的化学方程式: 。
29.(6 分) 某烃A的产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如右图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
根据如图回答下列问题:
(1)写出D的结构简式: D____________。
(2)写出②⑤两步反应的化学方程式,并注明⑤反应类型:
②____________________________________
⑤____________________________________(反应类型___________ )。
四、实验题(6分)
30. 硫酸是一种重要的化学试剂。某实验小组的同学利用浓硫酸进行制取二氧化硫并探究其性质的实验。请按要求回答下列问题。
(1)装置A中发生反应的化学方程式为 。上述装置中适于收集二氧化硫的气体是(填字母) 。
(2)将一收集满二氧化硫气体的小试管倒置于滴有紫色石蕊溶液的水中,可观察到的现
象是 。
(3)上述实验所产生的二氧化硫尾气可选用E装置来吸收,该反应的化学方程式为
。
五. 计算题(6分)
31. 现将21 g碳酸钠和碳酸氢钠的固体混合物加热到固体质量不再发生变化为止,生成的二氧化碳气体的质量为4.4g。试计算:
(1)混合物中碳酸钠的质量
(2)求出混合物中碳酸氢钠的质量分数。
唐山一中2012—2013学年度第一学期期中考试
高二年级文科化学试卷答案
28. (10分)(1)H2 (1分) Na2O2 (1分)
(2)2H++CO32- = H2O+CO2↑ (2分)
(3)出现白色沉淀。(1分)
(4)Cl2+2I-=I2+2Cl- (2分) 强 (1分)
(5)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH) 3 (2分)
30.(6分)(1)Cu+2H2SO4(浓)CuSO4 + 2H2O + SO2↑(2分) C (1分)
卷Ⅰ(选择题 共72分)
说明:
1.考试时间60分钟,满分100分。2.将卷Ⅰ答案用2B铅笔涂在答题卡上,卷Ⅱ用蓝黑钢笔或圆珠笔答在答题纸上.。3.Ⅱ卷卷头和答题卡均填涂本次考试的考号,不要误填学号,答题卡占后5位。
本卷可能用到的相对原子质量 H:1 C:12 N:14 Na:23 O:16 S:32 Fe:56 Cu:64
一、单项选择题(在每题的4个选项中。只有1个选项是符合要求的(本部分23题,1-9题每题2分,10-23题每题 3分。共60分)。
1.现代社会,人们越来越关注饮食中的营养成分。肉、鱼和红枣等食物含有丰富的铁,这里的铁应理解为
A.单质 B.分子 C.元素 D.同位素
2.当光束通过鸡蛋清水溶液时,从侧面观察到一条光亮的“通路”,说明鸡蛋清水溶液是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
3.体操运动员比赛时为了防滑。常在手掌上涂抹碳酸镁粉末。碳酸镁属于
A.酸 B.碱 C.盐 D.氧化物
4.下列关于二氧化硫的说法错误的是
A.无色无味 B.有毒 C.密度比空气大 D.氧化物
5.石墨烯是仅由一层碳原子构成的新型材料,具有超强的导电性。下列元素与碳元素处于同一主族的是
A.He B.O C.Si D.P
6.下列各组物质互为同分异构体的是
A.O2和O3 B.CH3CH2CH2CH3和CH(CH3)3 C.12C和13C D.CH3和CH3CH3
7.某溶液中存在大量的H+、Cl一、SO42一,该溶液中还可能大量存在的是
A.HCO3一 B.Ba2+ C.Al3+ D.Ag+
8.下列物质含有离子键的是
A.C12 B.NaCl C.CO2 D.H2O
9.下列试剂需要用棕色试剂瓶保存的是
A.浓硫酸 B.浓硝酸 C.浓盐酸 D.碳酸钠溶液
10.2010年诺贝尔化学奖授予在“钯催化交叉偶联反应”领域作出突出贡献的三位化学家。下列有关钯原子(46106Pd)的说法错误的是
A.原子序数为46 B.质子数为46 C.电子数为46 D.中子数为46
11.用下列方法制取氢气,反应速率最大的是
A.冬天,块状锌与2 mol·L一1硫酸溶液反应
B.冬天,粉末状锌与2 mol·L一1硫酸溶液反应
C.夏天,块状锌与2 mol·L一1硫酸溶液反应
D.夏天,粉末状锌与2mol·L一1硫酸溶液反应
12.下列离子方程式正确的是
A.稀硝酸与氢氧化钾溶液反应H++OH一=H2O
B.铝与稀盐酸反应Al+2H+=Al3++H2↑
C.三氯化铁溶液与氢氧化钠溶液反应FeCl3+3OH一=Fe(OH)3↓+3C1-
D.二氧化碳与石灰水反应 CO2+2OH一=CO32一+ H2O
13.下列反应属于吸热反应的是
A.金属钠与水反应 B.甲烷在空气中燃烧
C.盐酸与氢氧化钠溶液反应 D.石灰石高温分解
14. 下列说法正确的是
A.含碳元素的化合物都是有机物 B.乙醇难溶于水
C.乙酸的酸性比碳酸弱 D.乙烯分子中含有碳碳双键
15.下列有关实验原理或操作正确的是
16.制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
①Si+3HCl(气)===SiHCl3(气)+H2 ②SiHCl3(气)+H2=====Si+3HCl(气)
对上述两个反应的叙述错误的是
A.都是置换反应 B.都是氧化还原反应
C.反应中硅元素都被还原 D.都不是离子反应
17.下列化学用语正确的是
A.氯化氢的电子式
B. 镁的原子结构示意图:
C.乙酸的结构简式C2H4O2 D.碳酸钠的电离方程式 Na2CO3=Na++CO32-
18. 用NA表示阿伏加德罗常数的值。下列说法正确的是
A.2 g H2中含有的分子数为NA
B.常温常压下,22.4 L Cl2中含有的分子数为NA
C.1 L 1 mol/LK2SO4溶液中含有的钾离子数为NA
D.1 mol钠原子中含有的电子数为NA
19.下列反应属于加成反应的是
A.2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
B.
C.
D.
20.在下列自然资源的开发利用中,不涉及化学变化的是
A.用蒸馏法淡化海水 B.用铁矿石冶炼铁
C.用石油裂解生产乙烯 D.用煤生产水煤气
21.某原电池结构如图所示,下列有关该原电池的说法正确的是
A.能将电能转换成化学能
B.电子从碳棒经外电路流向铁棒
C. 碳棒发生氧化反应
D.总反应为Fe+H2SO4= FeSO4+H2↑
22.X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
23.在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225mol/L B.0.25mol/L C.0.45mol/L D.0.9mol/L
二、双项选择题(本题包括 4 小题,每小题 3 分,共 12 分。每小题有两个选项符合题意 ,只选一个且正确的得 2 分,两个全选对的得 3 分,不选、多选、错选均不得分) ,
24.合理使用食品添加剂既不会影响人体健康 ,又能有效改善食物品质和色 、香 、味 ,但有 些物质严禁用作食品添加剂 。下列做法正确的是
A.二氧化硫用作银耳的漂白剂 B.胡萝卜素用作饮料的着色剂
C.次氯酸钠用作饼干的膨松剂 D. 苯甲酸钠用作火腿肠的防腐剂
25. 合理使用药物有利于身心健康 。下列有关说法正确的是
A 氯化钠用于治疗胃酸过多 B 阿司匹林常用于解热镇痛
C 青霉素是一种常用的抗生素 D 非处方药都无毒副作用 、可长期大量服用
26.下列防止金属腐蚀的做法可行的是
A. 在铁制的炒锅 、蒸锅等炊具上镀铜 、防止生锈
B. 埋在地下的钢铁管道每隔一段距离就连结一定数量的铜块
C. 供应热水的水龙头使用陶瓷制品代替钢铁制品
D. 洗衣机的滚筒采用不锈钢材料 、既耐磨又耐腐蚀
27.下列有关环境问题的叙述正确的是
A. 沉淀法是对污水处理的一种化学方法 B. 常见非金属氧化物都属于大气污染物
C. 澄清且显中性的水一定是没有被污染的水
D. 新装饰居室中最常见的污染物是甲醛 、苯等
卷Ⅱ(非选择题 共28分)
三 、填空题(本题包括 2 小题 ,共 16分)
28. (10分)下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化合物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。反应①和②均在溶液中进行。
请按要求回答下列问题。
(1)写出下列物质的化学式:D 、F 。
(2)反应①的离子方程式为 。
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为 。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色,该反应的离子方程式
为 。这说明单质C的氧化性 于单质碘(填“强”或“弱”)。
(5)向J溶液中滴入NaOH溶液时,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由灰白色变成红褐色的化学方程式: 。
29.(6 分) 某烃A的产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如右图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
根据如图回答下列问题:
(1)写出D的结构简式: D____________。
(2)写出②⑤两步反应的化学方程式,并注明⑤反应类型:
②____________________________________
⑤____________________________________(反应类型___________ )。
四、实验题(6分)
30. 硫酸是一种重要的化学试剂。某实验小组的同学利用浓硫酸进行制取二氧化硫并探究其性质的实验。请按要求回答下列问题。
(1)装置A中发生反应的化学方程式为 。上述装置中适于收集二氧化硫的气体是(填字母) 。
(2)将一收集满二氧化硫气体的小试管倒置于滴有紫色石蕊溶液的水中,可观察到的现
象是 。
(3)上述实验所产生的二氧化硫尾气可选用E装置来吸收,该反应的化学方程式为
。
五. 计算题(6分)
31. 现将21 g碳酸钠和碳酸氢钠的固体混合物加热到固体质量不再发生变化为止,生成的二氧化碳气体的质量为4.4g。试计算:
(1)混合物中碳酸钠的质量
(2)求出混合物中碳酸氢钠的质量分数。
唐山一中2012—2013学年度第一学期期中考试
高二年级文科化学试卷答案
28. (10分)(1)H2 (1分) Na2O2 (1分)
(2)2H++CO32- = H2O+CO2↑ (2分)
(3)出现白色沉淀。(1分)
(4)Cl2+2I-=I2+2Cl- (2分) 强 (1分)
(5)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH) 3 (2分)
30.(6分)(1)Cu+2H2SO4(浓)CuSO4 + 2H2O + SO2↑(2分) C (1分)
同课章节目录
