第十单元课题2酸和碱的中和反应课后练习-2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 第十单元课题2酸和碱的中和反应课后练习-2021-2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 133.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-22 20:13:49 | ||
图片预览


文档简介
2021——2022学年度人教版九年级化学下册 第十单元 酸和碱
课题2 酸和碱的中和反应课后练习
一、选择题
1.某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是
A.用湿润的pH试纸测定稀硫酸的pH B.用干燥的pH试纸测定二氧化碳气体的pH
C.用干燥的pH试纸测定浓硫酸的pH D.用干燥的pH试纸测定氢氧化钠稀溶液的pH
2.下列有关辨析中正确的是
①物质都是由分子构成的;②生成盐和水的反应不一定是中和反应;③点燃甲烷和氢气混合气体前一定要检验其纯度;④和盐酸反应生成气体的固体中一定含碳酸盐;⑤盐溶液的pH一定等于7;⑥由相同元素组成的物质不一定是同一种物质。
A.①③⑤ B.①④⑤ C.②④⑥ D.②③⑥
3.下列反应属于复分解反应的是
A.S+O2SO2 B.2H2O2H2↑+O2↑
C.C+2CuOCO2+2Cu D.Al(OH)3+3HCl=AlCl3+3H2O
4.北京大学的两位教授发现人体心肺血管中存在微量的硫化氢(H2S),它对调节心血管功能有重要作用.硫化氢能溶于水,其水溶液显酸性,称为氢硫酸.下列叙述不正确的是( )
A.硫化氢是由硫、氢元素组成的 B.硫化氢是由两个氢原子和一个硫原子构成的
C.氢硫酸能腐蚀大理石雕像 D.氢硫酸能与KOH溶液发生中和反应
5.下列图像能正确反映对应变化关系的是
A B C D
电解水 向一定量锌粒中加入过量稀硫酸 加热一定量高锰酸钾固体 向一定量氢氧化钠溶液中滴加稀盐酸
A.A B.B C.C D.D
6.下列说法中正确的是
A.氢氧化铜可使无色酚酞溶液变红
B.向pH为2的盐酸中加入氢氧化钠,溶液的pH变小
C.在食醋、石灰水、汽水三种物质中,石灰水的pH最小
D.向pH为4的酸性污水中加入生石灰,可减少污水对河流的污染
7.苯甲酸(C6H5COOH)是一种酸,可用于食品防腐,下列说法正确的是
A.苯甲酸能使湿润的紫色石蕊试液变蓝 B.苯甲酸能和铜反应产生氢气
C.苯甲酸能与氢氧化钠溶液反应生成盐和水 D.在食品中可以大量添加苯甲酸以延长保质期
8.S2-、SO32-和SO42-是比较常见的离子。对这三种离子的认识正确的是
A.三种离子中都含有硫元素 B.SO32-和SO42-都属于氧化物
C.硫元素在化合物中的化合价有-2、+4、+6 D.S2-和H+不能结合成酸分子
9.某同学对氢氧化钠溶液与稀盐酸的中和反应设计了下图所示的四种实验方案,通过对四个实验方案的评价,你认为最佳的实验方案是( )
A.A B.B C.C D.D
10.实验小组用传感器探究NaOH溶液与稀盐酸反应过程中pH的变化。测定结果如下图所示。下列说法正确的是
A.在0s至40s之间,溶液中的溶质为HCl、NaCl和H2O B.20s时,溶液显碱性
C.60s时,取适量所得溶液加入锌粒,有气泡产生 D.该实验是将NaOH溶液滴入稀盐酸中
11.常温下,向某浓度的硫酸溶液中逐滴滴入某浓度的氢氧化钡溶液,生成沉淀的质量与加入氢氧化钡溶液的体积关系如图所示.a、b、c、d分别表示实验时不同阶段的反应结果,下列说法中正确的是
A.溶液的导电能力:a > b > c > d B.溶液的pH大小:a< b < c < d
C.a、c溶液呈酸性 D.c、d溶液呈碱性
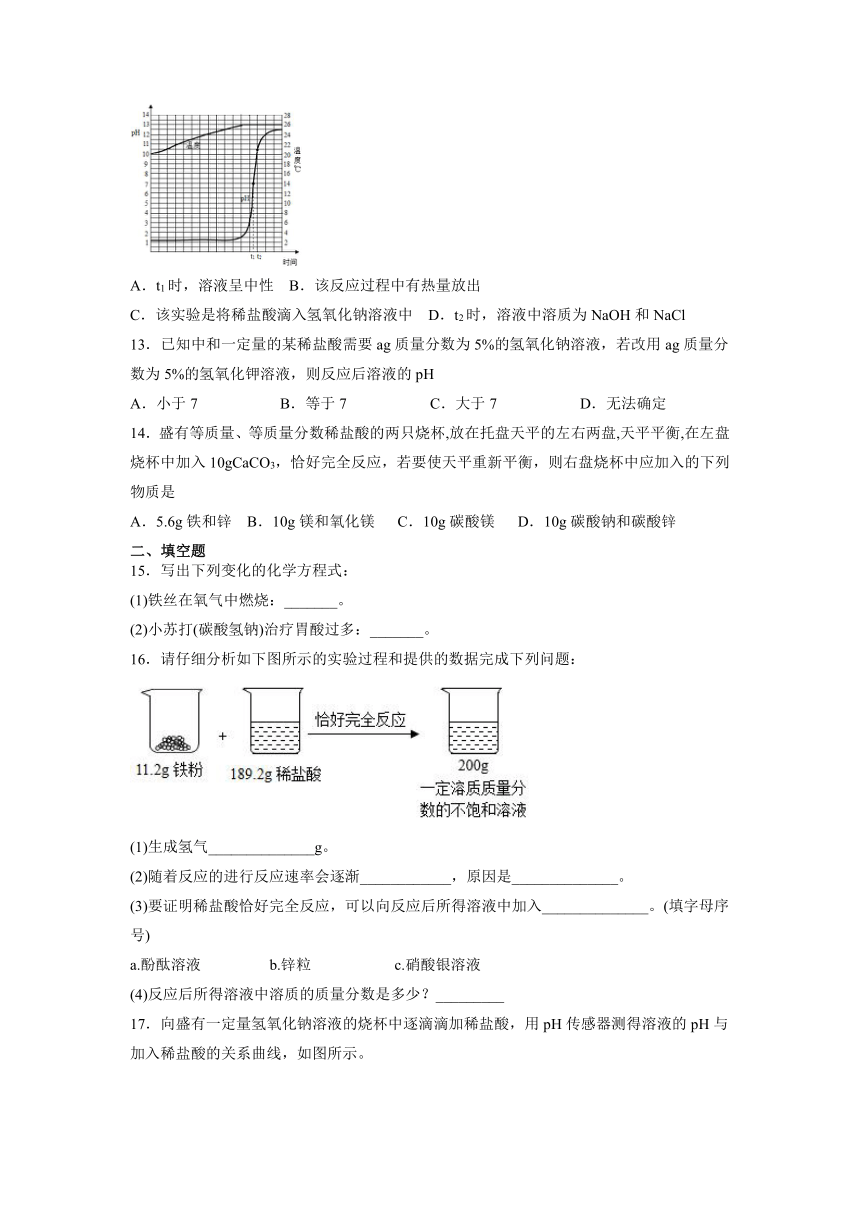
12.某实验小组同学用传感器探究氢氧化钠溶液与稀盐酸的反应,向一种溶液中逐滴滴加另一种溶液,用传感器实时获得溶液的pH、温度变化曲线如下图所示。下列说法不正确的是
A.t1时,溶液呈中性 B.该反应过程中有热量放出
C.该实验是将稀盐酸滴入氢氧化钠溶液中 D.t2时,溶液中溶质为NaOH和NaCl
13.已知中和一定量的某稀盐酸需要ag质量分数为5%的氢氧化钠溶液,若改用ag质量分数为5%的氢氧化钾溶液,则反应后溶液的pH
A.小于7 B.等于7 C.大于7 D.无法确定
14.盛有等质量、等质量分数稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡,在左盘烧杯中加入10gCaCO3,恰好完全反应,若要使天平重新平衡,则右盘烧杯中应加入的下列物质是
A.5.6g铁和锌 B.10g镁和氧化镁 C.10g碳酸镁 D.10g碳酸钠和碳酸锌
二、填空题
15.写出下列变化的化学方程式:
(1)铁丝在氧气中燃烧:_______。
(2)小苏打(碳酸氢钠)治疗胃酸过多:_______。
16.请仔细分析如下图所示的实验过程和提供的数据完成下列问题:
(1)生成氢气______________g。
(2)随着反应的进行反应速率会逐渐____________,原因是______________。
(3)要证明稀盐酸恰好完全反应,可以向反应后所得溶液中加入______________。(填字母序号)
a.酚酞溶液 b.锌粒 c.硝酸银溶液
(4)反应后所得溶液中溶质的质量分数是多少?_________
17.向盛有一定量氢氧化钠溶液的烧杯中逐滴滴加稀盐酸,用pH传感器测得溶液的pH与加入稀盐酸的关系曲线,如图所示。
①请写出该反应的化学方程式。__________
②若把原烧杯中氢氧化钠溶液化为等质量、等浓度的澄清石灰水进行,则该实验pH传感器测得的曲线可能经过__________点。
18.化学是研究物质的。我们身边有很多种重要的单质和化合物。
(1)下列溶液敞口放置在空气中,因为变质而使溶液质量减小的是_____。(填字母)
A 浓盐酸 B 浓硫酸 C 烧碱溶液 D 饱和石灰水
(2)某校化学小组在做氢氧化钠溶液与稀盐酸中和反应实验时,用pH传感器测得溶液的pH变化如图所示,回答下列问题。
①中和反应实质是_____。
②该反应的化学方程式是_____。
③该实验操作是将_____(填“氢氧化钠溶液”或稀盐酸溶液)逐滴加入到另一种溶液中。
④该小组又对反应后溶液中溶质成分进行了探究,他们取反应后的部分溶液加热、蒸干,得到白色固体,以下是探究白色固体成分的实验,请填写下表。
实验操作 测定结果 白色固体的化学式
用pH试纸测定反应后溶液的酸碱度,操作方法是_____ pH>7 _____
_____ NaCl
19.中和反应是一类重要的化学反应。某同学利用图1实验研究稀盐酸与氢氧化钠液反应的过程,并测量反应过程中溶液的pH和温度的变化情况,得到图2和图3
(1)烧杯中发生反应的化学方程式为_____;
(2)滴管A中溶液的溶质是_____(填化学式);
(3)结合图2中有关信息可知图3中V的数值最接近_____(填“6”、“12”或“16”);
(4)下列说法正确的是_____。
A 图2中b点所示溶液中的溶质是NaCl和HCl
B 取图2中d点所示溶液加热蒸干所得固体为纯净物
C 图2中c→d所示溶液中NaCl的质量不断增加
D 图3中e→f变化趋势可说明该反应是放热反应
20.某科学兴趣小组为测定稀硫酸的溶质质量分数。在实验室中用 NaOH固体配制 100克质量分数为 20%的氢氧化钠溶液,将其滴入盛有 50克稀硫酸的烧杯中,其反应过程放热导致的温度变化如图甲所示。
(1)配制氢氧化钠溶液,除了天平和玻璃棒等仪器外,还需要图乙中的 _____ (填字母)仪器。
(2)结合图甲,列式计算稀硫酸的溶质质量分数。 _____ (2NaOH+H2SO4=Na2SO4+2H2O)
(3)称量氢氧化钠固体时,若砝码已生锈,则对稀硫酸质量分数的测定有何影响 _____ ,并简要说明理由 _____ 。
三、简答题
21.向盛有氢氧化钠溶液(滴有酚酞溶液)的烧杯中加入盐酸,观察到烧杯中的溶液由红色变为无色。
(1)请写出有关反应的化学方程式。_____
(2)反应前后没有发生变化的离子有哪些?_____
(3)烧杯中无色溶液的溶质一定含有NaCl,也可能还含有HCl。要确定该溶质的成分,请写出一种可选用的试剂。_____
22.化学源于生活而且服务于生活,请同学们用所学的化学知识来解决下列生活中的问题:
(1)在铁制品表面涂油、刷漆或镀铬等都能防止铁制品生锈,其原理是什么?
(2)为什么可以用含氢氧化镁的药物治疗胃酸过多?
(3)用扇子扇煤炉火焰,为什么越扇越旺?
23.室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图:
(1)由如图可知,盐酸与氢氧化钠溶液中和反应是_____(填“吸热”、“放热”)反应。
(2)在A处溶液中加入酚酞,溶液呈_____色。
(3)B到C的过程中溶液的pH逐渐_____(填“增大”、“减小”或“无变化”)。
(4)B到C的过程中温度降低的原因为_____。
24.用稀硫酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的pH变化如图所示。
(1)写出该反应的化学方程式___________。
(2)该实验是将_____________________________滴加到另一种溶液中。
(3)当所加溶液的质量为bg时,写出此时溶液中溶质的化学式___________
四、综合应用题
25.酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
(实验探究)在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度_______,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示
(1)由图可知,盐酸、氢氧化钠溶液稀释时均_______(填“放热”或“吸热”),但它们稀释时温度的变化量远_______两溶液混合时温度的变化量;
(2)小王同学用质量分数为10%的稀盐酸和20%的氢氧化钠溶液进行酸碱反应实验(如图一),用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器测得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。
①A点溶液的溶质_______(填化学式)。
②计算所用的稀盐酸溶液的质量_____。(保留小数点后一位)
【参考答案】
1.D 2.D 3.D 4.B 5.C 6.D 7.C 8.C 9.C 10.D 11.B 12.C 13.A 14.C
15.(1) (2)
16.(1)0.4 (2)减慢 稀盐酸的浓度逐渐减小 (3) b (4)12.7%;
17. c
18.(1)D (2)酸中的氢离子(H+)与碱中的氢氧根离子(OH-)结合成水(H2O)分子(或) 氢氧化钠溶液 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较 NaCl、NaOH pH≤7
19.(1) (2)NaOH (3) 12 (4)AD
20.(1)BDE (2)19.6% (3)偏小 若砝码已生锈,其质量变大,称量氢氧化钠固体时质量偏大,氢氧化钠溶液的质量分数偏大,滴加所用的氢氧化钠溶液质量偏小,计算稀硫酸质量分数偏小
21.(1) (2)Na+、Cl- (3)紫色石蕊溶液(答案合理即可)
22.(1)隔绝氧气和水(2)氢氧化镁与盐酸反应生成氯化镁和水(3)增加了氧气的浓度
23.(1)放热 (2) 红 (3)减小 (4) 反应终止,热量散失(反应终止,继续加盐酸起冷却作用)
24.(1)2NaOH+H2SO4=Na2SO4+2H2O (2)氢氧化钠 (3)Na2SO4、NaOH
25.(1)升高 放热 小于(2) NaCl、NaOH 54.75g。
课题2 酸和碱的中和反应课后练习
一、选择题
1.某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是
A.用湿润的pH试纸测定稀硫酸的pH B.用干燥的pH试纸测定二氧化碳气体的pH
C.用干燥的pH试纸测定浓硫酸的pH D.用干燥的pH试纸测定氢氧化钠稀溶液的pH
2.下列有关辨析中正确的是
①物质都是由分子构成的;②生成盐和水的反应不一定是中和反应;③点燃甲烷和氢气混合气体前一定要检验其纯度;④和盐酸反应生成气体的固体中一定含碳酸盐;⑤盐溶液的pH一定等于7;⑥由相同元素组成的物质不一定是同一种物质。
A.①③⑤ B.①④⑤ C.②④⑥ D.②③⑥
3.下列反应属于复分解反应的是
A.S+O2SO2 B.2H2O2H2↑+O2↑
C.C+2CuOCO2+2Cu D.Al(OH)3+3HCl=AlCl3+3H2O
4.北京大学的两位教授发现人体心肺血管中存在微量的硫化氢(H2S),它对调节心血管功能有重要作用.硫化氢能溶于水,其水溶液显酸性,称为氢硫酸.下列叙述不正确的是( )
A.硫化氢是由硫、氢元素组成的 B.硫化氢是由两个氢原子和一个硫原子构成的
C.氢硫酸能腐蚀大理石雕像 D.氢硫酸能与KOH溶液发生中和反应
5.下列图像能正确反映对应变化关系的是
A B C D
电解水 向一定量锌粒中加入过量稀硫酸 加热一定量高锰酸钾固体 向一定量氢氧化钠溶液中滴加稀盐酸
A.A B.B C.C D.D
6.下列说法中正确的是
A.氢氧化铜可使无色酚酞溶液变红
B.向pH为2的盐酸中加入氢氧化钠,溶液的pH变小
C.在食醋、石灰水、汽水三种物质中,石灰水的pH最小
D.向pH为4的酸性污水中加入生石灰,可减少污水对河流的污染
7.苯甲酸(C6H5COOH)是一种酸,可用于食品防腐,下列说法正确的是
A.苯甲酸能使湿润的紫色石蕊试液变蓝 B.苯甲酸能和铜反应产生氢气
C.苯甲酸能与氢氧化钠溶液反应生成盐和水 D.在食品中可以大量添加苯甲酸以延长保质期
8.S2-、SO32-和SO42-是比较常见的离子。对这三种离子的认识正确的是
A.三种离子中都含有硫元素 B.SO32-和SO42-都属于氧化物
C.硫元素在化合物中的化合价有-2、+4、+6 D.S2-和H+不能结合成酸分子
9.某同学对氢氧化钠溶液与稀盐酸的中和反应设计了下图所示的四种实验方案,通过对四个实验方案的评价,你认为最佳的实验方案是( )
A.A B.B C.C D.D
10.实验小组用传感器探究NaOH溶液与稀盐酸反应过程中pH的变化。测定结果如下图所示。下列说法正确的是
A.在0s至40s之间,溶液中的溶质为HCl、NaCl和H2O B.20s时,溶液显碱性
C.60s时,取适量所得溶液加入锌粒,有气泡产生 D.该实验是将NaOH溶液滴入稀盐酸中
11.常温下,向某浓度的硫酸溶液中逐滴滴入某浓度的氢氧化钡溶液,生成沉淀的质量与加入氢氧化钡溶液的体积关系如图所示.a、b、c、d分别表示实验时不同阶段的反应结果,下列说法中正确的是
A.溶液的导电能力:a > b > c > d B.溶液的pH大小:a< b < c < d
C.a、c溶液呈酸性 D.c、d溶液呈碱性
12.某实验小组同学用传感器探究氢氧化钠溶液与稀盐酸的反应,向一种溶液中逐滴滴加另一种溶液,用传感器实时获得溶液的pH、温度变化曲线如下图所示。下列说法不正确的是
A.t1时,溶液呈中性 B.该反应过程中有热量放出
C.该实验是将稀盐酸滴入氢氧化钠溶液中 D.t2时,溶液中溶质为NaOH和NaCl
13.已知中和一定量的某稀盐酸需要ag质量分数为5%的氢氧化钠溶液,若改用ag质量分数为5%的氢氧化钾溶液,则反应后溶液的pH
A.小于7 B.等于7 C.大于7 D.无法确定
14.盛有等质量、等质量分数稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡,在左盘烧杯中加入10gCaCO3,恰好完全反应,若要使天平重新平衡,则右盘烧杯中应加入的下列物质是
A.5.6g铁和锌 B.10g镁和氧化镁 C.10g碳酸镁 D.10g碳酸钠和碳酸锌
二、填空题
15.写出下列变化的化学方程式:
(1)铁丝在氧气中燃烧:_______。
(2)小苏打(碳酸氢钠)治疗胃酸过多:_______。
16.请仔细分析如下图所示的实验过程和提供的数据完成下列问题:
(1)生成氢气______________g。
(2)随着反应的进行反应速率会逐渐____________,原因是______________。
(3)要证明稀盐酸恰好完全反应,可以向反应后所得溶液中加入______________。(填字母序号)
a.酚酞溶液 b.锌粒 c.硝酸银溶液
(4)反应后所得溶液中溶质的质量分数是多少?_________
17.向盛有一定量氢氧化钠溶液的烧杯中逐滴滴加稀盐酸,用pH传感器测得溶液的pH与加入稀盐酸的关系曲线,如图所示。
①请写出该反应的化学方程式。__________
②若把原烧杯中氢氧化钠溶液化为等质量、等浓度的澄清石灰水进行,则该实验pH传感器测得的曲线可能经过__________点。
18.化学是研究物质的。我们身边有很多种重要的单质和化合物。
(1)下列溶液敞口放置在空气中,因为变质而使溶液质量减小的是_____。(填字母)
A 浓盐酸 B 浓硫酸 C 烧碱溶液 D 饱和石灰水
(2)某校化学小组在做氢氧化钠溶液与稀盐酸中和反应实验时,用pH传感器测得溶液的pH变化如图所示,回答下列问题。
①中和反应实质是_____。
②该反应的化学方程式是_____。
③该实验操作是将_____(填“氢氧化钠溶液”或稀盐酸溶液)逐滴加入到另一种溶液中。
④该小组又对反应后溶液中溶质成分进行了探究,他们取反应后的部分溶液加热、蒸干,得到白色固体,以下是探究白色固体成分的实验,请填写下表。
实验操作 测定结果 白色固体的化学式
用pH试纸测定反应后溶液的酸碱度,操作方法是_____ pH>7 _____
_____ NaCl
19.中和反应是一类重要的化学反应。某同学利用图1实验研究稀盐酸与氢氧化钠液反应的过程,并测量反应过程中溶液的pH和温度的变化情况,得到图2和图3
(1)烧杯中发生反应的化学方程式为_____;
(2)滴管A中溶液的溶质是_____(填化学式);
(3)结合图2中有关信息可知图3中V的数值最接近_____(填“6”、“12”或“16”);
(4)下列说法正确的是_____。
A 图2中b点所示溶液中的溶质是NaCl和HCl
B 取图2中d点所示溶液加热蒸干所得固体为纯净物
C 图2中c→d所示溶液中NaCl的质量不断增加
D 图3中e→f变化趋势可说明该反应是放热反应
20.某科学兴趣小组为测定稀硫酸的溶质质量分数。在实验室中用 NaOH固体配制 100克质量分数为 20%的氢氧化钠溶液,将其滴入盛有 50克稀硫酸的烧杯中,其反应过程放热导致的温度变化如图甲所示。
(1)配制氢氧化钠溶液,除了天平和玻璃棒等仪器外,还需要图乙中的 _____ (填字母)仪器。
(2)结合图甲,列式计算稀硫酸的溶质质量分数。 _____ (2NaOH+H2SO4=Na2SO4+2H2O)
(3)称量氢氧化钠固体时,若砝码已生锈,则对稀硫酸质量分数的测定有何影响 _____ ,并简要说明理由 _____ 。
三、简答题
21.向盛有氢氧化钠溶液(滴有酚酞溶液)的烧杯中加入盐酸,观察到烧杯中的溶液由红色变为无色。
(1)请写出有关反应的化学方程式。_____
(2)反应前后没有发生变化的离子有哪些?_____
(3)烧杯中无色溶液的溶质一定含有NaCl,也可能还含有HCl。要确定该溶质的成分,请写出一种可选用的试剂。_____
22.化学源于生活而且服务于生活,请同学们用所学的化学知识来解决下列生活中的问题:
(1)在铁制品表面涂油、刷漆或镀铬等都能防止铁制品生锈,其原理是什么?
(2)为什么可以用含氢氧化镁的药物治疗胃酸过多?
(3)用扇子扇煤炉火焰,为什么越扇越旺?
23.室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图:
(1)由如图可知,盐酸与氢氧化钠溶液中和反应是_____(填“吸热”、“放热”)反应。
(2)在A处溶液中加入酚酞,溶液呈_____色。
(3)B到C的过程中溶液的pH逐渐_____(填“增大”、“减小”或“无变化”)。
(4)B到C的过程中温度降低的原因为_____。
24.用稀硫酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的pH变化如图所示。
(1)写出该反应的化学方程式___________。
(2)该实验是将_____________________________滴加到另一种溶液中。
(3)当所加溶液的质量为bg时,写出此时溶液中溶质的化学式___________
四、综合应用题
25.酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
(实验探究)在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度_______,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示
(1)由图可知,盐酸、氢氧化钠溶液稀释时均_______(填“放热”或“吸热”),但它们稀释时温度的变化量远_______两溶液混合时温度的变化量;
(2)小王同学用质量分数为10%的稀盐酸和20%的氢氧化钠溶液进行酸碱反应实验(如图一),用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器测得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。
①A点溶液的溶质_______(填化学式)。
②计算所用的稀盐酸溶液的质量_____。(保留小数点后一位)
【参考答案】
1.D 2.D 3.D 4.B 5.C 6.D 7.C 8.C 9.C 10.D 11.B 12.C 13.A 14.C
15.(1) (2)
16.(1)0.4 (2)减慢 稀盐酸的浓度逐渐减小 (3) b (4)12.7%;
17. c
18.(1)D (2)酸中的氢离子(H+)与碱中的氢氧根离子(OH-)结合成水(H2O)分子(或) 氢氧化钠溶液 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较 NaCl、NaOH pH≤7
19.(1) (2)NaOH (3) 12 (4)AD
20.(1)BDE (2)19.6% (3)偏小 若砝码已生锈,其质量变大,称量氢氧化钠固体时质量偏大,氢氧化钠溶液的质量分数偏大,滴加所用的氢氧化钠溶液质量偏小,计算稀硫酸质量分数偏小
21.(1) (2)Na+、Cl- (3)紫色石蕊溶液(答案合理即可)
22.(1)隔绝氧气和水(2)氢氧化镁与盐酸反应生成氯化镁和水(3)增加了氧气的浓度
23.(1)放热 (2) 红 (3)减小 (4) 反应终止,热量散失(反应终止,继续加盐酸起冷却作用)
24.(1)2NaOH+H2SO4=Na2SO4+2H2O (2)氢氧化钠 (3)Na2SO4、NaOH
25.(1)升高 放热 小于(2) NaCl、NaOH 54.75g。
同课章节目录
