2013届高三《化学反应与能量及方》复习学案
文档属性
| 名称 | 2013届高三《化学反应与能量及方》复习学案 |
|
|
| 格式 | zip | ||
| 文件大小 | 309.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-19 00:00:00 | ||
图片预览




文档简介
2013届高三化学第一轮复习学案
【考试要求】
⑴能说明化学反应中能量转化的原因,知道化学变化中常见的能量转化形式。了解化学能与热能的相互转化及其应用。
⑵了解吸热反应、放热反应、反应热等概念。
⑶了解热化学方程式的含义,能根据盖斯定律进行有关反应热的简单计算。
⑷了解化学反应在一定条件下能否自发进行的判断依据,能够利用化学反应的焓变和熵变判断化学反应的方向。
【命题趋势】考查主要内容仍是吸热反应、放热反应判断和原因,热化学方程式的正误判断与书写,根据盖斯定律进行有关反应热的简单计算,利用化学反应的焓变和熵变判断化学反应的方向。反应热的计算由数句变为字母,由具体到抽象;根据盖斯定律进行计算时会增加热化学方程式的选择,或与其它化学知识联系进行综合考查。
【要点梳理】
1.反应热、焓变、吸热反应、放热反应、燃烧热、中和热等概念。
⑴反应热和焓变
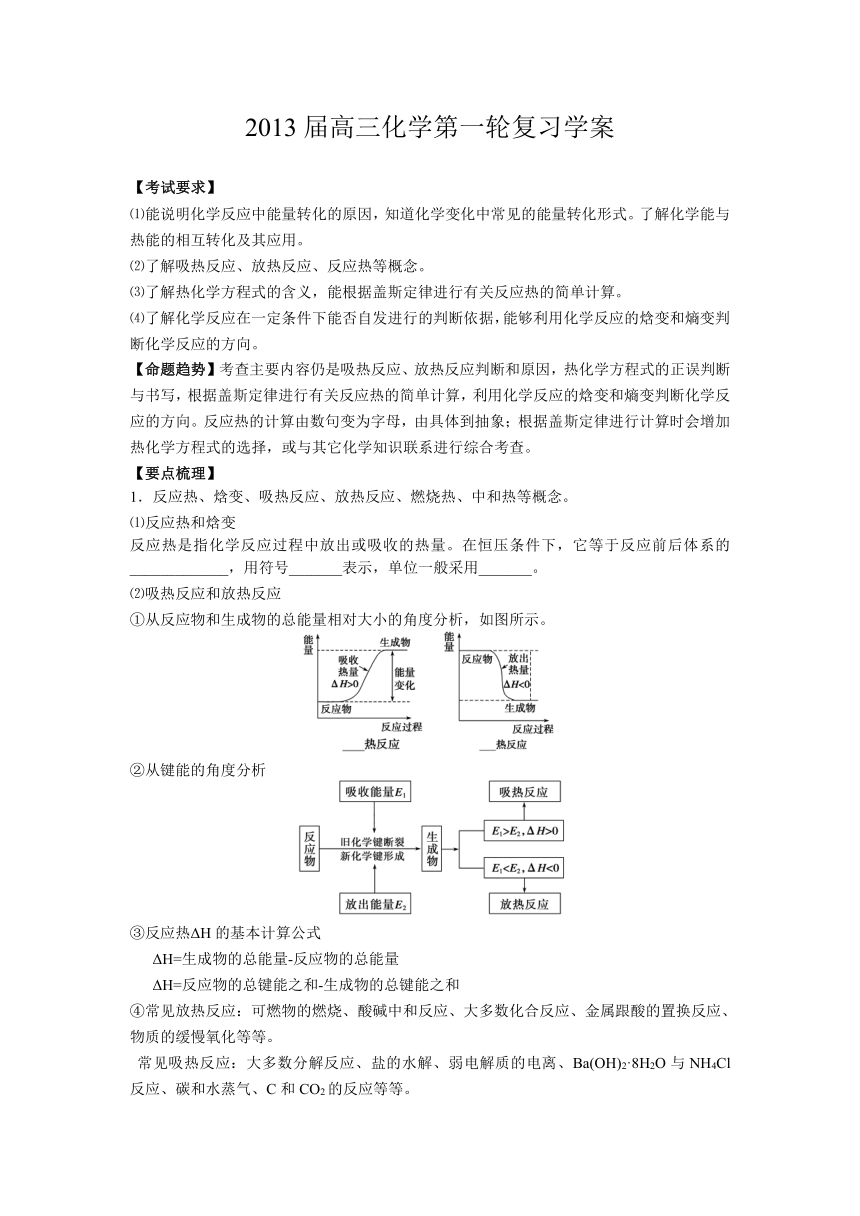
反应热是指化学反应过程中放出或吸收的热量。在恒压条件下,它等于反应前后体系的_____________,用符号_______表示,单位一般采用_______。
⑵吸热反应和放热反应
①从反应物和生成物的总能量相对大小的角度分析,如图所示。
②从键能的角度分析
③反应热ΔH的基本计算公式
ΔH=生成物的总能量-反应物的总能量
ΔH=反应物的总键能之和-生成物的总键能之和
④常见放热反应:可燃物的燃烧、酸碱中和反应、大多数化合反应、金属跟酸的置换反应、物质的缓慢氧化等等。
常见吸热反应:大多数分解反应、盐的水解、弱电解质的电离、Ba(OH)2·8H2O与NH4Cl反应、碳和水蒸气、C和CO2的反应等等。
⑶燃烧热、中和热
比较项目
燃烧热
中和热
相同点
能量变化
____反应
ΔH
ΔH__0,单位:________
不同点
概念
________时,____ mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。不同反应物,燃烧热不同
在稀溶液中,酸与碱发生中和反应生成___mol H2O时所释放的热量。
不同反应物的强酸跟强碱发生中和反应生成 ____ mol H2O时所释放的热量;大致相同,均约为______ kJ·mol-1
反应物的量
____ mol (O2的量不限)
可能是1 mol,也可能是0.5 mol
生成物的量
不限量
H2O是 ____ mol
2.热化学方程式
⑴热化学方程式的概念:表示参与化学反应的物质的__________和__________的关系的化学方程式。热化学方程式不仅表示了化学反应中的________变化,也表明了化学反应中的________变化。
⑵书写热化学方程式时的注意点
①要注明________,但中学化学中所用ΔH的数据一般都是在101kPa和25℃时的数据,因此可不特别注明;
②需注明ΔH的“+”与“—”,“+”表示________,“—”表示________;比较ΔH的大小时,要考虑ΔH的正负。
③要注明反应物和生成物的状态。g表示________,l表示________,s表示________;
④各物质前的化学计量数表示__________________,可以是整数,也可以是分数。
⑤对于可逆反应中的△H指的是正向完全进行时的焓变。
⑥当反应逆向进行时,其反应的焓变数值________,符号________。
3.盖斯定律
对于一个化学反应,无论是________完成,还是__________完成,其反应的焓变是________的。如由A到B可以设计如下两个途径:
途径一:A→B(ΔH)
途径二:A→C→B(ΔH1+ΔH2)
则焓变ΔH、ΔH1、ΔH2的关系可以表示为ΔH=_______________。
4.利用化学反应的焓变和熵变判断化学反应的方向。
①化学反应是否自发进行的判据应是由_______判据和_______判据组成的复合判据,能够使反应体系焓减小、熵增大的反应方向,就是化学反应自发进行的方向。当然,反应是否自发与温度有关,一般低温时焓变影响为主;高温时熵变影响为主。
②同一条件下,不同物质有不同的熵值,同一物质在不同状态下熵值也不同,一般规律是S(g)>S(l)>S(s)。
③一般地,产生气体的反应,气体物质的物质的量增大的反应,熵变通常都是正值,为熵增加的反应。
【典例精析】
【例1】(2012年江苏高考题)某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
【例2】下列热化学方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g) + 3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
C. 已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气,放出484 kJ热量,D.2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
D. 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,
2H+(aq) +(aq)+(aq)+2OH(aq)=BaSO4(s)+2HO(1);H=57.3 kJ/mol
【例3】⑴(2008年江苏高考)某研究小组在实验室用重晶石(主要成分BaSO4)对工业上制备BaCl2的工业过程进行模拟实验。先高温焙烧制备BaS(s),后再制备BaCl2。查表得
BaSO4(s) + 4C(s)4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
则反应C(s) + CO2(g)2CO(g)的△H2= _________kJ·mol-1。实际生产中必须加入过量的炭,同时还要通入空气,其目的是______________________________________________
______________________________________________________________________。
⑵(2012年江苏高考)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=3Al(l)+AlCl3(g) △H=b kJ·mol-1
则反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=_____________kJ·mol-1(用含a、b的代数式表示)。
⑶(2009年江苏高考)用的混合溶液可溶出印刷电路板金属粉末中的铜。已知 ====
====
====
在溶液中与反应生成和的热化学方程式为________________。
⑷(2011年江苏高考)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点,以甲烷为原料制取氢气是工业上常用的制氢方法。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=169.8 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_________________________。
【例4】下列有关说法不正确的是 ( )
A. (2012年江苏高考)CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B. (2011年江苏高考)一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0 △S>0
C.(2010年江苏高考)常温下,反应不能自发进行,则该反应的
D.对于反应N2H4(l)===N2(g)+2H2(g) ΔH=-50.6 kJ·mol-1,它在任何温度下都是自发的
【课堂练习】
1.(2013届苏北四市)反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是 ( )
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=
2.下列关于热化学反应的描述中正确的是 ( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1
B.CO(g)的燃烧热是283.0kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+(2×283.0) kJ·mol-1
C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
3.下列说法正确的是 ( )
A.对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0,
B.8NH3(g)+6NO2(g)==7N2(g)+12H2O(g) △H<0,则该反应一定能自发进行
C.常温下,反应C(s) + CO2(g)= 2CO(g)不能自发进行,则该反应的ΔH>0
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应△S<0
4.⑴(2012届苏锡常镇四市)肼可作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。N2 + 2O2(g) = 2NO2(g);ΔH=+67.7 kJ·mol―1
N2H4 + O2(g) = N2(g) + 2H2O(g);ΔH=–534 kJ·mol―1
写出肼和NO2反应的热化学方程式:______________________________________。
⑵(2010年江苏高考)下面列出了燃煤烟气脱硫方法的原理重要发生了下列反应:
与反应生成的热化学方程式为 。
【专题检测】
1.甲烷是一种高效清洁的新能源,4g甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l);ΔH== +890KJ·mol—1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l);ΔH== +890KJ·mol—1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l);ΔH== -890KJ·mol—1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l);ΔH== -890KJ·mol—1
2.已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g )2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为 ( )
A.一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
3.下列依据热化学方程式得出的结论正确的是 ( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol--1,则氢气的燃烧热为
241.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) △H=a、2C(s)+O2(g)=2CO(g) △H=b,
则a>b
D.已知P (白磷,s)=P (红磷,s) △H<0,则白磷比红磷稳定
4.某反应过程中体系的能量变化如图所示,下列说法错误的是 ( )
A.反应过程可表示为 ―→ ―→
B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
5.(2006年江苏高考题) 下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
6.(2010年广东高考题)在298K、100kPa时,
已知:2 ⊿
⊿
⊿
则⊿与⊿和⊿间的关系正确的是 ( )
A .⊿=⊿+2⊿ B ⊿=⊿+⊿
C. ⊿=⊿-2⊿ D. ⊿=⊿- ⊿
7.设反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,
反应②Fe(s)+H2O(g)? FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
T/K
K1
K2
973
1.47
2.38
1 173
2.15
1.67
下列有关叙述正确的是 ( )
A.b>0 B.在973 K下增大压强,K2增大
C.a>b D.在常温下反应①一定能自发进行
8.⑴ (2012届南通一模)已知:H2(g)、CO(g)和CH3CH2OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和1365.5 kJ·mol-1。
反应2CO(g)+4H2(g)CH3CH2OH(l)+H2O(l) 的△H=________________。
⑵(2011届盐城)已知:N2H4(l) + O2 (g) = N2 (g) + 2H2O(l) △H= -akJ/mol
Cu(OH)2(s) = CuO(s) + H2O(l) △H=bkJ/mol
4CuO(s) = 2Cu2O(s) +O2(g) △H=ckJ/mol
则4Cu(OH)2(s) +N2H4(l) = 2Cu2O(s) + N2(g) +6H2O(l) △H= ▲ kJ/mol
⑶(2011届苏锡常镇四市)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式_____________________________________。
9.(2012届镇江)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);ΔH=-235. 8 kJ·mol-1。
已知2Ag2O(s)=4Ag(s)+O2(g);ΔH=+62.2 kJ·mol-1,
则常温下反应2O3(g)=3O2(g)为______________反应(填“自发”或“非自发”)。
10.(2012届海门)能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
⑴下列做法有助于能源“开源节流”的是___________ (填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如下右图所示。
(a)在通常状况下,金刚石和石墨____________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为____________。
(b)12 g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量___________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol—1、497 kJ·mol—1。
N2(g)+O2(g)=2NO(g);ΔH=+180.0 kJ·mol-1。
NO分子中化学键的键能为___________kJ·mol—1。
(4)综合上述有关信息,请写出CO除NO的热化学方程式___________。
11.(2012届如皋)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
CO(g)+2H2(g) CH3OH (g) △H 1 (反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+O2(g)=CO2(g) △H 2=-283 kJ·mol-1 (反应Ⅱ)
H2(g)+O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
化学键
C-C
C-H
H-H
C-O
CO
H-O
键能/kJ·mol-1
348
413
436
358
1072
463
请回答下列问题:
⑴反应Ⅰ的焓变△H1=_______________。
⑵CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+O2(g)=CO2(g)+2H2O(g) △H4
该反应的焓变△H4=_______________。
与CO和H2相比,甲醇作为汽车动力燃料的优点是 ________________________
_______________________________________________________________。
⑶反应Ⅰ的平衡常数表达式为 ___________________________。
为提高甲醇的产率,可以采取的措施有_________________________________
___________________________________________________________(写出3点)。
既能提高产率,又能提高反应速率的措施是____________________________。
⑷甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 _______________________。
2013届高三化学第一轮复习答案
【典例精析】
【例1】C 【例2】C
【例3】
⑴(2008年江苏高考)172.5 使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需高温
⑵(2012年江苏高考)a+b
⑶(2009年江苏高考) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
⑷(2011年江苏高考)CH4(g)+2H2O(g) =CO2(g)+4H2(g) △H=165.0 kJ·mol-1
【例4】A
【课堂练习】
1.C 2.B 3.BC
4.⑴2N2H4(g) +2NO2(g)=3N2(g) + 4H2O(g);ΔH=–1135.7 kJ·mol―1(2分)
(2)S(g)+O2(g)= S O2(g) H=-574.0kJmol-1
【专题检测】
1.C 2.C 3.A 4.D 5.C 6.A 7.C
8.答:⑴-343.7 kJ·mol-1 ⑵4b+c-a
⑶2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH3=-270 kJ·mol-1(2分)
9.答:自发(2分)
10.
(1)acd
(2)石墨 393.5kJ/mol 252.0kJ
(3)631.5
(4)2NO (g)+2CO(g)=N2(g) +2CO2(g);?H=-746.0 kJ·mol-1
11.(16分)⑴-116 kJ·mol-1
⑵-651 kJ·mol-1 单位体积供能多;密度大易于运输;单位产能耗氧量较少(1分,其它合理答案均给分)
⑶K=
降低温度;增加反应气体的压强;将反应生成的甲醇及时冷凝从反应体系中移去。(其它合理答案均给分)
增加反应气体的压强(其它合理答案均给分)
⑷① 如图:
②CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+
【考试要求】
⑴能说明化学反应中能量转化的原因,知道化学变化中常见的能量转化形式。了解化学能与热能的相互转化及其应用。
⑵了解吸热反应、放热反应、反应热等概念。
⑶了解热化学方程式的含义,能根据盖斯定律进行有关反应热的简单计算。
⑷了解化学反应在一定条件下能否自发进行的判断依据,能够利用化学反应的焓变和熵变判断化学反应的方向。
【命题趋势】考查主要内容仍是吸热反应、放热反应判断和原因,热化学方程式的正误判断与书写,根据盖斯定律进行有关反应热的简单计算,利用化学反应的焓变和熵变判断化学反应的方向。反应热的计算由数句变为字母,由具体到抽象;根据盖斯定律进行计算时会增加热化学方程式的选择,或与其它化学知识联系进行综合考查。
【要点梳理】
1.反应热、焓变、吸热反应、放热反应、燃烧热、中和热等概念。
⑴反应热和焓变
反应热是指化学反应过程中放出或吸收的热量。在恒压条件下,它等于反应前后体系的_____________,用符号_______表示,单位一般采用_______。
⑵吸热反应和放热反应
①从反应物和生成物的总能量相对大小的角度分析,如图所示。
②从键能的角度分析
③反应热ΔH的基本计算公式
ΔH=生成物的总能量-反应物的总能量
ΔH=反应物的总键能之和-生成物的总键能之和
④常见放热反应:可燃物的燃烧、酸碱中和反应、大多数化合反应、金属跟酸的置换反应、物质的缓慢氧化等等。
常见吸热反应:大多数分解反应、盐的水解、弱电解质的电离、Ba(OH)2·8H2O与NH4Cl反应、碳和水蒸气、C和CO2的反应等等。
⑶燃烧热、中和热
比较项目
燃烧热
中和热
相同点
能量变化
____反应
ΔH
ΔH__0,单位:________
不同点
概念
________时,____ mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。不同反应物,燃烧热不同
在稀溶液中,酸与碱发生中和反应生成___mol H2O时所释放的热量。
不同反应物的强酸跟强碱发生中和反应生成 ____ mol H2O时所释放的热量;大致相同,均约为______ kJ·mol-1
反应物的量
____ mol (O2的量不限)
可能是1 mol,也可能是0.5 mol
生成物的量
不限量
H2O是 ____ mol
2.热化学方程式
⑴热化学方程式的概念:表示参与化学反应的物质的__________和__________的关系的化学方程式。热化学方程式不仅表示了化学反应中的________变化,也表明了化学反应中的________变化。
⑵书写热化学方程式时的注意点
①要注明________,但中学化学中所用ΔH的数据一般都是在101kPa和25℃时的数据,因此可不特别注明;
②需注明ΔH的“+”与“—”,“+”表示________,“—”表示________;比较ΔH的大小时,要考虑ΔH的正负。
③要注明反应物和生成物的状态。g表示________,l表示________,s表示________;
④各物质前的化学计量数表示__________________,可以是整数,也可以是分数。
⑤对于可逆反应中的△H指的是正向完全进行时的焓变。
⑥当反应逆向进行时,其反应的焓变数值________,符号________。
3.盖斯定律
对于一个化学反应,无论是________完成,还是__________完成,其反应的焓变是________的。如由A到B可以设计如下两个途径:
途径一:A→B(ΔH)
途径二:A→C→B(ΔH1+ΔH2)
则焓变ΔH、ΔH1、ΔH2的关系可以表示为ΔH=_______________。
4.利用化学反应的焓变和熵变判断化学反应的方向。
①化学反应是否自发进行的判据应是由_______判据和_______判据组成的复合判据,能够使反应体系焓减小、熵增大的反应方向,就是化学反应自发进行的方向。当然,反应是否自发与温度有关,一般低温时焓变影响为主;高温时熵变影响为主。
②同一条件下,不同物质有不同的熵值,同一物质在不同状态下熵值也不同,一般规律是S(g)>S(l)>S(s)。
③一般地,产生气体的反应,气体物质的物质的量增大的反应,熵变通常都是正值,为熵增加的反应。
【典例精析】
【例1】(2012年江苏高考题)某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
【例2】下列热化学方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g) + 3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
C. 已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气,放出484 kJ热量,D.2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
D. 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,
2H+(aq) +(aq)+(aq)+2OH(aq)=BaSO4(s)+2HO(1);H=57.3 kJ/mol
【例3】⑴(2008年江苏高考)某研究小组在实验室用重晶石(主要成分BaSO4)对工业上制备BaCl2的工业过程进行模拟实验。先高温焙烧制备BaS(s),后再制备BaCl2。查表得
BaSO4(s) + 4C(s)4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
则反应C(s) + CO2(g)2CO(g)的△H2= _________kJ·mol-1。实际生产中必须加入过量的炭,同时还要通入空气,其目的是______________________________________________
______________________________________________________________________。
⑵(2012年江苏高考)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=3Al(l)+AlCl3(g) △H=b kJ·mol-1
则反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=_____________kJ·mol-1(用含a、b的代数式表示)。
⑶(2009年江苏高考)用的混合溶液可溶出印刷电路板金属粉末中的铜。已知 ====
====
====
在溶液中与反应生成和的热化学方程式为________________。
⑷(2011年江苏高考)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点,以甲烷为原料制取氢气是工业上常用的制氢方法。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) △H=169.8 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_________________________。
【例4】下列有关说法不正确的是 ( )
A. (2012年江苏高考)CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B. (2011年江苏高考)一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0 △S>0
C.(2010年江苏高考)常温下,反应不能自发进行,则该反应的
D.对于反应N2H4(l)===N2(g)+2H2(g) ΔH=-50.6 kJ·mol-1,它在任何温度下都是自发的
【课堂练习】
1.(2013届苏北四市)反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是 ( )
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=
2.下列关于热化学反应的描述中正确的是 ( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1
B.CO(g)的燃烧热是283.0kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+(2×283.0) kJ·mol-1
C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
3.下列说法正确的是 ( )
A.对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0,
B.8NH3(g)+6NO2(g)==7N2(g)+12H2O(g) △H<0,则该反应一定能自发进行
C.常温下,反应C(s) + CO2(g)= 2CO(g)不能自发进行,则该反应的ΔH>0
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应△S<0
4.⑴(2012届苏锡常镇四市)肼可作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。N2 + 2O2(g) = 2NO2(g);ΔH=+67.7 kJ·mol―1
N2H4 + O2(g) = N2(g) + 2H2O(g);ΔH=–534 kJ·mol―1
写出肼和NO2反应的热化学方程式:______________________________________。
⑵(2010年江苏高考)下面列出了燃煤烟气脱硫方法的原理重要发生了下列反应:
与反应生成的热化学方程式为 。
【专题检测】
1.甲烷是一种高效清洁的新能源,4g甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l);ΔH== +890KJ·mol—1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l);ΔH== +890KJ·mol—1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l);ΔH== -890KJ·mol—1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l);ΔH== -890KJ·mol—1
2.已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g )2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为 ( )
A.一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
3.下列依据热化学方程式得出的结论正确的是 ( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol--1,则氢气的燃烧热为
241.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) △H=a、2C(s)+O2(g)=2CO(g) △H=b,
则a>b
D.已知P (白磷,s)=P (红磷,s) △H<0,则白磷比红磷稳定
4.某反应过程中体系的能量变化如图所示,下列说法错误的是 ( )
A.反应过程可表示为 ―→ ―→
B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
5.(2006年江苏高考题) 下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
6.(2010年广东高考题)在298K、100kPa时,
已知:2 ⊿
⊿
⊿
则⊿与⊿和⊿间的关系正确的是 ( )
A .⊿=⊿+2⊿ B ⊿=⊿+⊿
C. ⊿=⊿-2⊿ D. ⊿=⊿- ⊿
7.设反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,
反应②Fe(s)+H2O(g)? FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
T/K
K1
K2
973
1.47
2.38
1 173
2.15
1.67
下列有关叙述正确的是 ( )
A.b>0 B.在973 K下增大压强,K2增大
C.a>b D.在常温下反应①一定能自发进行
8.⑴ (2012届南通一模)已知:H2(g)、CO(g)和CH3CH2OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和1365.5 kJ·mol-1。
反应2CO(g)+4H2(g)CH3CH2OH(l)+H2O(l) 的△H=________________。
⑵(2011届盐城)已知:N2H4(l) + O2 (g) = N2 (g) + 2H2O(l) △H= -akJ/mol
Cu(OH)2(s) = CuO(s) + H2O(l) △H=bkJ/mol
4CuO(s) = 2Cu2O(s) +O2(g) △H=ckJ/mol
则4Cu(OH)2(s) +N2H4(l) = 2Cu2O(s) + N2(g) +6H2O(l) △H= ▲ kJ/mol
⑶(2011届苏锡常镇四市)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式_____________________________________。
9.(2012届镇江)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);ΔH=-235. 8 kJ·mol-1。
已知2Ag2O(s)=4Ag(s)+O2(g);ΔH=+62.2 kJ·mol-1,
则常温下反应2O3(g)=3O2(g)为______________反应(填“自发”或“非自发”)。
10.(2012届海门)能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
⑴下列做法有助于能源“开源节流”的是___________ (填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如下右图所示。
(a)在通常状况下,金刚石和石墨____________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为____________。
(b)12 g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量___________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol—1、497 kJ·mol—1。
N2(g)+O2(g)=2NO(g);ΔH=+180.0 kJ·mol-1。
NO分子中化学键的键能为___________kJ·mol—1。
(4)综合上述有关信息,请写出CO除NO的热化学方程式___________。
11.(2012届如皋)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
CO(g)+2H2(g) CH3OH (g) △H 1 (反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+O2(g)=CO2(g) △H 2=-283 kJ·mol-1 (反应Ⅱ)
H2(g)+O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
化学键
C-C
C-H
H-H
C-O
CO
H-O
键能/kJ·mol-1
348
413
436
358
1072
463
请回答下列问题:
⑴反应Ⅰ的焓变△H1=_______________。
⑵CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+O2(g)=CO2(g)+2H2O(g) △H4
该反应的焓变△H4=_______________。
与CO和H2相比,甲醇作为汽车动力燃料的优点是 ________________________
_______________________________________________________________。
⑶反应Ⅰ的平衡常数表达式为 ___________________________。
为提高甲醇的产率,可以采取的措施有_________________________________
___________________________________________________________(写出3点)。
既能提高产率,又能提高反应速率的措施是____________________________。
⑷甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 _______________________。
2013届高三化学第一轮复习答案
【典例精析】
【例1】C 【例2】C
【例3】
⑴(2008年江苏高考)172.5 使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需高温
⑵(2012年江苏高考)a+b
⑶(2009年江苏高考) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
⑷(2011年江苏高考)CH4(g)+2H2O(g) =CO2(g)+4H2(g) △H=165.0 kJ·mol-1
【例4】A
【课堂练习】
1.C 2.B 3.BC
4.⑴2N2H4(g) +2NO2(g)=3N2(g) + 4H2O(g);ΔH=–1135.7 kJ·mol―1(2分)
(2)S(g)+O2(g)= S O2(g) H=-574.0kJmol-1
【专题检测】
1.C 2.C 3.A 4.D 5.C 6.A 7.C
8.答:⑴-343.7 kJ·mol-1 ⑵4b+c-a
⑶2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH3=-270 kJ·mol-1(2分)
9.答:自发(2分)
10.
(1)acd
(2)石墨 393.5kJ/mol 252.0kJ
(3)631.5
(4)2NO (g)+2CO(g)=N2(g) +2CO2(g);?H=-746.0 kJ·mol-1
11.(16分)⑴-116 kJ·mol-1
⑵-651 kJ·mol-1 单位体积供能多;密度大易于运输;单位产能耗氧量较少(1分,其它合理答案均给分)
⑶K=
降低温度;增加反应气体的压强;将反应生成的甲醇及时冷凝从反应体系中移去。(其它合理答案均给分)
增加反应气体的压强(其它合理答案均给分)
⑷① 如图:
②CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+
