铝元素及其化合物复习案例分析
文档属性
| 名称 | 铝元素及其化合物复习案例分析 |

|
|
| 格式 | zip | ||
| 文件大小 | 719.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-19 00:00:00 | ||
图片预览





文档简介
课件37张PPT。元素化合物复习对策与课例分析
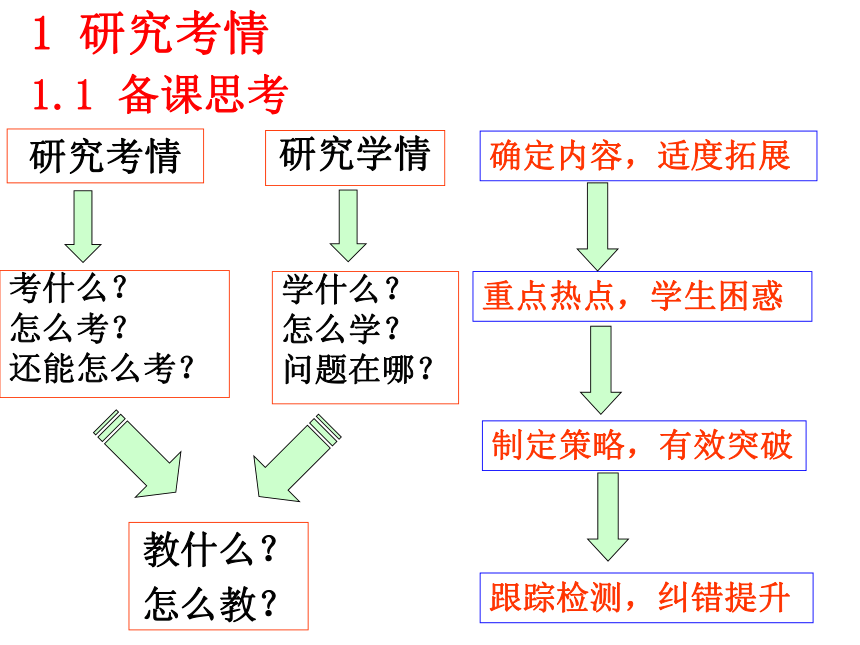
2012.10.30研究考情 研究学情 考什么?
怎么考?
还能怎么考? 学什么?
怎么学?
问题在哪?
教什么?
怎么教? 确定内容,适度拓展重点热点,学生困惑制定策略,有效突破跟踪检测,纠错提升1 研究考情1.1 备课思考1、了解常见金属Al及其重要化合物的主要性质和重要应用。
2、认识化学在海水、金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。(11考纲:认识化学在海水、金属矿物等自然资源综合利用方面的重要作用。)
3、了解常见金属的活动顺序。
4、能列举铝合金的重要应用。
5、了解金属材料在生产和生活中的重要应用。认识常见无机物在生产中的应用和对生态环境的影响。1 研究考情1.2 考纲要求铝及其化合物性质
1、铝与氧气、水、酸、碱、盐等物质的反应情况,常温下铝在浓硫酸、浓硝酸中的钝化现象。
2、氧化铝与酸、碱反应情况。
3、氢氧化铝的制备方法,氢氧化铝的两性,氢氧化铝的受热分解。
4、Al3+的检验方法,Al3+、AlO2-的水解反应。
5、同一周期中元素电离能的变化规律,了解元素电离能和原子核外电子排布的关系。
6、能用金属键理论解释金属的一些物理性质。
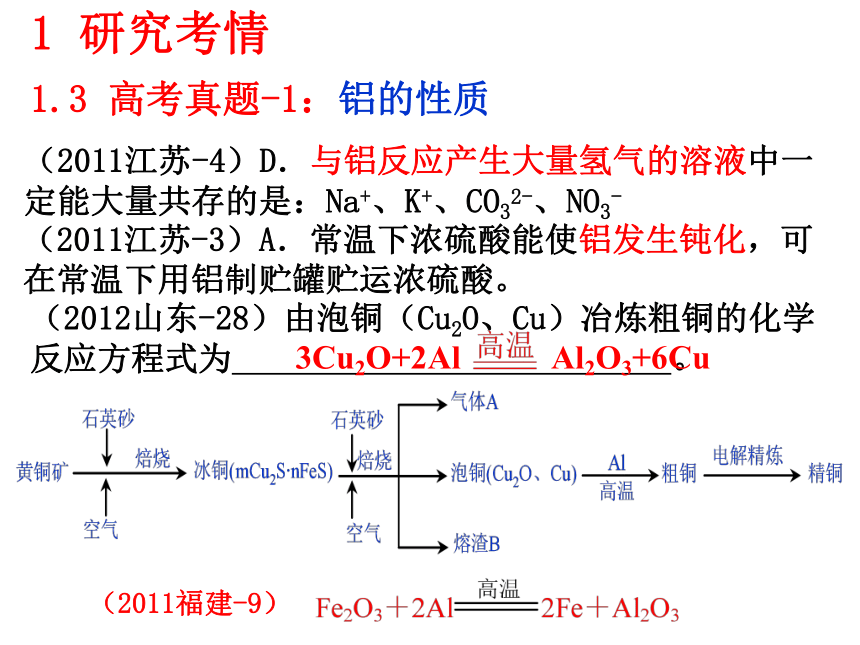
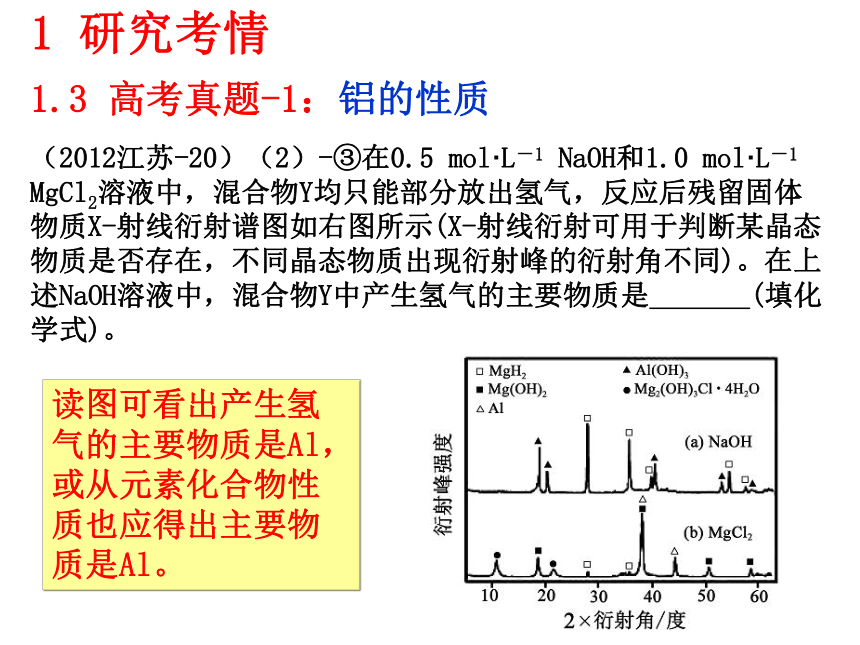
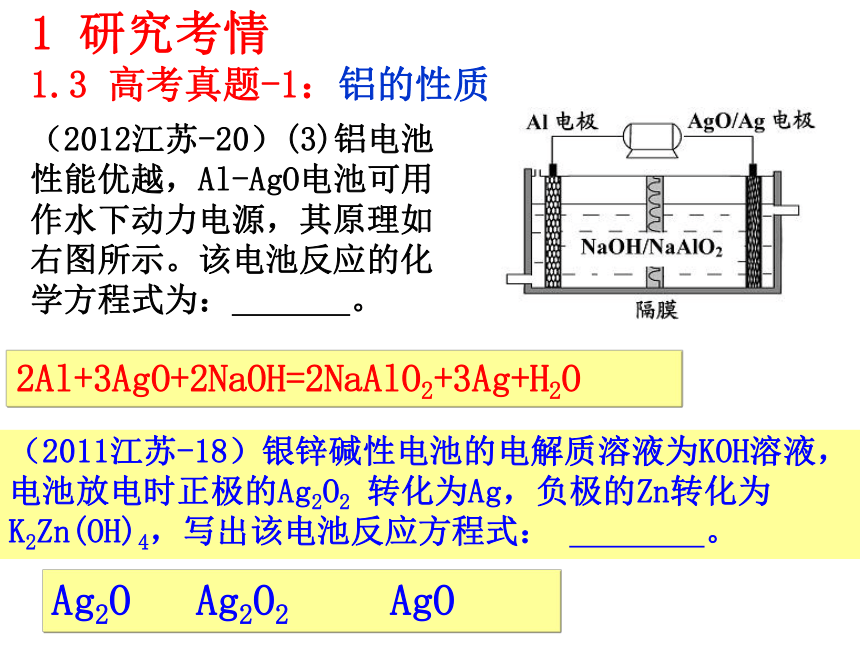
7、知道电解在电冶金等方面的应用。(冶炼铝和铝热反应)1 研究考情1.2 考纲要求(2011江苏-4)D.与铝反应产生大量氢气的溶液中一定能大量共存的是:Na+、K+、CO32-、NO3- 1 研究考情1.3 高考真题-1:铝的性质(2011江苏-3)A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸。(2012山东-28)由泡铜(Cu2O、Cu)冶炼粗铜的化学反应方程式为 。 (2012江苏-20)(2)-③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质X-射线衍射谱图如右图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是 (填化学式)。读图可看出产生氢气的主要物质是Al,或从元素化合物性质也应得出主要物质是Al。1 研究考情1.3 高考真题-1:铝的性质1 研究考情1.3 高考真题-1:铝的性质(2012江苏-20)(3)铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如右图所示。该电池反应的化学方程式为: 。2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2OAg2O Ag2O2 AgO(2011江苏-18)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2?转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:?????????。(2011广东-32)由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:(注:NaCl熔点为801℃;AlCl3在181℃升华)1 研究考情1.3 高考真题-1:铝的性质(2011广东-32) (1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和② 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(4)镀铝电解池中,金属铝为 极,熔融盐电镀中铝元素和氯元素主要以AlCl4― 和Al2Cl7―形式存在,铝电镀的主要电极反应式为 。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是 。1.3 高考真题-1:铝的性质(2010江苏-3)B.用氢氧化钠溶液除去铝表面的氧化
膜:Al2O3+2OH- = 2AlO2-+H2O 1 研究考情1.3 高考真题-2:氧化铝的性质(2012广东-10)B.工业上电解熔融状态Al2O3制备Al (2012安徽-13)已知室温下,Al(OH)3的Ksp,或溶解度远大于Fe(OH)3。向浓度均为0.1mol/L的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH 溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系。合理的是( C )1 研究考情1.3 高考真题-3:氢氧化铝的性质(2010江苏-6)C.C(H+)/C(OH-)=1012的溶液中:NH4+、
Al3+、NO3-、Cl- 能否大量共存。
(2010江苏-13)短周期元素铝的合金是日常生活中常用的金属材料,工业上常用电解法制备钠、铝、氯气。
(2012江苏-5)A.明矾能水解生所氢氧化铝胶体,可用作净水剂。(2009-5)1 研究考情1.3 高考真题-4:铝盐的性质1 研究考情1.3 高考真题-4:铝盐的性质(2011山东12)Al、Fe、Cu都是重要的金属元素。下列说法正确的是( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al(2012山东-30)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4。主要流程如下:(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”或“B"),再滴加另一反应物。25℃ Ksp[Mg(OH)2]=5.61×10-12 25℃ Ksp[Al(OH)3](无定形)=1.1×10-331.3 高考真题-4:铝盐的性质(4)除去HCl;吸收水蒸气;碱石灰(或NaOH与CaO混合物)(2012山东-30)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是 。F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 _。 1.3 高考真题-4:铝盐的性质(2011江苏-4)B.甲基橙呈红色的溶液中:NH4+、
Ba2+、AlO2-、Cl- 能否大量共存。
(2011江苏-6)D.向NaAlO2溶液中通入过量CO2,
2AlO2_-+CO2+3H2O = 2Al(OH)3↓+CO32- 1 研究考情1.3 高考真题-5:偏铝酸盐的性质(2012江苏-7)下列物质转化在给定条件下能实现的是②③④⑤A.①③⑤ B.②③④ C.②④⑤ D.①④⑤①1 研究考情1.3 高考真题-6:铝及其化合物的相互转化(2009江苏-3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )1 研究考情1.3 高考真题-6:铝及其化合物的相互转化2009-2012江苏高考铝及其化合物命题点归纳:(5)AlO2-的性质:离子共存,NaAlO2和酸、CO2等的反应。(1)铝的化学性质(强碱溶液),以及铝相关原电池的分析。(3)氢氧化铝的两性,铝及其化合物的转化关系。(4)Al3+的性质:Al3+与氨水、强碱反应,Al3+的检验,离子共存,水解反应(涉及无水氯化铝的制备)。(2)氧化铝的两性,氧化铝与碱的反应。(6)铝及其化合物的相互转化与推断等。观念前卫 融合特征 板块清晰 思路跳跃
情境新颖 信息丰富 铺垫隐含 套路多元元素化合物知识复习的考点分析高三专题复习模式构建收集错误
找准问题解读考纲自主梳理反思总结
形成能力反馈检测
纠错提升突破难点
掌握方法2 研究学情2 研究学情2.2 自主学案编写
【自主梳理知识】:考点的复习梳理,强化基础。
【自主复习反馈】:针对典型考点反馈自查,找出存在的困惑和难点。
【典型考点精讲】:重点讲解学生存在的问题,
【突破难点】:选择教学方法,帮助学生突破知识难点。
【方法规律总结】:归纳总结化学规律和方法,培养学生的能力,形成化学思想。
【巩固反馈】:围绕教学重难点进行针对性训练反馈,发现问题,及时纠错。2.1 考点内容整合2 研究学情知识主线:使知识系统化、类别化 ,在统一中掌握“共性”,在比较中理解“个性”。2 研究学情 借助分类观理解掌握Al、Al2O3、Al(OH)3的共性。引导学生找到Al、Al2O3、Al(OH)3分别与强酸强碱反应的离子方程式的共同之处和不同之处,用对比方法加以比较掌握,避免混淆。 2.3 学生自主学习活动:理清知识主线2 研究学情2.3 学生自主学习活动:构建知识网络3 研究教情3.1 教师的教学活动
教师批阅学生的典型考点反馈自查,总结学生学习中的困惑和难点。针对学生存在的问题,选择教学方法,帮助学生突破知识难点,并归纳总结化学规律和方法,培养学生的能力,形成化学思想。 (1) 铝盐与碱液反应① Al3+ Al(OH)3 AlO2-
② Al3+ Al(OH)3 不溶解
(2)偏铝酸盐与酸反应:(3)Al3+与AlO2-的双水解反应:Al3++3AlO2-+6H2O=4Al(OH)3↓②优于①②优于①再比较优劣3 研究教情3.2 解决问题—氢氧化铝的制备 问题交流与讨论:
1、在实验室里用铝盐溶液制备氢氧化铝常用通入氨气的方法,而不用加入氢氧化钠溶液的方法,为什么?
2、若用偏铝酸钠溶液制备氢氧化铝常用往其中通入二氧化碳气体的方法,而不用往其中加入盐酸的方法,为什么?
3、要实现Al3+ 转化为Al(OH)3,除了加碱的方法外,还可以通过什么方法实现转化?
4、要实现AlO2-转化为Al(OH)3,除了加酸或通入酸性气体的方法外,还可以通过什么方法实现转化?
5、今用铝、稀硫酸和氢氧化钠溶液为原料,在实验室里制备一定量的氢氧化铝,设计可能的制备方案;若制备等量的Al(OH)3,用哪一种制备途径比较节约试剂?为什么?3 研究教情3.2 解决问题—氢氧化铝的制备Al3+ 与S2-、HS-、CO32-、HCO3-、AlO2-
因发生双水解反应不能共存2Al3+ + 3CO32- + 6H2O = 2Al(OH)3↓+3 CO2↑Al3+ + 3HCO3- = Al(OH)3↓+3 CO2↑Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓AlO2- 与Al3+ 、Fe3+、NH4+
因发生双水解反应不能共存Fe3+ + 3AlO2- + 6H2O = Fe(OH)3 ↓+ 3Al(OH)3 ↓3 研究教情3.2 解决问题—离子共存3 研究教情3.2 解决问题—铝及其化合物转化关系借助“转化观”理解掌握Al3+、Al(OH)3、AlO2-的互变。
借助“平衡观”理解氢氧化铝的两性。H+ Al3+ Al(OH)3 AlO2- OH-(2009福建-24)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: 因向铝土矿中加入NaOH时形成的赤泥(残渣)中常含有铝硅酸钠,故流程乙常处理SiO2含量小于8%的铝土矿,若SiO2含量较高则可采用流程甲来处理。3.2 解决问题—冶炼铝工业流程分析3.2 解决问题—氢氧化铝图像n(OH—)/ n (Al3+)Al(OH)3AlO2-Al3+、Al(OH)312343.2 解决问题—可溶性铝盐与强碱溶液的计算规律Al(OH)3、AlO2-(2008江苏-13)研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是( )
A.密闭容器中CuO和C高温反应的气体产物:B.Fe在Cl2中的燃烧产物:C.AlCl3溶液中滴加NaOH后铝的存在形式:D.氨水与SO2反应后溶液中的铵盐:3 研究教情3.3 总结归纳—构建体系Al3+ Al(OH)3 AlO2- H+ Al3+ Al(OH)3 AlO2- OH-H++AlO2-+H2OH3AlO3 (HAlO2+H2O)H+H+过量H+OH-OH-过量OH-Al(OH)3Al3++3OH- 3 研究教情3.3 总结归纳—突破难点 复习不是单纯的重复,而是用旧知识的砖瓦建造新的高楼大厦。
-乌申斯基(俄)
2012.10.30研究考情 研究学情 考什么?
怎么考?
还能怎么考? 学什么?
怎么学?
问题在哪?
教什么?
怎么教? 确定内容,适度拓展重点热点,学生困惑制定策略,有效突破跟踪检测,纠错提升1 研究考情1.1 备课思考1、了解常见金属Al及其重要化合物的主要性质和重要应用。
2、认识化学在海水、金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。(11考纲:认识化学在海水、金属矿物等自然资源综合利用方面的重要作用。)
3、了解常见金属的活动顺序。
4、能列举铝合金的重要应用。
5、了解金属材料在生产和生活中的重要应用。认识常见无机物在生产中的应用和对生态环境的影响。1 研究考情1.2 考纲要求铝及其化合物性质
1、铝与氧气、水、酸、碱、盐等物质的反应情况,常温下铝在浓硫酸、浓硝酸中的钝化现象。
2、氧化铝与酸、碱反应情况。
3、氢氧化铝的制备方法,氢氧化铝的两性,氢氧化铝的受热分解。
4、Al3+的检验方法,Al3+、AlO2-的水解反应。
5、同一周期中元素电离能的变化规律,了解元素电离能和原子核外电子排布的关系。
6、能用金属键理论解释金属的一些物理性质。
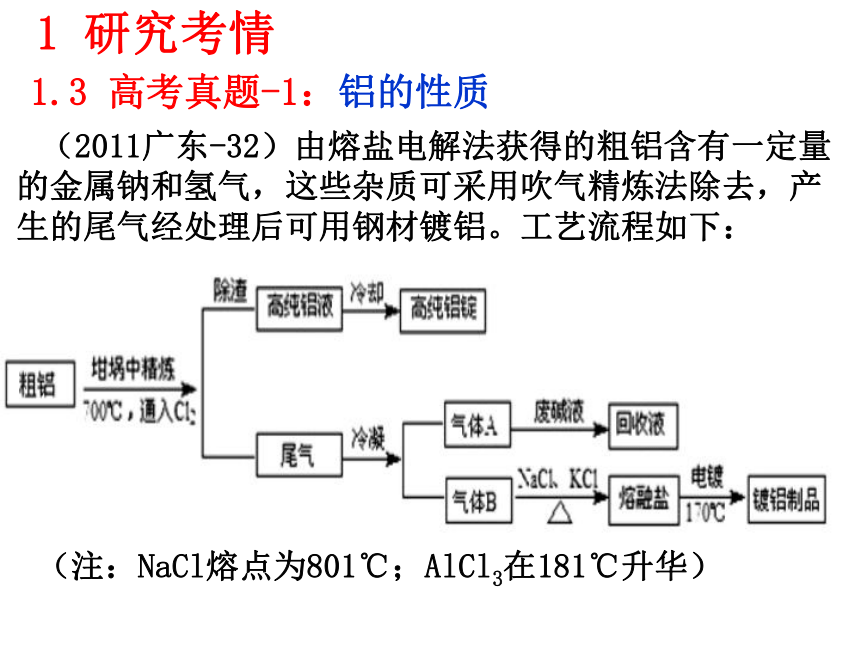
7、知道电解在电冶金等方面的应用。(冶炼铝和铝热反应)1 研究考情1.2 考纲要求(2011江苏-4)D.与铝反应产生大量氢气的溶液中一定能大量共存的是:Na+、K+、CO32-、NO3- 1 研究考情1.3 高考真题-1:铝的性质(2011江苏-3)A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸。(2012山东-28)由泡铜(Cu2O、Cu)冶炼粗铜的化学反应方程式为 。 (2012江苏-20)(2)-③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质X-射线衍射谱图如右图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是 (填化学式)。读图可看出产生氢气的主要物质是Al,或从元素化合物性质也应得出主要物质是Al。1 研究考情1.3 高考真题-1:铝的性质1 研究考情1.3 高考真题-1:铝的性质(2012江苏-20)(3)铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如右图所示。该电池反应的化学方程式为: 。2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2OAg2O Ag2O2 AgO(2011江苏-18)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2?转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:?????????。(2011广东-32)由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:(注:NaCl熔点为801℃;AlCl3在181℃升华)1 研究考情1.3 高考真题-1:铝的性质(2011广东-32) (1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和② 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(4)镀铝电解池中,金属铝为 极,熔融盐电镀中铝元素和氯元素主要以AlCl4― 和Al2Cl7―形式存在,铝电镀的主要电极反应式为 。
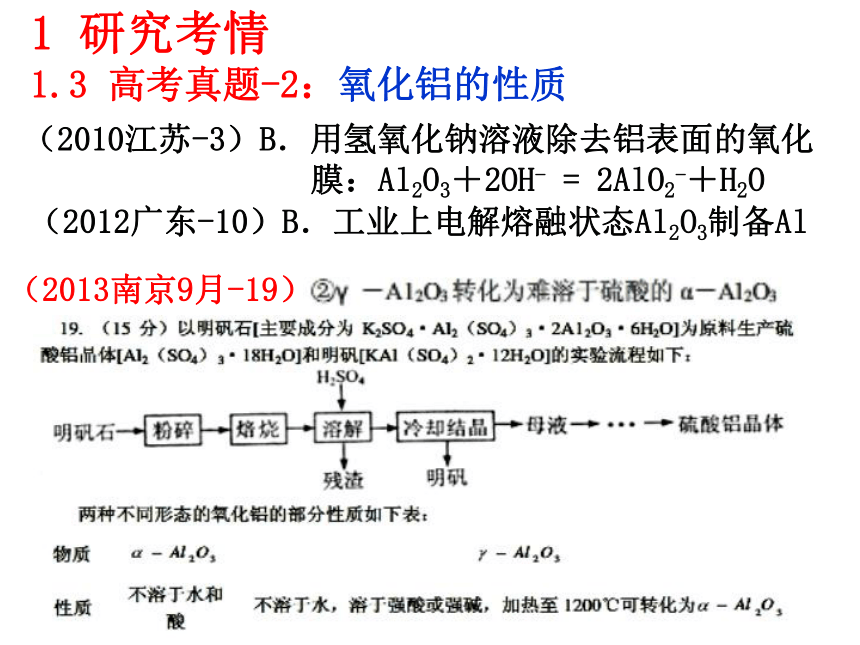
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是 。1.3 高考真题-1:铝的性质(2010江苏-3)B.用氢氧化钠溶液除去铝表面的氧化
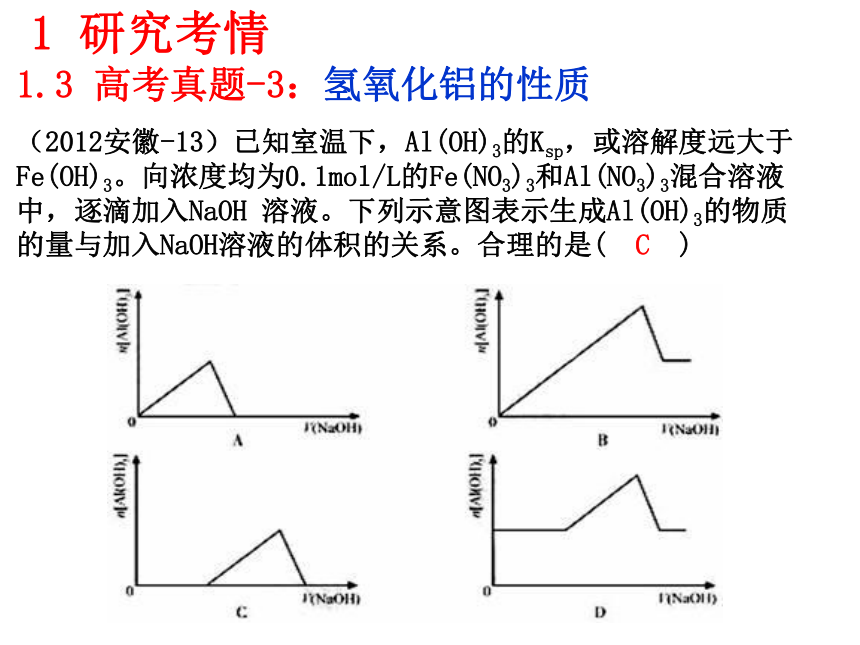
膜:Al2O3+2OH- = 2AlO2-+H2O 1 研究考情1.3 高考真题-2:氧化铝的性质(2012广东-10)B.工业上电解熔融状态Al2O3制备Al (2012安徽-13)已知室温下,Al(OH)3的Ksp,或溶解度远大于Fe(OH)3。向浓度均为0.1mol/L的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH 溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系。合理的是( C )1 研究考情1.3 高考真题-3:氢氧化铝的性质(2010江苏-6)C.C(H+)/C(OH-)=1012的溶液中:NH4+、
Al3+、NO3-、Cl- 能否大量共存。
(2010江苏-13)短周期元素铝的合金是日常生活中常用的金属材料,工业上常用电解法制备钠、铝、氯气。
(2012江苏-5)A.明矾能水解生所氢氧化铝胶体,可用作净水剂。(2009-5)1 研究考情1.3 高考真题-4:铝盐的性质1 研究考情1.3 高考真题-4:铝盐的性质(2011山东12)Al、Fe、Cu都是重要的金属元素。下列说法正确的是( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al(2012山东-30)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4。主要流程如下:(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”或“B"),再滴加另一反应物。25℃ Ksp[Mg(OH)2]=5.61×10-12 25℃ Ksp[Al(OH)3](无定形)=1.1×10-331.3 高考真题-4:铝盐的性质(4)除去HCl;吸收水蒸气;碱石灰(或NaOH与CaO混合物)(2012山东-30)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是 。F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 _。 1.3 高考真题-4:铝盐的性质(2011江苏-4)B.甲基橙呈红色的溶液中:NH4+、
Ba2+、AlO2-、Cl- 能否大量共存。
(2011江苏-6)D.向NaAlO2溶液中通入过量CO2,
2AlO2_-+CO2+3H2O = 2Al(OH)3↓+CO32- 1 研究考情1.3 高考真题-5:偏铝酸盐的性质(2012江苏-7)下列物质转化在给定条件下能实现的是②③④⑤A.①③⑤ B.②③④ C.②④⑤ D.①④⑤①1 研究考情1.3 高考真题-6:铝及其化合物的相互转化(2009江苏-3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )1 研究考情1.3 高考真题-6:铝及其化合物的相互转化2009-2012江苏高考铝及其化合物命题点归纳:(5)AlO2-的性质:离子共存,NaAlO2和酸、CO2等的反应。(1)铝的化学性质(强碱溶液),以及铝相关原电池的分析。(3)氢氧化铝的两性,铝及其化合物的转化关系。(4)Al3+的性质:Al3+与氨水、强碱反应,Al3+的检验,离子共存,水解反应(涉及无水氯化铝的制备)。(2)氧化铝的两性,氧化铝与碱的反应。(6)铝及其化合物的相互转化与推断等。观念前卫 融合特征 板块清晰 思路跳跃
情境新颖 信息丰富 铺垫隐含 套路多元元素化合物知识复习的考点分析高三专题复习模式构建收集错误
找准问题解读考纲自主梳理反思总结
形成能力反馈检测
纠错提升突破难点
掌握方法2 研究学情2 研究学情2.2 自主学案编写
【自主梳理知识】:考点的复习梳理,强化基础。
【自主复习反馈】:针对典型考点反馈自查,找出存在的困惑和难点。
【典型考点精讲】:重点讲解学生存在的问题,
【突破难点】:选择教学方法,帮助学生突破知识难点。
【方法规律总结】:归纳总结化学规律和方法,培养学生的能力,形成化学思想。
【巩固反馈】:围绕教学重难点进行针对性训练反馈,发现问题,及时纠错。2.1 考点内容整合2 研究学情知识主线:使知识系统化、类别化 ,在统一中掌握“共性”,在比较中理解“个性”。2 研究学情 借助分类观理解掌握Al、Al2O3、Al(OH)3的共性。引导学生找到Al、Al2O3、Al(OH)3分别与强酸强碱反应的离子方程式的共同之处和不同之处,用对比方法加以比较掌握,避免混淆。 2.3 学生自主学习活动:理清知识主线2 研究学情2.3 学生自主学习活动:构建知识网络3 研究教情3.1 教师的教学活动
教师批阅学生的典型考点反馈自查,总结学生学习中的困惑和难点。针对学生存在的问题,选择教学方法,帮助学生突破知识难点,并归纳总结化学规律和方法,培养学生的能力,形成化学思想。 (1) 铝盐与碱液反应① Al3+ Al(OH)3 AlO2-
② Al3+ Al(OH)3 不溶解
(2)偏铝酸盐与酸反应:(3)Al3+与AlO2-的双水解反应:Al3++3AlO2-+6H2O=4Al(OH)3↓②优于①②优于①再比较优劣3 研究教情3.2 解决问题—氢氧化铝的制备 问题交流与讨论:
1、在实验室里用铝盐溶液制备氢氧化铝常用通入氨气的方法,而不用加入氢氧化钠溶液的方法,为什么?
2、若用偏铝酸钠溶液制备氢氧化铝常用往其中通入二氧化碳气体的方法,而不用往其中加入盐酸的方法,为什么?
3、要实现Al3+ 转化为Al(OH)3,除了加碱的方法外,还可以通过什么方法实现转化?
4、要实现AlO2-转化为Al(OH)3,除了加酸或通入酸性气体的方法外,还可以通过什么方法实现转化?
5、今用铝、稀硫酸和氢氧化钠溶液为原料,在实验室里制备一定量的氢氧化铝,设计可能的制备方案;若制备等量的Al(OH)3,用哪一种制备途径比较节约试剂?为什么?3 研究教情3.2 解决问题—氢氧化铝的制备Al3+ 与S2-、HS-、CO32-、HCO3-、AlO2-
因发生双水解反应不能共存2Al3+ + 3CO32- + 6H2O = 2Al(OH)3↓+3 CO2↑Al3+ + 3HCO3- = Al(OH)3↓+3 CO2↑Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓AlO2- 与Al3+ 、Fe3+、NH4+
因发生双水解反应不能共存Fe3+ + 3AlO2- + 6H2O = Fe(OH)3 ↓+ 3Al(OH)3 ↓3 研究教情3.2 解决问题—离子共存3 研究教情3.2 解决问题—铝及其化合物转化关系借助“转化观”理解掌握Al3+、Al(OH)3、AlO2-的互变。
借助“平衡观”理解氢氧化铝的两性。H+ Al3+ Al(OH)3 AlO2- OH-(2009福建-24)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: 因向铝土矿中加入NaOH时形成的赤泥(残渣)中常含有铝硅酸钠,故流程乙常处理SiO2含量小于8%的铝土矿,若SiO2含量较高则可采用流程甲来处理。3.2 解决问题—冶炼铝工业流程分析3.2 解决问题—氢氧化铝图像n(OH—)/ n (Al3+)Al(OH)3AlO2-Al3+、Al(OH)312343.2 解决问题—可溶性铝盐与强碱溶液的计算规律Al(OH)3、AlO2-(2008江苏-13)研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是( )
A.密闭容器中CuO和C高温反应的气体产物:B.Fe在Cl2中的燃烧产物:C.AlCl3溶液中滴加NaOH后铝的存在形式:D.氨水与SO2反应后溶液中的铵盐:3 研究教情3.3 总结归纳—构建体系Al3+ Al(OH)3 AlO2- H+ Al3+ Al(OH)3 AlO2- OH-H++AlO2-+H2OH3AlO3 (HAlO2+H2O)H+H+过量H+OH-OH-过量OH-Al(OH)3Al3++3OH- 3 研究教情3.3 总结归纳—突破难点 复习不是单纯的重复,而是用旧知识的砖瓦建造新的高楼大厦。
-乌申斯基(俄)
